局灶性脑缺血大鼠纹状体区域Shh信号通路成分的表达变化及对髓鞘修复的影响
赵 红,吴晓君,刘赞华,王苏平,闫 旭
局灶性脑缺血大鼠纹状体区域Shh信号通路成分的表达变化及对髓鞘修复的影响
赵红1,吴晓君2,刘赞华1,王苏平1,闫旭2
目的检测Sonic Hedgehog (Shh)信号通路及其转录因子Gli1在局灶性脑缺血后不同时间点的表达变化,探讨该通路对脑缺血后髓鞘再生的影响。方法线栓法建立大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,使用免疫组化和RT-PCR的方法观察脑缺血后1 d,3 d,7 d和14 d Shh,Gli1的表达变化。碱性髓鞘蛋白(myelin basic protein,MBP)是髓鞘的组成成分,用作髓鞘的标志物,观察脑缺血后上述各时间点MBP的表达变化。结果正常大鼠Shh和Gli1广泛分布于脑白质和灰质,如皮质,胼胝体和纹状体等区域。Shh和Gli1的表达在脑缺血后3 d~14 d呈逐渐上升趋势。MBP的表达在脑缺血后1 d~28 d逐渐下降。结论脑缺血性损伤可激活Shh信号通路,激活的Shh可能通过调控细胞的增殖参与神经修复,针对Shh的表达量进行干预治疗将为脱髓鞘疾病的治疗提供理论依据。
局灶性脑缺血;Shh信号通路;Gli1;髓鞘再生
白质损伤越来越受到人们的关注。轴突、少突胶质细胞及由少突胶质细胞形成的髓鞘是中枢神经系统(central nerve system,CNS)白质的重要成份。与神经元类似,少突胶质细胞对于损伤也极为敏感,导致髓鞘的脱失和变性[1]。CNS的白质和灰质中广泛存在神经前体细胞,这类细胞在脱髓鞘损伤后能分化为成熟的少突胶质细胞并参与新髓鞘的形成[2]。虽然脑内存在自发性的髓鞘再生的保护性机制,但这些前体细胞的分化多数情况下被抑制,且这种内源性的神经再生不足以修复卒中后的神经功能障碍。
近年来Sonic Hedgehog (Shh)信号通路因与神经组织发生及神经前体细胞增殖、分化、迁移的密切关系而备受关注。Shh信号通路主要包括Shh配体,Patched (Ptch)和Smo受体以及Gli转录因子[3]。研究发现Shh信号通路可能参与脑损伤后的神经再生,使用外源性Shh蛋白能促进缺血动物模型的神经功能恢复[4]。有文献观察到脑缺血后Shh信号通路成分表达上调,而在缺血性脑损伤后纹状体区域Shh信号通路成分的动态变化及与髓鞘损伤修复的关系未有报道。本实验系统的观察了大脑中动脉闭塞(middle cerebral artery occlusion,MCAO) 2h后再灌注大鼠Shh、Gli1及MBP在脑内的分布及不同时间点的表达变化,并探讨Shh参与髓鞘修复的可能性机制,为临床脱髓鞘疾病的治疗提供理论依据。
1 材料和方法
1.1动物分组和MCAO模型制备雄性SD大鼠由大连医科大学实验动物中心提供,体重280~320 g。随机分成6组,分别是正常对照组、缺血2 h再灌注1 d、3 d、7 d和14 d组。每组8只,其中4只用于免疫组织化学分析,4只用于RT-PCR mRNA检测。采用Nagasawa[5]方法,改良线栓法制成MCAO模型。大鼠用10%水合氯醛腹腔注射麻醉(0.35 g/kg),仰卧位固定,经颈部正中切开皮肤暴露右侧颈总动脉、颈外动脉、颈内动脉颅外段,结扎颈外动脉主干,在颈外动脉近颈总动脉分叉处剪一切口,将线栓向颈内动脉颅内方向插入17~20 mm,遇阻力表明栓子头端已达大脑中动脉起始部并进入大脑前动脉,阻断了大脑中动脉的血流导致脑缺血,结扎入口处以固定线栓。术后大鼠不能直行,向缺血对侧划圈爬行或倾倒,提尾悬空时患侧前肢屈曲内收,提示脑缺血制作成功;2 h后直接拔出线栓恢复血流,实现再灌注。
1.2免疫组织化学实验再灌注后1 d、3 d、7 d和14 d,动物经10%水合氯醛(300 mg/kg,i.p.)麻醉后,打开胸腔,行左心室灌流。取出脑组织,放于恒冷切片机中做连续切片,切片厚度20 μm。脑片经水化、灭活内源性过氧化氢酶、封闭,分别加入Shh多克隆抗体(Santa Cruz,1:50),Gli1多克隆抗体(Santa Cruz,1:50)和MBP多克隆抗体(武汉博士德,1:750),4℃过夜后,依次加入生物素标记的二抗(SP 9002,北京中杉)、辣根过氧化酶标记链酶卵白素(SP 9002,北京中杉),之后3,3’联苯二胺(DAB)显色,梯度酒精脱水,二甲苯透明,封片后显微镜下照相。
1.3RT-PCR mRNA检测各组大鼠于再灌注后按上述时间点断头,取出缺血侧纹状体组织,每100 mg组织中加入1 ml Trizol提取总RNA,通过琼脂糖电泳检测RNA的完整性,分光光度计测定RNA的浓度和纯度。取4 ul总RNA逆转录成cDNA,建议PCR反应体系。引物序列由上海生工生物工程技术服务有限公司设计并合成。Shh基因上游引物:5’-CATAGGCTCCCTTGCTCTCA-3’,下游引物:5’-TAACAACCAGCGTCTTCCTG-3’,产物长度501bp;Gli1基因上游引物:5’-CAGTCAGGTCCCTACCCTCA-3’,产物长度304 bp;MBP基因上游引物:5’-TGATTGGACAGTGGTGATGG-3’,下游引物:5’-TGTGAGAAGGACAAAGGTAGCA TGTGAGAAGGACAAAGGTAGCA-3’,产物长度100 bp。反应条件为:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。实验中以GAPDH为内参。
1.4图像分析图像采集应用Spot Advanced软件,分析处理采用Metamorph对缺血侧纹状体区域Shh,Gli1和MBP染色进行灰度分析。每只大鼠选取6张切片,纹状体的平均灰度值为右侧纹状体平均灰度与白质的平均灰度的差值,将6张切片累加求其平均。每个时间点3只动物。RT-PCR扩增后得到所需目的基因的RNA电泳鉴定后采用图像分析系统进行半定量分析,根据目的条带与内参GAPDH的mRNA条带灰度值的比值计算其相对含量。

2 结 果
2.1局灶性脑缺血大鼠缺血侧纹状体区域Shh,Gli和MBP的免疫组化染色免疫组化显示Shh和Gli1免疫阳性反应的细胞广泛分布与大脑皮质,胼胝体,纹状体等区域,Shh和Gli1呈棕黄色颗粒主要表达与细胞浆和细胞核;脑缺血后Shh和Gli1免疫阳性染色明显增加。MBP在纹状体区域呈簇状分布,缺血后观察到髓鞘的脱失、变性,纤维间间距的形成。
正常组和MCAO模型组均有Shh,Gli1蛋白表达,正常和缺血侧纹状体区域的平均光密度定量分析显示,模型组Shh和Gli1表达与3 d,7 d和14 d呈逐渐上升趋势(*P<0.05)。MBP在脑缺血后3 d~14 d呈逐渐下降趋势(*P<0.05) (见表1)。
2.2局灶性脑缺血大鼠缺血侧纹状体区域Shh,Gli1和MBP的mRNA表达RT-PCR显示,正常组即有Shh和Gli1 mRNA的表达。脑缺血后3 d Shh表达开始升高(*P<0.05),并与7 d和14 d呈逐渐上升趋势(**P<0.01) (见图1)。Gli1表达在脑缺血后3 d开始升高(*P<0.05),并与7 d达峰值,并维持此水平至脑缺血后的14 d(**P<0.01) (见图2)。MBP的表达在脑缺血后1 d开始下降(*P<0.05),7 d和14 d呈逐渐下降趋势(**P<0.01) (见图3)。
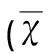
表1 MCAO大鼠脑缺血后不同时间点缺血侧纹状体区域Shh,Gli1和MBP灰度值比较 ±s)
与正常对照组相比*P<0.05
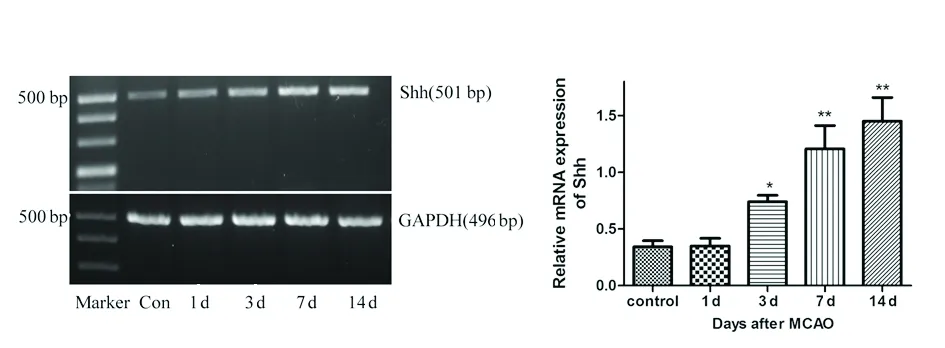
图1 MCAO模型大鼠脑缺血后不同时间点Shh mRNA的表达情况。与正常对照组相比 * P<0.05,** P<0.01
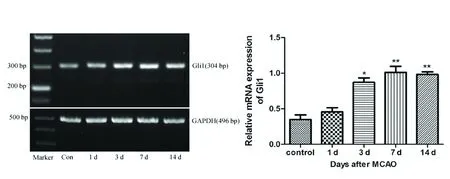
图2 MCAO模型大鼠脑缺血后不同时间点Gli1 mRNA的表达情况。与正常对照组相比 * P<0.05,** P<0.01
图3 MCAO模型大鼠脑缺血后不同时间点MBP mRNA的表达情况。与正常对照组相比 * P<0.05,** P<0.01
3 讨 论
1980年,Nusslein-Volhard和Wieschaus在研究果蝇的基因突变时发现了Hh基因,该基因编码高度保守的糖蛋白,在果蝇中仅有一种形式的Hh基因,在哺乳动物中则存在三种同源基因:Sonic hedgehog (Shh)、Indian hedgehog (Ihh)和Desert hedgehog (Dhh),分别编码三种相应蛋白[6]。其中Ihh特征性地参与软骨发育;Dhh在生殖细胞的发育中起关键作用;Shh在Hh家族中具有最广泛表达,在胚胎发育过程中对各器官的分化成形起重要调节作用,出生后Shh在组织器官完整性和功能发育保持中起到重要作用,并能调控细胞的分化和增殖,参与脑损伤后的神经修复过程。Shh信号通路主要由Shh配体,两个跨膜蛋白受体Ptched (Ptc)和Smoothened (Smo)组成的复合物,以及下游转录因子Gli蛋白 (Gli1,Gli2,Gli3)组成。当不存在Shh时,Ptc抑制Smo的活性,从而抑制目标基因的表达;当Shh与Ptc结合时,Ptc对 Smo的抑制作用解除,Smo的功能被释放出来,将信号传递并激活下游的Gli,后者进入细胞核内,启动多种目的基因的表达[7~9]。Gli1既是Shh信号的靶基因,又是Shh信号通路被激活的标志。
Shh可调控神经细胞的增殖,分化和轴突形成[10~12]。最近研究表明,在胚胎期CNS内的参与神经发生的一系列塑型因子,在成体神经损伤后重新激活,参与神经组织的修复重建。Shh信号通路,特别是Gli1在完成胚胎的体节发育和细胞定位后,处于失活状态,损伤后导致其重新激活。我们的研究检测到Shh信号通路成分Shh和下游转录因子Gli1在成年大鼠脑内(大脑皮质,纹状体,胼胝体等)均有表达,表明Shh信号在未损伤的成年脑中是有功能的。同时我们观测到局灶性脑缺血后3 d,缺血侧Shh,Gli1 mRNA和蛋白表达开始增加,7 d和14 d呈逐渐上升的趋势,对侧纹状体中没有发现此种改变,提示Shh表达水平的改变和损伤相关,脑缺血后内源性Shh通路被激活。这与文献报道的一致,在阻断大脑中动脉血流20 min再灌注的大鼠模型中,Shh及其转录因子Gli1在缺血侧表达增高[13];在皮质缺血的小卒中动物模型中,Shh在缺血侧皮质和纹状体区域表达上调[14];多发性硬化的实验性动物模型和患者中Shh表达水平发生改变。那么,Shh主要表达与何种细胞,激活后发挥了何种作用?有文献报道,激活的Shh主要表达与NG2+阳性的少突胶质前体细胞,参与了髓鞘修复过程[15];另有研究者观察到成年鼠海马和从海马区分离出的神经前体细胞均高表达Shh的受体Ptc。用腺病毒载体输注Shh cDNA到海马,细胞增殖3倍;Shh抑制剂环巴明抑制Shh后,海马神经前体细胞的增殖显著减少[16]。可见,Shh可以调控脑缺血后前体细胞的分化和成熟,促进髓鞘再生,提示Shh信号通路可能成为脑缺血治疗的潜在理想靶点,促进缺血后的神经功能修复。
MBP作为髓鞘的组成成分之一,是少突胶质成熟和髓鞘的标志物。实验观察到,MBP mRNA表达在脑缺血后的1 d~14 d逐渐下降,14 d达到最低点。这反应了髓鞘的脱失和破坏发生在缺血的早期,并随着缺血时间的延长逐渐加重。同时我们对缺血侧纹状体区域的髓鞘和轴突进行了形态学观察,发现缺血后髓鞘脱失、排列方向紊乱、神经纤维间空洞形成以及染色强度下降,同时轴突也发生类似的改变,这种改变进行性加重直到损伤后的14 d。髓鞘染色的变化和此次实验检测的MBP mRNA表达结果相吻合。
Shh能够促进髓鞘再生,但缺血后其表达变化和MBP的变化并不一致:Shh在损伤后的3 d到14 d逐渐增加,但MBP的表达在进行性下降。Shh调控细胞增殖,参与脱髓鞘损伤后的修复,其表达生理性增加时,髓鞘并没有修复的迹象,推测内源性激活的正常量的Shh对于髓鞘的重建是不足够的。另外,髓鞘抑制因子的存在以及受损髓鞘的残骸未能被巨噬细胞及时清除对于髓鞘再生也有抑制性的作用。可见,虽然脑缺血可以启动内源性神经再生的保护性机制,但是这种内源性的反应远不能替代脑卒中等破坏性较大的创伤所造成的神经元或胶质细胞的脱失,因此,损伤大脑尚不能达到自我修复的程度。那么,上调Shh表达对神经修复有何影响?有研究显示脊髓损伤大鼠局部给予Shh或Shh信号通路的激动剂将会加速前体细胞的增殖、分化和成熟,并促进脊髓功能的恢复[17];脑缺血模型大鼠,缺血后24 h鞘内给予Shh蛋白能促进神经前体细胞的增殖,减少梗死灶体积并促进神经功能恢复[18]。可见,上调Shh的表达能促进神经修复。总之,Shh对脑缺血后神经修复作用的具体机制仍需进一步的研究。了解调控内源性神经修复背后的分子机制,以求应用神经修复治疗的手段增强卒中后内源性神经修复,将为脑缺血后的神经康复研究提供重要的理论依据和新的治疗途径。
[1]Dewar D,Underhill SM,Goldberg MP. Oligodendrocytes and ischemic brain injury[J]. J Cereb Blood Flow Metab,2003,23:263-274.
[2]Grade S,Bernardino L,Malva JO. Oligodendrogenesis from neural stem cells:perspectives for remyelinating strategies[J]. Int J Dev Neurosci,2013,31:692-700.
[3]Traiffort E,Angot E,Ruat M. Sonic Hedgehog signaling in the mammalian brain [J]. J Neurochem,2010,113:576-590.
[4]Podolska K,Lipiec A,Hajdukiewicz K,et al. Sonic hedgehog stimulates the recruitment of endothelial progenitor cells[J]. Med Wieku Rozwoj,2013,17:151-156.
[5]Nasagawa H,Kogure K. Correlation between cerebral blood flow and histologic changes in a new rat model of middle cerebral artery occlusion[J]. Stroke,1989,20:1037-1043.
[6]Nüsslein-Volhard C,Wieschaus E. Mutations affecting segment number and polarity in Drosophila [J]. Nature,1980,287:795-801.
[7]Choudhry Z,Rikani AA,Choudhry AM,et al. Sonic hedgehog signalling pathway:a complex network [J]. Ann Neurosci,2014,21:28-31.
[10]Podolska K,Lipiec A,Hajdukiewicz K,et al. Sonic hedgehog stimulates the recruitment of endothelial progenitor cells[J]. Med Wieku Rozwoj,2013,17:151-156.
[11]Hor CH,Tang BL. Sonic hedgehog as a chemoattractant for adult NPCs[J]. Cell Adh Migr,2010,4:1-3.
[12]Ferent J,Zimmer C,Durbec P,et al. Sonic hedgehog signaling is a positive oligodendrocyte regulator during demyelination[J]. J Neurosci,2013,33:1759-1772.
[13]Sims JR,Lee SW,Topalkara K,et al. Sonic hedgehog regulates ischemia/hypoxia-induced neural progenitor proliferation [J]. Stroke,2009,40:3618-3626.
[14]Jin Y,Raviv N,Barnett A,et al. The shh signaling pathway is upregulated in multiple cell types in cortical ischemia and influences the outcome of stroke in an animal model[J]. PLoS One,2015,10:e0124657.
[15]Loulier K,Ruat M,Traiffort E. Increase of proliferating oligodendroglial progenitors in the adult mouse brain upon Sonic hedgehog delivery in the lateral ventricle[J]. J Neurochem,2006,98:530-542.
[16]Lai K,Kaspar BK,Gage FH,et al. Sonic hedgehog regulates adult neural progenitor proliferation in vitro and in vivo[J]. Nat Neurosci,2003,6:21-27.
[17]Bambakidis NC,Wang X,Lukas RJ,et al. Intravenous hedgehog agonist induces proliferation of neural and oligodendrocyte precursors in rodent spinal cord injury[J]. Neurosurgery,2010,67:1709-1715.
[18]Bambakidis NC,Petrullis M,Kui X,et al. Improvement of neurological recovery and stimulation of neural progenitor cell proliferation by intrathecal administration of Sonic hedgehog[J]. J Neurosurg,2012,116:1114-1120.
The expression changes of Sonic Hedgehog signaling pathway in the striatum after focal cerebral ischemia in rats and its role on remyelination
ZHAOHong,WUXiaojun,LIUZanhua,etal.
(DepartmentofNeurology,DalianMunicipalCentralHospital,Liaoning116033,China)
ObjectiveSonic Hedgehog (Shh) signal pathway regulates precursor cells proliferation and differentiation and is involved in the neurogenesis after ischemia. Our study is to explore the expression changes of Shh and its transcription factor Gli1 at different time points after focal cerebral ischemia and the effect of Shh on myelin repair. MethodsWe used the middle cerebral artery occlusion (MCAO) for 120 min as a rat model. MBP was used as a marker of myelin. Used immunohistochemistry and RT-PCR technique,we detected the expression of Shh,Gli1 and MBP at different time points after focal cerebral ischemia. ResultsShh and Gli1 were distributed throughout the white and gray matter of the normal brain,such as cortex (Cx),corpus callosum (cc) and striatum (Str). In addition,Shh and Gli1 expression significantly increased from day 3 to day 14 after MCAO. The expression of MBP gradually reduced from day 1 to day 14 in MCAO rats. ConclusionThe ischemia injury can activate Shh signal pathway. The activation of Shh might promote remyelination through regulating the neural precursor cells proliferation,which might have implications in the treatment of demyelinating disease.
Focal cerebral ischemia;Sonic Hedgehog (Shh) singal pathway;Gli1;Remyelination
1003-2754(2016)07-0629-04
2016-01-12;
2016-05-20
(1.大连市中心医院神经内科,大连 辽宁116033;2.大连医科大学在读研究生,大连 辽宁 116044)
王苏平,E-mail:zhaohong2003@126.com
R743.3
A

