应用通用引物量化检测鲜肉及其制品中羊源性成分
赵新,刘娜,陈锐,王成,朱珠,王永,兰青阔(天津市农业质量标准与检测技术研究所,天津300381)
应用通用引物量化检测鲜肉及其制品中羊源性成分
赵新,刘娜,陈锐,王成,朱珠,王永,兰青阔*
(天津市农业质量标准与检测技术研究所,天津300381)
分别以牛、羊、猪、鸡、鸭、马线粒体细胞色素b基因为研究对象,设计羊源性成分特异性引物和探针,同时结合实时荧光定量PCR技术,引入16SrDNA内参基因校正羊种属特异性基因测定方法,建立快速、高通量的鲜肉及鲜肉制品中羊源性成分确证方法,实现科学准确的食品掺假量化判定技术体系。通过特异性、通用性及模拟混合样品的检测,对所建立方法进行验证。结果表明:建立的羊源性成分含量测定方法具有良好的特异性和通用性,且通过标准曲线的构建,呈现良好的线性关系均达0.996以上;通过羊种属特异性基因与16SrDNA内参基因Quantity值及校正系数,可以计算出样品中所含羊源性成份的质量百分比含量,经模拟混合样品的检测,回收率平均值到达96.25%,说明量化研究结果具有较高的准确性。
16SrDNA内参基因;外源种属特异性基因;羊源性成分;量化检测
多源化的肉类品种是人们餐桌文化日趋丰富的重要组成部分,然而随着市场上牛羊肉价格的不断大幅上涨,部分不法企业及商贩,为了自身经济利益的最大化,在高成本的牛肉或羊肉中掺入低廉的其他肉类品种进行销售。随着欧洲“马肉风波”丑闻的不断发酵,爱尔兰、荷兰、罗马尼亚等多个国家卷入其中,欧盟食品标签制度的权威性受到严重挑战,欧洲消费者对食品产业的信心大大降低[1-3]。我国公安部近日公布了多起假牛羊肉、病死肉、有毒有害肉制品案件,严重危害了人民健康、扰乱和破坏了市场秩序和社会安定。
目前对于动物源性成分的鉴定方法,无论是国标方法还是商检方法均不完善,传统的感官和化学方法耗时长、操作繁琐、且不能量化,而实时荧光定量PCR技术等最常用的分子生物学方法[4-5]大多数仍停留在用定量的方法作为定性判定的指标,缺乏真正意义上的量化技术标准,致使市场监管部门无法依据掺假轻重情节(即掺假量化数值)针对性地进行处罚和治理[6-8]。因此,基于以上市场背景,迫切需要一种快速、精准、量化的肉类鉴别方法。
实时荧光定量PCR技术相对于传统的感官、化学等方法存在相对优势,但要想将实时荧光定量PCR技术发展成为动物源性成分量化判定的一种有效方法,必须消除待测样品和标准品间因DNA断裂程度引起的偏差,而内参基因的引入对肉源品种的整体DNA损伤程度和提取效率进行监控,校正种属特异性基因百分含量,消除量值结果偏差,获得真实可信的食品掺假数值,有效提高检测方法的灵敏度和准确性[9-10]。
本研究采用牛、羊、猪、鸡、鸭、马等常见肉源品种的线粒体DNA细胞色素b(Cytb)基因和16SrDNA内参基因为研究对象,旨在运用实时荧光定量PCR技术结合内参基因去除样品在DNA断裂以及提取效率上可能与标准品存在的差异,对羊种属特异性基因的量值判定进行校正,建立科学、快速、精准的鲜肉及鲜肉制品中羊源性成分确证及量化判定标准化技术体系,为市场规范与监管提供科学可靠的技术手段。
1 材料与方法
1.1材料与仪器
牛肉、羊肉、猪肉、鸡肉、鸭肉、马肉、驴肉、鲫鱼、大豆粉:均购于天津市农贸市场;羊源性成分(100%)标准品:购于辽宁出入境检验检疫局;动物基因组提取试剂盒:天津市农业质量标准与检测技术研究所动植物分子鉴定实验室研制;Premix Ex Taq(Probe qPCR)预混液:TaKaRa公司;引物、探针:由上海生工生物技术有限公司合成。
StepOnePlus Real-time PCR仪:美国ABI公司;ND-1000 NanoDrop核酸蛋白测定仪:美国Bio-Rad公司;Allegra 21R Centrifuge高速冷冻离心机:美国BECKMAN公司。
1.2试验方法
1.2.1引物与探针的设计
根据NCBI等网站中公布的不同物种16SrDNA基因序列,选取物种间序列保守区域运用引物设计软件Beacon Designer 7设计通用引物和探针。再同时参照文献[11],对不同物种线粒体DNA细胞色素b基因序列进行比对分析,选取物种间序列变异大的区域设计特异性引物和探针。引物和探针由上海生工生物工程有限公司合成,引物和探针序列见表1。

表1PCR和测序引物序列Table 1 PCR and sequencing primers sequence
1.2.2DNA模板的提取
取100 mg放入2 mL离心管,参照本实验室研制的动物基因组提取试剂盒方法提取基因组DNA,在NanoDrop核酸蛋白测定仪中进行核酸含量的测定。也可用其他等效动物基因组提取试剂盒提取基因组DNA。
1.2.3PCR反应条件的建立
PCR反应体系为20 μL,各成分含量为:2×Premix Ex Taq(Probe qPCR)预混液 10 μL,上下游引物各1 μL,探针引物0.5 μL,模板2 μL(模板浓度50 ng/μL)无菌超纯水补足20 μL,混匀后离心,在实时荧光PCR仪上开始循环。循环参数为:95℃预变性15 min,然后进行45个循环,每个循环为95℃变性20 s,62℃退火30 s。
1.2.4方法特异性检测
用羊种属特异性基因引物扩增9种动物源性样品(牛、羊、猪、鸡、鸭、马、驴、鼠、狗)及其他一些非动物源性样品(水稻混合样品、大豆混合样品、玉米混合样品、革兰氏阳性细菌混合样品、革兰氏阴性细菌混合样品),以去离子水作为阴性对照模板,按1.2.3反应程序及条件进行实时荧光PCR扩增。
1.2.5内参基因通用性检测
为了确定16SrDNA内参基因通用性,用内参基因引物扩增9种动物源性样品(牛、羊、猪、鸡、鸭、马、驴、鼠、狗)及其他一些非动物源性样品(水稻混合样品、大豆混合样品、玉米混合样品、革兰氏阳性细菌混合样品、革兰氏阴性细菌混合样品),以去离子水作为阴性对照模版,按1.2.3反应程序及条件进行实时荧光PCR扩增。
1.2.6标准曲线绘制
将羊源性成分(100%)标准品提取DNA梯度稀释,配制成100%、50%、10%、5%、1%的5个梯度标准品作为模板,每个反应设置3个平行。根据标准DNA溶液PCR反应的Ct值及初始模板浓度的对数分别绘制16SrDNA内参基因和羊种属特异性基因的标准曲线。
1.2.7模拟混合样品检测及回收率分析
取生鲜牛肉、羊肉、猪肉、鸡肉、鸭肉按照质量比模拟混合肉样进行不同比例的制备,制备比例分别为羊源性成分占0%、20%、40%、60%、80%、100%。通过内参基因对种属特异性基因表达量的校正,获得模拟混合样品的百分含量,并进行检测样品回收率分析,以验证所建立方法的准确性。按照公式1计算出待测样品中羊源性成分含量。
X/%=(Qm1/Qt1)×(Qt1/Qt2)×100(1)
式中:X为试样中羊源成分含量;Qm1为试样羊特异性引物体系RT-PCR含量平均值(Qutantity Mean);Qt1为试样通用引物体系RT-PCR含量平均值;Qt2为含量100%羊标准品通用引物体系RT-PCR含量平均值。
1.2.8市售样品检测
采用本研究所建立的鲜肉及鲜肉制品中羊源性成分定量检测方法对市售不同鲜肉及鲜肉制品进行羊源性成分定量检测,统计检测结果与市售样品标签标注羊源性成分含量的符合情况。
2 结果与分析
2.1引物和探针的特异性试验
用羊种属特异性基因引物扩增9种动物源性样品(牛、羊、猪、鸡、鸭、马、驴、鼠、狗)及其他一些非动物源性样品(水稻混合样品、大豆混合样品、玉米混合样品、革兰氏阳性细菌混合样品、革兰氏阴性细菌混合样品)。扩增结果表明,羊种属特异性基因引物只有以羊源性样品的DNA为模板才有荧光信号,其他样品均没有荧光信号,表明PCR扩增体系具有良好的扩增特异性(图1)。
2.2内参基因通用性检测试验
用内参基因引物扩增9种动物源性样品(牛、羊、猪、鸡、鸭、马、驴、鼠、狗)及其他一些非动物源性样品(水稻混合样品、大豆混合样品、玉米混合样品、革兰氏阳性细菌混合样品、革兰氏阴性细菌混合样品)。扩增结果表明,只有以动物源性样品的DNA为模板才有荧光信号,其他样品均没有荧光信号,表明PCR扩增体系对于动物源性成分具有良好的种内通用性和种间特异性(图2)。

图1 方法特异性检测荧光扩增曲线Fig.1 Fluorescent amplification curve of specific research method
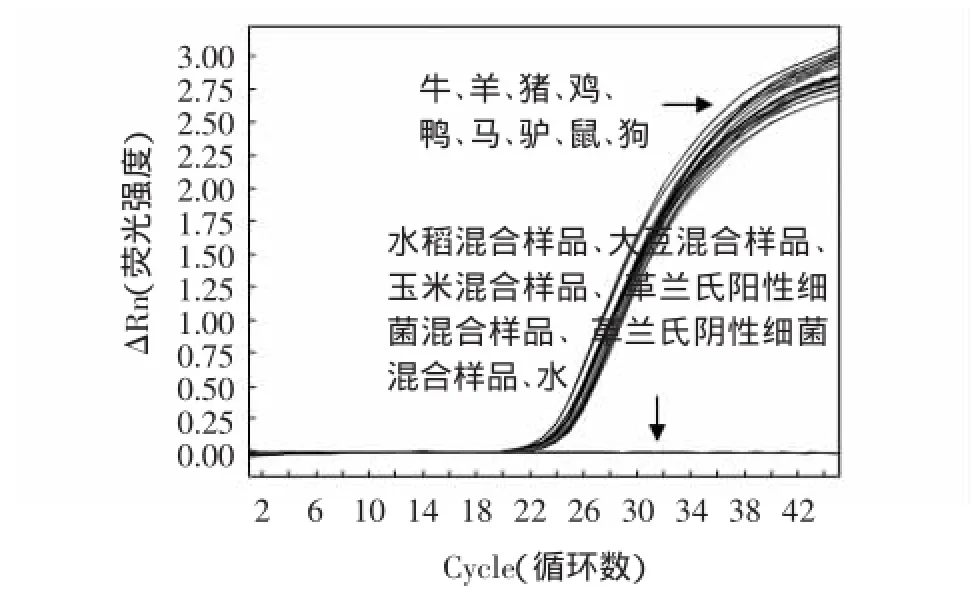
图2 内参基因通用性检测荧光扩增曲线Fig.2 Fluorescent amplification curve of reference gene universal research method
2.3标准曲线的建立
将羊源性成分(100%)标准品提取DNA梯度稀释,配制成100%、50%、10%、5%、1%的5个梯度标准品作为模板,分别用羊种属特异性基因和16SrDNA通用基因的引物和探针对梯度质量浓度的羊源性成分DNA标准品进行实时荧光PCR扩增,验证方法的线性关系(图3)。
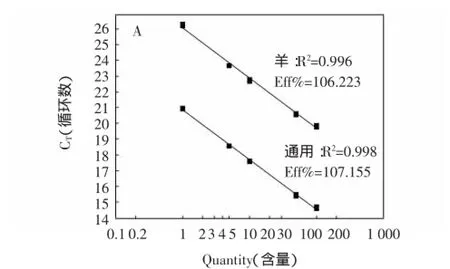

图3定量标准曲线Fig.3 Quantitative standard curve
从图3表明,羊种属特异性体系和16SrDNA通用体系都呈现出良好的线性关系,线性拟合度的平方值R2分别达到0.996到0.998,扩增效率(Eff%)分别为106.223%和109.487%。
2.4模拟混合样品检测及回收率分析
根据市售羊肉掺假状况,按照表2中的方案,模拟制作含有羊/鸡、羊/鸭、羊/猪不同成分的混合肉样,混合肉样的DNA提取方法参照1.2.2。应用所建立的方法体系,通过内参基因对种属特异性基因的校正,测定混合肉样中羊源性成分百分含量,并进行模拟样品回收率分析(即测定值与真实值之间的差异),以验证所建立方法的准确性。

表2 混合肉样中各肉种成分的比例Table 2 Percentages of different species in meat mixtures for accuracy evaluation
3组混合肉样的实时荧光PCR扩增曲线以羊/鸡混合(0%、20%、40%、60%、80%、100%)为例,如图4所示,3组混合肉样的测定结果如表3所示。
羊/鸡、羊/鸭、羊/猪3组不同成分的混合样品回收率平均值分别为96.62%、95.14%、96.98%,说明该方法的测定结果与真实值较为接近,具有较高的准确度,使用该方法体系能够较为准确的测定样品中羊源性成分含量。


图4 羊/鸡混合肉样中羊源性成分含量测定RT-PCR扩增曲线Fig.4 RT-PCR amplification curves obtained from the determination of the percentage of sheep/chicken ingredients in meat mixtures

表3 混合肉样中羊源性成分含量测定结果Table 3 Results of determinati on of the percentage of sheepdelved ingredients in meat mixture

续表3 混合肉样中羊源性成分含量测定结果Continue table 3 Results of determinati on of the percentage ofsheep-delved ingredients in meat mixture
2.5市售样品检测结果
为了验证本试验所建立方法的适用性,采用本研究所建立的定量检测方法对市售不同鲜肉及鲜肉制品进行羊源性成分含量测定,统计检测结果与市售样品标签标注动物源性成分含量的符合情况,结果见表4。市售样品标签对于样品含量的标注很少,但都会对样品成分进行详细的标注,比如精选羊肉、羊羔肉、羊肉猪肉混合肉等,将只标注单一羊肉的样品含量视为100%,混合肉样视为<100%进行测定结果与标签标注的对比参照,此方法可以进行市售样品的含量测定。
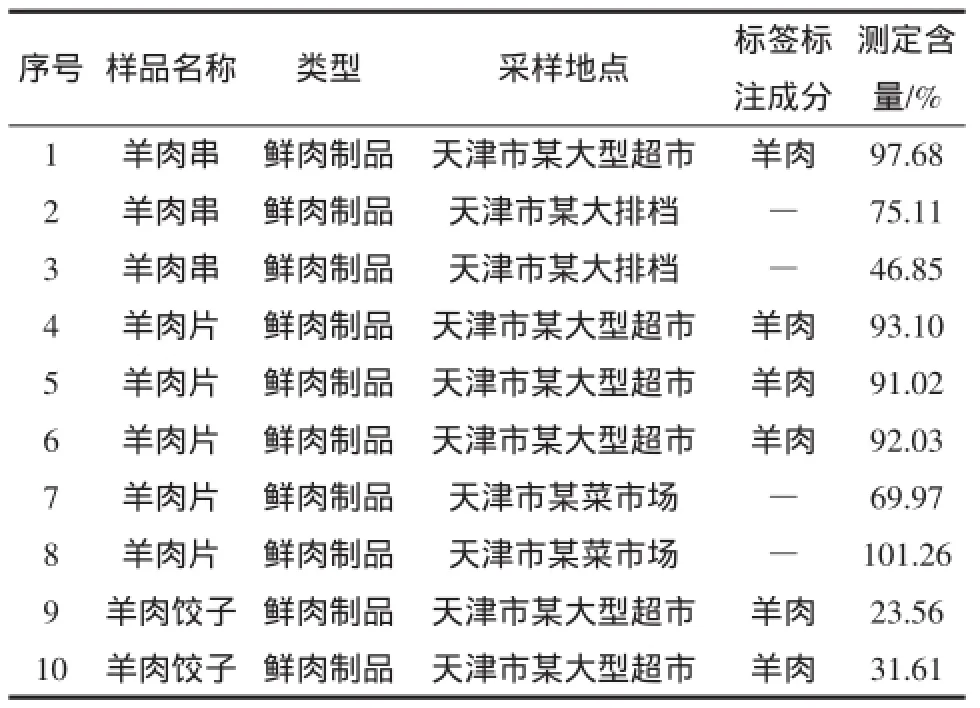
表4 本研究建立的实时荧光PCR方法和市售样品标签标注成分含量比对结果Table 4 Comparison of results detected by real-time PCR and commercial sample the label ingredients
3 讨论
本试验研究所建立的肉类鉴别方法是以线粒体为基础,线粒体DNA是高等动物唯一的核外遗传物质且遗传数量丰富[12],经加工不易完全降解、种内遗传稳定、种间高度变异,是目前肉类鉴别研究常用靶基因的首选[13]。然而,也有相关研究者认为线粒体DNA的数量在不同物种、不同组织之间存在着表达差异[14-15],因此本方法的建立是基于肌肉组织的鲜肉及鲜肉制品,不涉及参杂动物心脏或肝脏等组织器官成分的样品。同时本研究所建立的羊源性成分含量鉴定方法通过大量试验数据验证,以100%纯羊肉为其他物种线粒体DNA差异的表达校正系数,对种属特异性基因校正内参基因的成分含量进行系数校正。对于不同动物组织及同一组织不同物种之间含有的线粒体和线粒体DNA的数量的差异,本课题组将基于数字PCR技术进行拷贝数与DNA表达量之间的相互关系开展下一步更深入的研究,以期对更全面的肉类样品进行更加精准的定量分析。
本试验研究建立的以内参基因校正种属特异性基因的鲜肉及鲜肉制品中羊源性成分含量的实时荧光PCR测定方法具有较高的准确性和稳定性,方法回收率平均值可达到96.25%,无论是羊特异性体系还是通用体系都呈现良好的线性关系和较宽的线性范围,同时样品实测也具有市场适用性,有效解决了无法依据掺假轻重情节(即掺假量化数值)针对性地进行处罚和治理的难题,为相关监管和执法部门进一步加强监管、减少掺伪欺诈等行为的发生提供了可靠的技术支撑。
[1]殷海生.谈谈对牛马肉鉴别的方法与体会[J].学习与讨论,1994 (1):37-38
[2]郑明光,张国利,周志江,等.聚合酶链反应(PCR)鉴定马肉方法的建立及应用[J].肉晶卫生,1997(7):6-8
[3]J Chisholm,C Conyers,C Booth,et al.The detection of horse and donkey using real-time PCR[J].Meat Science,2005,70(4):727-732
[4]汪永信,安虹,程坚,等.双重实时荧光PCR法检测食品和饲料中的鸡源性成分[J].生物技术通报,2012(1):134-138
[5]曾少灵,秦智锋,阮周曦,等.多重实时荧光PCR检测牛、山羊和绵羊源性成分[J].生物工程学报,2009,25(1):139-146
[6]Zulal Kesmen,Ahmet E Yetiman,Fikrettin Sahin.et al.Detection o f Chicken and Turkey Meat in Meat Mixtures by Using Real-Time PCR Assays[J].Journal of food science,2012,77(2):C167-C173
[7]Rene Koppel,Ju g Ruf,Jurg Rentsch.Multiplex real-time PCR for the detection and quantification of DNA from beef,pork,horse and sheep[J].Eur Food Res Technol,2011,232(1):151-155
[8] Ergün■akalar,Mustafa Fatih Abasiyanik.Qualitative analysis of meat and meat products by multiplex polymerase chain reaction (PCR)technique[J].African Journal of Biotechnology,2011,10(46):9379-9386
[9]唐永凯,俞菊华,徐跑,等.建鲤内参基因EF-la的实时荧光定量PCR方法的建立[J].江西农业大学学报,2012,34(3):580-584
[10]周彤,李家鹏,田寒友,等.一种基于实时荧光聚合酶链式反应的肉及肉制品中猪源性成分含量测定[J].肉类研究,2013(12):11-15
[11]Köppel R,Ruf J,Rentsch J.Multiplex real-time PCR for the detection and quantification of DNA from beef,pork,horse and sheep[J]. European Food Research and Technology,2011,232(1):151-155
[12]Tartaglia M,Saulle E,Pestalozza S,et al.Detection of bovine mitochondrial DNA in ruminant feeds:a molecular approach to test for the presence of bovine-derived materials[J].Journal of Food Protection,1998,61(5):513-518
[13]Ballin N Z,Vogensen F K,Karlsson A H.Species determination-Can we detect and quantify meat adulteration?[J].Meat science,2009,83(2):165-174
[14]何玮玲,黄明,张驰.食品中肉类成分种属鉴别技术研究进展[J].食品科学,2012,33(3):304-307
[15]Brown W M,George M,Wilson A C.Rapid evolution of animal mitochondrial DNA[J].Proceedings of the National Academy of Sciences,1979,76(4):1967-1971
Quantitative Detection Method for Ovine-derived Materials in Fresh Meat and Meat Products Using Universal Primer
ZHAO Xin,LIU Na,CHEN Rui,WANG Cheng,ZHU Zhu,WANG Yong,LAN Qing-kuo*
(Institute of Tianjin Agriculture Quality Standard and Testing Technology,Tianjin 300381,China)
Targeting cytochrome b gene of mitochondrial DNA from beef,sheep,pork,chicken,duck,horse,the specific primers and TaqMan probes of sheep were designed.Combined with real-time PCR technology,the 16SrDNA reference gene was introduced,and the quantitative detection method of sheep in Fresh meat and meat products was established using reference gene correction by exogenous species-specific gene.The established method was validated through specific,universal detection,and analog mixed samples.The results showed a good specificity and a good universality.Through the construction of standard curve,both sheep-specific and universal systems showed a good linear relationship(R2>0.996).By Quantity value and the correction coefficient of sheep species-specific gene and 16SrDNA reference gene,the mass percentage content of the sample contained in sheep-derived ingredients could be calculated.The PCR method showed a high accuracy and the average recovery of sheep-derived ingredients in meat mixtures of simulation samples was 96.25%.
16SrDNA reference gene;exogenous species-specific gene;sheep-derived ingredient;quantitative analysis
2016-04-26
天津市应用基础与前沿技术研究计划(14JCQNJC14800)作者简介:赵新(1983—),女(汉),助理研究员,硕士,主要从事农产品分子检测技术研究。
兰青阔(1987—),男,副研究员,硕士,主要从事农产品安全质量分子检测技术研究。

