肝细胞癌患者外周血NK细胞频率及受体表达
张爱民,柳芳芳,杨 晓,李文刚,韩 萍,刘丽英,段学章
肝细胞癌患者外周血NK细胞频率及受体表达
张爱民,柳芳芳,杨 晓,李文刚,韩 萍,刘丽英,段学章
目的 检测肝细胞癌(hepatocellular carcinoma, HCC)患者外周血NK细胞频率、功能及受体表达的变化,并分析其在HCC患者中表达特点。方法 用流式细胞术检测36例HCC患者、34例乙型肝炎肝硬化(liver cirrhosis, LC)患者的外周血NK细胞频率及其受体CD158a、CD158b、NKG2D 、NKP30、NKP44、NKP46的表达情况,用IL-12刺激外周血单个核细胞(peripheral blood mononuclear cell, PBMC)、流式细胞术检测NK细胞分泌IFN-γ、TNF-α的能力,并用流式细胞毒性分析法检测NK细胞对K562细胞的杀伤效率,对2组NK细胞频率、受体及功能进行分析和比较。结果 2组患者NK细胞的频率差异无统计学意义(P>0.05)。CD56dimNK细胞的活化性受体NKG2D、NKP30表达在HCC组高于LC组(P<0.05)。在IL-12刺激下HCC组CD56brightNK细胞IFN-γ、TNF-α表达率、CD56dimNK细胞IFN-γ表达率均低于LC组(P<0.05)。HCC组NK细胞对K562的杀伤比例高于LC组(P<0.05)。结论 HCC组NK细胞分泌细胞因子能力低于LC组,但杀伤功能强于LC组,可能与其表面活化性受体高表达有关。
杀伤细胞;癌,肝细胞;流式细胞术; 细胞毒性, 免疫
NK细胞为固有免疫细胞,具有广泛的免疫学功能,参与适应性免疫应答,是连接固有免疫与适应性免疫的桥梁[1],是机体抗肿瘤免疫的第一道防线。NK细胞功能的发挥主要由其活化性受体和抑制性受体传递的信号共同决定,其对靶细胞的杀伤活性与其细胞表面受体密切相关。本研究通过检测HBV相关性肝细胞癌(hepatocellular carcinoma, HCC)患者外周血NK细胞频率、活化性及抑制性受体的表达情况及NK细胞的杀伤活性,探讨HCC患者外周血NK细胞受体表达变化及对NK细胞杀伤功能的影响。
1 对象与方法
1.1 对象 选择2013年6月—2014年12月我院收治的乙型肝炎肝硬化基础上发生的原发性HCC患者36例(HCC组),乙型肝炎肝硬化患者34例(肝硬化组)。HCC组患者男30例,女6例,平均年龄(52.59±9.28)岁, Child-Pugh分级A级14例、B级22例,按巴塞罗那肝癌(Barcelona Clinic Liver Cancer, BCLC)分期8例为早期、12例为中期、16例为晚期;肝硬化组患者男28例,女6例,平均年龄(47.54±15.29)岁,Child-Pugh分级A级15例、B级19例。所有病例均已接受核苷(酸)类似物抗病毒治疗,HBV DNA病毒载量皆低于500 IU/ml。2组患者男女比例、年龄、肝功能(Child-Pugh分级)差异无统计学意义(P>0.05)。肝癌诊断标准参照卫生部《肝细胞癌诊疗规范》(2011年版)[2],乙型肝炎肝硬化患者符合中华医学会肝病学分会和感染病学分会于2010 年制订的《慢性乙型肝炎防治指南》诊断标准[3],并排除其他肝炎病毒重叠感染、酒精性肝炎、药物性肝炎和自身免疫性肝炎者,所有病例均不合并其他恶性肿瘤及免疫性疾病。本研究所有入选病例均征得研究对象本人同意并经医院伦理委员会批准。
1.2 主要试剂和仪器 CD3-perCP、HLA-DR-perCP、CDl23-PE、CD11c-APC、lin-1 FITC、CD56-APC、INF-γ-PE单抗、TNF-α-PE单抗和7-AAD均购自美国BD Pharmingen公司;MultiTEST IMK试剂盒和TruCOUNT绝对计数管购自美国BD公司;IL-12、蛋白转运阻断剂(Golgistop)、破膜剂(Cytofix/Cytoperm)、破膜洗液(Cytoperm/Cytowash)购自美国Sigma公司;CFSE购自美国Invitrogen公司;FACSCalibur流式细胞仪为美国BD公司产品。
1.3 方法
1.3.1 NK细胞频率和数量检测 入选者于清晨采集肝素钠抗凝的空腹静脉血20 ml。采用MultiTEST IMK试剂盒和TruCOUNT绝对计数管,使用FACSMULTISET软件检测并进行自动分析。
1.3.2 流式细胞术检测NK细胞受体表达 常规方法分离3 ml外周血单核细胞(peripheral blood mononuclear cell, PBMC),加入到含有 4 ml淋巴细胞分离液的10 ml离心管中,以2000 r/min的速度,离心20 min。小心吸出中间层的淋巴细胞,PBS缓冲液洗涤 2 次,2000 r/min,离心15 min,计数细胞并调整细胞密度为1×106/ml。将获得的淋巴细胞立即进行荧光标记,检测6个指标,每管加入6种不同荧光素标记的抗体: CD3-CD56+NKG2D+;CD3-CD56+NKP30+;CD3-CD56+NKP44+;CD3-CD56+NKP46+;CD3-CD56+CD158a+;CD3-CD56+CD158b+各10 μl,对照管中加入相应的同型对照,取待测样品 100 μl分别加入各管,室温下避光孵育30 min,加入溶血剂300 μl,室温下避光孵育15 min,加入PBS缓冲液1 ml洗1次,1000 r/min离心10 min,弃上清,沉淀用PBS缓冲液重悬,上流式细胞仪检测。
1.3.3 细胞刺激及流式染色分析 常规方法分离PBMC。按l×107/ml的浓度接种于96孔板,每孔200 μl。加入终浓度为5 ng/ml的IL-12。按终浓度1.7μg/ml的量加入蛋白转运阻断剂(Golgistop)。将细胞培养板置于37℃,5%的CO2孵箱中孵育6 h后收获细胞进行流式染色。收获细胞于流式管中,每管加入CD3-PerCP 3 μl、CD56-APC 1 μl,避光染色15 min,洗涤后弃上清,加入破膜剂300 μl,避光20 min,加破膜洗液洗涤细胞后弃上清,分别加入INF-γ-PE、TNF-α-PE单抗3 μl避光染色15 min,加破膜洗液洗涤后弃上清,多聚甲醛400 μl固定,24 h内上机检测。使用Cellquest软件检测,FlowJo软件分析。
1.3.4 NK细胞杀伤K562细胞功能试验 用流式细胞毒性分析法检测,按说明书操作。用CFSE标记K562细胞作为靶细胞。将各组PBMC按照NK细胞的比例换算成NK细胞绝对数作为效应细胞数,以3×104/孔的浓度将K562细胞接种在96孔板中,按效/靶比(E/T)为3∶1、10∶1、30∶l的浓度梯度加入效应细胞,用培养基调整至200 μl/孔,将细胞培养板置于37 ℃,5%的CO2孵箱中孵育6 h后收获细胞于流式管中,尽快加入7-AAD 3 μl,5 min后立即上机检测。用CFSE圈出K562细胞,7-AAD阳性K562细胞为被NK细胞杀伤的靶细胞。
1.4 统计学处理 实验结果采用STATA12.0统计软件进行统计学分析,计量资料用sktest进行正态性检验,正态分布资料2组间采用t检验,结果以±s表示,非正态分布资料2组间采用ranksum检验,结果以中位数M(Q1~Q3)表示,2组间等级相关采用spearman检验,定性资料采用χ2检验,显著性检验标准为双侧P<0.05。
2 结 果
2.1 NK细 胞频 率、CD107a及 受 体 表 达 比较 2组患者外周血总NK细胞、CD56dimNK细胞、CD56brightNK细胞频率差异无统计学意义。CD56dimNK细胞在活化性受体NKG2D、NKP30表达HCC组高于肝硬化组,差异有统计学意义。详见表1和表2。
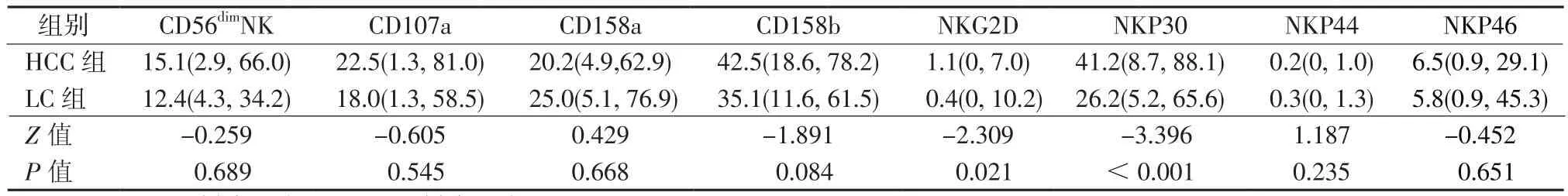
表1 CD56dimNK细胞频率与CD107a及受体表达频率[M(P25, P75) ,%]Table 1 Frequency of CD56dimNK cells, and expressing frequence of CD107a and its receptor

表2 CD56brightNK细胞频率与CD107a及受体表达频率[M(P25, P75) ,%]Table2 Frequency of CD56brightNK cells, and expressing frequency of CD107a and its receptor [M(P25, P75) ,%]
2.2 NK细胞IFN-γ、TNF-α表达频率比较 IL-12刺激后,CD56dimNK细胞、CD56brightNK细胞IFN-γ、 CD56brightNK细胞TNF-α表达频率LC组高于HCC组,差异有统计学意义。详见表3。

表3 NK细胞IFN-γ与TNF-α表达频率比较[M(P25, P75) ,%]Table 3 Comparison of frequency of IFN -γ and TNF-α of CD56brightNK and CD56dimNK cells under IL-12 stimulus[M(P25, P75) ,%]
2.3 NK细胞对K562细胞的杀伤率比较 2组患者外周血NK细胞对K562细胞的杀伤作用由表4可见,随着效靶比(E∶T)的升高,K562细胞被杀伤的比例逐渐增大。HCC组NK细胞对K562的杀伤比例高于肝硬化组(P<0.05)。
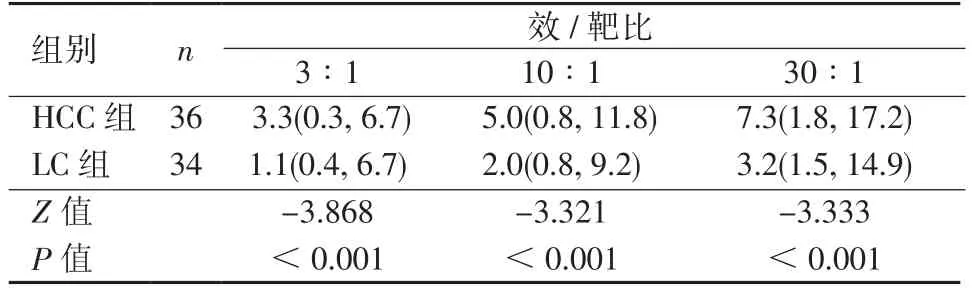
表4 NK细胞对K562细胞的杀伤率比较[M(P25, P75) ,%]Table 4 Comparison of the killing rate of NK cells to K562 cells[M(P25, P75) ,%]
2.4 NK细胞受体表达率与NK细胞毒功能相关分析 CD56dimNK细胞NKG2D、NKP30表达率与NK细胞杀伤K562细胞率等级相关分析显示,NKP30表达率与效靶比1∶10时NK细胞杀伤率等级相关(r=0.336,P=0.045),其余P值皆>0.05。
2.5 不同分期HCC患者NK细胞频率、受体表达率及功能比较 按BCLC分期标准分为早、中、晚期3组,分别进行比较,3组患者NK细胞频率、受体表达率、IFN-γ、TNF-α表达频率、K562细胞杀伤率差异皆无统计学意义(P值皆>0.05)。
3 讨 论
NK细胞是骨髓来源的淋巴细胞,可通过细胞毒效应和分泌细胞因子非特异杀伤肿瘤细胞和病毒感染细胞。根据NK细胞表面CD56密度的不同,可将其分CD56bright和 CD56dim2种亚型,人体内90%以上的NK细胞为高表达CD16且具有强烈的细胞毒效应的CD56dim细胞,而可产生大量细胞因子的CD56bright细胞不到10%。NK细胞主要通过2种方式诱导靶细胞的凋亡:颗粒胞吐作用和死亡受体作用。NK细胞受体主要有活化性受体NKp30、NKp44、NKp46、NKG2D、KIR2DS等和CD158a、CD158b等抑制性受体。NK细胞受体变化与细胞毒作用及肿瘤发生发展密切相关[4]。许多研究显示HCC患者外周血及癌组织标本中活化性受体表达降低而抑制性受体表达增强[5-7]。本研究显示HCC组外周血CD56dimNK细胞在活化性受体NKG2D、NKP30表达频率高于肝硬化组,结果与上述研究报道不一致。可能与本研究分别检测了CD56dimNK细胞和CD56brightNK细胞的活化性受体表达有关,而既往研究一般检测总的NK细胞活化性受体表达频率,且大部分研究选择对照组为健康志愿者,本研究选择的对照组为较健康志愿者NK细胞受体表达减低的肝硬化患者[8]。另本研究入选的HCC病例中少部分患者既往已行肝动脉栓塞化疗或放射治疗,而肝动脉栓塞化疗和放射治疗皆能提高NK细胞活化性受体表达[9-10]。
本研究中使用IL-12作为刺激剂,其刺激NK细胞分泌IFN-γ、TNF-α可以反映NK细胞分泌细胞因子的功能。本研究结果表明,经IL-12刺激后CD56brightNK细胞IFN-γ、TNF-α表达率,CD56dimNK细胞IFN-γ表达率HCC组均低于肝硬化组,故说明HCC组NK细胞分泌细胞因子功能受损,结果与相关研究一致[11]。IFN-γ对人NK细胞识别功能的负调节作用,可抑制NK细胞系活化受体NKG2D的表达,增强抑制性受体NKG2A/B和KIR2DLI的表达[12]。本研究结果显示HCC组外周血CD56dimNK细胞在活化性受体NKG2D、NKP30表达高于肝硬化组,推测可能与HCC组IFN-γ表达率低于肝硬化组有关,HCC患者NK细胞分泌IFN-γ减少,对活化性受体NKG2D抑制作用减弱,NKG2D受体表达增强。
NK细胞功能主要包括3个方面: 通过释放穿孔素、颗粒酶等杀伤效应分子发挥细胞毒作用;分泌 IFN-γ、TNF-α等细胞因子调节免疫反应;通过表达配体或受体介导细胞凋亡、传递胞间信号等。本研究结果显示HCC患者外周血NK细胞分泌IFN-γ、TNF-α功能受损,脱颗粒表达CD107a较肝硬化患者无明显差异,但其表面活化性受体NKG2D、NKP30表达增高,同时对K562细胞的杀伤功能增强。NK细胞主要通过释放粒酶和穿孔素杀伤靶细胞,其对K562细胞的杀伤的比例可以很好的反映NK细胞的杀伤功能。NK细胞主要通过2种方式诱导靶细胞的凋亡,颗粒胞吐作用和死亡受体作用。NK细胞中CD56dim是主要的释放穿孔素、发挥主要的杀伤功能的亚群。本研究同时显示2组患者CD56dimNK细胞百分率及脱颗粒表达CD107a功能无明显差异,但活化性受体NKG2D、NKP30表达HCC组高于肝硬化组,且CD56dimNK细胞活化性受体NKP30表达率与效靶比1∶10时NK细胞杀伤率等级相关,说明HCC组NK细胞杀伤K562细胞功能较强与CD56dimNK细胞表面活化性受体高表达有关。NK细胞受体的表达情况与NK细胞功能密切相关。实验表明,在NK细胞发挥细胞毒作用时,NKG2D和NCR常常具有协同作用。细胞表面表达呈低密度NCR的NK细胞(NCRdull型)时,NKG2D可发挥抗肿瘤作用,NK细胞受体变化与细胞毒作用及肿瘤发生发展密切相关[13]。
本研究结果显示HCC患者外周血NK细胞活化性受体表达增高、杀伤功能增强,提示在NK细胞介导的抗HCC免疫中,NK细胞受体发挥了重要的作用。为进一步通过调节NK细胞表面受体表达途径,选择合适的联合免疫治疗方法提供理论依据。
[1] Sun JC, Lanier LL. Natural killer cells remember: an evolutionary bridge between innate and adaptive immunity[J]. Eur J Immunol, 2009, 39(8):2059-2064.
[2] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011 年版)[J].临床肝胆病杂志,2011,27(11):1141-1159.
[3] 中华医学会肝病学分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版)[J]. 传染病信息,2011,24( 1): Ⅲ-ⅩⅤ.
[4] Domaica CI, Fuertes MB, Rossi LE, et al. Tumour-experienced T cells promote NK cell activity through trogocytosis of NKG2D and NKp46 ligands[J]. EMBO Rep, 2009, 10(8):908-915.
[5] Kohga K, Takehara T, Tatsumi T, et al. Serum levels of soluble major histocompatibility complex (MHC) class I-related chain A in patients with chronic liver diseases and changes during transcatheter arterial embolization for hepatocellular carcinoma[J]. Cancer Sci, 2008, 99(8):1643-1649.
[6] Kamimura H, Yamagiwa S, Tsuchiya A, et al. Reduced NKG2D ligand expression in hepatocellular carcinoma correlates with early recurrence[J]. J Hepatol, 2012, 56(2):381-388.
[7] Sha WH, Zeng XH, Min L. The correlation between NK cell and liver function in patients with primary hepatocellular carcinoma[J]. Gut Liver, 2014, 8(3):298-305.
[8] 张敏,徐向升,秦恩强,等. 慢性HCV感染者外周血自然杀伤细胞亚群的检测及临床意义[J]. 传染病信息,2013,26(2):100-102.
[9] Demaria S, Pilones KA, Vanpouille-Box C, et al. The optimal partnership of radiation and immunotherapy: from preclinical studies to clinical translation[J]. Radiat Res, 2014, 182(2):170-181.
[10] 严汀华,江金华,阙华星,等. TACE对肝癌细胞凋亡与NK细胞受体表达的影响[J]. 临床医药文献杂志,2015,2(2):203-205.
[11] Wu Y, Kuang DM, Pan WD, et al. Monocyte/macrophage-elicited natural killer cell dysfunction in hepatocellular carcinoma is mediated by CD48/2B4 interactions[J]. Hepatology, 2013,57(3):1107-1116.
[12] Zhang C, Niu J, Zhang J, et al. Opposing effects of interferon-alpha and interferon-gamma on the expression of major histocompatibility complex class I chain-related A in tumors[J]. Cancer Sci, 2008,99(6):1279-1286.
[13] Domaica CI, Fuertes MB, Rossi LE, et al. Tumour-experienced T cells promote NK cell activity through trogocytosis of NKG2D and NKp46 ligands[J]. EMBO Rep, 2009, 10(8):908-915.
(2015-12-09 收稿 2016-03-15 修回)
(责任编委 王永怡 本文编辑 卢福昱)
Peripheral NK cell frequency function and receptor expression in patients with hepatocellular carcinoma
ZHANG Ai-min, LIU Fang-fang, YANG Xiao, LI Wen-gang, HAN Ping, LIU Li-ying, DUAN Xue-zhang*Tumor Radiation Therapy Center, 302 Military Hospital of China, Beijing 100039, China * Corresponding author, E-mail: duanxuezhang2006@163.com
Objective To explore the changes of peripheral NK cell frequency, functions and the expression of the activating and inhibitory receptors on the surface of NK cells in patients with hepatocellular carcinoma (HCC), and to analyze the features of these two-type receptors in HCC patients. Methods Flow cytometry was detected in 36 cases of HCC patients, 34 patients with hepatitis B liver cirrhosis (LC) patients with peripheral blood NK cell frequency and receptor 158a, cd158b, NKG2D and NKp30 and NKP44,NKp46 expression, with interleukin 12 (IL-12) stimulation of peripheral blood mononuclear cells (PBMC) and flow cytometry detection of NK cell secretion of IFN-and TNF-A, and with the flow type cell toxicity analysis method was used to detect NK cells on K562 cell killing efficiency, through the analysis and comparison of the two groups of NK cell frequency, receptors and function. Results There was no significant difference in the frequency of NK cells between the two groups (P>0.05). The expression of NKG2D and NKP30 in CD56dimNK cells was higher than that in LC group (P<0.05). The expression rate of IFN-, TNF- and IFN- in CD56brightNK cells stimulated by IL-12 was lower than that in LC group (P<0.05). The ratio of HCC cells to K562 was higher in group NK than in group LC (P <0.05). Conclusions In group NK, the ability of secreting cytokines of HCC cells was lower than that of LC group, but the killer function was stronger than that of LC group, which might be related to the high expression of the surface active receptor.
killer cells; carcinoma, hepatocellular ; flow cytometry; cytotoxicity, immunologic
[中国图书资料分类号] R392.12;R512.6 A
1007-8134(2016)04-0213-04
10.3969/j.issn.1007-8134.2016.04.005
首都特色课题(Z151100004015002)
100039 北京 ,解放军第三〇二医院肿瘤放射治疗中心(张爱民、杨晓、李文刚、韩萍、刘丽英、段学章),肝衰竭诊疗研究中心(柳芳芳)
段学章,E-mail: duanxuezhang2006@163.com

