恩替卡韦治疗慢性HBV感染者KIR基因多态性与疗效的相关性研究
孙 迪,杨 建,刘祥忠,赵守光,宋 哲,胡克义,徐明华,苏 洁,刘金玲,庄云龙
恩替卡韦治疗慢性HBV感染者KIR基因多态性与疗效的相关性研究
孙 迪,杨 建,刘祥忠,赵守光,宋 哲,胡克义,徐明华,苏 洁,刘金玲,庄云龙
目的 探讨慢性HBV感染者杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptor, KIR)基因多态性及其与应用恩替卡韦疗效差异相关性。方法 采用序列特异性引物聚合酶链反应(PCR-SSP)法,对60例应用恩替卡韦治疗的慢性HBV感染者(试验组)和60例健康对照者(对照组)的KIR基因进行基因分析,比较试验组和对照组的差异。60例患者中18例为治疗完全应答者 (完全应答组),42例为非完全应答者(非完全应答组),比较2组之间差异。结果 通过试验组和对照组的16种KIR基因分析,框架基因KIR2DL4、3DL2、3DL3和3DP1存在于所有个体中,其基因频率均为1.0。试验组KIR 2DS2和KIR2DS3基因型频率高于对照组(P值依次为0.038和0.035);完全应答组KIR2DS1、KIR3DS1和KIR2DL5基因型频率高于非完全应答组 (P值依次为0.010、0.029和0.018)。结论 KIR2DS2、KIR2DS3可能是HBV的易感基因型,KIR2DS1、KIR3DS1、KIR2DL5可能与恩替卡韦抗HBV治疗有效应答有关。
杀伤细胞免疫球蛋白样受体;基因型;完全应答;序列特异性引物聚合酶链反应;恩替卡韦;无应答;部分应答
杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptor, KIR)属于免疫球蛋白样受体超家族的一组分子,其基因位于人染色体19q13.4,是继人类白细胞抗原后发现的具有高度多态性的免疫调节基因家族,表达于NK细胞和部分T细胞表面。KIR基因多态性是其分子多态性的遗传基础, 因而 KIR 基因多态性有可能影响慢性HBV感染后的机体免疫反应及其临床抗HBV疗效[1]。
恩替卡韦是一种鸟嘌呤核苷类似物,其作用靶点为HBV的逆转录酶,可抑制HBV的逆转录酶。其强效降低HBV载量及低耐药发生率的特点在慢性乙型肝炎(慢乙肝)的治疗中得到广泛的临床应用。为了探讨KIR基因多态性与慢性HBV感染者及其对恩替卡韦抗HBV治疗应答差异的相关性,我们对60例接受恩替卡韦治疗的HBeAg阳性慢乙肝患者(包括完全应答、部分应答及无应答者)及60例健康志愿者分别检测 KIR 基因分型,分析基因多态性分布的差异。
1 对象与方法
1.1 对象 2012年10月—2013年6月于烟台市传染病医院就诊的初治HBeAg阳性慢乙肝患者,在患者知情同意应用恩替卡韦(商品名润众,江苏正大天晴药业)抗HBV治疗基础上,随机选取60例患者(试验组),男40例,女20例,年龄28~55岁,平均年龄40岁,均为山东籍汉族。口服恩替卡韦0.5 mg/d用于抗HBV治疗,疗程为48周。48周后达到病毒学应答(病毒载量低于检测下限),且HBeAg血清学转换者为完全应答;达到病毒学应答,未出现HBeAg血清学转换者为部分应答;未达到病毒学应答者为原发性无应答。HBeAg阳性慢乙肝诊断标准符合2015年中华医学会肝病分会和感染病学分会制订的病毒性肝炎诊断标准[2], 并排除其他病毒(HIV、HCV、HEV及EBV)感染、自身免疫性疾病、药物性肝炎以及核苷类抗病毒药物应用史者。正常对照为随机选择同一时期本站无偿献血者(要求供血者符合献血者健康标准)60例(对照组), 男38例,女22例, 年龄19~55岁,平均年龄38岁,均为山东籍汉族。对照组和试验组成员均无亲缘关系。
1.2 检测方法 所有试验组及对照组均采集EDTA抗凝血5 ml和血清3 ml置-70 ℃冰箱保存,分别进行血清HBV感染指标和KIR基因型检测。
1.3 试剂与仪器 定量分析试剂 [美国雅培,HBsAg(稀释),批号54642LF00],HBsAb(美国雅培,批号50317LF00),HBeAg(美国雅培,批号51306LI00),HBeAb(美国雅培,批号52227LI00),HBcAb(美国雅培,批号45710LI00;生化分析仪(美国雅培,Abbott Ci16200);HBV核酸定量分析试剂(深圳凯杰,批号20150501/2),HBV荧光定量核酸分析仪(A美国ABI,BI7500)。
血液基因组DNA提取试剂为EZBeadTMBlood DNA Extraction Kit (美国Texas BioGene,批号148023522),dNTP (美 国Promega,批号18125),Tag DNA聚合酶(美国Promega,批号CKA3701D),普通酶(美国Promega,批号00122458),琼脂糖(美国Genetech,批号111860),PCR特异性引物和内参照引物(上海博尚生物技术有限公司合成);EZBeadTMsystem-32DNA提取工作站(美国Texas BioGene),PCR扩增仪(美国ABI公司,GeneAmp PCR system 9700);BYY-6B型电泳仪(北京六一仪器厂),GeneGenius型Syngene生物图像分析仪(美国Syngene 公司)。
1.4 DNA提取 利用DNA提取工作站和试剂提取血液基因组DNA,按说明书操作。
1.5 KIR基因型检测 采用PCR-SSP法对60例HBV患者和60例健康者的17个KIR基因进行分型。KIR基因PCR特异性引物序列(见表1)。PCR反应体系10 μ l:包括20 ng的受检基因组DNA(1 μ l)、0.2 mmol/L的dNTP (0.4 μ l)、0.5 IU Taq DNA聚合酶(0.1 μ l)、0.4 μ mol/L的引物(除KIR2DS1的引物为0.8 μ mol/L外)(0.4 μ l)和1×PCR反应缓冲液(2 μ l,5X),用水补齐总体积。PCR反应的阳性内参照为生长因子基因(growth hormone gene, GH),上游引物5′TTCCCAACCATTCCCTTA 3′,下游引物5′CGGATTTCTGTTGTGTTTC3′,扩增片段大小为423 bp。PCR反应参数94℃,4 min;94 ℃,30 s,65 ℃,30 s,72℃,90 s,30个循环。72℃,10 min;4℃,保存。部分KIR基因PCR扩增的退火温度略有变化:KIR2DS2 (63℃)、KIR2DS3 (63℃)、KIR2DS4 (61℃)和KIR2DS5(63℃)。PCR产物用1%~2%琼脂糖凝胶电泳检查,Syngene生物图像分析仪进行结果分析。

表1 KIR 基因的序列特异性PCR引物Table 1 Sequence-specific PCR primers of KIR genes
1.6 KIR基因单体型分析 依据Hsu等[3]制定的KIR基因单体型分型综合标准分型。①所有单体型均包含3DL3、2DL4和3DL2;②一个单体型中含有2DL2或2DL3,但非同时存在;③一个单体型中含有3DP1或3DP1v,但非同时存在;④单体型B携带一个或多个KIR2DS1、KIR2DS2、KIR2DS3、KIR2DS5和KIR3DS1,而单体型A不包含这些基因。单体型1包含:KIR3DL3、2DL3、2DP1、2DL1、3DP1、2DL4、3DL1、1D和3DL2;单体型2包含:KIR3DL3、2DL3、2DP1、2DL1、3DP1、2DL4、3DL1、2DS4和3DL2;单体型3包含:KIR3DL3、2DS2、2DL2、3DP1v、2DL4、3DL1、1D和3DL2;单体型4包含:KIR3DL3、2DS2、2DL2、3DP1v、2DL4、3DL1、2DS4和3DL2; 单体 型5包 含:KIR3DL3、2DL3、2DP1、2DL1、3DP1、2DL4、3DS1、2DL5、2DS5、2DS1和3DL2;单体型6包含:KIR3DL3、2DL3、2DP1、2DL1、3DP1、2DL4、3DS1、2DL5、2DS3、2DS1 和3DL2;单体型8包含:KIR3DL3、2DS2、2DL2、2DP1、2DL1、3DP1、2DL4、3DL1、2DL5、2DS3、1D和3DL2;单体型9包含:KIR3DL3、2DS2、2DL2、2DP1、2DL1、3DP1、2DL4、3DS1、2DL5、2DS3、2DS1和3DL2;单体型11包含:KIR3DL3、2DP1、2DL4、2DS1和3DL2;单体型13包含:KIR3DL3、2DS2、2DL2、3DP1v、2DL4、3DL1、2DL5、2DS5、2DS1和3DL2;单体型17包含:KIR3DL3、2DS2、2DL2、2DP1、2DL1、3DP1、2DL4、3DL1、2DL5、2DS5、2DS1和3DL2;单体型23包 含:KIR3DL3、2DP1、2DL1、3DP1、2DL4、3DL1、2DL5、2DS3、1D和3DL2。基因型为2个单体型的组合,并以不同的字母表示。新发现的基因型暂以NF命名。
1.7 统计学处理 参照文献方法[3], KIR基因的基因型频率(genotypic frequency, gf)通过直接计数测得百分率。用SPSS 13.0统计软件进行χ2相关分析,P<0.05表示差异有统计学意义。用比值比(OR)分析关联强度,用Woolf公式计算OR (OR=ad/bc)及95%CI。
2 结 果
2.1 试验组gf 试验组KIR2DS2和KIR2DS3 gf均显著高于对照组(P值依次为0.038和0.035),OR值依次为2.213和2.500,其余各激活型KIR基因的表型频率在2组人群中差异无统计学意义,抑制型KIR基因的表型频率在试验组和对照组中相比差异无统计学意义(见表2)。

表2 试验组和对照组KIR gf比较Table 2 Comparison of KIR gf between experimental group and control group
2.2 试验组治疗应答情况 60例患者接受恩替卡韦治疗18周时,完全应答18例(30%)、部分应答36例(60%)、无应答6例(10%)。见表3。2.3 试验组中完全应答组与非完全应答组中KIR gf比较 完全应答组KIR2DS1、KIR3DS1和KIR2DL5 gf高于非完全应答组 (P值均<0.05),OR依次为4.462,3.523,3.929。见表4。
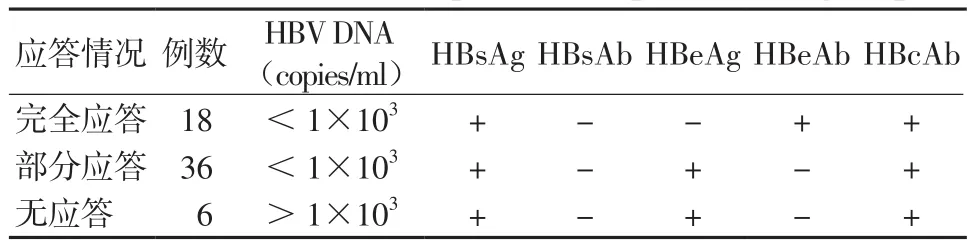
表3 试验组治疗应答情况Table 3 Treatment response of experimental group
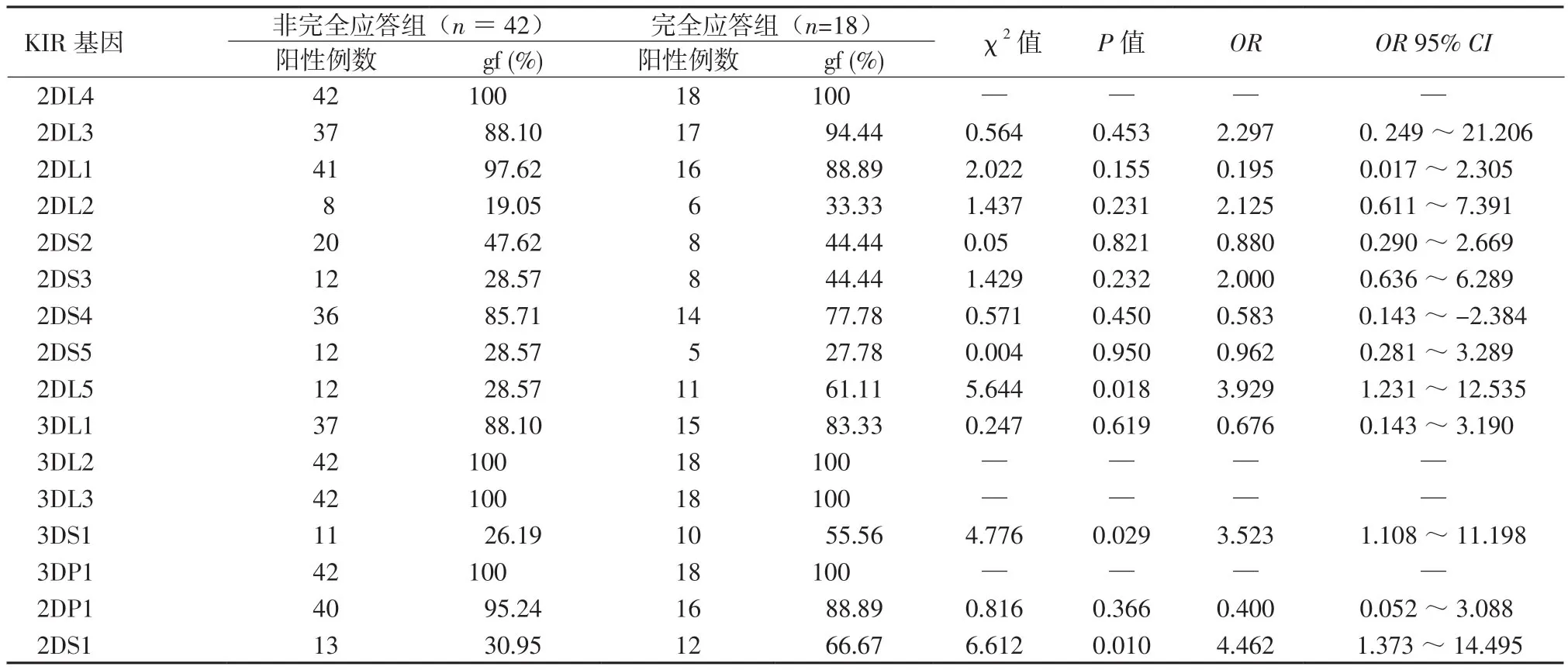
表4 完全应答组与非完全应答组中KIR gf 比较Table 4 Comparison of the frequency of KIR genotypes between CRG and partial or null response group
2.4 试验组中部分应答、无应答及完全应答患者KIR gf详情 部分应答组、无应答组和完全应答组KIR gf详情见表5,因无应答组样本量少,未做进一步统计分析。
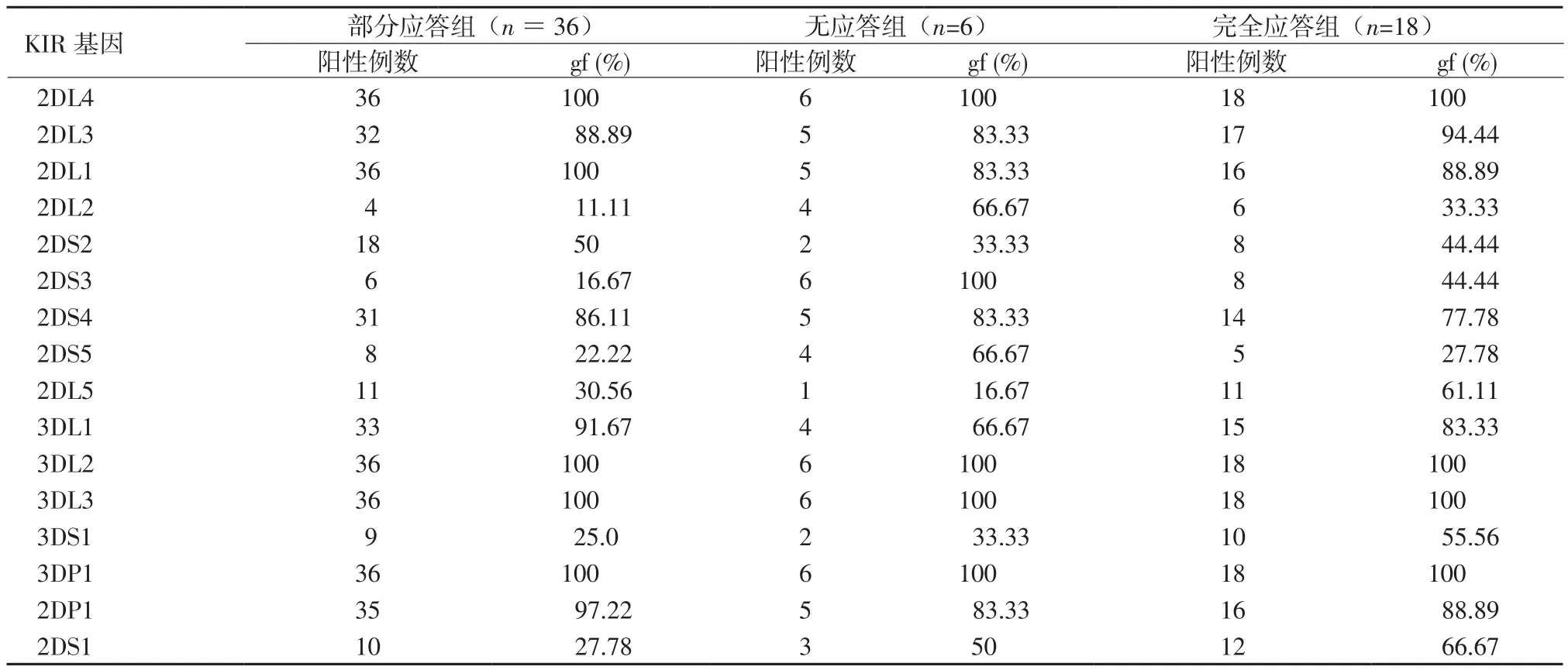
表5 部分应答组、无应答组和完全应答组中KIR gfTable 5 Comparison of the frequency of KIR genotypes among CRG, PRG and NRG
3 讨 论
KIR基因多态性是其分子多态性的遗传基础,KIR基因的高度多态性构成了不同种族和个体间疾病易感性和免疫应答差异的遗传学基础。KIR基因的多态性决定着机体对病毒等生物致病因素的免疫能力,KIR在多种疾病的发生和发展中起着重要的作用[4-8],随着近年来的研究,KIR基因在疾病中的作用愈发受到关注,在许多疾病病因学的研究中均发现不同疾病的易感性与不同的KIR基因相关[9-11]。
在我国慢性HBsAg携带者中至少有1/3~1/2或以上是母婴传播而造成,HBsAg携带者中母亲传播给婴儿的概率平均为40%(25%~45%),明显高于非洲和欧美地区,其可能与病毒复制状态、母亲血液中HBV DNA载量和遗传因素有关[12]。机体感染HBV后,部分患者可发生免疫反应,自然清除HBV,部分患者转为慢性HBV携带,在多种因素作用下可发展成慢乙肝,需要接受临床治疗。目前认为HBV感染的临床结局与宿主遗传因素、免疫状态和病毒因素等多种因素有关,NK细胞及CD8+T细胞表面的KIR能够特异性与靶细胞表面HLA-Ⅰ类分子结合形成受体配体复合物,调节NK及细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)毒活性[3, 13],从而发挥抗病毒作用,而KIR分子具有的高度多态性,将影响到其与配体结合的特异性和稳定性,是影响上述细胞功能状态的重要原因之一[14-15],因而 KIR基因多态性有可能影响HBV感染后的机体免疫反应及其临床结局。近年来研究表明KIR与HBV感染、HCV感染及抗病毒治疗效果有关[14, 16-17]。
本研究中显示试验组与对照组中框架基因2DL4、3DL2、3DL3和3DP1存在于所有个体中,其基因频率均为1.0;通过比较KIR基因在试验组与对照组中的频率可以看出,KIR2DS2、KIR2DS3在试验组中的分布频率均高于对照组,与报导相一致[13, 18-20],提示KIR2DS2、2DS3与HBV感染的易感性相关。激活型KIR基因与疾病的发生发展和治疗的关系密切,提示这些基因可能通过转导抑制或活化信号调节NK细胞介导的抗感染免疫,激活型KIR基因通过NK、T细胞传递更多的激活信号,激活型和抑制型基因平衡紊乱可能是HBV感染后发病的免疫因素,并可导致机体感染HBV后慢性化。
目前抗HBV药物主要包括干扰素和核苷(酸)类似物2类,其中核苷类似物恩替卡韦,由于其强效、快速降低病毒量,并且具备耐药基因屏障等特点,被我国慢乙肝治疗指南及国外慢乙肝治疗指南推荐为主要或一线药物[21-24],其在临床上广泛应用,可有效缓解病情进展,经过治疗,部分患者可达完全应答,但仍有应答不佳患者(部分应答),甚至为无应答。慢乙肝患者临床药物疗效,国内已有KIR基因多态性与干扰素的相关性报导[1],但对于应用核苷类似物恩替卡韦抗病毒疗效与KIR基因型的相关性尚未有报导。我们的研究提示慢性HBV感染者应用恩替卡韦抗病毒的疗效可能与某些KIR基因型明显相关,完全应答组KIR2DS1、KIR3DS1、KIR2DL5阳性率较非完全应答组增高,我们推测KIR2DS1、KIR3DS1、KIR2DL5可能与抗病毒治疗有效应答有关,KIR2DS1、KIR3DS1、KIR2DL5可能促进HBV清除。不同KIR基因型,由于其KIR位点基因的组成不同,NK细胞受体对HBV病毒感染的影响可能涉及多个激活性和抑制性受体,使NK细胞和/或T细胞功能异常而导致机体发生不利的免疫反应,进而影响HBV特异性细胞毒性T淋巴细胞功能的有效发挥,继而影响机体抗病毒感染、对病毒清除的敏感性, 从而造成慢性HBV感染者对恩替卡韦治疗应答的差异,但KIR基因与恩替卡韦在抗病毒免疫反应的内在联系尚不十分清楚。本次分析样本量较少,尚未包括HBeAg阴性的慢乙肝患者,因此须要进一步扩大样本量继续研究,尤其是对部分应答、无应答者进行分组分析,以及探寻传播途径方式的影响等,以便为我们更深入地了解慢乙肝的发病机制,并对治疗方案疗效预测提供依据。
[1] 李长缨,罗维礁,柳富会,等. KIR基因多态性与HBV感染及干扰素疗效的相关性研究[J]. 预防医学论坛,2011,8(17):675-678.
[2] 中华医学会肝病学分会,中会医学会感染病学分会. 慢性乙型肝炎防治指南 (2015年更新版)[J]. 传染病信息,2015,28(6):321-340.
[3] Hsu KC, Liu XR, Selvakumar A, et al. Killer Ig-like receptor haplotype analysis by gene content: evidence for genomic diversity with a minimum of six basic framework haplotypes, each with multiple subsets[J]. J Immunol, 2002, 169(9):5118-5129.
[4] Yen JH, Lin CH, Tsai WC, et al. Killer cell immunoglobulin-like receptor gene's repertoire in rheumatoid arthritis[J]. Scand J Rheumatol, 2006, 35 (2):124-127.
[5] 张海清,赵家军,赵跃然,等. 杀伤细胞免疫球蛋白样受体基因多态性与 Graves病相关[J]. 中华内分泌代谢杂志,2006,22(2):130-131.
[6] Gardiner CM, Shilling HG, Shilling HG. Different NK cell surface phenotypes defined by the DX9 antibody are due to KIR3DL1 gene polymorphism [J]. Immunol, 2001, 166(5):992-3001.
[7] 陈阿梅,郭晓明,闫文瑛,等. 白血病患者的杀伤细胞免疫球蛋白样受体基因多态性研究[J]. 中国实验血液学杂志,2007,15(1):35-38.
[8] 乔文本,刘丽,庄云龙,等. 山东地区汉族人群杀伤细胞免疫球蛋白样受体和白细胞抗原C基因与梅毒的关系[J]. 国际免疫学杂志,2013,36(1):64-69.
[9] Eller MA, Koehler RN, Kijak GH, et al. Human immunodeficiency virus type 1 infection is associated with increased NK cell polyfunctionality and higher levels of KIR3DL1+ NK cells in ugandans carrying the HLA-B Bw4 motif[J]. J Virol, 2011,85(10):4802-4811.
[10] Salim P H, Jobim M, Jobim L F, et al. Autoimmune rheumatic diseases and their association with killer immunoglobulin- like receptor genes[J]. Rev Bras Reumatol, 2011, 51(4):351-364.
[11] Omar S Y, Marshall E, Middleton D, et al. Increased killer immunoglobulin- like receptor expression and functional defects in natural killer cells in lung cancer[J]. Immunology, 2011,133(1):94-104.
[12] 姚光弼. 临床肝脏病学[M].上海:上海科学技术出版社,2011:238.
[13] Lu Z, Zhang B,Chen S, et a1. Association of KIR genotypes and haplotypes with susceptibility to chronic hepatitis B virus infection in Chinese Han population[J]. Cell Mol Immunol, 2008,5(6):457-463.
[14] 张园园,王青青,王建莉,等. NK受体KIR生物学功能的研究进展[J]. 免疫学杂志,2005,21(3):262-264.
[15] Willianms AP, Baterman AR, Khakoo SI. Hanging in the balance KIR and their role in disease[J]. Mol Interv, 2005, 5(4):226-240.
[16] Bonorino P, Leroy V, Dufeu-Duchesne T, et al. Features and distribution of CD8 T cells with human leukocyte antigen class I-specific receptor expression in chronic hepatitis C[J]. Hepatology, 2007, 46(5):1375-1386.
[17] Taniguchi M, Kawabata M. KIR3DL1/S1 genotypes and KIR2DS4 allelic variants in the AB KIR genotypes are associated with Plasmodium-positivein dividual sinmalariain fection[J].Immunogenetics, 2009, 61(11-12):717-730.
[18] Zhi-ming L, Yu-lian J, Zhao-lei F, et al. Polymorphisms of killer cell immunoglobulin-like receptor gene: possible association with susceptibility to or clearance of hepatitis B virus infection in Chinese Han population[J]. Croat Med J, 2007, 48(6):800-806.
[19] Lu Z, Zhang B, Chen S, et a1. Association of KIR genotypes and haplotypes with susceptibility to chronic hepatitis B virus infection in Chinese Han population[J]. Cell Mol Immunol, 2008, 5:457-463.
[20] Lu ZM, Jiao YL, Feng ZL, et a1. Polymorphisms of killer cell immunoglobulin-like receptor gene: possible association with susceptibility to or clearance of hepatitis B virus infection in Chinese Han population[J]. Croat Med J, 2007, 48:800-806.
[21] Lok AS, McMahon BJ. Chronic hepatitis B: update 2009[J]. Hepatology, 2009, 50(3):661-662.
[22] 中华医学会肝病学分会,中会医学会感染病学分会.慢性乙型肝炎防治指南 (2015年更新版) [J].传染病信息,2016,29(1):1-33.
[23] Liaw YF, Kao JH,Piratvisuth T, et al. Asian-Pacific consensus statement on the management of chronic hepatitis B:a 2012 update [J]. Hepatol Int, 2012, 6(3):531-561.
[24] European Association for the Study of the Liver. EASL clinical practice guidelines:management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1) :167-185.
(2016-03-29 收稿 2016-06-28 修回)
(责任编委 王永怡 本文编辑 卢福昱)
Association between KIR genes polymorphisms and the efficacy of entecavir treatment in patients with chronic hepatitis B
SUN Di, YANG Jian, LIU Xiang-zhong*, ZHAO Shou-guang, SONG Zhe, HU Ke-yi, XU Ming-hua, SU Jie, LIU Jin-ling, ZHUANG Yun-long Yantai Central Blood Station, Yantai 264003, China *Corresponding author, E-mail: xiangzhong8686@sina.com
Objective To explore whether KIR genotype polymorphisms is associated with HBV infection and the efficiency of chronic hepatitis B (CHB) patients treated with entecavir (ETV). Methods Polymerase chain reaction with sequence -specific primers (PCR-SSP ) method was used to genotype KIR genes in 60 CHB patients and 60 healthy controls. Of the 60 patients, 18 were total responders to the treatment with ETV (complete response group, CRG) and 42 were null or partial responders (partial or null response group, PRG or NRG). The distributions of KIR genotypes were analyzed between the experimental group and the control group. Results Analyzing 16 KIR genotypes between the experimental group and the control group, framework genes KIR2DL4,KIR3DL2, KIR3DL3 and KIR3DP1 were present in all individuals.The frequencies of them are both 1.0. The frequencies of KIR2DS2 and KIR2DS3 in the experimental group were significantly higher than those in the control group (P= 0.038 and P = 0.035, respectively). The frequencies of KIR2DS1 , KIR3DS1 and KIR2DL5 in CRG were significantly higher than those in PRG and NRG (P= 0.010 , P = 0.029 and P = 0.018 respectively). Conclusions KIR2DS2 and KIR2DS3 may be HBV susceptible genotypes. KIR2DS1, KIR3DS1 and KIR2DL5 may be of benefit to anti-HBV therapy with ETV.
KIR; genotype; complete response; PCR-SSP; ETV; null response ; partial response
[中国图书资料分类号] R512.62; R394.21 A
1007-8134(2016)04-0216-06
10.3969/j.issn.1007-8134.2016.04.006
烟台市科学技术发展计划(2013WS259)
264003,山东烟台市中心血站(孙迪、杨建、赵守光、宋哲、胡克义、徐明华、苏洁);264001,山东烟台市传染病医院(刘祥忠);250014 济南,山东省血液中心(刘金玲、庄云龙)
刘祥忠,E-mail: xiangzhong8686@sina.com

