激素与静脉丙种球蛋白及其联合应用治疗静脉丙种球蛋白无反应川崎病的回顾性对照研究
杨 莹 张 静
·论著·
激素与静脉丙种球蛋白及其联合应用治疗静脉丙种球蛋白无反应川崎病的回顾性对照研究
杨莹张静
目的探讨激素对静脉丙种球蛋白(IVIG)无反应川崎病(KD)患儿的治疗价值。方法回顾性收集重庆医科大学附属儿童医院IVIG无反应KD住院患儿,根据再治疗情况分为IVIG组、激素组和IVIG+激素组;将应用激素者根据激素应用途径分为静脉滴注序贯口服激素组和口服激素组。统计各组患儿的总热程、平均热退时间、治疗前后实验室检查结果并计算治疗前后的差值与治疗前值的比值(即差值比△)、急性期及出院后6、12、24个月冠状动脉病变和随访中的血栓形成情况。结果IVIG无反应KD患儿143例进入本文分析。IVIG组107例,激素组12例, IVIG+激素组24例,3组性别、年龄、体重差异无统计学意义。IVIG+激素组治疗后WBC高于IVIG组,△WBC、△PLT均低于IVIG组,△CRP高于IVIG组,总热程长于IVIG组;急性期冠状动脉瘤发生率及随访至6个月时冠状动脉扩张发生率高于IVIG组,差异均有统计学意义;激素组△WBC低于IVIG组,总热程长于IVIG组,差异均有统计学意义。静脉滴注序贯口服激素组和口服激素组各18例,2组性别、年龄、体重差异无统计学意义,口服激素组再次治疗前和再次治疗后CRP均低于静脉滴注序贯口服激素组, 口服激素组△PLT高于静脉滴注序贯口服激素组,2组随访时点冠状动脉扩张和冠状动脉瘤发生率差异均无统计学意义。随访病例中,静脉滴注序贯口服激素组有2例出现血栓,经积极抗凝治疗后血栓消失。结论IVIG无反应KD患儿再治疗时应用激素或再次IVIG无反应后应用激素,与单纯IVIG相比急性期治疗效果相近,且均不增加远期冠状动脉损伤的发生率;选择普通剂量口服或者静脉滴注序贯口服疗法临床效果相近,但静脉滴注序贯口服激素较口服激素有更高的血栓形成风险。
川崎病;静脉丙种球蛋白无反应;激素
川崎病(KD)是一种急性发热出疹性疾病。主要引起全身中小血管非特异性炎性反应,其中以冠状动脉病变(CALs)最为严重,可形成冠状动脉扩张、冠状动脉瘤。目前公认的标准疗法是静脉输注丙种球蛋白(IVIG)联合口服阿司匹林[1]。但是仍有15%~25% KD患儿对此治疗无反应[2]。大量研究提示,IVIG无反应KD患儿出现CALs的风险更高[2,3],寻找更有利于这部分患儿的治疗方案很重要。目前IVIG无反应KD患儿应用激素治疗已经受到越来越多临床医生的认可,但激素使用的方式、时机、剂量、对KD急性期临床症状的缓解及对CALs的远期影响等仍存在争议,本研究就激素在初次IVIG无反应KD患儿中的应用价值进行初步探讨。
1 方法
1.1研究设计回顾性收集重庆医科大学附属儿童医院(我院)IVIG无反应KD住院患儿,根据再治疗情况分为IVIG组、激素组和IVIG+激素组,分别采集并评价急性期治疗效果及远期疗效。
1.2KD诊断标准根据日本KD研究委员会2005年提出的修订版KD诊断标准[4]。
1.3IVIG无反应KD诊断标准[5]IVIG治疗后36 h发热不退(体温≥38℃)或给药2~7 d发热及至少1项KD诊断的症状再现,同时除外继发感染者。
1.4CALs定义①行CALs超声检查同时有体重测量记录者:急性期冠状动脉Z值的计算参考de Zorzi等[6]制定的经体表面积校正的冠状动脉正常值公式,Z=(实际观察值-正常值均数)/标准差,冠状动脉内径Z值>2.5判定为冠状动脉扩张,冠状动脉内径Z值>2.5且最大径>4 mm判定为冠状动脉瘤。②行CALs超声检查时无体重测量记录者:采用我院CALs诊断标准[7]:a.冠状动脉扩张:≤3岁冠状动脉内径≥2.5 mm,~9岁冠状动脉内径≥3.0 mm,~14岁冠状动脉内径≥3.5 mm;b.冠状动脉瘤:不同形状的冠状动脉扩张且冠状动脉内径>4 mm。
1.5病例纳入标准①在我院出院诊断为KD病例,并符合IVIG无反应KD诊断标准;②初次治疗均在急性期(起病10 d内)且予IVIG 2 g·kg-1·d-1×1 d或1 g·kg-1·d-1×2 d同时口服阿司匹林治疗。
1.6病例排除标准①出院诊断中有其他影响体温变化的疾病,如幼年特发性关节炎等;②院外初次治疗信息不详者。
1.7IVIG无反应KD再次治疗方案和分组IVIG无反应KD再次治疗包括:①IVIG 2 g·kg-1·d-1×1 d和1 g·kg-1·d-1×2 d;②静脉滴注激素后口服激素:一次或分次静脉滴注甲泼尼龙1~7.5 mg·kg-1·d-1,根据退热情况改为分次口服泼尼松1~2 mg·kg-1·d-1,根据退热情况逐渐减量至停药;③分次口服泼尼松1~2 mg·kg-1·d-1,根据退热情况逐渐减量至停药。均口服阿司匹林。根据治疗方案归纳分组:①IVIG组,②激素组(静脉滴注激素后口服激素亚组和口服激素亚组),③IVIG+激素组(IVIG+静脉滴注激素后口服激素亚组和IVIG+口服激素亚组),简称3方案分组。为观察激素对IVIG无反应KD再次治疗效果,将静脉滴注激素后口服激素者(包括用或不用IVIG)或口服激素者(包括用或不用IVIG)分别进入静脉滴注序贯口服激素组和口服激素组,简称2方案分组。
西江,珠江水系最大干流,全长2129公里,发源于云南,如一条经济长飘带穿越云南、贵州、广西、广东四省区,通达港澳,年进出港船舶高达百万艘次,是云贵等内陆地区融入粤港澳大湾区的交通大动脉。其中,广东段全长约347公里,经6个口门流入南海,沿江有44座取水口,是沿江千万住户的饮用水源;有码头230座,二类及以上口岸24个,桥梁33座,渡口54道,水上加油站23个,水上安全监管及防污染的压力都非常大。
1.8观察指标初次IVIG无反应KD应用激素(静脉滴注序贯口服激素和口服激素):①总热程(发热开始至治疗后体温稳定48 h的总天数);②平均热退时间(再次治疗当天至体温稳定48 h所需时间);③实验室检查结果:治疗前(再次治疗前最近1次检查结果)、治疗后(再次治疗后最接近1周时)WBC、中性粒细胞分类(N%)、PLT和CRP,并计算治疗前后差值与治疗前值的比值即差值比(△);④治疗后1周内超声评价CALs严重程度;⑤出院后6、12、24个月CALs随访情况;⑥随访中的血栓病变。

2 结果
2.1一般情况2010年1月至2014年12月从我院住院病历中共收集到符合本文纳入和排除标准的初次IVIG无反应KD 143例,男95例,女48例,平均发病年龄为27.8月龄。3方案分组中治疗前总发热时间10.6 d,治疗后平均退热时间1.9 d;2方案分组中治疗前总发热时间13.6 d,治疗后平均退热时间2.1 d。
IVIG组107例(IVIG 2 g·kg-1·d-1×1 d者 97例、1 g·kg-1·d-1×2 d者 10例),男71例,女36例,平均发病年龄为(27.7±19.6)月龄,体重(12.5±4.2) kg;激素组12例(静脉滴注序贯口服激素亚组3例,口服激素亚组9例),男8例,女4例,平均发病年龄为(31.7±17.7)个月, 体重(12.6±3.7) kg;IVIG+激素组24例(IVIG 2 g·kg-1·d-1×1 d者 22例,其中静脉滴注序贯口服激素亚组14例,口服激素亚组8例;1 g·kg-1·d-1×1 d者 2例,静脉滴注序贯口服激素亚组和口服激素亚组各1例),男16例,女8例;平均发病年龄为(26.2±18.6)个月, 体重(12..0±3.5) kg。IVIG组、激素组和IVIG+激素组,性别(χ2=0.001,P=0.999),年龄(Z=1.294,P=0.524),体重(Z=0.348,P=0.840)差异无统计学意义。
静脉滴注序贯口服激素组和口服激素组各18例,2组男/女均为12/6,静脉滴注序贯口服激素组平均发病年龄(31.6±17.6)月龄,体重(12.8±2.8) kg,口服激素组平均发病年龄(24.4±18.7)月龄,体重(11.6±4.1) kg, 静脉滴注序贯口服激素组和口服激素组,性别(χ2=0.000,P=1.000),年龄(Z=-1.520,P=0.134),体重(Z=-1.322,P=0.192)差异无统计学意义。
2.23方案分组急性期临床疗效表1显示,激素组△WBC低于IVIG组,总热程长于IVIG组,差异均有统计学意义;IVIG+激素组治疗后WBC高于IVIG组,△WBC、△PLT均低于 IVIG组,△CRP高于 IVIG组,总热程长于IVIG组;冠状动脉瘤发生率高于IVIG组,差异均有统计学意义。

表1 IVIG组、激素组和IVIG+激素组不同治疗方案对急性期临床疗效的影响±s,n(%)]
注1)激素组vsIVIG组,P<0.05;2)IVIG+激素组vsIVIG组,P<0.05
2.33方案分组对冠状动脉病变远期随访比较表2显示,除IVIG+激素组在随访6个月时点冠状动脉扩张发生率高于IVIG组,差异有统计学意义,其余随访时点冠状动脉扩张和冠状动脉瘤的发生率3组间差异均无统计学意义。
2.42方案分组对急性期临床疗效表3显示,再次治疗前和再次治疗后:WBC、N%和PLT 2组差异均无统计学意义,口服激素组治疗前后CRP 均低于静脉滴注序贯口服激素组,差异均有统计学意义;△WBC 、△N% 和△CRP 2组差异无统计学意义,△PLT口服激素组高于静脉滴注序贯口服激素组,差异有统计学意义;总热程、热退时间、冠状动脉扩张和冠状动脉瘤发生率2组差异均无统计学意义。

表2 IVIG组、激素组和IVIG+激素组治疗方案对远期冠状动脉病变随访[n/N(%)]
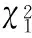
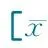
表3 静脉滴注序贯口服激素组和口服激素组急性期临床疗效的影响±s,n(%)]
2.5静滴序贯口服激素组和口服激素组对冠脉病变远期随访表4显示,2组3、6、12和24个月随访时点冠脉扩张和冠脉瘤差异均无统计学意义。

表4 静脉滴注序贯口服激素组和口服激素组对冠脉病变远期随访[n/N(%)]
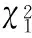
2.6随访中激素应用的不良反应随访病例中,静脉滴注序贯口服激素组有1例在静脉滴注甲泼尼龙后2 d出现血栓,经积极抗凝治疗后于甲泼尼龙治疗第4 d时血栓消失,1例在随访至3月时发现血栓,1年时血栓消失。
3 讨论
大量文献提示IVIG无反应KD患儿出现冠状动脉病变的风险更高[2,3],因此寻找更有利于这部分患儿的治疗方案至关重要。目前的再治疗方案主要包括IVIG、激素、免疫抑制剂、血浆置换和英夫利昔单抗等,但在治疗策略的选择上尚存在争议。
激素可抑制免疫反应,具有强大的抗炎效果,是目前临床治疗多种血管炎症的一线药物[8~10]。加之成本效益关系,其在IVIG无反应KD中的应用受到越来越多临床医生的关注,但激素对KD临床疗效及对冠状动脉病变的近期和远期影响仍缺乏有说服力的研究。2004年美国心脏病协会修订了KD诊断、治疗和长期随访指南,提出对于IVIG无反应KD患儿,激素应限制在使用≥2剂IVIG后仍未能缓解发热者[11]。Adachi 等[12]通过对IVIG无反应KD患儿直接应用激素或再次IVIG对比研究后,发现激素可改善冠状动脉瘤远期预后并促进其缩小。Zhu等[1]通过Meta分析发现激素并不增加KD冠状动脉扩张发生率,且可明显缩短热程。Yang等[13]的Meta分析也证实了IVIG无反应KD激素治疗与再次输注IVIG相比,前者退热快且不增加冠状动脉扩张发生率。
本研究通过IVIG组、IVIG+激素组比较发现,IVIG+激素组在热退时间、降低N%、急性期冠状动脉扩张发生率差异无统计学意义,且△CRP高于IVIG组,提示IVIG+激素急性期治疗效果肯定,且降低CRP方面优于IVIG;虽然其在急性期冠状动脉瘤发生率及随访至6个月时冠状动脉扩张发生率稍高,但两者在改善远期冠状动脉预后并差异无统计学意义,可见对IVIG不敏感患儿,再次应用IVIG后临床症状仍不缓解者,可立即加用激素治疗,以改善急性期临床表现及远期冠状动脉预后。激素在IVIG无反应KD的应用,除了再次IVIG无反应后应用,也有少数患儿在初次IVIG无反应后直接应用。本研究激素组有12例初始IVIG无反应后直接应用激素治疗,与IVIG组相比,热退时间、总热程、△PLT、△CRP、△N%、急性期及远期冠状动脉病变发生率差异均无统计学意义,由此推测对IVIG无反应KD患儿早期应用激素有效,且相对安全,亦不会增加冠状动脉病变发生率。对于初始IVIG治疗后PLT值仍偏低者,临床经验常提示该类患儿再次IVIG无反应可能性大,本研究IVIG+激素组治疗前PLT值明显较低,经再次IVIG后临床症状仍未缓解,经激素治疗后体温稳定,若此类患儿在再次IVIG时同时联合激素治疗,或初始IVIG无反应后直接予激素,是否可缓解症状,仍需进一步临床研究证实。
IVIG价格昂贵,且其为血制品,有输血相关风险,激素的抗炎作用肯定,医疗费用相对较低,成本效益综合分析可见,激素治疗IVIG无反应KD前景广阔[14]。
在激素使用途径选择方面,本研究中激素的初始用法包括静脉滴注甲泼尼龙和口服泼尼松,依据退热情况进行减量。静脉滴注序贯口服激素组和口服激素组在热退时间、总热程、△CRP和△N%、急性期及随访(3、6、12个月)时点冠状动脉病变发生率差异均无统计学意义,提示对IVIG无反应KD加用激素治疗既可选择静脉滴注序贯口服疗法,也可选择口服疗法。随访病例中,仅在静脉滴注序贯口服激素组有2/16例出现血栓,经积极抗凝治疗后血栓消失。口服激素组无血栓形成,提示口服普通剂量激素治疗可能更安全。但研究样本量较小,有待于大样本研究证实。
激素在IVIG无反应KD的治疗中,有文献报道激素大剂量冲击治疗,即甲泼尼龙30 mg·kg-1·d-1,连用1~3 d。Ogata等[15]研究了27例IVIG无反应KD患儿,13例予甲泼尼龙30 mg·kg-1·d-1,连用 3 d,14例予再次IVIG 2 g·kg-1.结果发现甲泼尼龙冲击治疗组总热程明显缩短、CRP明显降低,且不增加急性期冠状动脉瘤发生率。Zhu等[1]、Yang等[13]也得出了类似的结论。Miura等[16]研究提示,大剂量甲泼尼龙冲击治疗可能导致心动过缓,血糖及血压升高等不良反应。因此国内对于冲击治疗量激素应用于IVIG无反应KD较为慎重,多采用普通剂量治疗。本研究中甲泼尼龙使用最大剂量为7.5 mg·kg-1。
本研究提示对初次IVIG无反应KD患儿可选择激素治疗;对IVIG无反应KD加用激素治疗,选择普通剂量激素口服或者静脉滴注对急性期治疗效果及远期预后差异无统计学意义,但由于静脉滴注途径显著增加PLT水平,导致血栓形成风险增高,因此口服激素可能是更好的选择。
本研究的不足与局限,①本文回顾性收集IVIG无反应KD病例的临床信息,虽然对总热程、平均热退时间做了定义,也对治疗前后实验室检查结果截取进行了定义,但采集的信息不可避免地受到临床因素的影响;②随着随访时间的延长,失访病例增加,影响对CALs的准确判断和应用激素不良反应事件的统计。
[1]Zhu BH, Lv HT, Sun L, et al. A meta-analysis on the effect of corticosteroid therapy in Kawasaki disease.Eur J Pediatr, 2012, 171(3): 571-578
[2]Yeung RS. Kawasaki disease: update on pathnesis. Curr Opin Rheumatol, 2012, 22(5): 551-560
[3]Kim JY, Kim HJ. A Case of Kawasaki disease with coronary aneurysm responding to the 4th IVIG treatment. Case Rep Cardiol, 2014, 2014: 821812
[4]Ayusawa M, Sonobe T, Uemura S, et al. Revision of diagnostic guidelines for Kawasaki disease (the 5th revised edition). Pediatr Int, 2005,47(2):232-234
[5]赵晓东, 杜忠东. 川崎病专题讨论会纪要. 中华儿科杂志, 2007,45(11):826-830
[6]de Zorzi A, Colan SD, Gauvreau K, et al.Coronary artery dimensions may be misclassified as normal in Kawasaki disease.J Pediatr,1998,133( 2) : 254-258
[7]胡亚美,江载芳,实用儿科学. 第7版. 北京. 人民卫生出版社 ,2002.698-705
[8]Eleftheriou D, Levin M, Shingadia D, et al. Management of Kawasaki disease. Arch Dis Child, 2013, 99(1): 74-83
[9]Rowley AH, Shulman ST. Recent advances in the understanding and management of Kawasaki disease. Curr Infect Dis Rep, 2010, 12(2): 96-102
[10]Son MB, Newburger JW. Management of Kawasaki disease: corticosteroids revisited . Lancet, 2012, 379(9826): 1571-1572
[11]Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association. Pediatrics, 2004, 114(6): 1708-1733
[12]Adachi S, Sakaguchi H, Kuwahara T,et al. High regression rate of coronary aneurysms developed in patients with immune globulin-resistant Kawasaki disease treated with steroid pulse therapy. Tohoku J Exp Med, 2010, 220(4): 285-290
[13]Yang X, Liu G, Huang Y,et al. A meta-analysis of re-treatment for intravenous immunoglobulin-resistant Kawasaki disease. Cardiol Young, 2015, 25(6): 1182-1190
[14]张永兰, 杜忠东,付培培.不同剂量静脉丙种球蛋白或加甲泼尼龙治疗无反应川崎病患儿疗效观察.中国循证儿科杂志,2013,8(3):220-223
[15]Ogata S,Bando Y,Kimura S, et al. The strategy of immune globulin resistant Kawasaki disease: a comparative study of additional immune globulin and steroid pulse therapy.J Cardiol, 2009,53(1): 15-19
[16]Miura M, Ohki H, Yoshiba S, et al. Adverse effects of methylprednisolone pulse therapy in refractory Kawasaki disease. Arch Dis Child, 2005, 90(10): 1096-1097
(本文编辑:张崇凡)
Retrospective controlled study of steroid and IVIG treatment for IVIG unresponsive Kawasaki disease
YANGYing,ZHANGJing
(DepartmentofCardiology,Children′sHospitalofChongqingMedicalUniversity,KeyLaboratoryofPediatrics,CommitteeofScienceandTechnologyinChongqing,KeyLaboratoryofDevelopmentalDiseasesinChildhood(ChongqingMedicalUniversity),MinistryofEducation,ChongqingInternationalScienceandTechnologyCooperationCenterforChildDevelopmentandDisorders,Chongqing400014,China)
ZHANG Jing,E-mail:zhangjing1211@cqmu.edu.cn
Kawasaki disease; Intravenous immunoglobulin unresponsiveness; Steroid
重庆医科大学附属儿童医院心血管专业;儿科学重庆市重点实验室 重庆市科委;儿童发育疾病研究教育部重点实验室 教育部;重庆市(儿童发育重大疾病诊治与预防)国际科技合作基地重庆,410014
张静,E-mail:zhangjing1211@cqmu.edu.cn
10.3969/j.issn.1673-5501.2016.04.005
2016-04-30
2016-07-18)

