Fe3O4/GO复合材料对甲基橙的吸附性能
王 韬,刘泽玲
(1.天津工业大学环境与化学工程学院,天津 300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津 300387)
Fe3O4/GO复合材料对甲基橙的吸附性能
王韬1,2,刘泽玲1
(1.天津工业大学环境与化学工程学院,天津300387;2.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津300387)
采用超声沉淀法合成Fe3O4/GO复合材料,通过SEM、XRD、FTIR和VSM对Fe3O4/GO复合材料的形貌、结构和磁性进行表征,通过对甲基橙溶液的吸附实验考察pH值、吸附剂添加量、吸附时间等因素对Fe3O4/GO复合材料吸附效果的影响,并进行了吸附动力学和等温吸附模型拟合.结果表明:Fe3O4与GO成功复合,Fe3O4/GO复合材料具有超顺磁性,在外在磁场的作用下可实现吸附剂与吸附质的快速分离;pH>3.5时,染料去除率随着pH值增大呈下降趋势;随着吸附剂添加量增大,染料去除率逐渐增大;随着吸附时间增加,染料去除率先急剧上升,然后上升幅度趋缓直至达到吸附平衡;Fe3O4/GO复合材料对甲基橙的吸附符合准二级动力学模型和Langmuir模型,为化学单层吸附;pH为3左右,温度为298 K时,Fe3O4/GO复合材料对甲基橙的最大吸附容量可达139.7 mg/g.
Fe3O4;磁性氧化石墨烯;吸附;染料废水
目前,染料被广泛应用在纺织、造纸、塑料等行业.染料随工业废水排出,能够渗入地表水和地下水,对水体造成污染,严重威胁人类的饮水安全,并给人类和其他生物的健康留下隐患[1-2].目前常用生物降解法[3]、光催化法[4]、臭氧氧化法、电芬顿法、吸附法[5]、离子交换法、膜过滤法[6]等处理染料废水.吸附法由于具有成本较低,去除效率高以及操作过程简单等优点,受到科学工作者的广泛关注.而吸附法的关键是制备环保、经济、高效的吸附剂.
石墨烯(Graphene)是由单层六边形碳原子连接而成的二维碳材料.石墨烯物化性质极佳,具有高比表面积、高导电性、高机械强度、易于修饰等特点.因此,它在电池、传感器、电子设备、太阳能电池、超级电容器以及氢储存方面具有巨大的应用潜力[7-9].但是,石墨烯具有易发生团聚的缺点,会导致实际比表面积大大降低,使得其作为吸附材料在实际应用过程中具有一定的局限性.相对而言,石墨烯的氧化衍生物,即氧化石墨烯(GO)含有大量亲水性的含氧官能团(如羟基、羰基、羧基、环氧基团等),这些含氧官能团的存在对氧化石墨烯的溶解性起到提高作用,有效避免了团聚现象的发生[10].另外,引入含氧官能团后,氧化石墨烯的活性增大,在吸附金属离子[11]和有机染料[12]等方面表现出更大优势.
由于磁性材料可在外界磁场作用下实现与其他物质的快速分离,因此该种材料被应用在很多领域[13].例如Fe3O4磁性纳米粒子具有特殊的磁导向性、表面可连接生化活性功能基团等特性,可广泛应用在靶向药物、分子成像、酶和细胞固定化等领域[14-15].磁性石墨烯材料能够很好地克服氧化石墨烯不易从溶液分离的缺点,同时保留了氧化石墨烯的高吸附能力.
本文采用超声沉淀法,利用超声波能使介质混合均匀、对团聚能起到剪切作用、提高反应速度的特点[16-17],制备了微小颗粒的Fe3O4/GO复合材料,克服了氧化石墨烯吸附染料后难以从溶液中分离的缺点.通过对甲基橙溶液的吸附实验,探明了pH值、吸附剂添加量、反应时间、甲基橙浓度和温度等因素对吸附实验的影响规律和差异性,并进行了吸附动力学模型和等温吸附模型拟合,以期为Fe3O4/GO复合材料吸附废水中染料等污染物提供科学依据.
1 实验部分
1.1实验材料与仪器
所用材料包括:盐酸、浓硫酸、甲基橙、氢氧化钠、硝酸钠、高锰酸钾,均为国药集团化学试剂有限公司产品;氨水、过氧化氢(30%)、三氯化铁、氯化亚铁,天津市光复科技发展有限公司产品;石墨粉(1 200目),上海阿拉丁生化科技股份有限公司产品.
所用仪器包括:SD型超声波清洗器,北京中晟铭科技有限公司提供;DF-101S型集热式恒温加热磁力搅拌器,河南省巩义市予华仪器有限责任公司产品;CP64C型电子天平,奥豪斯仪器(上海)有限公司产品;HNY-200B型恒温摇床,上海乔跃电子有限公司产品:TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司产品;TG16-WS型台式高速离心机,湖南湘仪实验室仪器开发有限公司产品;DZF6021型真空干燥箱,上海恒一科学仪器有限公司产品;pH610型台式测定仪,天津市劳尔科技有限公司产品;Hitachi S4800型冷场发射扫描电子显微镜,日本日立公司产品;D8-Focus型X射线衍射仪,德国布鲁克AXS有限公司产品;Nicolet 6700型傅里叶红外光谱仪,美国赛默飞世尔科技公司产品;MPMS-XL-7型超导量子干涉仪磁强计,美国QuantumDesign公司产品.
1.2Fe3O4/GO复合材料的制备
GO的制备方法参照Hummer法[18],本文主要应用超声沉淀法制备了Fe3O4/GO复合材料,具体步骤:在烧杯中加入10 g FeCl3,4 g FeCl2和500 mL蒸馏水,超声2 h;同时向另一个烧杯中加入1.5 g GO,500 mL蒸馏水,超声2 h;再将超声后的400 mL GO与超声后的400 mL FeCl3与FeCl2混合液混合后,超声2 h;然后加入NH3·H2O调节pH为10左右,超声2 h;最后将所得产品采用离心分离的方法洗涤至中性,在60℃真空干燥箱中烘干,即可制得Fe3O4/GO复合材料.
1.3样品表征
采用Hitachi S4800型冷场发射扫描电子显微镜测试合成材料的表面形貌;采用D8-Focus型X射线衍射仪对制得的氧化石墨烯、Fe3O4/GO复合材料进行XRD表征;采用Nicolet 6700型傅里叶红外光谱仪对制得的材料进行表面化学键与官能团分析;采用MPMS-XL-7型超导量子干涉仪磁强计对Fe3O4/GO复合材料进行磁滞回线测试;采用TU-1810型紫外可见分光光度计对染料进行吸光度测试.
1.4Fe3O4/GO复合材料对甲基橙染料的吸附性能
(1)pH值对吸附性能的影响:在甲基橙初始质量浓度为40 mg/L、溶液体积为25 mL条件下,采用适当浓度的NaOH及HCl溶液调节甲基橙溶液的pH值,使溶液pH值变化范围为2~10,加入吸附剂Fe3O4/GO 10 mg,在摇床里震荡17 h,用紫外分光光度计测量吸附后溶液中甲基橙的吸光度.
(2)吸附剂添加量对吸附效果的影响:在室温条件下,将40 mg/L,pH值为3左右的甲基橙溶液分别加入6个锥形瓶中,再向其中分别加入5~60 mg的Fe3O4/GO吸附剂,放入摇床中震荡17 h.用磁铁将吸附剂从溶液中分离后,取上清液,用紫外分光光度计测其吸光度.
(3)吸附时间对吸附效果的影响:在最佳pH值,最佳吸附剂添加量条件下恒温振荡,每间隔一定时间使用磁铁将Fe3O4/GO复合材料从溶液中分离,然后对上清液中的残余染料浓度进行测试.如此重复若干次,直至吸附平衡.
(4)吸附等温线的研究:取一定量的吸附剂置于含有不同浓度甲基橙染料的锥形瓶中,在不同温度下震荡至吸附平衡.最后,使用磁铁将Fe3O4/GO复合材料从溶液中分离,用紫外可见分光光度计对上清液中的残余甲基橙测试吸光度.吸附剂对甲基橙染料的平衡吸附量可用公式(1)进行计算:

式中:qe(mg/g)为平衡吸附量;Re为染料去除率;C0(mg/L)为染料的初始浓度;Ce(mg/L)为达到吸附平衡时的染料浓度;V(L)为溶液体积;m(g)为吸附剂质量.
2 结果与讨论
2.1Fe3O4/GO复合材料的表征
2.1.1SEM图
图1为GO和Fe3O4/GO复合材料的表面形貌图.

图1 复合材料的SEMFig.1 SEM images of GO and Fe3O4/GO composites
由图1(a)可以看到,氧化石墨烯(GO)表面光滑,上面有很多褶皱,有利于Fe3O4粒子与GO复合.从图1(b)中可以看到样品的表面形貌不规整,有许多白色粒子聚合而成,表明GO与Fe3O4已经成功复合.
2.1.2XRD谱图
GO和Fe3O4/GO复合材料的XRD谱图如图2所示.

图2 GO和Fe3O4/GO复合材料的XRD图Fig.2 XRD patterns of GO and Fe3O4/GO
由图2可以看出,GO在2θ=11°附近出现了特征峰[19].Fe3O4/GO复合材料在2θ角为30.1°、35.4°、43.0°、53.4°、56.9°、62.5°、74.9°处出现了6个衍射峰,可分别归属于 Fe3O4晶体的(220)、(311)、(400)、(422)、(511)、(440)和(622)晶面,这与Fe3O4的衍射峰位置吻合度极高.由此表明,Fe3O4已经成功与GO复合. Fe3O4/GO复合材料在2θ角为11°左右时,衍射峰强度特别弱,这可能是由于Fe3O4的加入,使Fe3O4/GO复合材料在此处的衍射峰不明显.
2.1.3红外光谱
图3所示为GO和Fe3O4/GO的红外光谱图.

图3 GO和Fe3O4/GO复合材料的FTIR图Fig.3 FTIR spectra of GO and Fe3O4/GO
由图3可以看出,在3436cm-1处GO有一个强吸收峰,该峰为—OH的伸缩振动峰,在1608cm-1和1400 cm-1处的吸收峰分别是由C=C和C—OH集团伸缩振动引起的,而1 136 cm-1处为C—O—C的特征吸收峰. 从Fe3O4/GO复合材料的红外谱图可以看到,在3448cm-1处有一个—OH引起的伸缩振动峰,在1 608 cm-1的吸收峰是由C=C引起的,在1 386 cm-1和1 140 cm-1处的吸收峰来源于C—OH、C—O—C集团的伸缩振动;在617 cm-1处出现的吸收峰是由Fe-O伸缩振动引起的.根据以上分析,可以看到GO和Fe3O4/GO均含有—OH、C—OH、C—O—C、C=C等官能团,而在Fe3O4/GO的红外光谱图中出现了Fe—O伸缩振动引起的吸收峰,表明Fe3O4已经成功与GO复合,得到了磁性氧化石墨烯.
2.1.4磁滞回线
图4所示为Fe3O4/GO在室温条件下所测的磁滞回线.
由图4可以看到,该磁滞回线呈S型,并且经过原点,表明样品具有超顺磁性,矫顽力为0[20].经过吸附后甲基橙溶液的颜色基本消失,用磁铁很容易将吸附剂从溶液中分离出来.文献中曾报道,当吸附剂的饱和磁化强度为16.3 emu/g时,在磁场作用下就能与吸附质分离[21].由图4可以看出,Fe3O4/GO复合材料的饱和磁化强度为47 emu/g,远大于文献中报道的饱和磁化强度,用磁铁很容易将吸附剂从溶液中分离出来.
2.2影响甲基橙吸附的因素
2.2.1pH值影响
pH值是吸附过程中的一个重要参数,因为它不仅影响吸附剂的活性位点,还影响在吸附过程中染料的表面电荷分布[22].在酸性条件下,甲基橙以醌式结构存在,而在中性或碱性溶液中以偶氮结构存在[23].它的基本结构如图5所示.
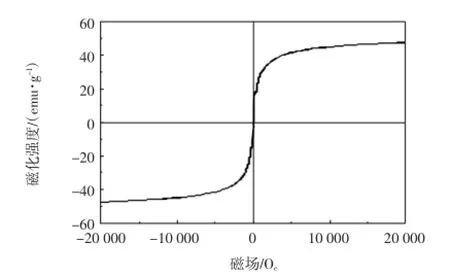
图4 Fe3O4/GO复合材料的磁滞回线Fig.4 Magnetization curves of Fe3O4/GO composites
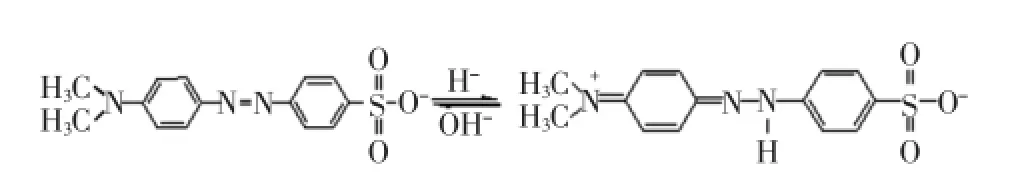
图5 甲基橙的基本结构Fig.5 Structure of methyl orange
在甲基橙初始质量浓度40 mg/L、溶液体积25 mL、吸附剂Fe3O410 mg、吸附时间17 h条件下,采用NaOH及HCl调解溶液pH值,考察pH值对Fe3O4/GO复合材料吸附甲基橙的影响,如图6所示.

图6 pH值对Fe3O4/GO复合材料吸附甲基橙的影响Fig.6 Effect of pH value on MO adsorption byFe3O4/GO composites
由图6可以看出,在溶液pH值为2和3时,染料的去除率为80%左右,在溶液pH值比3大时,染料去除率呈下降趋势.造成这种现象的原因,可能是磁性氧化石墨烯的等电点为3.5,当pH<3.5时,吸附剂表面带正电荷,当pH>3.5时,吸附剂表面带负电荷,而甲基橙表面带负电荷,所以,甲基橙与磁性氧化石墨烯之间的静电排斥力使得pH大于3.5时的吸附量下降.综合考虑,后续实验将pH=3作为实验条件.
2.2.2吸附剂添加量的影响
在甲基橙初始质量浓度40 mg/L、溶液pH值为3、吸附时间17 h条件下,考察吸附剂添加量对吸附甲基橙的影响,结果如图7所示.

图7 Fe3O4/GO复合材料添加量对吸附甲基橙的影响Fig.7 Effect of Fe3O4/GO dose on MO adsorption
由图7可知,随着吸附剂添加量的增大,Fe3O4/ GO吸附剂提供了更多可利用的吸附活性位点,甲基橙的去除率逐渐增大,但甲基橙的平衡吸附容量却从100 mg/g降为17 mg/g,这可能是由于吸附剂加入过多,导致吸附位点过剩.为了达到较高的去除率,同时节约成本,选取10 mg Fe3O4/GO为最佳吸附剂添加量.
2.2.3吸附时间的影响
在298 K条件下,采用10 mg Fe3O4/GO对pH为3左右、质量浓度为40 mg/L、体积为25 mL的甲基橙溶液进行吸附实验,考察吸附时间对吸附效果的影响,结果如图8所示.
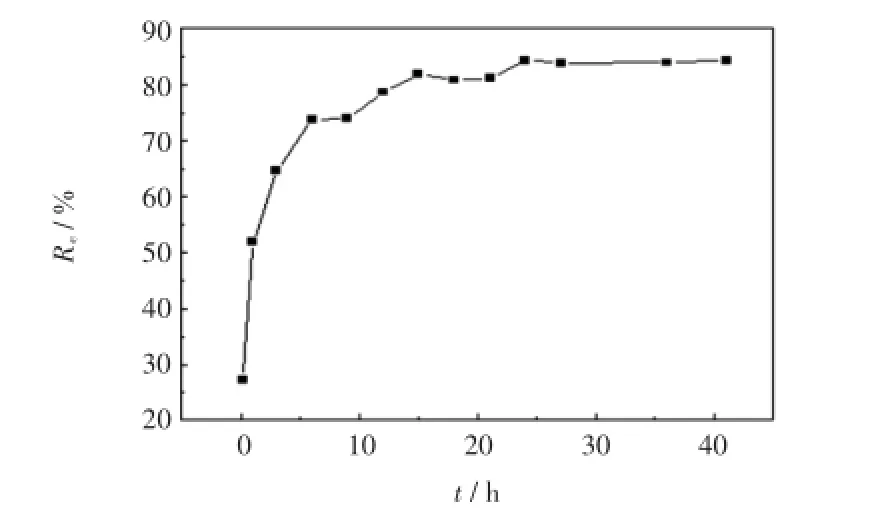
图8 吸附时间对Fe3O4/GO复合材料吸附甲基橙的影响Fig.8 Effect of contact time on MO adsorption by Fe3O4/GO
由图8可以看出,在前6 h内,Fe3O4/GO吸附剂对甲基橙的吸附量急剧上升,然后缓慢上升,并在24 h时达到吸附平衡.这可能是因为在开始阶段,吸附剂提供了大量可利用的吸附位点,但随着时间的推移,吸附位点变得越来越少,并且甲基橙溶液的浓度差变小,导致吸附过程变得缓慢.
2.3吸附机理
为了研究吸附机理,本文采用准一级动力学模型(pseudo-first-order model)与准二级动力学模型(pseudo-second-order model)进行吸附动力学分析.准一级动力学模型可用如下公式表示:

式中:qe为平衡吸附容量(mg/g);qt为吸附t小时后的吸附容量(mg/g);k1为准一级模型的吸附速率常数(min-1).
准二级动力学模型公式如下:

式中:qe和qt与准一级方程代表意义相同;k2为准二级模型的吸附速率常数.拟合结果如图9所示,吸附甲基橙的动力学参数列于表1中.

图9 Fe3O4/GO复合材料吸附甲基橙的准一级动力学拟合和准二级动力学拟合Fig.9 Pseudo-first-order kinetics and Pseudo-second-order kinetics for adsorption of MO onto Fe3O4/GO

表1 Fe3O4/GO复合材料吸附甲基橙的动力学参数Tab.1 Kinetic parameters for adsorption of MO onto Fe3O4/GO
由表1可知,与准一级动力学吸附模型相比,准二级动力学模型拟合的相关系数R2>0.999,这说明吸附过程更符合准二级动力学吸附模型,即Fe3O4/GO复合材料对甲基橙的吸附过程为化学吸附[24].
为了研究吸附剂和吸附质之间的相互关系,本文进行了吸附等温线研究,在pH值为3左右,不同浓度的甲基橙溶液中加入Fe3O4/GO吸附剂,在不同温度下震荡至吸附平衡后,测其吸光度.采用Langmuir等温吸附模型和Frenudlich等温吸附模型对实验数据进行拟合.基于单层吸附的Langmuir模型方程如下:
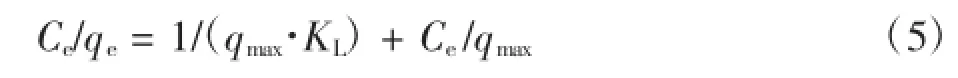
式中:qe表示平衡吸附量;Ce表示平衡浓度;qmax为单层吸附的最大吸附量;KL为模型的吸附平衡常数.基于多层吸附的Frenudlich模型方程式如下:

式中:ln KF(L/g)和1/n分别是与吸附量和吸附剂的吸附密度相关的系数.在不同温度下,Langmuir模型和Frenudlich模型的等温常数和相关系数如表2所示.
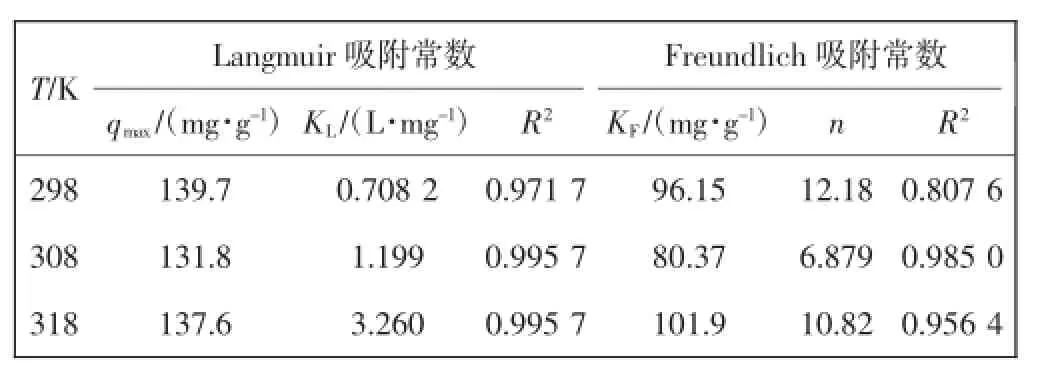
表2 Fe3O4/GO复合材料吸附MO的等温吸附模型参数Tab.2 Isotherm parameters for adsorption of MO with Fe3O4/GO
由表2数据可以看出,与Freundlich模型相比,Langmuir模型拟合相关系数R2明显较高,因此Langmuir模型能更好地描述Fe3O4/GO对溶液中甲基橙的等温吸附,表明该吸附行为为单层吸附.Fe3O4/GO对甲基橙的最大吸附容量为139.7 mg/g,吸附效果较好.这可能是因为Fe3O4/GO含有较多的吸附位点,吸附质与吸附剂之间的静电引力对吸附也起到了促进作用.
3 结论
本文用超声沉淀法合成了Fe3O4/GO复合材料,采用SEM、XRD、FTIR和VSM等对该复合材料进行了形貌、结构以及磁性等表征,并通过对溶液中甲基橙染料的去除实验考察了该复合材料的吸附性能.结果表明:
(1)超声沉淀法操作简单,条件可控,能够使得Fe3O4成功与GO复合,获得Fe3O4/GO复合材料.
(2)Fe3O4/GO具有超顺磁性,能够在外加磁场的作用下很容易的从溶液中分离回收.
(3)Fe3O4/GO对甲基橙染料的去除率随着pH值升高呈下降趋势,随着吸附剂添加量增大而增大,随着吸附时间延长而增大直至达到吸附平衡.
(4)pH为3左右、温度为298 K时,Fe3O4/GO复合材料对甲基橙达到最大吸附容量139.7 mg/g.
(5)Fe3O4/GO复合材料对于溶液中的甲基橙染料表现出良好的吸附性能,符合准二级动力学模型,主要为化学吸附;平衡吸附数据符合Langmuir模型,为单分子层吸附.
[1]HU J,SONG Z,CHEN L,et al.Adsorption properties of MgO (1 1 1)nanoplates for the dye pollutants from wastewater[J]. Chem Eng,2010,55:3742-3748.
[2]GOTTLIEB A,SHAW C,SMITH A,et al.The toxicity of textile reactive azo dyes after hydrolysis and decolourisation[J]. Biotechnol,2003,101:49-56.
[3]KORNAROS M,LYBERATOS G.Biological treatment of wastewaters from a dye manufacturing company using a trickling filter[J].Hazard Mater,2006,136:95-102.
[4] KONSTANTINOU I K,ALBANIS T A.TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution:Kinetic and mechanistic investigations-a review[J].Appl Catal B-Environ,2004,49(1):1-14.
[5]CRINI G.Non-conventional low-cost adsorbents for dye removal:A review[J].Bioresource Technol,2006,97(9):1061-1085.
[6]LEE J W,CHOI S P,THIRUVENKATACHARI R,et al. Submerged microfiltration membrane coupled with alum coagulation/powdered activated carbon adsorption for complete decolorization of reactive dyes[J].WaterRes,2006,3:435-444.
[7]AI L H,ZHANG C M,CHEN Z L.Removal of methylene blue from aqueous solution by a solvothermal-synthesized graphene/ magnetite composite[J].Hazard Mater,2011,192:1515-1524.
[8]NAVARRO C G,BURGHARD M,KERN K.Elastic properties of chemically derived single graphene sheets[J].Nano Lett,2008,8:2045-2049.
[9]BUNCH J S,ZANDE A M,VERBRIDGE S S,et al.Electromechanical resonators from graphene sheets[J].McEuen Science,2007,315:490-493.
[10]MABAYO J E,SEREDYCH M,BANDOSZ T J.Cobalt(hydr)oxide/graphite oxide composites:Importance of surface chemical heterogeneity for reactive adsorption of hydrogen sulfide[J]. Colloid Interf Sci,2012,378:1-9.
[11]YANG S T,CHANG Y L,WANG H F,et al.Folding/aggregation of graphene oxide and its application in Cu2+removal[J]. Colloid Interface Sci,2010,351:122-127.
[12]KIM H,KANG S O,PARK S Y,et a1.Adsorption isotherms and kinetics of cationic and anionic dyes on three-dimensional reduced graphene oxide macrostructure[J].J Ind Eng Chem,2015,21:1191-1196.
[13]LU A H,SALABAS E L,SCHU¨TH F.Magnetic nanoparticles:Synthesis,protection,functionalization,and application [J].Angew Chem Int Ed,2007,46:1222-1244.
[14]HONG R Y,PAN T T,HAN Y P,et al.Magnetic field synthesis of Fe3O4nanoparticles used as a precursor of ferofluids [J].J Magn Magn Mater,2007,310:37-47.
[15]XIE J,XU C J,XU Z C,et al.Linking hydrophilic macromolecules to monodisperse magnetite(Fe3O4)nanoparticles via trichloro-s-triazine[J].Chem Mater,2006,18:5401-5403.
[16]吴伟,贺全国,陈洪,等.Fe3O4磁性纳米粒子的超声包金及其表征[J].化学学报,2007,13:1273-1279. WU W,HE Q G,CHEN H,et al.Sonochemical gold coating of Fe3O4nanoparticles and itscharaeterizations[J].ActaChimica Sinica,2007,65(13):1273-1279(in Chinese).
[17]SUSLICK K S.Applications of ultrasound to materials chemistry[J].Annual Review of Materials Science,1999,29:295-236.
[18]HUMMERS W S,Jr OFFEMAN R E.Preparation of graphitic oxide[J].J Am Chem Soc,1958,80:1339-1339.
[19]SEGER B,KAMAT P V.Electrocatalytically active grapheneplatinum nanocomposites:Role of 2-D carbon support in PEM fuel cells[J].The Journal of Physical Chemistry C,2009,113 (19):7990-7995.
[20]KASSAEE M,MOTAMEDI E,MAJDI M.Magnetic Fe3O4-graphene oxide/polystyrene:Fabrication and characterization of a promising nanocomposite[J].Chemical Engineering Journal,2011,172(1):540-549.
[21]GONG J L,WANG X Y,ZENG G M,et al.Copper(II)removal by pectin-iron oxide magnetic nanocomposite adsorbent [J].Chemical Engineering Journal,2012,185:100-107.
[22]ARSHADI M,SALIMI VAHID F,SALVACION J W L,et al. A practical organometallic decorated nano-size SiO2-Al2O3mixed-oxides for methyl orange removal from aqueous solution [J].Appl Surf Sci,2013,280,726-736.
[23]MA H Z,WANG B,LUO X Y.Studies on degradation of methyl orange wastewater by combined electrochemical process[J].Hazard Mater,2007,149:492-498.
[24]WANG S,WEI J,LÜ S,et al.Removal of organic dyes in environmental water onto magnetic-sulfonic graphene nanocomposite[J].Clean-Soil,Air,Water,2013,41:992-1001.
Adsorption properties of Fe3O4/GO composite for methyl orange
WANG Tao1,2,LIU Ze-ling1
(1.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China;2.State KeyLaboratoryofSeparationMembranesandMembraneProcesses,TianjinPolytechnicUniversity,Tianjin300387,China)
Fe3O4/GO composite was prepared by precipitation under ultrasonic radiation,the morphology,chemical structure and magnetic properties of composites are characterized by SEM,XRD,FTIR and VSM.Batch experiments were carried out to investigate the effects of solution pH,adsorbent dosage,contact time on sorption efficiency and the adsorption kinetics,isothems were investigated.The results showed that Fe3O4/GO composite with paramagnetic property was prepared successfully by compositing Fe3O4with GO,so that it could be utilized as an magnetically separable adsorbent under external magnetic field;when pH>3.5,dye removal rate decreased as the pH was increased;the removal of dye increased with the increase of the adsorbent dosage;the removal efficiency of dye grew fast at the initial stage,then increased slowly,and adsorption equilibrium appeared at last state;the adsorption equilibrium data of methyl orange dyes on to the Fe3O4/GO adsorbent surface showed good correlation with psudo-second-order model and Langmuir isotherm models,which revealed that the adsorption process is spontaneous and chemical;The maximum adsorption capacity of Fe3O4/GO composite for methyl orange was 139.7 mg/g when pH=3 and T=298 K.
Fe3O4;magnetic graphene oxide;adsorption;dye pollution
TB383;X703.5
A
1671-024X(2016)04-0028-06
10.3969/j.issn.1671-024x.2016.04.004

