Flag和GFP双标记的BKCa通道α亚基表达质粒的构建、鉴定和序列分析*
李 涛,程秀丽,黄文俊,闫 莉,曹济民△,谭晓秋,△
Flag和GFP双标记的BKCa通道α亚基表达质粒的构建、鉴定和序列分析*
李 涛1,程秀丽2,黄文俊1,闫 莉2,曹济民2△,谭晓秋1,2△
(1.四川医科大学医学电生理学 省部教育部重点实验室 ,四川省心血管疾病防治协同创新中心 ,泸州646000;2.北京协和医学院基础学院 中国医学科学院基础医学研究所生理学系 ,北京100005)
目的:采用重叠PCR法构建表达质粒 ,为下一步研究通道功能奠定基础。方法:在已有编码大电导钙激活钾通道(BKCa)通道α亚单位的表达质粒pcDNA3.1-hSlo的基础上,采用重叠PCR法构建Flag和GFP双标签标记的表达质粒pcDNA3.1-Flag-hSlo-GFP(Flag-hSlo-GFP)。结果:构建的表达质粒Flag标签插入BKCa通道的S1-S2胞外环,GFP标签连接BKCa通道的胞内C末端,测序结果证实质粒构建成功。结论:成功构建BK通道基因表达质粒Flag-hSlo-GFP,重叠PCR能够很好的用于长片段基因扩增和插入片段的实验。
大电导钙激活钾通道;重叠PCR;基因工程
【DOI】10.13459/j.cnki.cjap.2016.03.024
大电导钙激活钾通道(large conductance calcium activated potassium channels,BKCa)又称为 Slo、BK、KCa、KCa1.1或MaxiK通道,是细胞膜上重要的离子通道,在血管平滑肌上的表达尤为丰富。BKCa通道作为一种负反馈机制,对维持血管张力、调节血管功能起重要作用。异源表达离子通道在工具细胞如HEK293、CHO等,目前已成为研究离子通道功能活动和药物筛选的主要方法之一。本研究旨在采用重叠PCR方法进行含标签的表达质粒的构建,为下一步研究BKCa通道蛋白的转运过程以及功能活性奠定基础,同时探讨其在长片段基因的扩增和插入片段中的应用。
1 材料与方法
1.1 试剂和仪器
主要试剂包括胶回收试剂盒(北京天根)、质粒提取试剂盒(北京天根)、PCR反应试剂(宝生物生物科技)、限制性内切酶(宝生物生物科技)、琼脂糖粉(Biowest公司)、LB培养基(上海生工),大肠杆菌DH5α(碧云天)、DNA Marker(碧云天)和连接反应试剂(Promega公司),其余试剂为国产分析纯。主要实验仪器有PCR仪(ABI公司)、紫外分光光度仪(Nanodrop公司)和离心机(Eppendorf公司)。
1.2 方法
本实验旨在已有编码人血管平滑肌BKCa通道α亚单位的表达质粒pcDNA3.1-hSlo的基础上,构建Flag和GFP双标签标记的BKCa通道表达质粒FlaghSlo-GFP。其中Flag标签的氨基酸序列为:DYKDDDDK,拟将其插入BKCa通道S1与S2跨膜序列的胞外侧连接处,插入后的氨基酸序列为:SNPIESDYKDDDDKCQNFYKDF。构建Flag标签的目的是用于检测BKCa通道蛋白在细胞膜上的表达水平。GFP标签连接于BKCa通道胞内的C末端,用于检测BKCa通道蛋白在细胞整体的表达水平。本实验的基因克隆在表达质粒pcDNA3.1-hSlo(丹麦Philip K.Ahring教授友情馈赠)的基础上,进行重叠PCR法和酶切连接完成的。引物序列见表1所示,引物由Invitrogen公司合成。

Tab.1 Primer for Overlapping PCR
Flag标签插入pcDNA3.1-hSlo的具体步骤和实验流程如下所示:(1)将Flag(红色)插入到含有酶切位点Hind III和EcoR I的表达质粒pcDNA3.1-hSlo(蓝色)S1与S2胞外环的位点(图1A)。以质粒pcDNA3.1-hSlo为模板,分段扩增包含有部分BKCa通道和Flag标签的片段1和片段2(图1B);(2)以片段1和片段2的混合片段为模板,使用片段1的上游引物和片段2的下游引物,进行重叠PCR反应得到包含有Flag的BKCa通道片段3(图1C);(3)选择酶切位点EcoR I和Hind III,采用双酶切法酶切质粒pcDNA3.1-hSlo和片段3后,然后进行T4连接反应,将连接产物进行转化就得到含有Flag标签的BKCa通道表达质粒pcDNA3.1-Flag-hSlo(图1D,图1见彩图页Ⅵ)。
在此基础上,采用限制性内切酶的方法将GFP(绿色)插入表达质粒pcDNA3.1-Flag-hSlo(蓝色)的胞内 C末端。以 pcDNA3.1-Flag-hSlo为模板(图2A),PCR扩增得到含有BKCa通道C末端序列和EcoR I、BamH I酶切位点的片段1。在扩增片段1时,由于构建GFP融合蛋白,所以去掉原来编码BKCa通道的终止密码子TGA,增加GCG碱基序列以便于酶切和连接反应。以质粒pEGFP-N1(含有GFP序列)为模板,PCR扩增得到的含有完整GFP序列和BamH I、Xba I酶切位点的片段2(图2B)。分别将片段1、片段2和质粒pcDNA3.1-Flag-hSlo进行双酶切,即片段1使用EcoR I和BamH I,片段2使用BamH I和Xba I,质粒pcDNA3.1-Flag-hSlo使用EcoR I和Xba I。然后将酶切后的片段1和片段2连接到含有Flag标签的表达质粒pcDNA3.1-Flag-hSlo(图2C,图2见彩图页Ⅵ)。将连接产物进行转化培养后提取质粒,酶切鉴定,测序。测序正确的质粒进行下一步实验。
PCR反应体系、酶切反应体系和连接反应体系都是根据试剂公司推荐的实验条件进行。PCR反应的退火温度见表1,酶切反应为37℃水浴过夜,连接反应为16℃水浴过夜。转化步骤按照碧云天大肠杆菌DH5α说明书进行。
2 结果
2.1 Flag标签插入质粒pcDNA3.1-hSlo以及pcDNA3.1-Flag-hSlo质粒酶切鉴定
使用PCR分别得到含有部分BKCa通道和Flag标签的片段1和片段2,PCR产物电泳结果如图3A所示,目标条带位置与预测大小基本一致。然后以这两个片段为模板,使用重叠PCR方法得到片段3后,Flag标签插入BKCa通道S1-S2之间,同时还含有EcoR I与Hind III酶切位点,片段3条带大小约1 000 bp,电泳条带位置符合预期(图3B)。质粒pcDNA3.1-hSlo双酶切后,与片段3进行连接反应,得到含有Flag标签的质粒pcDNA3.1-Flag-hSlo。得到的质粒首先经过EcoR I与Hind III双酶切鉴定,结果如图3C所示,经EcoR I与Hind III双酶切之后能够得到一约1 000 bp左右的目的条带。
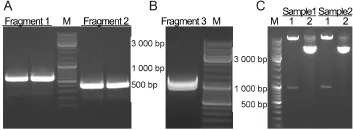
Fig.3 Electrophoresis of overlapping PCR productsA:Electrophoresis of PCR products of Fragment 1 and Fragment2;B:Fragment3 was obtained by overlapping PCR;C: Digestion electrophoresis of the pcDNA3.1-Flag-hSlo plasmid;Lane 1:Double digestion by EcoR I and Hind III;Lane 2: Without digestion;M:Marker
2.2 GFP标签插入pcDNA3.1-Flag-hSlo质粒以及Flag-hSlo-GFP质粒酶切鉴定
采用引入一个酶切位点BamH I的方法,将GFP插入pcDNA-Flag-hSlo质粒BKCa通道的C末端。通过三个酶切位点EcoR I,BamH I,Xba I将GFP连接到C末端,得到含有Flag和GFP双标签融合标记的BKCa通道表达质粒Flag-hSlo-GFP。第一步即为得到含有EcoR I和BamH I酶切位点的片段1,含有BamH I和Xba I酶切位点的片段2,两个片段的PCR产物电泳结果(图4A)分别在预测位置附近有明显的条带。将片段1、片段2和pcDNA3.1-Flag-hSlo质粒进行相应的双酶切后,三个酶切片段进行连接,得到含有Flag和GFP双标签标记的质粒Flag-hSlo-GFP。质粒经酶切鉴定(图4B)所示,Flag-hSlo-GFP质粒经BamH I和Xba I双酶切的结果,可见一约700 bp的条带,推测为插入的GFP片段。质粒经EcoR I和BamH I双酶切的结果,可见约2 500 bp左右的条带,推测为片段1,但存在一定的非特异性条带。泳道3为未进行酶切的质粒电泳图,可见位置较实际大小更靠前,推测质粒主要为超螺旋结构,表明质粒结构未被破坏,质量较好。
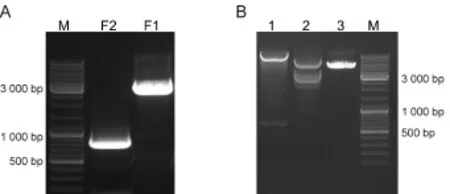
Fig.4 Electrophoresisof Flag-hSlo-GFPA:Electrophoresis of PCR products of Fragment 1 and Fragment2;B:Digestion electrophoresisof the plasmid Flag-hSlo-GFP;Lane 1:Double digestion by BamH Iand Xba I;Lane 2:Double digestion by BamH Iand EcoR I;Lane 3:Without digestion;M:Marker
2.3 Flag-hSlo-GFP质粒测序结果
测序结果显示:Flag插入BKCa通道的S1-S2胞外环(图5B),GFP标签连接与BKCa通道的胞内C末端(图5C)。
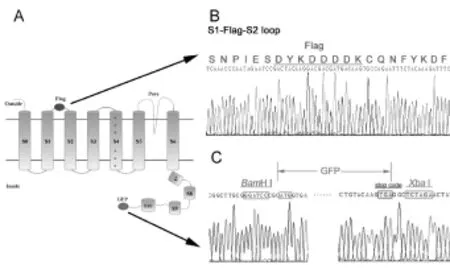
Fig.5 Structure diagram and sequencing results of the plasmid Flag-hSlo-GFPA:Structure diagram of BKCa channelwith the labels of flag and GFP;B:Sequencing results of S1-S2 extracellular loop,inwhich the sequencemarked red is the flag label;C:Sequencing resultsof C terminal containing restriction sitesBamH Iand Xba I
3 讨论
重叠PCR技术由于采用具有互补末端的引物,使第一轮PCR产物形成了重叠链,从而在第二轮PCR反应中通过重叠链的延伸,将不同来源的扩增片段重叠连接起来[1]。此技术不需要限制性内切酶的消化和连接酶的处理,在基因的定点突变、融合基因的构建、长片段基因的合成、基因敲除以及目的基因的扩增等方面有其广泛而独特的应用[2]。
为研究BKCa通道蛋白转运过程,本研究构建Flag与GFP双标记的BKCa通道a亚单位表达质粒Flag-hSlo-GFP,其中Flag插于胞外环S1-S2之间,GFP连接于C末端。文献报道跨膜序列之间的连接片段在通道蛋白细胞膜转运中发挥着重要的作用[3]。因此,本研究选择一个较小的标签Flag,由八个氨基酸(DYKDDDDK)组成[4],插入到S1-S2之间,最大限度减少插入位点对BKCa通道结构的影响。目前直接针对BKCa通道胞外抗体的特异性和亲和力较差,不能准确和有效反映通道蛋白在细胞膜上的表达。插入Flag的好处在于针对标签的抗体特异性和亲和力要比针对直接通道胞外环的抗体特异性要高很多,更能准确的研究BKCa通道在细胞膜上的表达水平。因此,采用Flag标签抗体研究蛋白定位和表达时,比直接使用目的蛋白的抗体阳性率、准确性均有明显提高,同时还能降低研究的科研成本。
在BKCa通道C末端连接一个GFP标签,插入GFP标签的优势是可以直接使用荧光或激光共聚焦显微镜或活细胞工作站观察活细胞BKCa通道蛋白的转运过程和机制。并且,已经有文献报道在BKCa通道C末端连接GFP对通道电压依赖性、钙离子敏感性以及向细胞膜的转运没有明显的影响[5]。
综上所述,Flag和GFP标签并不影响BKCa通道的基本电生理特性,包括大电导特性和通道动力学特征等,同时使用Flag标签能够很好的检测通道在膜上的表达。因此,使用Flag-hSlo-GFP表达质粒有以下几方面的优势:(1)通道融合有GFP蛋白,可以直接使用荧光显微镜观察活细胞BKCa通道蛋白的定位、分布和转运轨迹等,实现实时、动态的研究BKCa通道蛋白的转运机制。(2)该质粒S1-S2胞外的连接有Flag标签,可以方便的使用抗Flag抗体准确的检测BKCa通道蛋白在膜上的表达,并且结合能够代表BKCa通道总体表达的GFP荧光强度,从而可以使用流式细胞术、共聚焦显微成像技术准确地研究细胞膜上通道的表达量与整体表达量之间的比例,从而反映通道蛋白的转运效率。因为单纯的细胞膜上表达的高低是不能准确反映通道蛋白在细胞膜上的表达是促进还是抑制的过程。(3)Flag和GFP标记的Flag-hSlo-GFP质粒不影响BKCa通道的电导及动力学等电生理特性,因此可以采用该质粒,结合配套的荧光显微镜膜片钳系统,研究BKCa通道的电生理特性及其药物作用机制,大大提高实验效率并简化筛选稳定表达克隆的过程。
综上,表达质粒 Flag-hSlo-GFP不仅可以用于BKCa通道的电生理学及调控研究,同时也可以作为研究BKCa通道蛋白转运的很好工具。其表达质粒在BKCa通道蛋白转运过程中的研究具有明显的特点和应用价值,为以后的研究奠定基础。
[1]谭晓秋,陈桂兰,李 涛,等.重叠PCR法构建人心房肌SK2(KCNN2)基因表达质粒及鉴定和序列分析[J].中国应用生理学杂志,2012,28(4):381-384.
[2]王 峰,程海霞,袁冬清,等.重叠PCR法构建XLRS1三种不同类型突变体[J].现代生物医学进展,2012,12(16):3068-3070.
[3]JeffriesO,Geiger N,Rowe IC,et al.Palmitoylation of the S0-S1 linker regulates cell surface expression of voltage-and calcium-activated potassium(BK)channel[J].JBiol Chem,2010,285(43):33307-33314.
[4]Sasaki F,Okuno T,Saeki K,et al.A high-affinitymonoclonalantibody against the FLAG tag useful forG-protein-coupled receptor study[J].Anal Biochem,2012,425(2):157-165.
[5]Lv C,Chen M,Gan G,et al.Four-turn alpha-helical segment prevents surface expression of the auxiliary beta2 subunit of BK-type channel[J].JBiolChem,2008,283(5):2709-2715.
Construction and identification of BKCaαsubunit exp ression plasm id w ith double labeling of Flag and GFP
LITao1,CHENG Xiu-li2,HUANGWen-jun1,YAN Li2,CAO Ji-min2△,TAN Xiao-qiu1,2△
(1.Key Laboratory of Medical Electrophysiology of Ministry of Education,Collaborative Innovation Center for Prevention and Treatment of Cardiovascular Disease/Institute of Cardiovascular Research,Sichuan Medical University,Luzhou 646000;2.Department of Physiology,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences,School of Basic Medicine,Peking Union Medical College,Beijing 100005,China)
【ABSTRACT】Objective:This study aimed to constructa large conductance calcium activated potassium channelα(BKCa)subunitplasmid with two tags by the overlapping PCR technique to setup a steady base for future ion channel study.Methods:Based on the existing coding BKCa channelαsubunitexpression plasmid pcDNA3.1-hSlo,we constructed a double-tag expression plasmid,namely,pcDNA3.1-Flag-hSlo-GFP(Flag-hSlo-GFP).Results:Flag tagwas inserted into the S1-S2 extracellular loop of BKCa channelαsubunit,and GFP tagwas connected to the C-terminusof BKCa channelαsubunit.Sequence of the constructed plasmidwas confirmed successful.Conclusion:The expression plasmid Flag-hSlo-GFPwas constructed successfully with overlapping PCR.Overlapping PCR is a valuablemethod for amplifying long size genes.
large conductance calcium activated potassium channels; overlapping PCR; gene cloning
R34
A
1000-6834(2016)03-279-04
国家自然科学基金资助项目(31300948);泸州市-四川医科大学联合资助项目(2015LZCYD-S03)
2015-06-29
2016-01-25
Tel:13982765332;E-mail:caojimin@126.com,tanxiaoqiu1981@163.com

