激活多巴胺I类受体对氧化性低密度脂蛋白诱导的人单核细胞THP-1分泌NO/NOS的影响*
柳 磊,时 飒,李鸿珠,李 弘,徐长庆
激活多巴胺I类受体对氧化性低密度脂蛋白诱导的人单核细胞THP-1分泌NO/NOS的影响*
柳 磊,时 飒,李鸿珠,李 弘△,徐长庆△
(哈尔滨医科大学基础医学院病理生理学教研室 ,黑龙江哈尔滨150086)
目的:探讨激活多巴胺Ⅰ类受体(DR1)对氧化型低密度脂蛋白(ox-LDL)诱导的人单核细胞(THP-1)分泌一氧化氮/一氧化氮合酶(NO/NOS)的影响及可能机制。方法:THP-1细胞经佛波酯PMA诱导分化,分为正常对照组(control),氧化型低密度脂蛋白处理组(ox-LDL),DR1激动剂干预组(SKF),DR1阻断剂干预组(SCH),ERK阻断剂干预组(PD98059);应用油红O染色法鉴定泡沫细胞;硝酸还原法检测NO、NOS的变化情况;免疫荧光和Western blot检测各组细胞蛋白表达情况。结果:ox-LDL刺激48 h可形成泡沫细胞;DR1在THP1细胞上表达,ox-LDL刺激后,DR1蛋白表达降低(P<0.01);激活DR1受体能够明显抑制由ox-LDL引起的NO、iNOS增多(P<0.01);在MAPK阻断剂PD98059存在的情况下,SKF的作用部分丧失。结论:激活DR1受体可抑制ox-LDL引起的THP-1细胞NO的大量产生,此过程可能由ERK信号通路所介导。
多巴胺受体;巨噬细胞;一氧化氮;单核细胞;低密度脂蛋白
【DOI】10.13459/j.cnki.cjap.2016.03.022
动脉粥样硬化(atherosclerosis,AS)是心脏及脑血管疾病的主要病理基础,而冠状动脉硬化性心脏病是人类死亡的首位原因[1]。其病因和发病机制十分复杂,目前认为AS是由脂质代谢紊乱引起的慢性炎症反应过程,包括内皮细胞功能不全、单核巨噬细胞、平滑肌细胞及其源性的泡沫细胞的迁移、活化、增生及炎症因子的释放等病理过程[2,3]。AS过程中所涉及的内皮细胞、平滑肌细胞、巨噬细胞皆有多巴胺受体的表达,激活多巴胺I类受体具有明显的抗氧化作用[3-6]。本研究拟在前期工作的基础上 ,以人单核细胞作为研究对象,利用ox-LDL刺激复制泡沫细胞模型,观察DR1激动剂对人单核细胞功能的影响。
1 材料与方法
1.1 材料和试剂
人单核细胞系THP-1(American Type Culture collection);RPMI 1640培养液、优级胎牛血清(Hyclone);DR1阻断剂 SCH-23390、DR1激动剂SKF83959、ERK阻断剂PD98059和佛波酯PMA(Sigma);ox-LDL(北京协生生物);油红O试剂(北京索莱宝);Western及 IP细胞裂解液(Beyotime);Western Blue(Promega);NO和NOS检测试剂盒(南京建成);p-ERK、ERK、DR1抗体(Santa Cruz);碱性磷酸酶标记的二抗和荧光二抗(博士德);其他试剂均为分析纯。
1.2 泡沫细胞模型的建立及油红O染色
THP-1细胞培养在含10%胎牛血清、100 mg/ml链霉素、300mg/L谷氨酰胺的RPMI1640培养液中,加入PMA(终浓度为100μg/L)诱导贴壁48 h后,更换培养液,加入ox-LDL(终浓度为50 mg/L)继续孵育48 h。弃培养液,PBS清洗3次,加入4%的多聚甲醛常温固定20min,油红O常温染色10min,再加入60%的异丙醇分化至间质清晰,PBS清洗3遍,苏木素复染,于显微镜下观察。
1.3 实验分组
正常对照组(control):仅用PMA诱导单核细胞贴壁;氧化性低密度脂蛋白干预组(ox-LDL):PMA诱导48 h后,加入ox-LDL,继续培养48 h;DR1激动剂干预组(SKF):PMA诱导48 h后,加入DR1激动剂SKF83959(10 mmol/L),作用30 min,然后加入ox-LDL,继续培养48 h;DR1阻断剂干预组(SCH):PMA诱导48 h后,先加入DR1阻断剂SCH-23390(10 mmol/L)作用30 min,再加入DR1激动剂,作用30 min,最后加入ox-LDL,继续培养48 h;ERK阻断剂干预组(PD98059):PMA诱导48 h后,加入PD98059(10 mmol/L),作用30 min,再加入DR1激动剂作用30 min,最后加入ox-LDL,继续培养48 h。
1.4 免疫荧光检测DR1的表达情况
取培养的细胞,弃培养液,PBS清洗,4%的多聚甲醛常温固定30min;PBS清洗,0.5%Triton-100常温孵育30min,PBS清洗,羊血清37℃湿盒封闭1 h,DR1兔IgG一抗(1∶50)4℃孵育过夜,PBS清洗,荧光二抗(1∶100)避光常温孵育1 h,PBS清洗,DAPI染核,PBS清洗,荧光显微镜下观察并摄片。
1.5 NO和NOS含量检测
取各组经ox-LDL刺激48 h的细胞培养液,每组8个孔(每孔5×105cells),按照试剂盒说明书,运用紫外分光光度计测定吸光度(OD)值,通过相应的计算公式,计算培养液中一氧化氮(nitric oxide,NO)和一氧化氮合酶(nitric oxide synthase,NOS)的含量;培养细胞经胰酶消化后细胞计数;计算细胞分泌NO 和NOS的含量。
1.6 蛋白质免疫印迹检测相关蛋白的表达
取各组培养细胞,PBS洗涤,加入全细胞裂解液,冰上处理10min,4℃,12 000 r/min离心20min,取上清进行蛋白质定量。取40μg总蛋白样品于10%变性聚丙烯酰胺凝胶电泳,随后转印至PVDF膜,用10%无脂肪牛奶封闭后,用兔IgG一抗(1∶500)4℃孵育过夜,碱性磷酸酶标记二抗(1∶500)室温孵育1 h,最后用western blue stabilized substrate for AP(Promega)显色,光密度扫描半定量分析显影条带。
1.7 统计学分析
2 结果
2.1 ox-LDL刺激THP-1细胞泡沫化
单纯PMA诱导的THP-1细胞,胞浆内未见红色颗粒;而ox-LDL刺激48 h的THP-1细胞,大部分胞浆内出现红色的脂质颗粒(图1)。

Fig.1 Lipid aggregation in THP-1 cells induced by ox-LDL(Oil Red O staining×400)
2.2 ox-LDL刺激THP-1细胞DR1蛋白表达降低
免疫荧光结果显示,THP-1细胞存在DR1的表达,主要存在于细胞膜和细胞质中(图2A);Westernblot检测也显示DR1的蛋白表达(图2B);经过ox-LDL诱导48 h后,与对照组相比,DR1表达降低(P <0.01,图2B)。
2.3 DR1激活可以抑制ox-LDL诱导的THP-1细胞NO和NOS的产生
与正常对照组相比,经ox-LDL刺激后,THP-1细胞分泌到培养液中的NO、tNOS和iNOS均增多(P <0.01);DR1激动剂预处理后,能明显抑制NO(P <0.05)、tNOS和iNOS的增多(P<0.01);DR1阻断剂预处理后,与ox-LDL组相比,NO、tNOS和iNOS分泌没有明显变化;ERK阻断剂预处理后,与单纯DR1激动剂处理组相比,NO,tNOS和iNOS有所增多(P <0.05,表1)。
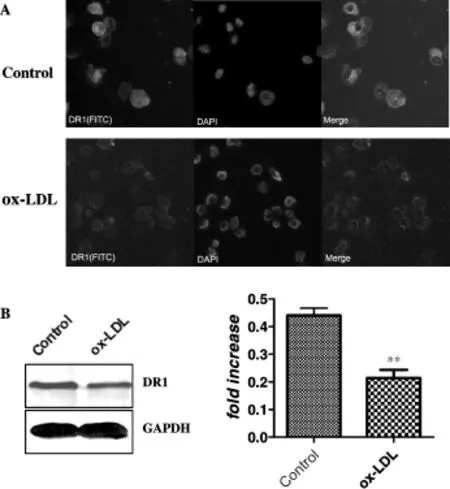
Fig.2 Expression of dopamine receptor(DR1)in THP-1 cellsA:Protein expression of DR1 in differentiated THP-1 cellswas detected by immnunofluorescence staining(×400);B:Protein expression of DR1 in differentiated THP-1 cells
Tab.1 Contentof NO/NOS in the supernatantof THP-1 cell(±s,n=8)

Tab.1 Contentof NO/NOS in the supernatantof THP-1 cell(±s,n=8)
ox-LDL:Oxidized low density lipoprotein;SKF:DR1 agonist SKF83959+ox-LDL;SCH:DR1 antagonitSCH23390+DR1 agonist SKF83959+ox-LDL;PD98059:ERK antagonit PD98059+ DR1 agonist SKF83959+ox-LDL**P<0.01 vs control group;#P<0.05,##P<0.01 vs ox-LDL group;△P<0.05 vs SKF group
Group NO(μmol/L) tNOS(U/ml) iNOS(U/ml)Control 12.642±2.073 5.486±0.757 3.455±0.172 ox-LDL 21.014±4.270**7.345±1.311**5.143±1.047**SKF 15.133±2.229# 5.663±0.793##4.001±0.145##SCH 19.219±3.521 7.076±1.362 5.279±0.145 PD98058 18.841±3.521△ 6.677±1.362△4.742±0.634△
2.4 p-ERK和ERK蛋白的表达
Western blot结果显示,与正常对照组相比,低密度脂蛋白处理后,p-ERK表达明显减少(P<0.01,图3);经过DR1激动剂预处理后,与ox-LDL组相比,p-ERK表达增多(P<0.05);DR1阻断剂预处理后,p-ERK表达降低;使用ERK阻断剂并没有影响p-ERK的表达水平。
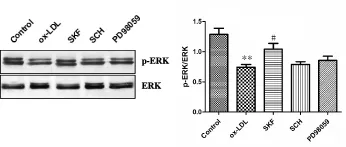
Fig.3 The expression of p-ERK/ERK in THP-1 cells(n=8)ox-LDL:Oxidized low density lipoprotein;SKF:DR1 agonist SKF83959+ox-LDL;SCH:DR1 antagonit SCH23390+ DR1 agonist SKF83959+ox-LDL;PD98059:ERK antagonit PD98059+DR1 agonist SKF83959+ox-LDL
3 讨论
动脉粥样硬化是多种因素共同参与的慢性炎症过程,病变的各个阶段都伴有大量炎细胞的浸润,而单核巨噬细胞的异常是引发和促进动脉粥样硬化的关键因素,因此针对其黏附、聚集、胆固醇代谢,炎症活动的研究已成为近年来AS的研究热点[2]。脂类代谢异常尤其是低密度脂蛋白增多是AS的首位危险因素。巨噬细胞通过吞噬大量氧化修饰的低密度脂蛋白(ox-LDL),转化成细胞内脂质堆积的泡沫细胞,进而形成脂质条纹乃至脂质斑块[7]。本实验通过ox-LDL刺激THP-1细胞,复制AS的细胞模型,结果显示,经过48 h的ox-LDL孵育,大部分细胞内可见染成红色的脂滴,提示使用该模型研究AS是可行的。
ox-LDL刺激的巨噬细胞会产生大量炎性介质和活性氧,而氧化应激可引起内皮细胞损伤,促进平滑肌细胞增殖迁移,加速AS的进程[8,9]。适量的NO具有重要的生理功能,过量则具有毒性作用,引起细胞损伤,加重炎性反应[6]。本实验证实ox-LDL刺激的巨噬细胞诱导性一氧化氮合酶((iNOS)增多,产生和分泌大量NO,引起氧化应激,因此降低NO的水平将会抑制AS的进程。
多巴胺受体属于G蛋白偶联受体超家族成员,根据生化和药理学特性的不同,将其分为D1样和D2样受体,其中D1与G蛋白中Gs结合,激活腺苷酸环化酶(AC),使cAMP增高,刺激磷脂酶C,导致细胞内钙增高。D2样受体与Gi/Gq作用,抑制AC,降低cAMP,抑制钙通道,调节钾通道[10]。研究显示,在血管平滑肌细胞中,多巴胺发挥抗氧化作用主要通过DR1[3-4]。巨噬细胞上存在多巴胺受体,激活DR1可抑制ox-LDL诱导的巨噬细胞增生[11],但DR1在此过程中是如何发挥作用并不清楚。
本课题组前期实验已证实,小剂量的多巴胺通过DR1能够抑制过氧化氢诱导的心肌细胞的损伤,具有抗氧化作用[6]。本实验结果显示,THP-1细胞的胞浆和细胞膜上存在DR1表达,但经ox-LDL刺激后表达降低,提示其可能参与了泡沫细胞的形成。使用DR1激动剂预处理后,细胞生成的NO明显减少,说明DR1激动剂能够抑制由ox-LDL诱导的NO增多。为了进一步探讨其介导的信号转导通路[12],选择ERK阻断剂PD98059,可见多巴胺受体激动剂的作用受到抑制,说明DR1激活介导的抗氧化作用与ERK通路有关,具体机制还有待进一步探讨。
综上所述,氧化性低密度脂蛋白对细胞有损伤作用,激活DR1受体可抑制ox-LDL引起的THP-1细胞NO的大量产生,此过程可能通过ERK信号通路所介导。
[1]Rice BH.Dairy and cardiovascular disease:a review of recent observational research[J].Curr Nutr Rep,2014,3: 130-138.
[2]Legein B,Temmerman L,Biessen EA,et al.Inflammation and immune system interactions in atherosclerosis[J].Cell Mol Life Sci,2013,70(20):3847-3869.
[3]YasunariK,KohnoM,Kano H,etal.Dopamine asa novel antioxidative agent for rat vascular smooth muscle cells through dopamine D(1)-like receptors[J].Circulation,2000,101(19):2302-2308.
[4]Zeng C,Han Y,Huang H,et al.D1-like receptors inhibit insulin-induced vascular smoothmuscle cell proliferation via down regulation of insulin receptor expression[J].JHypertens,2009,27(5):1033-1041.
[5]杨 迪,韩 愈,寇 恂,等.多巴胺D1类受体在小鼠巨噬细胞上的表达及其对ox-LDL诱导的小鼠巨噬细胞增殖的影响[J].第三军医大学学报,2014,36 (1):11-14.
[6]蔡晓娜,时 飒,李鸿珠 ,等.小剂量多巴胺对氧化应激诱导的大鼠心肌细胞凋亡的影响及其机制[J].中国应用生理学杂志,2015,31(1):67-71.
[7]Yu XH,Fu YC,Zhang DW,etal.Foam cells in atherosclerosis [J].Clin Chim Acta,2013,424:245-252.
[8]Huang H,Koelle P,Fendler M,et al.Induction of inducible nitric oxide synthase(iNOS)expression by oxLDL inhibitsmacrophage derived foam cellmigration[J].Atherosclerosis,2014,235(1):213-222.
[9]Raman KG,Gandley RE,Rohland J,et al.Early hypercholesterolemia contributes to vasomotor dysfunction and injury associated atherogenesis that can be inhibited by nitric oxide [J].JVasc Surg,2011,53(3):754-763.
[10]Vallone D,Picetti R,Borrelli E.Structure and function of dopamine receptors[J].Neurosci Biobehav Rev,2000,24 (1):125-132.
[11]李 帅 ,黄 健,李红艳,等 .NO/PKG对THP-1巨噬细胞ABCA1基因mRNA表达和胆固醇含量的影响[J].临床心血管病杂志,2011,27(10):791-794.
[12]王媛媛 ,彭 洋 ,张 琦,等.ERK1/2信号通路对黄芪苷Ⅳ抗H2O2诱导H9c2细胞氧化损伤的作用[J].中国应用生理学杂志,2011,27(3):363-366.
Effects of activation of dopam ine type I receptor on the production of NO/NOS in ox-LDL activated THP-1 cells
LIU Lei,SHISa,LIHong-zhu,LIHong△,XU Chang-qing△
(Department of Pathophysiology,Harbin Medical University,Harbin 150086,China)
【ABSTRACT】Objective:To study the effectof excited dopamine type Ireceptoron the production ofnitric oxide/nitric oxide synthase(NO/ NOS)in ox-LDL activated THP-1 cells and the possiblemechanism.Methods:Cultured THP-1 cellsactivated by PMAwere random ly assigned in the following groups:control group(control),oxidized low density lipoprotein group(ox-LDL),dopamine receptor 1(DR1)agonistgroup (SKF),DR1 antagonistgroup(SCH),ERK blocker group(PD98059).Oil Red O stainingwas used to identify the accumulation of cellular lipid.The levels of NO and NOS in the supernatantof THP-1 were assayed by nitrate reductasemethod.The protein expression of DR1,p-ERK and ERK were obtained byWestern blotand immunity fluorescence.Results:After48 h of incubation ofox-LDL,accumulation of lipid in the cytoplasm was found inmost THP-1 cells.Compared with control group,DR1 protein expressionwas reduced in ox-LDL-induced cells (P<0.01).Activation of DR1 agonist decrease the production of NO and iNOS(P<0.01),and PD98059 partly reversed the above effect. Conclusion:Activation of DR1 can inhibit the production of NO/NOS in ox-LDL-induced THP-1 cells,whichmay be relatedwith ERK pathway.
dopamine receptor(DR); foam cells; nitric oxide(NO); THP-1 cells; LDL
R363.2
A
1000-6834(2016)03-274-04
黑龙江省自然科学基金项目资助(D200880);黑龙江省教育厅课题(12521181)
2015-03-09
2015-10-20
Tel:0451-86674548;E-mail:drlihong1971@163.com

