大口黑鲈溃疡综合征病毒MCP基因的原核表达及重组蛋白的免疫效果初步分析
马冬梅邓国成白俊杰江小燕曹婷婷蔡磊
(1. 中国水产科学研究院珠江水产研究所 农业部热带亚热带鱼类选育与养殖重点开放实验室,广州 510380;2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070)
大口黑鲈溃疡综合征病毒MCP基因的原核表达及重组蛋白的免疫效果初步分析
马冬梅1,2邓国成1白俊杰1,2江小燕1曹婷婷1蔡磊1
(1. 中国水产科学研究院珠江水产研究所 农业部热带亚热带鱼类选育与养殖重点开放实验室,广州 510380;2. 淡水水产健康养殖湖北省协同创新中心,武汉 430070)
为了预防近年来流行于广东省养殖大口黑鲈(Micropterus salmoides)中的病毒性溃疡综合征,以大口黑鲈溃疡综合征病毒(Largemouth bass ulcerative syndrome virus,以下简称 LBUSV)的主要衣壳蛋白(MCP)作为目标抗原蛋白,将MCP基因开放阅读框插入到pBV220载体中,转化大肠杆菌DH5α,构建重组表达MCP蛋白的工程菌。重组菌经过42℃温度诱导和SDSPAGE电泳,检测到在分子量51 kD处有一条特异表达蛋白带,重组蛋白约占重组菌体总蛋白的30%。重组MCP蛋白经洗涤、纯化、溶解、复性和透析后纯度达90%以上。将纯化后的重组蛋白与不完全弗氏佐剂混合、乳化后,免疫大口黑鲈,然后进行感染实验,感染后20 d疫苗保护率最高达67.7%。结果表明,该病毒MCP蛋白具有一定的免疫原性,可以作为制作重组疫苗的候选蛋白。
大口黑鲈;溃疡综合征病毒;主要衣壳蛋白;原核表达;免疫效果
大口黑鲈(Micropterus salmoides)因具有生长快、养殖周期短、肉质细致鲜美和容易起捕等特点,目前已成为中国重要的经济养殖品种[1,2]。根据中国《2014年渔业统计年鉴》统计,2013年中国大口黑鲈的产量约为34万t。但从2008年起,每年6-10月期间,在广东省的养殖大口黑鲈中都会流行病毒性溃疡综合征表现为皮肤和肌肉坏死溃烂,并伴有脾脏和肾脏变大等,病鱼死亡率最高达60%,该病给养殖户造成了巨大的经济损失[3,4]。经研究发现,该病毒性溃疡综合征是由一种虹彩病毒科(Iridoviridae)蛙病毒属(Ranavirus)的病毒感染引起的[5]。目前,已对该病毒建立了快速的检测方法[6-8],但还没有有效的治疗手段。
鱼类的虹彩病毒具有直径120-300 nm 的二十面体衣壳结构特征[9],衣壳是包围在病毒核酸外面的蛋白质外壳,虹彩病毒的主要衣壳蛋白(major capsid protein,MCP)分子量约为50 kD,占病毒总蛋白的40%-45%[10]。衣壳蛋白具有保护病毒核酸和介导病毒与宿主细胞结合的作用,一般具有该种病毒特异的表面抗原,可刺激宿主的机体产生病毒抗原免疫应答[11,12]。疫苗免疫是预防鱼类流行疾病发生的一种有效方法,传统的鱼用疫苗以获取方法来分有活疫苗、灭活疫苗和化学疫苗[13]。新型的用基因工程疫苗(synthetic peptide vaccine)是利用DNA重组技术方法,将病毒的抗原基因片段定向插入载体,导入细菌、酵母菌或哺乳动物细胞等宿主中,使之重组表达,经纯化后而制得的疫苗[14,15]。基因工程疫苗具有制备容易、可大量生产、稳定、易保存、副反应少、使用安全等优点,但存在免疫原性不足的缺点[13,14]。以鱼类虹彩病毒MCP作为保护性抗原的基因工程疫苗已有大量的研究报道,但在实际应用中还存在争议,如在国内外对虹彩病毒的研究中都有发现MCP是鱼虹彩病毒的保护性抗原,具有一定的免疫保护效果[16,17],但同时也有文献报道MCP是一种无效抗原,尽管具有较强的免疫原性,但并不能介导有效地免疫保护[18,19]。
为了预防近年来流行的病毒性大口黑鲈溃疡综合征,本研究利用原核表达的方法,构建重组表达该致病病毒MCP蛋白的重组工程菌。重组菌表达的重组蛋白经过纯化、复性和浓缩,与不完全弗氏佐剂混匀乳化后免疫大口黑鲈,并检测LBUSV 的MCP蛋白免疫保护效果,旨在为该病毒病疫苗的开发提供可靠的实验数据。
1 材料与方法
1.1材料
实验用大口黑鲈溃疡综合征病毒(Largemouth bass ulcerative syndrome virus,LBUSV)由珠江水产研究所生物技术实验室保存。感染实验用的大口黑鲈来自珠江水产研究所良种基地,平均体质量约为50 g,经PCR检测LBUSV病毒[6]为阴性,认为是健康鱼用于实验。
1.2方法
1.2.1大口黑鲈溃疡综合征病毒MCP重组表达工程菌的构建 根据LBUSV MCP基因的1 392 bp的ORF设计引物MCPEP1:5'-CGGAATTCATGTCTTCT GTTACGGGTTC-3'和MCPEP2:5'-CGCGGATCCTTA CAGGATGGGGAAACCCA-3',PCR产物经过纯化后,用EcoRⅠ和BamHⅠ酶切并插入pBV220原核表达载体,转化大肠杆菌DH5α,经过筛选得到阳性克隆,在ABI 3730自动测序仪上进行测序。
1.2.2MCP重组蛋白的表达和纯化 将测序结果正确的阳性重组大肠杆菌接种在LB培养基中,37℃200 r/min 培养至OD600值达0.4-0.5时,将菌液快速升温至42℃诱导重组蛋白表达,4 h后停止诱导,离心以收集细菌菌体,超声波破碎后,12 000 r/min离心10 min分别取上清液和沉淀物,用12% SDS-PAGE胶电泳、考马斯亮蓝染色,检测。包涵体先用0.05 mol/L Tris-HCl(pH8.5)洗涤1次,含2 mo/L尿素的Tris-HCl(pH8.5)洗涤2次,再用含有4 mol/L 尿素的Tris-HCl(pH8.5)各洗涤1次,最后用8 mol/L 尿素溶解包涵体。将溶解后的蛋白溶液装入透析袋进行尿素梯度浓度透析以去除尿素,并用聚乙二醇6000浓缩后,用12% SDS-PAGE电泳检测,并用Bradford 法测定纯化后的蛋白浓度[20]。
1.2.3免疫保护实验 把健康的大口黑鲈随机分为4组,每组35尾,其中3个实验组,1个对照组。将纯化后的重组MCP蛋白与不完全弗氏佐剂混合并乳化后,实验鱼腹腔注射进行免疫,3个实验组的免疫剂量分别为每尾鱼50 μg/200 μL、100 μg/200 μL和150 μg/200 μL,对照组腹腔注射0.05 mol/L Tris-HCl(pH8.5)。免疫后分别放入独立已消毒的5 m3的水泥池中,实验过程中每天早晚各投喂一次饲料和吸污一次,水温控制在28℃左右,免疫30 d后,实验组和对照组全部进行攻毒实验,每尾背鳍肌肉注射剂量为102.5LD50/0.2 mL,每天观察记录各组鱼的死亡情况,20 d后计算免疫实验保护效率:

将发病的死鱼进行PCR检测,以确定死亡原因。
2 结果
2.1MCP蛋白的诱导表达
对测序结果证明插入正确的重组工程菌进行诱导表达,温度诱导后的重组菌经SDS-PAGE电泳,考马斯亮蓝染色后,在分子量约51 kD处检测到一条特异表达蛋白带,与预期蛋白大小一致,42℃温度诱导4 h该工程菌特异表达的重组蛋白约占菌体总蛋白量的30%。将诱导后的重组菌超声波破碎、离心后,分别取上清液和沉淀物进行SDS-PAGE电泳检测,结果(图1)表明,工程菌表达的重组蛋白带主要是以包涵体的形式出现在沉淀物中,而上清液中基本无此特异条带的出现。
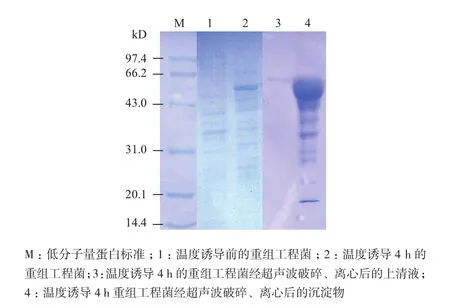
图1 SDS-PAGE检测重组主要衣壳蛋白(MCP)的表达
2.2MCP蛋白的纯化
将表达MCP蛋白的重组工程菌超声波破碎、离心得到的沉淀即为包涵体,优化洗涤方法,用尿素洗涤沉淀中的包涵体纯化MCP蛋白,然后用8 mol/L尿素溶解包涵体,并透析复性浓缩。纯化后的MCP蛋白占溶液中总蛋白浓度的90%(图2)。用Bradford 法测定蛋白浓度,每升LB培养基可生产纯化的重组MCP蛋白约86.7 mg。

图2 SDS-PAGE检测重组MCP蛋白的纯化

图3 累积死亡曲线
2.3MCP蛋白免疫保护效果
将纯化后的MCP蛋白以3个不同的浓度与不完全弗氏佐剂乳化后免疫大口黑鲈,30 d后进行攻毒实验,检测免疫保护效果。结果(图3)表明,攻毒后第6天开始,除150 μg组外,各组均有鱼开始发病死亡,而150 μg组是在攻毒后第7天开始出现发病死亡;第7-9天,除150 μg组外,各组死亡率加剧,对照组累积死亡率最高,达94.3%,50 μg组和100 μg组分别为73.5%和42.9%,而150 μg组是在攻后第10天出现死亡加剧,累积死亡率为29%;对照组在第10天累积死亡率达到100%,而100 μg组和150 μg组在第11天累积死亡率达到峰值,分别为57.1%和32.3%,50 μg组在第12天累积死亡率为85.3%,从第13天开始各组再无实验鱼死亡。对照组与免疫组相比死亡速度最快、死亡率最高,免疫剂量达150 μg的实验组免疫效果最好,攻毒15 d,保护率达67.7%,比100 μg组(保护率42.9%)和50 μg组(保护率11.8%)的免疫效果显著提高(表1)。以每尾鱼50 g计算,MCP蛋白的免疫剂量要在3 μg/g鱼以上才能达到较好的免疫效果。经PCR检测,攻毒后的发病鱼均感染了LBUSV(图4)。
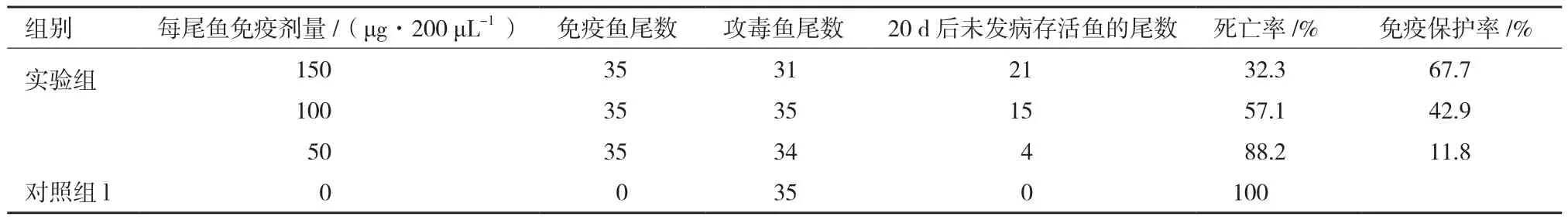
表1 MCP蛋白免疫效果分析
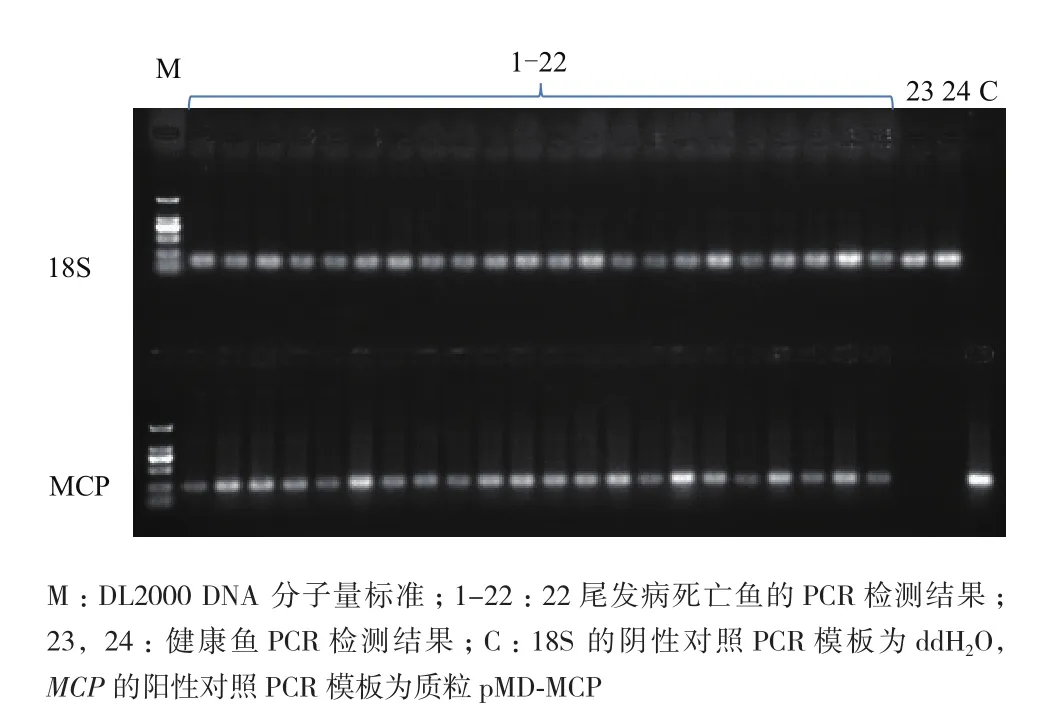
图4 PCR检测发病鱼电泳结果
3 讨论
人类基因工程疫苗已有深入的研究和广泛的应用[21,22],在鱼类中重组蛋白疫苗的开发还一直处于研究阶段,但也有多种渔用重组蛋白疫苗和DNA疫苗等新型疫苗得到研究和开发[23,24],如IPNV重组VP2亚单位疫苗[25]、VHSV重组G蛋白亚单位和AHNV重组MCP重组[26]蛋白疫苗的研制和开发,鱼类基因工程疫苗有着广阔的发展前景,是鱼类疫苗发展的重要方向[27]。选择免疫原性好的目标蛋白对于成功开发重组蛋白疫苗至关重要,病毒的衣壳蛋白因具有较强的抗原特性,成为鱼类重组病毒蛋白疫苗开发和制备的首选优良候选目标蛋白。
关于重组虹彩病毒MCP疫苗免疫效果的研究结果很不一致,有的研究发现MCP是鱼虹彩病毒的保护性抗原,具有一定的免疫保护效果,但有研究却认为MCP是一种无效抗原,尽管具有较强的免疫原性,但并不能介导有效的免疫保护[16-19]。本研究表明,大口黑鲈溃疡综合征病毒(LBUSV)的主要衣壳蛋白MCP作为免疫蛋白源对大口黑鲈进行免疫具有一定的免疫效果。与本研究相似,重组虹彩病毒MCP疫苗的研究表明,将鳜传染性脾肾坏死病毒重组MCP免疫鳜,再用该病毒攻毒后,每尾鱼(体质量40-50 g)注射50 μg重组MCP蛋白组免疫保护效率最高,达64.3%[29,30]。用重组大西洋鳕鱼神经坏死病毒(SJNNV)衣壳蛋白免疫大西洋鳕鱼(平均体质量约为2.2 g),攻毒后10 μg组比50 μg组免疫效果好,免疫保护效率最高达80%以上[31]。用赤点石斑鱼神经坏死病毒衣壳蛋白基因重组蛋白制备的疫苗免疫军曹鱼,经过3次免疫和一次免疫,相对保护率最高分别为56%和54%,但浓度50 μg组的免疫效果比10 μg和100 μg的免疫效果好[32]。以上研究表明重组病毒衣壳蛋白的免疫保护效率约在50%-80%之间。与本研究结果相比,以LBUSV的主要衣壳蛋白MCP作为免疫蛋白源对大口黑鲈进行免疫,每尾鱼(平均体质量约为50 g)注射150 μg MCP蛋白免疫1个月,免疫保护率为67.7%,约每克大口黑鲈需注射3 μg重组MCP蛋白即可产生免疫保护效果,免疫原蛋白需求量高于鳜传染性脾肾坏死病毒重组MCP疫苗[29,31],低于大西洋鳕鱼重组神经坏死病毒(SJNNV)重组MCP疫苗,免疫原蛋白需求量可能与鱼的种类和鱼的体质量有关。
在用大肠杆菌表达重组MCP蛋白时,该研究首先选用的是pET-30c(+)(Novagen公司)载体构建了MCP基因的表达质粒,经诱导后得到分子量约60 kD的带组氨酸标签的重组表达蛋白,但在纯化时,该蛋白不能与Ni亲合纯化柱结合,可能是由于蛋白在复性时发生了异构化,组氨酸标签不能很好地暴露在蛋白表面,或形成了细小的沉淀[33],所以未能与Ni亲合纯化柱有效结合。将MCP基因插入用pBV220载体,进行温度诱导得到了51 kD大小的重组蛋白,去掉了用pET-30c(+)载体表达的组氨酸标签,用传统的尿素洗涤的方法得到了纯化的MCP蛋白[34],纯度达90%。该方法与Ni亲合纯化柱相比也有操作简单,成本低,纯化速度快等优点,更适合大量生产疫苗的需求。
4 结论
将大口黑鲈溃疡综合征病毒的MCP基因经过改造后,插入到原核表达载体pBV220,构建重组表达MCP蛋白的工程菌。工程菌经过温度诱导,表达的重组MCP蛋白经过纯化和复性后与不完全弗氏佐剂乳化后,免疫大口黑鲈,然后进行感染实验,20 d后计算疫苗保护率最高达67.7%。结果表明,该病毒MCP蛋白具有一定的免疫原性,可以作为制作重组疫苗的候选蛋白。
[1] 梁素娴, 白俊杰, 叶星, 等. 养殖大口黑鲈的遗传多样性分析[J]. 大连水产学院学报, 2007, 22(4):260-263.
[2]Bai JJ, Lutz-carrillo DJ, Quan YC, et al. Taxonomic status and genetic diversity of cultured largemouth bass Micropterus salmoides in China[J]. Aquaculture, 2008, 278:27-30.
[3]邓国成, 谢骏, 李胜杰, 等. 大口黑鲈病毒性溃疡病病原的分离和鉴定[J]. 水产学报, 2009, 33(5):871-877.
[4]邓国成, 白俊杰, 李胜杰, 等. 大口黑鲈池塘养殖常见病害及其防治[J]. 广东农业科学, 2011, 18:102-103.
[5]Deng GC, Li SJ, Xie J, et al. Characterization of a ranavirus isolated from cultured largemouth bass(Micropterus salmoides)in China[J]. Aquaculture, 2011, 312:198-204.
[6]马冬梅, 白俊杰, 邓国成, 等. 大口黑鲈溃疡综合症病毒MCP基因序列分析及PCR快速检测方法的建立[J]. 中国水产科学,2010, 17(6):1149-1156.
[7]马冬梅, 白俊杰, 邓国成, 等. 大口黑鲈溃疡综合症病毒TaqMan-MGB探针荧光定量PCR检测方法的建立[J]. 华南农业大学学报, 2011, 32(2):99-102.
[8]王庆, 曾伟伟, 刘春, 等. 大口黑鲈虹彩病毒双重PCR 检测方法的建立[J]. 华中农业大学学报, 2013, 32(4):106-110.
[9]Williams T. The iridoviruses[J]. Adv Virus Res, 1996, 46:345-412.
[10] Chinchar VG, Essbauer S, He JG, et al. Family Iridoviridae[R]// Fauquet CM, Mayo MA, Maniloff J, et al. Virus taxonomy. Classification and nomeclature of viruses. Eighth report of the international committee on the taxonomy of viruses. San Diego:Academic Press, 2005:145-162.
[11]张奇亚, 桂建芳. 水生病毒学[M]. 北京:高等教育出版社,2008:12.
[12]Young RK, Jun-ichi H, Ho BJ, et al. Identification and determination of antigenic proteins of Koreanranavirus-1(KRV-1)using MALDI-TOF/TOF MS analysis[J]. Comp Immunol Microbiol Infect Dis, 2011, 34:237-245.
[13] 张颖, 杨舸. 鱼类疫苗的研究概况与进展[J]. 西昌学院学报:自然科学版, 2009, 23(1):13-14.
[14]田园园, 叶星. 鱼用基因工程疫苗研究进展[J]. 中国农业科技导报, 2012, 5:145-152.
[15]夏永娟, 黄威权. 新型鱼用疫苗的研究进展[J]. 中国水产科学, 2001, 8(1):86-88.
[16]Kim TJ, Jang EJ, Lee JI. Vaccination of rock bream, Oplegnathus fasciatus(Temminck and Schlegel), using a recombinant major capsid protein of fish iridovirus[J]. J Fish Dis, 2008, 31:547-551.
[17]Nusbaum KE, Smith BF, Delnnocentes P, Bird RC. Protective immunity induced by DNA vaccination of channel catfish with early and late transcripts of the channel catfish herpesvirus(IHV-1)[J]. Vet Immunol Immunopathol, 2002, 84:151-168.
[18]Shimmoto H, Kawai K, Ikawa T, Oshima S. Protection of red sea bream Pagrus major against red sea bream iridovirus infection by vaccination with a recombinant viral protein[J]. Microbiol Immunol, 2010, 54(3):135-142.
[19]Zhang M, Hu YH, Xiao ZZ, et al. Construction and analysis of experimental DNA vaccines against megalocytivirus[J]. Fish Shellfish Immunol, 2012, 33(5):1192-1198.
[20]汪家政, 范明. 蛋白质技术手册[M]. 北京:科学出版社,2002:42-47.
[21]张婷婷. 特异性抗原融合蛋白结核病疫苗研究进展[J]. 微生物学免疫学进展, 2014, 42(1);61-66.
[22]陈洪. 合成肽重组疫苗的抗病毒效力[J]. 国外医学:预防.诊断. 治疗用生物制品分册, 2002, 25(5):211-214.
[23]Van Muiswinkel WB, Nakao M. A short history of research on immunity to infectious diseases in fish[J]. Dev Comp Immunol,2014, 43(2):130-50.
[24]Leong JC, Anderson E, Bootland LM, et al. Fish vaccine antigens produced or delivered by recombinant DNA technologies[J]. Dev Biol Stand, 1997, 90:267-277.
[25]Sommerset I, Skern R, Biering E, et al. Protection against Atlantic halibut nodavirus in turbot is induced by recombinant capsid protein vaccination but not following DNA vaccination[J]. Fish Shellfish Immunol, 2005, 18(1):13-29.
[26]Lepal A, Siwickil AK, Terech-majewska E. Application of DNA vaccines in fish[J]. Polish J Veterin Sci, 2010, 13(1):2l3-215.
[27]Salgado-miranda C, Loza-rubio E, Rojas-anaya E, et al. Viral vaccines for bony fish:past, present and future[J]. Expert Rev Vaccines, 2013, 12(5):567-578.
[28]Mao J, Wang J, Chinchar G D, et al. Molecular characterization of a ranavirus isolated from largemouth bass Micropterus salmoides[J]. Dis Aquat Organ, 1999, 37(2):107-114.
[29]张敏, 白俊杰, 劳海华, 等. 鳜传染性脾肾坏死病毒主要衣壳蛋白基因的原核表达[J]. 中国病毒学, 2004, 19(2):137-140.
[30]付小哲, 李宁求, 彭媛媛, 等. 鳜传染性脾肾坏死病毒重组主衣壳蛋白免疫效果的初步验证[J]. 中国水产科学, 2009, 16 (3):388-393.
[31]Husgar S, Grotmol S, Hjeltnes BK, et al. Immune response to a recombinant capsid protein of striped jack nervous necrosis virus (SJNNV)in turbot Scophthalmus maximus and Atlantic halibut Hippoglossu shippoglossus, and evaluation of a vaccine against SJNNV[J]. Dis Aquat Organ, 2001, 45:33-44.
[32]苏友禄, 郭志勋, 冯娟, 等. 神经坏死病毒 MCP 重组疫苗对军曹鱼稚鱼的免疫保护[J]. 生物技术通报, 2009(S1):228-241.
[33]龚晓亮, 朱家鸿. 细菌重组蛋白的表达及分离纯化[J]. 国外医学:预防. 诊断. 治疗用生物制品分册, 1991, 14(2):49-52.
[34]龙英娜, 刘焕奇, 王明志. 重组包涵体的纯化和复性[J]. 黑龙江畜牧兽医, 2008, 4:70-72.
(责任编辑 李楠)
Prokaryotic Expression of MCP Gene from Largemouth Bass Ulcerative Syndrome Virus and the Immune Effect Analysis of Recombinant Protein
MA Dong-mei1,2DENG Guo-cheng1BAI Jun-jie1,2JIANG Xiao-yan1CAO Ting-ting1CAI Lei1
(1. Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation(Ministry of Agriculture),Pearl River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510380;2. Freshwater Aquaculture Collaborative Innovation Center of Hubei Province,Wuhan 430070)
For preventing the outbreak of viral ulcerative syndrome in largemouth bass(Micropterus salmoides)in Guangdong province,the ORF of major capsid protein(MCP)gene,as target antigen protein gene,from largemouth bass ulcerative syndrome virus(LBUSV)was inserted in vector pBV220,then transformed into Escherichia coli DH5α,and the recombinant engineering bacterium for expressing MCP was constructed. Following 42℃ temperature inducement and SDS-PAGE analysis,the recombinant bacterium was detected to produce a special expression protein with molecular weight about 51 kD,and the proportion of recombinant MCP protein was nearly 30% of total bacterial protein. After washed,purified,dissolved,renatured and dialyzed,the purity of the recombinant protein reached over 90%. The purified protein was mixed and emulsified with incomplete Freund's adjuvant,then was injected in largemouth bass as vaccine. The immunized fish were challenged with LBUSV,and the highest relative percentage of survival reached 67.7% after 20 days. The results indicate that the MCP of LBUSV has the immunogenicity and can be selected as candidate protein for recombinant vaccine.
largemouth bass(Micropterus salmoides);ulcerative syndrome virus;major capsid protein;prokaryotic expression;immune effect
10.13560/j.cnki.biotech.bull.1985.2016.08.021
2015-11-04
国家自然科学基金项目(31001107),“948”计划重点项目(2011-G12),国家科技支撑计划(2012BAD26B03),广东省省级科技计划项目(2015A020209035)
马冬梅,女,博士,副研究员,研究方向:鱼类遗传育种;E-mail:madongmei2003@163.com
白俊杰,男,研究员,研究方向:水产动物遗传育种及生物技术;E-mail:jjbai@163.net

