梅花鹿CGI99基因RNAi慢病毒载体的构建及其对鹿茸干细胞增殖的影响
路晓 孙红梅 褚文辉 张伟 李春义
(中国农业科学院特产研究所 特种经济动物分子生物学国家重点实验室,长春 130000)
梅花鹿CGI99基因RNAi慢病毒载体的构建及其对鹿茸干细胞增殖的影响
路晓 孙红梅 褚文辉 张伟 李春义
(中国农业科学院特产研究所 特种经济动物分子生物学国家重点实验室,长春 130000)
利用慢病毒介导的基因沉默体系,对梅花鹿生茸区骨膜干细胞(AP)中CGI99基因进行RNA干扰,并初步研究该基因对细胞增殖的影响。设计出1条针对梅花鹿CGI99基因的shRNA序列与载体质粒 pLVTHM连接,之后与pSPAX2、pMD2.G质粒共转染HEK 293t细胞,获得重组慢病毒,感染AP细胞;通过荧光定量PCR检测CGI99基因的下调水平;通过MTT实验检测CGI99基因沉默对AP细胞增殖影响。基因的表达水平大幅度下调,干扰效率达到70.8%;MTT实验的数据曲线趋于一致。结果表明,成功构建了针对梅花鹿CGI99基因的RNAi载体并干扰了CGI99基因在AP细胞中的表达,且初步确定CGI99基因对AP细胞的增殖并无显著影响。
鹿茸;RNAi;CGI99基因;鹿茸干细胞
鹿茸作为哺乳动物中唯一能够完全再生的骨质性附属器官,生长极其迅速,且成骨过程极易观察。鹿茸生长顶端具有明显的真皮层、间充质层、前成软骨层、过渡层和软骨层[1],同时在生长高峰期细胞的生长速度可达到癌细胞的30倍,但其却不发生癌变[2]。研究表明,鹿茸的再生是基于干细胞的过程,鹿茸干细胞具有补充维持鹿一生中每一个鹿茸再生循环所需的快速增殖细胞的能力。鹿生茸区骨膜细胞(antlerogenic periosteum,AP)为鹿茸发生的干细胞[3],而且由于其可分化成皮肤、血管、神经、软骨及骨等多种成分[4],因此,鹿茸可作为一种研究骨快速生长、成骨过程以及干细胞生物学等的天然优秀模型。
CGI99基因(同名基因C14orf166)全长1 064 bp,核心编码区738 bp,编码分子量约26 kD的蛋白分子,该基因主要表达于细胞质,但在细胞核中也有表达[5]。本实验室构建的SSH(Suppression Subtractive Hybridization)文库筛选到了CGI99基因,通过原位杂交试验发现该基因在鹿茸软骨小梁中高度表达(未发表),而在鹿茸的其他部位则几乎不表达(如血管),因此,推测其在鹿茸软骨发育、成骨中具有重要的调节作用,如可能与参与软骨发生的调控[6]。由于AP细胞可分化为软骨,本实验利用慢病毒介导的RNAi途径,靶向沉默AP细胞中的CGI99基因[7],并进一步探究CGI99基因沉默对AP细胞增殖的影响,旨在为继续研究该基因的相关机制做好初步工作。
1 材料与方法
1.1材料
AP细胞、细胞株人胚肾细胞293t、载体质粒pLVTHM、包膜质粒pMD2.G、包装质粒pSPAX2均由本实验室保存;限制性内切酶Cla I、Mlu I 购自NEB公司;T4 DNA 连接酶、1 000 bp DNA Marker购自TaKaRa(大连)公司;感受态细胞DH5α购自全式金公司、小量质粒提取试剂盒购自Axygen公司;大量质粒DNA 提取试剂盒购自Promega公司;琼脂糖凝胶回收试剂盒购自上海生工公司;DMEM、Trypsin 购自Life Tech公司;标准胎牛血清购自Gibco公司;SYBR GREEN 、X-tremeGENE HP购自Roche公司;ploybrene购自Santa Cruz Biotech公司,其他试剂均为国产或进口分析纯。
1.2方法
1.2.1梅花鹿CGI99基因shRNA重组慢病毒载体的构建及鉴定 根据本课题组cDNA文库中的CGI99基因序列(数据未发表),并根据The RNAi Consortium(TRC)RNAi靶位点筛选法则、Angela筛选法则及通过在线设计等方法比较多条备选序列,最终选择了1条针对梅花鹿CGI99基因的高分RNAi靶序列。为确保该序列不会对梅花鹿其他基因造成影响,将靶序列在NCBI中进行同源性比对,另外在人类的基因组中进行相似的比对(包装细胞为人胚肾293t),以确保靶序列不会对包装细胞的相关基因产生RNAi效应。在RNAi序列两端加上酶切位点、终止信号、内成环结构等,送公司合成。共设计2对shRNA序列(表1),其中S2为无意义链,作为阴性对照。合成的序列经退火后形成双链Oligo DNA,与经Cla I、Mlu I双酶切后的pLVTHM质粒连接,经DH5α感受态细胞转化、扩增。挑选重组阳性克隆菌株,提取质粒后,按如下引物进行PCR鉴定[7]:上游5'-ctgggaaatcaccataaacg-3',下游5'-ttattcccatgcgacggtat-3'。对鉴定为阳性的质粒进行测序鉴定(博仕生物有限公司)。测序正确后大量提取质粒,同时对pSPAX2和pMD2.G两种质粒进行大量提取备用。
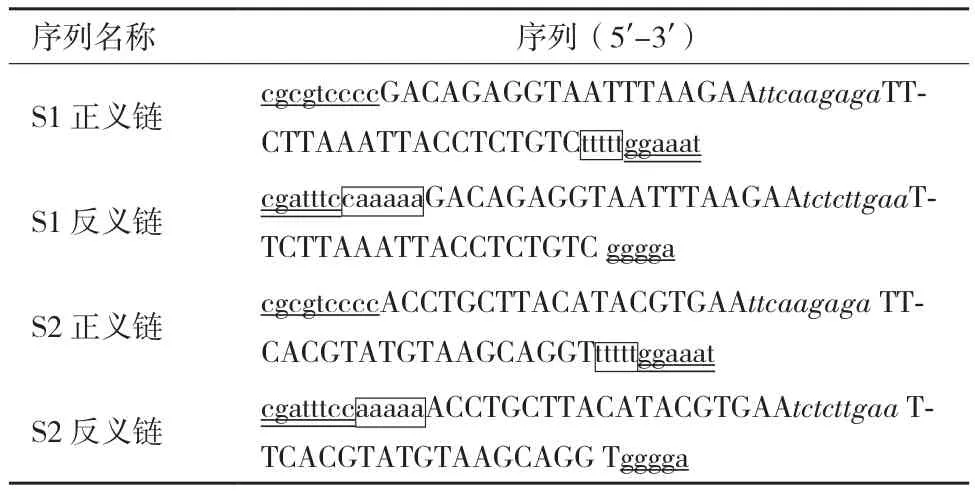
表1 shRNA序列
1.2.2重组慢病毒包装 对293t 细胞进行实验前的处理,当293t 细胞生长状态合适时,使用1.5 mL opti-MEM 稀释10 μg DNA(pLVTHM重组阳性质粒、pSPAX2与pMD2.G的质量比为4∶4∶2),同时添加20 μL X-tremeGENE HP转染试剂,室温下孵育25 min,将该混合溶液加到细胞培养皿中,轻摇培养皿以混匀。在37℃,CO2浓度为5%的培养箱中孵育12 h后,更换为完全培养基。继续培养12 h后检测绿色荧光蛋白(GFP)的表达情况,以此确定三质粒的转染效率。收集细胞培养皿中转染24 h的培养基,并用0.45 μm滤器过滤以弃去细胞碎片沉淀,然后经100 kD 超滤管浓缩后用1.5 mL EP管分装,-80℃保存待用。
1.2.3重组慢病毒感染AP细胞 消化并重悬AP细胞,准确计数后,添加2.5×104个细胞于6孔板中央,添加2 mL完全培养基。12 h后进行重组慢病毒感染,弃去6孔板中培养基,替换为2 mL含有200 μL(滴度3.2×106TU/mL)慢病毒液及2 μL polybrene的混合液,12 h后更换为完全培养基,24 h后观察AP细胞荧光蛋白GFP的表达情况。
1.2.4RT-PCR检测AP细胞RNAi效率 取感染后的AP细胞,提取总RNA,酶标仪测定RNA浓度及纯度后,反转录总RNA为cDNA,之后进行荧光定量PCR反应,选择GAPDH作为内参基因,对结果进行校正,以未做任何处理的AP细胞作对照,反应条件如下:95℃预变性10 min;94℃变性15 s,55.4℃退火30 s,72℃延伸1 min,共40个循环;72℃ 5 min,4℃。
针对CGI99基因及GAPDH内参基因分别设计一对引物,见表2。
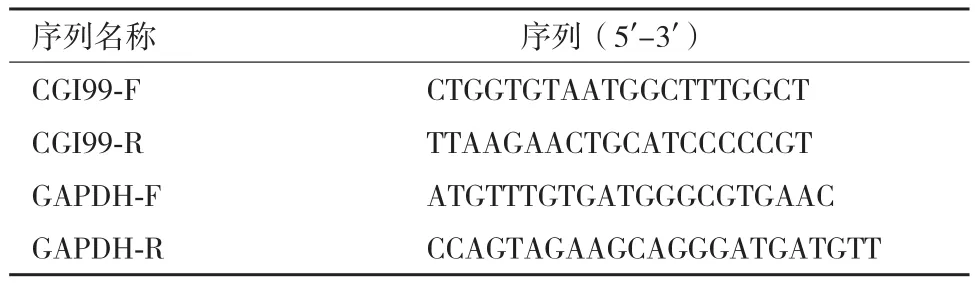
表2 CGI99基因及GAPDH内参基因引物序列
1.2.5MTT实验检测AP细胞增殖情况 消化感染AP-S1、S2细胞及不做任何处理的AP细胞(未进行慢病毒感染的,作为空白对照)并准确计数,将细胞浓度调整为2.5×104个/mL,取200 μL细胞悬液于96孔板中,使得每孔细胞数在5×103个左右,接种24、48、78、96和120 h后,每孔添加20 μL MTT试剂,继续培养4 h后,停止培养,小心弃去上清后,加入150 μL DMSO溶解,摇床避光反应10 min后,利用酶标仪在490 nm处测定吸光度。以时间为横坐标,吸光度为纵坐标绘制细胞增殖曲线。
2 结果
2.1阳性重组质粒pLVTHM的PCR鉴定
PCR鉴定结果如图1所示,1号泳道为空白质粒pLVTHM,作为阴性对照,其扩增片段十分接近Marker的100 bp条带;2、3号泳道为阳性克隆,2种阳性重组质粒分别命名为pLVTHM-S1和pLVTHM-S2,扩增片段接近Marker的200 bp条带。已知空白质粒pLVTHM 的扩增片段为85 bp,阳性重组质粒的扩增片段为141 bp,结果与实验预期相符,即表明挑选的阳性克隆的确为实验所需。测序结果最终确定阳性克隆中正确插入了所需的shRNA,即RNAi 靶位点序列。
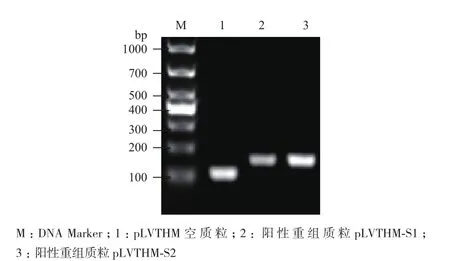
图1 重组质粒PCR鉴定结果
2.2重组慢病毒三质粒共转染293t细胞效果检测
在293t细胞中进行X-tremeGENE HP介导的pLVTHM阳性重组质粒、pSPAX2和pMD2.G三质粒共转染,培养24 h后,在倒置荧光显微镜下可观察到大量呈不规则状态分布的GFP荧光(图2-A)。在相同倍数的可见光下观察,293t细胞形状呈圆粒状,细胞生长状态良好,无死细胞(图2-B),表明3种质粒共转染293t细胞按预期进行,并得到慢病毒颗粒。
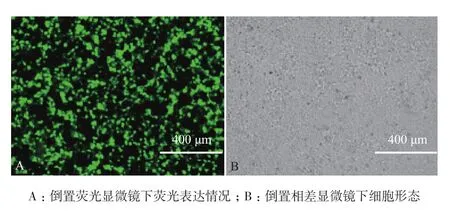
图2 三质粒共转染24 h后的293t细胞
2.3重组慢病毒对梅花鹿AP细胞的感染
用包装成功的慢病毒感染AP细胞,48 h后在倒置荧光显微镜下观察。如图3所示,感染慢病毒的AP细胞中有大量绿色荧光分布于视野,而可见光下的同一视野可看到AP细胞生长状态良好。
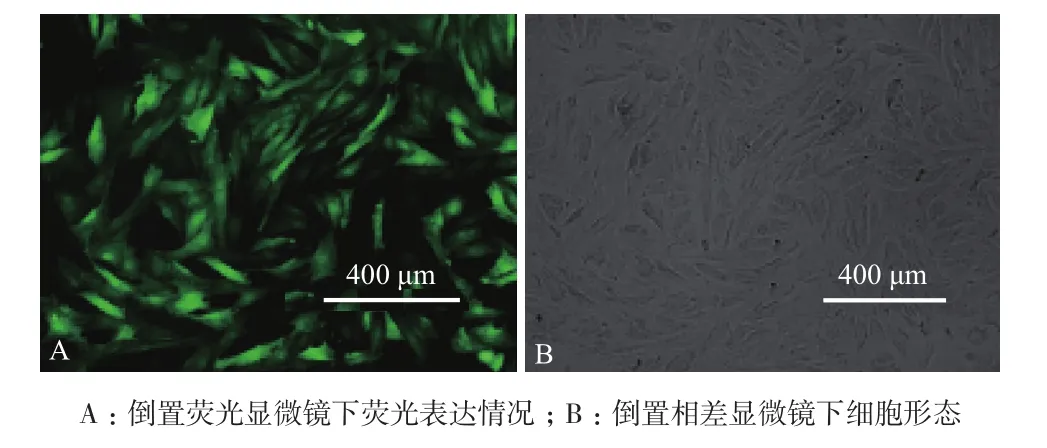
图3 重组慢病毒感染的AP细胞(48 h)
2.4感染效率的检测
将未感染的AP细胞作为对照进行荧光定量RT-qPCR检测,通过熔解曲线可知,GAPDH基因和CGI99基因均被特异性扩增。利用2-ΔΔCt分析方法进行数据分析,由图4可知,与阴性对照AP相比,AP-S1的CGI99基因的表达水平大幅度下调,干扰效率达到70.8%,而AP-S2的CGI99基因的表达基本不变。因此可确定携带pLVTHM-S1的质粒能够有效沉默CGI99基因的表达,本实验获得了可稳定传代的低表达梅花鹿AP细胞系。
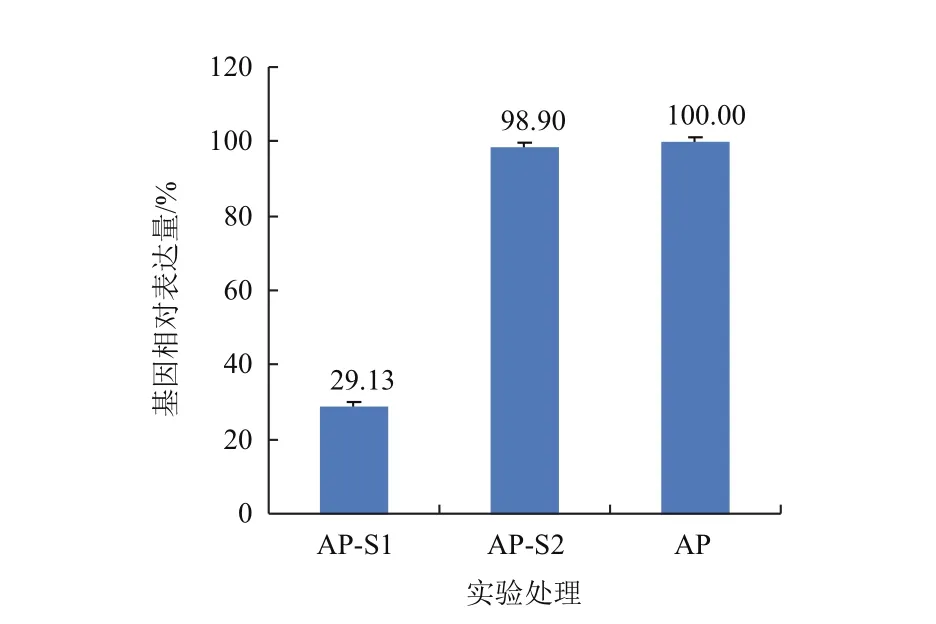
图4 RT-PCR检测CGI99基因的沉默水平
2.5CGI99下调对AP细胞分裂繁殖的影响
进行6 d的MTT实验后,由图5可知,AP-S1及AP-S2的增殖程度与空白对照AP相比,没有显著的变化(数据显著水平P> 0.05),说明CGI99的下调对AP细胞的增殖没有明显影响,同时说明慢病毒感染对细胞增殖也没有显著影响。
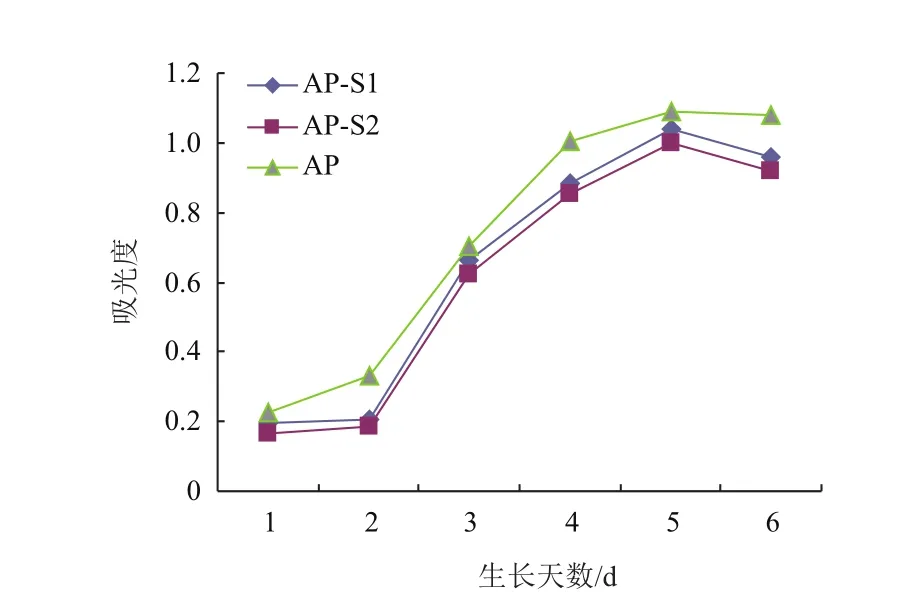
图5 MTT实验生长曲线
3 讨论
鹿茸作为哺乳动物中唯一可以再生的器官,在软骨发生及骨生长方面的研究具有重要意义。除此之外,由于鹿茸具有可再生性、干细胞依赖性以及成骨过程明显等诸多特性,是一种极具潜力的哺乳动物生物医学模型[8]。在目前能找到的相关报道中,该基因多在肿瘤细胞增殖及转移、流感病毒的复制以及脑组织发育等机体活动中起调控作用[9-13]。因此,研究CGI99基因的功能及作用机理就显得极为重要。而目前研究得出的关于CGI99基因的结论多集中在病毒调控及蛋白质复合物相互作用中[14-18],利用鹿茸这个独特的模型研究CGI99基因在软骨发生方面的功能研究目前还尚未见过报道。
RNAi技术作为一种研究基因功能的新工具,由于其实验简单、快速、重复性好等特点,越来越广泛地应用在研究细胞信号传导通路及基因病、癌症的治疗中[19-21]。本实验通过RNAi途径靶向沉默了CGI99基因在AP细胞中的表达,同时将鹿茸作为研究软骨组织发生机制的模型,为研究该基因提供了一种有效途径。而MTT实验结果显示CGI99基因的沉默对AP细胞的增殖并没有显著的影响,由此推断该基因在细胞增殖方面或许没有特异性的作用,而极有可能在细胞分化方面有着重要的作用。
本实验建立了靶向沉默CGI99基因的技术平台,为进一步在鹿茸或者其他模式动物中研究CGI99基因的功能及作用机理提供借鉴,但其在软骨发生等方面影响的机理还有待于继续研究。
4 结论
本实验成功干扰了CGI99基因在AP细胞中的表达,构建了梅花鹿CGI99基因的RNAi慢病毒载体,并且初步验证了CGI99基因的沉默对AP细胞的增殖没有显著影响。
[1]孙红梅, 李春义, 杨福合, 等. 鹿茸骨化机制的研究进展[J].黑龙江畜牧兽医, 2009(8):26-28.
[2] Goss RJ. Deer Antlers. Regeneration, function and evolution[M]. New York, NY:Academic Press, 1983, 290-291.
[3]Kierdorf U, Kierdorf H, Szuwart T. Deer antler regeneration:cells,concepts, and contro- versies[J]. Journal of Morphology, 2007,268(8):726-738.
[4]Li C. Histogenetic aspects of deer antler development[J]. Front Biosci(Elite Ed), 2013, 5:479-489.
[5]Pérez-González A, Pazo A, Navajas R, et al. hCLE/C14orf166 associates with DDX1-HSP C117-FAM98B in a novel transcriptiondependent shuttling RNA-transporting complex[J]. PLoS One,2014, 9(3):e90957.
[6] 路晓, 孙红梅, 张伟, 等. 以鹿茸为模型探索软骨组织发生[J].中国农业科技导报, 2015, 4:71-77.
[7]郭倩倩, 王大涛, 褚文辉, 等. 利用慢病毒表达载体干扰梅花鹿角柄骨膜细胞 P21 基因[J]. 吉林农业大学学报, 2014, 36(1):116-121.
[8]Li C, Suttie J. Morphogenetic aspects of deer antler development[J]. Front Biosci(Elite Ed), 2012, 4:1836-1842.
[9]张登禄, 韩金祥, 崔亚洲, 等. 胰腺癌转移相关基因C14orf166的真核表达及其蛋白相互作用的蛋白质组学筛选[J]. 中国医药生物技术, 2010, 5(3):189-192.
[10]Guo J, Wang W, Liao P, et al. Identification of serum biomarkers for pancreatic adenocarcinoma by proteomic analysis[J]. Cancer Science, 2009, 100(12):2292-2301.
[11]郭静会. 胰腺癌血清蛋白质指纹图谱及CCR7与胰腺癌淋巴结转移相关性研究[D]. 上海:复旦大学, 2010.
[12] Rodriguez A, Pérez-González A, Nieto A. Cellular human CLE/ C14orf166 protein interacts with influenza virus polymerase and is required for viral replication[J]. Journal of Virology, 2011, 85 (22):12062-12066.
[13]宋家升. H5N1亚型禽流感病毒对家鸭致病力分子机制的研究[D]. 北京:中国农业科学院, 2010.
[14] Mateos J, Landeira-Abia A, Fafián-Labora JA, et al. iTRAQ-based analysis of progerin expression reveals mitochondrial dysfunction, reactive oxygen species accumulation and altered proteostasis[J]. Stem Cell Research & Therapy, 2015, 6(1):119-135.
[15]Waldera-Lupa DM, Kalfalah F, Florea AM, et al. Proteome-wide analysis reveals an age-associated cellular phenotype of in situ aged human fibroblasts[J]. Aging(Albany NY), 2014, 6(10):856-872.
[16]Huarte M, Sanz-Ezquerro JJ, Roncal F, et al. PA subunit from influenza virus polymerase complex interacts with a cellular protein with homology to a family of transcriptional activators[J]. J Virol, 2001, 75(18):8597-8604.
[17]Lee JW, Liao PC, Young KC, et al. Identification of hnRNPH1,NF45, and C14orf166 as novel host interacting partners of the mature hepatitis C virus core protein[J]. Journal of Proteome Research, 2011, 10(10):4522-4534.
[18]Brobeil A, Graf M, Eiber M, et al. Interaction of PTPIP51 with Tubulin, CGI-99 and Nuf2 during cell cycle progression[J]. Biomolecules, 2012, 2(1):122-142.
[19] Gartel AL, Kandel ES. RNA interference in cancer[J]. Biomolecular Engineering, 2006, 23(1):17-34.
[20]Pecot CV, Calin GA, Coleman RL, et al. RNA interference in the clinic:challenges and future directions[J]. Nature Reviews Cancer, 2011, 11(1):59-67.
[21]韩庆功, 郑玉姝. RNAi 技术在抗甲型流感病毒中的研究进展[J]. 生物技术通报, 2014(12):55-60.
(责任编辑 李楠)
Construction of Lentiviral Vector for CGI99 RNAi and Its Effects on Antlerogenic Periosteum Cell Proliferation in Sika Deer
LU Xiao SUN Hong-mei CHU Wen-hui ZHANG Wei LI Chun-yi
(State Key Laboratory of Special Economical Animal Molecular Biology,Institute of Special Animal and Plant Sciences,Chinese Academy of Agricultural Sciences,Changchun 130000)
CGI99 of antlerogenic periosteum(AP)cells from Chinese sika deer was interfered using the lentivirus-mediated gene silencing system,and a preliminary study on the gene function on proliferation of AP cells was proceeded. One sequence shRNA targeting CGI99 of sika deer was designed,then reassembled into the lentiviral plasmids pLVTHM. Together with the plasmids pSPAX2 and pMD2.G,recombinant lentivirus was acquired by their co-transfection into HEK 293t cells,and then infected into AP cells. Detecting the down-regulating expression level of CGI99 mRNA in infected AP cells was conducted by RT-PCR,and the effect of silenced CGI99 on AP cell proliferation was assayed by MTT. The results showed that the expression level of CGI99 mRNA in cells that infected with recombinant lentivirus was obviously decreased,the interferential efficiency reached 70.8%;and the curves by MTT assay tended to be consistent. Therefore,we successfully constructed RNAi vector for CGI99 and interfered the expression of CGI99 in AP cells,and preliminarily confirmed that the CGI99 presented insignificant effect on the AP cells' proliferation.
deer antler;RNAi;CGI99;antlerogenic periosteum
10.13560/j.cnki.biotech.bull.1985.2016.08.018
2015-12-11
吉林省科技发展计划项目(20140204010YY),吉林省自然科学基金项目(20140101139JC)
路晓,女,硕士研究生,研究方向:鹿茸生物学;E-mail:1234wuguipa@163.com
李春义,男,研究员,博士生导师,研究方向:鹿茸干细胞与哺乳动物器官再生、鹿茸生物学及其基因工程;E-mail:lichunyi1959@163.com

