SIRT3通过Rb/p16途径促进肝癌细胞衰老的研究*
宋春丽,黄 荣,李泽华,周义文△
(南方医科大学深圳医院:1.临床检验医学中心;2.烧伤整形科,广东深圳 518100 )
SIRT3通过Rb/p16途径促进肝癌细胞衰老的研究*
宋春丽1,黄荣1,李泽华2,周义文1△
(南方医科大学深圳医院:1.临床检验医学中心;2.烧伤整形科,广东深圳 518100 )
目的探讨沉默信息调节因子3(SIRT3)对肝癌细胞老化的作用,并初步研究其作用机制。方法通过转染SIRT3基因,使其在肝癌细胞内过表达。用实时荧光定量PCR和Western blot技术验证SIRT3基因的过表达效果;BrdU标记实验检测它对肝癌细胞增殖的影响;β-半乳糖苷酶染色检测肝癌细胞的老化情况;Western blot检测它对衰老相关基因Rb、p16、P53蛋白表达的影响。结果SIRT3过表达质粒使肝癌细胞中SIRT3的mRNA及蛋白水平明显增加。SIRT3基因的过表达能抑制肝癌细胞的增殖,抑制率为40%~50%;同时,SIRT3基因过表达能显著诱导肝癌细胞G2期周期阻滞:转染pc-DNA3.1质粒的对照组细胞处于G2期比例为(22.83±1.58)%,而转染SIRT3基因的实验组处于G2期细胞为(35.65±1.55)%;SIRT3基因过表达使肝癌细胞中衰老相关的β-半乳糖苷酶染色较对照组显著增高,阳性细胞占40%~50%,差异有统计学意义(P<0.05),并伴随衰老相关基因Rb、p16蛋白表达水平明显增加。结论SIRT3基因过表达可能通过Rb/p16途径促进肝癌细胞衰老。
沉默信息调节因子3;肝细胞癌;细胞衰老
肝细胞癌(HCC)占原发性肝癌的90%[1]。HCC起病隐匿,出现典型临床症状时大多已处于中晚期,失去手术机会,自然生存期不超过半年[2]。sirtuin家族是一类依赖烟碱胺腺嘌呤二核苷酸(NAD+)的第Ⅲ类组蛋白去乙酰化酶[3],包括SIRT1~SIRT7,沉默信息调节因子3(SIRT3)是线粒体内主要的去乙酰化酶,一般存在于线粒体基质中,在成熟过程中它的N末端在线粒体基质容易被水解。只有被切割的SIRT3蛋白才具有活性,当SIRT3信号肽被切除以后,它使组蛋白去乙酰基化从而发挥其活性。SIRT3作为一种线粒体蛋白,主要在以下方面发挥着重要作用,如细胞凋亡[4]、物质代谢[5]、细胞老化[6]、能量产生[7]和细胞内信号控制等[8]。近年来SIRT3在肿瘤中的作用日益受到人们的关注,但其在HCC中发生、发展过程中的机制还不完全清楚。本研究通过将过表达SIRT3基因的质粒转染于肝癌细胞中,检测SIRT3基因过表达对肝癌细胞老化的作用,并初步探讨其作用机制,以寻求其对肝癌基因治疗的意义。
1 材料与方法
1.1仪器与试剂
1.1.1仪器荧光定量PCR仪、Western blot 电泳仪、Western blot 电转膜仪均购自美国Bio-rad公司,Mastercycler96孔普通PCR仪、5810R台式高速低温离心机购自美国Eppendorf公司,酶标仪购自美国Gene Company Limited公司。
1.1.2试剂人肝癌细胞株SK-Hep-1购自ATCC公司,SIRT3质粒(载体为pc-DNA3.1)、pc-DNA3.1质粒购自Addgene公司。Brdu ELISA试剂盒购自罗氏公司,BCA蛋白浓度测定试剂盒购自上海碧云天生物技术公司,SIRT3抗体(#2627)、P16抗体(#4824)、P53抗体(#2527)、Rb抗体(#9313)、β-actin 抗体(#4970) 购自CST公司,二抗购自瑞典GE healthcare公司。反转录试剂盒购自美国伯乐公司,LightCycler®FastStart DNA Master SYBR Green Ⅰ Roche 12239264001购自罗氏公司。
1.2方法
1.2.1细胞培养将SK-Hep-1肝癌细胞株在含有1%青/链霉素、10%胎牛血清的DMEM培养基中培养,放置于37 ℃细胞培养箱,于5% CO2的环境中进行常规培养。
1.2.2实时荧光定量PCR(qPCR)检测SIRT3基因过表达的mRNA水平提取细胞中的RNA,用30 μL去RNA酶的水将RNA溶解,测浓度,电泳检测RNA提取质量,纯度合格后构建反转录反应体系:1 000 ng RNA,5×反应混合液4 μL,iScript酶混合液1 μL,去RNA酶水补齐至20 μL。充分混匀后按以下条件反应:25 ℃ 5min,42 ℃ 30 min,85 ℃ 5 min,4 ℃ 10 min。构建10 μL qPCR体系:反转录产物1 μL,去RNA酶水3.6 μL,SYBR Green qPCR Mix(2×)5 μL,SIRT3上下游引物(10 μmol/L)各0.2 μL。反应条件:预变性95 ℃ 2 min;变性94 ℃ 20 s,退火60 ℃ 20 s,延伸72 ℃ 20 s,随后75 ℃ 1 s,34个循环,从第2个循环开始读数,溶解曲线为55~95 ℃,每次波动1 ℃,保持2 s。SIRT3引物序列,F:5′-ATCGATGGGCTTGAGAGAGT-3′;R:5′-AGGTTCCATGAGCTTCAACC-3′。所有测试管均采用三管重复,并重复实验3次,取其平均值。
1.2.3Western blot检测SIRT3基因过表达的蛋白水平种SK-Hep-1细胞(每孔8×104)于6孔板中,24 h后将表达SIRT3的质粒转染进SK-Hep-1细胞中,同时以pc-DNA3.1作为空白对照,24 h后换液继续培养72 h,然后裂解细胞进行Western blot检测。
1.2.4BrdU标记法检测肝癌细胞增殖SK-Hep-1细胞以25×104/mL细胞数接种于6孔板中24 h分别转染了pc-DNA3.1、SIRT3,第2天再以6 000/每孔的细胞数分至96孔板培养2 d,终止细胞培养前,加入BrdU(终浓度为30 μg/L),37 ℃ 6 h,用FixDenat37溶液固定细胞30 min,加抗BrdU单抗(工作浓度1∶100),阴性对照孔加磷酸盐缓冲液(PBS,室温,90 min),酶标仪读取的OD值跟细胞内DNA的合成速率呈正比。
1.2.5流式细胞仪检测细胞周期将表达SIRT3的质粒转染进SK-Hep-1细胞中,以pc-DNA3.1作为空白对照,96 h后收集细胞,应用5 mL的PBS洗涤收集的细胞3次,离心沉淀细胞,弃上清液,70%预冷的乙醇-20 ℃过夜固定,离心固定过的细胞,弃上清液,PBS洗涤细胞3次用来除去残留的乙醇,用含有0.2 mg RNase A的1 mL PI/Triton X-100染色液(20 μg PI/0.1% Triton X-100)重悬细胞,37 ℃染色15 min。上流式细胞仪检测细胞周期。
1.2.6衰老因子相关的β-半乳糖苷酶染色将生长状态良好的SK-Hep-1细胞接种至6孔板中,24 h后分别转染pc-DNA3.1、SIRT3质粒。转染4 d后加入X-Gal底物,进行跟衰老相关的β-半乳糖苷酶染色,在光学显微镜下观察变成蓝色的表达β-半乳糖苷酶的细胞数,随机选择3个视野进行观察,每个视野计数200个细胞,计算β-半乳糖苷酶染色阳性的细胞占总细胞数的百分比。
1.2.7Western blot分析衰老相关蛋白提取肝癌细胞中的蛋白,BCA法检测样本蛋白水平,取蛋白总量为30 μg的样品,加入对应体积的 6×SDS蛋白质电泳上样缓冲液(含β巯基乙醇),95 ℃ 10 min使蛋白变性,在含有8%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)的凝胶中120 V恒压电泳1.5 h,然后90 V恒压转膜4 h,将NC膜转至5%脱脂牛奶中封闭,摇床上室温1 h,TBST洗涤后分别加入用5%BSA稀释的一抗中(SIRT3抗体的工作浓度1∶3 000,P16抗体、P53抗体、Rb抗体的工作浓度均为1∶1 500),摇床,4 ℃过夜,1×TBST洗涤3次,将NC膜置于用5%脱脂牛奶稀释用HRP标记的二抗(工作浓度1∶3 000)中,摇床,室温2 h后,1×TBST洗涤3次,5 min 1次,然后将NC膜置在暗盒中ECL显影曝光。

2 结 果
2.1qPCR检测SIRT3的过表达效果将SIRT3质粒转染SK-Hep-1细胞,同时以pc-DNA3.1作为空白对照,转染72 h后提取细胞总RNA。结果显示转染了SIRT3质粒的肝癌细胞mRNA水平较对照组明显增加,说明SIRT3基因的过表达是成功的。见图1。
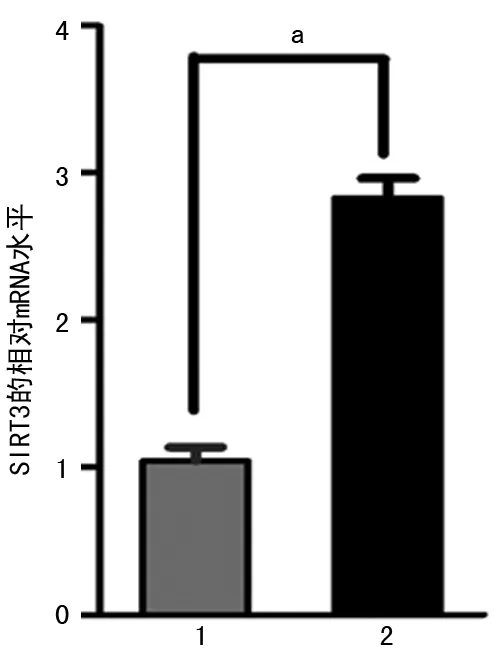
注:1为pc-DNA3.1;2为SIRT3;aP<0.05。
2.2Western blot检测SIRT3基因过表达的蛋白水平将SIRT3质粒转染SK-Hep-1细胞,同时以pc-DNA3.1作为空白对照,转染72 h后提取细胞蛋白裂解液进行Western blot检测,结果显示转染了SIRT3质粒的肝癌细胞中SIRT3基因的蛋白水平较对照组明显增加,说明SIRT3的蛋白水平也成功地过表达,见图2。

注:1为pc-DNA3.1;2为SIRT3。
2.4SIRT3基因过表达对细胞周期的影响将pc-DNA3.1、SIRT3质粒分别转染SK-Hep1细胞,转染96 h后固定细胞进行流式细胞术分析。结果显示,转染SIRT3的细胞处于G2期细胞较对照组细胞(pc-DNA3.1组)明显增加(P<0.05),说明SIRT3基因过表达会诱使细胞产生G2期细胞周期阻滞。见图3和表1。
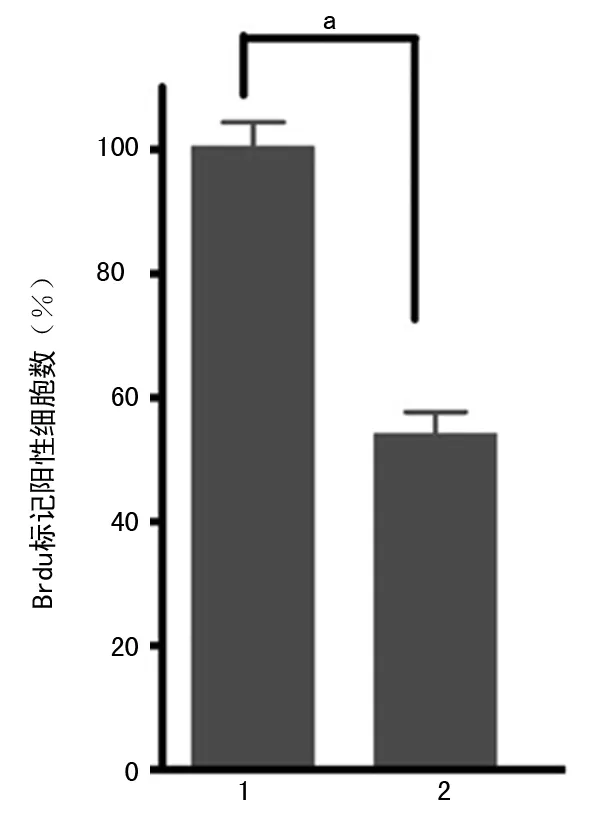
注:1为pc-DNA3.1;2为SIRT3;aP<0.05。

表1 流式细胞术检测细胞周期(%)
注:与pc-DNA3.1组比较,aP<0.05。

注:1为pc-DNA3.1;2为SIRT3;aP<0.05。
2.5SIRT3基因过表达诱导肝癌细胞衰老在光学显微镜下观察到变成蓝色的表达β-半乳糖苷酶的细胞数较对照细胞明显增多;在SK-Hep1细胞中,转染SIRT3质粒的细胞的染色阳性细胞数比对照细胞多近3倍,以上结果说明SIRT3过表达诱导肝癌细胞老化。见图4。
2.6SIRT3基因过表达促进衰老相关蛋白Rb、p16和p53的表达Western blot结果显示在SK-Hep-1细胞中,SIRT3基因过表达使SK-Hep1细胞中Rb蛋白和p16蛋白的表达量明显增多,而p53蛋白的表达量却没有明显变化。Rb可以通过诱导p16的表达从而引起细胞周期阻滞,从而在细胞衰老中起关键作用。提示SIRT3过表达可能通过调控Rb/p16途径诱导了细胞衰老。见图5。

图5 Western blot分析转染SIRT3质粒96 h后的细胞中Rb、p16和p53蛋白水平
3 讨 论
近年来,SIRT3在肿瘤发生、凋亡及调控中的作用越来越受到人们的关注。SIRT3可以通过调节KU70-Bax通路参与细胞凋亡[9],通过去乙酰化SOD2、MnSOD来调节氧化应激反应[10-11],通过调节p53途径来诱导老化等[7]。SIRT3在一些肿瘤中也起着双重调节的作用,比如它在口腔癌中表达上调,对口腔癌起促进肿瘤发生的作用[12],而在乳腺癌[13]、骨肉瘤[14]、结肠癌[15]中表达降低,对肿瘤起抑制作用。SIRT3在肝癌中的作用及机制,目前国内外这方面的报道很少。本研究通过前期大量HCC标本的筛查,发现SIRT3在人HCC组织中的表达明显低于癌旁组织,同时发现SIRT3在多个肝癌细胞系中也呈现低表达状态[16]。在本研究发现SIRT3过表达可使肝癌细胞受到明显抑制,引起细胞周期G2期细胞阻滞,并使与老化相关的β-半乳糖苷酶明显增加,Western blot检测发现部分老化相关基因(Rb、p16)的蛋白表达水平均明显增加,而p53蛋白表达却没有明显变化,从而得出 IRT3基因的过表达可能通过Rb/p16途径,而不是p53/p21途径促进肝癌细胞衰老从而抑制细胞的增殖。笔者前期报道过SIRT1基因沉默后引起细胞周期G1期细胞阻滞,衰老相关基因p53和p21蛋白表达增加,可能通过p53/p21途径促进细胞衰老[17]。说明SIRT1和SIRT3虽同属于sirtuin家族,但在肝癌细胞衰老中的作用路径和调控机制却有明显差异,甚至发挥相反的作用,特别是其作用在细胞内的信号通路也会有明显不同,进一步加深了研究者对sirtuin家族了解的兴趣。
细胞衰老是引起生物体老化的一种潜在因素,也被认为是生物体抑制肿瘤的一种方式。目前研究报道普遍认为端粒长度的缩短是触发细胞老化的关键因素[18-19]。本课题计划下一步将合成Rb和p16 siRNA,观察Rb和p16基因干扰后是否逆转SIRT3过表达引起的部分老化,以提供更充分的证据确定它是否通过Rb/p16途径引起肝癌细胞的衰老,并通过qPCR筛查端粒酶反转录酶(TERT)和保护端粒蛋白复合体(包括TRF1和POT1等)以及其他的端粒相关蛋白,希望通过对SIRT3在HCC中的功能鉴定和研究,加深对肝癌细胞老化机制的认识,为寻找新的肝癌治疗靶点打下基础。
[1]Brau N,Fox RK,Xiao P,et al.Presentation and outcome of hepatocellular carcinoma in HIV infected patients:a U.S.-Canadian multicenter study[J].J Hepatol,2007,47(4):527-537.
[2]Yuen MF,Hou JL,Chutaputti A,et al.Hepatocellular carcinoma in the Asia pacific region[J].J Gastroenterol Hepatol,2009,24(3):346-353.
[3]Imai S,Armstrong CM,Kaeberlein M,et al.Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase[J].Nature,2000,403(6771):795-800.
[4]Marfe G,Tafani M,Indelicato M,et al.Kaempferol induces apoptosis in two different cell lines via Akt inactivation,Bax and SIRT3 activation,and mitochondrial dysfunction[J].J Cell Biochem,2009,106(4):643-650.
[5]Hirschey MD,Shimazu T,Huang JY,et al.SIRT3 regulates mitochondrial protein acetylation and intermediary metabolism[J].Cold Spring Harb Symp Quant Biol,2011,76:267-277.
[6]Li S,Banck M,Mujtaba S,et al.p53-induced growth arrest is regulated by the mitochondrial SirT3 deacetylase[J].PLoS One,2010,5(5):e10486.
[7]Ahn BH,Kim HS,Song S,et al.A role for the mitochondrial deacetylase Sirt3 in regulating energy homeostasis[J].Proc Nat Acad Sci U S A,2008,105(38):14447-14452.
[8]Jing E,Emanuelli B,Hirschey MD,et al.Sirtuin-3(Sirt3) regulates skeletal muscle metabolism and insulin signaling via altered mitochondrial oxidation and reactive oxygen species production[J].Proc Nat Acad Sci U S A,2011,108(35):14608-14613.
[9]Sundaresan NR,Samant SA,Pillai VB,et al.SIRT3 is a stress-responsive deacetylase in cardiomyocytes that protects cells from stress-mediated cell death by deacetylation of Ku70[J].Mol Cell Biol,2008,28(20):6384-6401.
[10]Qiu X,Brown K,Hirschey MD,et al.Calorie restriction reduces oxidative stress by SIRT3-mediated SOD2 activation[J].Cell Metab,2010,12(6):662-667.
[11 ]Tao R,Coleman MC,Pennington JD,et al.Sirt3-mediated deacetylation of evolutionarily conserved lysine 122 regulates MnSOD activity in response to stress[J].Mol Cell,2010,40(6):893-904.
[12]Alhazzazi TY,Kamarajan P,Joo N,et al.Sirtuin-3(SIRT3),a novel potential therapeutic target for oral cancer[J].Cancer,2011,117(8):1670-1678.
[13]Zhang L,Ren X,Cheng Y,et al.Identification of Sirtuin 3,a mitochondrial protein deacetylase,as a new contributor to tamoxifen resistance in breast cancer cells[J].Biochem Pharmacol,2013,86(6):726-733.
[14]Aquila PD,Rose G,Panno ML,et al.SIRT3 gene expression:a link between inherited mitochondrial DNA variants and oxidative stress[J].Gene,2012,497(2):323-329.
[15]Bell EL,Emerling BM,Ricoult SJ,et al.SirT3 suppresses hypoxia inducible factor 1alpha and tumor growth by inhibiting mitochondrial ROS production[J].Oncogene,2011,30(26):2986-2996.
[16]Song CL,Tang H,Ran LK,et al.Sirtuin 3(SIRT3) inhibits hepatocellular carcinoma growth through the glycogen synthase kinase-3β/BCL2-associated X protein-dependent apoptotic pathway[J].Oncogene,2016,35(5):631-641.
[17]宋春丽,任吉华,张祯祯,等.SIRT1基因沉默诱导肝癌细胞老化及其机制[J].第三军医大学学报,2012,34(19):1929-1932.
[18]Deng,Y,Chan SS,Chang S.Telomere dysfunction and tumour suppression:the senescence connection[J].Nat Rev Cancer,2008,8(6):450-458.
[19]Stewart SA,Weinberg RA.Telomeres:cancer to human aging[J].Annu Rev Cell Dev Biol,2006,22:531-557.
Study on the SIRT3 inducing senescence in hepatocelluar carcinoma cells through the Rb/p16 pathway*
SONGChunli1,HUANGRong1,LIZehua2,ZHOUYiwen1△
(1.CenterforClinicalLaboratoryMedicine,ShenzhenHospitalofSouthernMedicalUniversity,Shenzhen,Guangdong518100,China;2.BurnandPlasticSurgeryDepartment,ShenzhenHospitalofSouthernMedicalUniversity,Shenzhen,Guangdong518100,China)
ObjectiveTo study the effect of SIRT3 gene(SIRT3) on aging of hepatocellular carcinoma cells(HCC) and it's mechanism.MethodsSIRT3 over-expression was targeted by plasmid transfected technology.Effect of SIRT3 on aging of HCC was detected by RT-PCR and Western blot,respectively.Proliferation of HCC was assayed by Brdu-labeling test.Cell cycle of HCC was displayed by flow cytometry.Aging of HCC was observed with SA-β-gal staining.Aging-related Rb,p16,P53 proteins were demonstrated by Western blot.ResultsSIRT3 over-expression significantly upregulated the SIRT3 mRNA and protein expression levels in HCC.SIRT3 suppressed the proliferation of HCC with an suppression rate of 40%-50%,and significantly induced cell cycle arrest of HCC at stage G2.The proportion of pc-DNA3.1,SIRT3 plasmid transfected HCC at stage G2was about (22.83±1.58)% and (35.65±1.55)%.The aging-related β-galactosidase-stained HCC were significantly greater with a positive rate of 40%-50%(P<0.05),and the aging-related Rb,p16 protein expression levels were significantly higher.ConclusionSIRT3 promotes the aging of HCC possibly through the Rb/p16 pathway.
SIRT3;hepatocellular carcinoma;cell aging
广东省医学科学技术研究基金资助项目(A2016568);广东省深圳市卫生计生系统科研基金(201601043)。
宋春丽,女,主管技师,主要从事分子生物学研究。△
,E-mail:yiwenzhou21@aliyun.com。
10.3969/j.issn.1673-4130.2016.16.006
A
1673-4130(2016)16-2220-04
2016-06-23
2016-07-29)

