聚集条件对罗非鱼皮Ⅰ型胶原自聚集动力学的影响
闫鸣艳,秦 松(中国科学院烟台海岸带研究所,山东烟台264003)
聚集条件对罗非鱼皮Ⅰ型胶原自聚集动力学的影响
闫鸣艳,秦 松*
(中国科学院烟台海岸带研究所,山东烟台264003)
采用Boltzmann函数拟合结合两阶段动力学模型(成核阶段和生长阶段),研究了胶原浓度、温度、溶液pH和离子强度对罗非鱼皮Ⅰ型胶原自聚集动力学的影响。结果表明:胶原浓度、温度、溶液pH和离子强度能调控胶原自聚集动力学。当浓度达到或高于0.34 mg/mL时,胶原表现明显的自聚集,且浓度越高越有利于胶原晶核的形成,过量的胶原分子能阻碍胶原纤维的生长;聚集温度越接近胶原来源原料的生活温度或溶液pH偏碱性,胶原越易自聚集;NaCl浓度也可影响胶原的自聚集动力学,适量浓度的NaCl有利于胶原晶核的形成,但NaCl浓度过高却对胶原纤维的生长有阻碍作用。
胶原,自聚集,罗非鱼,鱼皮,动力学
Ⅰ型胶原是动物皮肤、软骨、肌腱与韧带等组织的基本结构物质[1],由于其低抗原性、细胞粘附性、生物相容性和可降解性而被广泛应用于生物材料和组织工程等领域。胶原通常从猪和牛中提取,然而近年来由于疯牛病、口蹄疫等频发与宗教文化上的差异,猪牛源胶原的应用受到限制。鱼源胶原由于其来源的广泛性、生物安全性和产品成本等方面均具有明显优势[2],因而对其研究和应用逐渐受到重视。罗非鱼是我国常见的淡水鱼之一,其出口量的逐年增长产生大量鱼皮、鱼骨等废弃物,其中鱼皮约占4.0%,而鱼皮中的干物质70%以上为胶原。因此,对罗非鱼皮胶原进行研究利用,不仅可减少环境污染与资源浪费,更有利于提高企业的经济效益。
Ⅰ型胶原在体外能自聚集形成纤维,即具有完整三螺旋结构的胶原分子单体通过分子间的有序排列,形成具有交错条纹结构(D-周期)的胶原纤维[2],这是其在组织工程和生物材料领域的应用基础。胶原的自聚性与溶液pH、离子强度、溶剂、温度和浓度等密切相关[3-6]。到目前为止,相关学者已对狭鳕鱼皮[7]、大马哈鱼[8]、草鱼皮[2]和鱼鳞[9]与乌鳢鱼皮[10]等水产胶原在不同聚集条件下的自聚性开展了研究,发现聚集条件对水产胶原的自聚集动力学曲线有显著影响。Fessler[11]认为胶原的氨基酸组成随物种和组织的不同而表现差异,因此研究不同来源胶原的自聚性是极其必要的。然而,目前的研究工作大多集中于胶原自聚集体形态方面,对胶原自聚动力学的研究和解析甚少。因此,本文主要通过Boltamann函数拟合结合两阶段动力学模型探讨浓度、温度、溶液pH和离子强度等对罗非鱼皮Ⅰ型胶原自聚动力学的影响,研究结果将对天然海洋胶原基材料的研究开发具有理论价值与参考意义。
1 材料与方法
1.1 材料与仪器
罗非鱼皮 由青岛厂家提供,-20℃保存,实验时4℃解冻;胃蛋白酶(1∶10000) 购自Sigma公司。
BR4i冷冻离心机 法国Jouan公司;LGJ0-5冷冻干燥机 北京四环科技仪器厂;UV-2102 PC紫外-可见分光光度计 上海龙尼柯仪器有限公司;PHS-3C精密酸度计 上海虹益仪器仪表有限公司;HHSNi电热恒温水浴锅 北京长安科学仪器厂。
1.2 实验方法
1.2.1 罗非鱼皮Ⅰ型胶原的制备 参照Huang Y等[12]的I型胶原制备方法进行。由SDS-PAGE电泳分析其为Ⅰ型胶原。
1.2.2 胶原聚集条件 参照Yan M等的方法[7]。以浓度为0.5 mol/L的醋酸溶液为溶剂配制质量浓度为2 mg/mL的胶原溶液,将该溶液与等体积的40 mmol/L磷酸缓冲液(含有NaCl,pH为7.4)在冰浴中混合,使NaCl终浓度为0~260 mmol/L,胶原质量浓度为0.23~2.12 mg/mL,混合均匀后调节溶液pH为5.4~9.4,立即将溶液分别放在20、30、37℃水浴中进行自聚集。
1.2.3 胶原的自聚集动力学 溶液中胶原的自聚集过程可通过紫外-可见分光光度法来表征[13]。每1 h测定一次溶液在400 nm下的吸光度值以表征溶液中胶原的聚集,以0 h时的胶原溶液为空白。
所得胶原自聚集动力学曲线应用Boltzmann函数进行拟合,见式(1)。

依据Yan M等[7]的方法,胶原自聚集动力学可通过式(2)进行分析。

其中,At:胶原溶液在时间t时400 nm的吸光度;Ae:胶原溶液在平衡阶段400 nm的吸光度;A0:胶原溶液在时间为0 h时400 nm的吸光度;k:速率常数。
将ln[(Ae-At)/(Ae-A0)]对时间t作图可得到一条直线,斜率即为胶原自聚集速率常数k。
1.3 数据处理
数据统计采用Origin 7.5进行ANOVA单因素方差分析。p<0.05,表示差异显著。
2 结果与分析
2.1 浓度对罗非鱼皮Ⅰ型胶原自聚集动力学的影响
研究表明胶原的自聚集动力学曲线为S型[7,13],因此本研究通过Boltzmann函数对不同浓度胶原自聚集动力学曲线进行拟合,拟合结果如图1(a)和表1所示。可以看出浓度为0.34、0.52、0.94、2.12 mg/mL的胶原自聚集动力学曲线均可用Boltamann函数拟合(R2>0.9),但浓度为0.23 mg/mL胶原的拟合结果较差(R2<0.9),表明胶原在浓度为0.34~2.12 mg/mL时可发生明显的自聚集,但胶原浓度为0.23 mg/mL的自聚集现象不明显。Kadler[14]认为胶原自聚集存在临界浓度,在临界浓度以上,胶原能自聚集形成明显的聚集体;但在临界浓度以下,通过离心和浊度测定方法不能检测到胶原聚集体的形成[15]。由此推断,罗非鱼皮Ⅰ型胶原自聚集的临界浓度为0.23~0.34 mg/mL。

图1 不同浓度下罗非鱼皮Ⅰ型胶原自聚集动力学曲线(a)及线性拟合关系(b)Fig.1 The kinetic self-assembly curves(a)and linear fitting relationships(b)of type Ⅰ collagen from tilapia skin with different concentrations
为进一步研究不同浓度胶原的自聚集动力学,运用式(2)对测定数据进行分析,所得结果如图1(b)所示。可以看出胶原的自聚集过程可分为两个阶段,其分界点对应于溶液吸光度开始显著增大的时间,如图1(a)所示,这与胶原的成核-生长理论[16]相对应,说明运用式(2)对胶原自聚集动力学进行解析是合理的。因此,可以认为胶原自聚集过程的第一和第二阶段分别为其成核阶段和生长阶段[7];两阶段分界点对应的时间可认为是胶原的成核时间。图1(b)还表明随着浓度的增大,胶原的成核时间逐渐降低,表明胶原分子越多,越容易自聚集形成晶核。胶原自聚集两阶段的聚集速率常数可通过最小二乘法得到,结果如表1所示。随着胶原浓度的增大,成核阶段的速率常数逐渐增大,进一步说明胶原分子越多越有利于晶核的形成。但生长阶段的聚集速率常数随着胶原浓度的增大呈现先升高后降低的特点,在胶原浓度为0.94 mg/mL时达到最大值,表明适量的胶原分子能促进纤维的生长,但过多却产生抑制作用。

表1 不同浓度下罗非鱼皮Ⅰ型胶原自聚集速率常数Table1 The rate constant of typeⅠcollagen self-assembly from tilapia skin with different concentrations
2.2 温度对罗非鱼皮Ⅰ型胶原自聚集动力学的影响
温度对罗非鱼皮Ⅰ型胶原自聚集动力学的影响如图2(a)和表2所示。经Boltzmann函数拟合发现,胶原在20℃和37℃条件下也可发生明显的自聚集,并且与在30℃时自聚集类似,其聚集过程也分为两个阶段,但是自聚集参数却随着温度的不同而不同。在自聚集温度为30℃时,胶原的成核时间明显短于在其他温度下,且其自聚集速率常数也较高,表明罗非鱼皮胶原在30℃时较易自聚集,这可能与胶原原料的生活温度有关。罗非鱼的最适生活温度为28~30℃[17],由此可以认为自聚集温度越接近于动物的生活温度,由其来源的胶原的自聚集能力越强,这与在草鱼鱼鳞胶原自聚集研究上得到的结果是一致的[9]。
2.3 溶液pH对罗非鱼皮Ⅰ型胶原自聚集动力学的影响

图2 不同温度下罗非鱼皮Ⅰ型胶原自聚集动力学曲线(a)及线性拟合关系(b)Fig.2 The kinetic self-assembly curves(a)and linear fitting relationships(b)of type Ⅰ collagen from tilapia skin at different temperatures

表2 不同温度下罗非鱼皮Ⅰ型胶原自聚集速率常数Table2 The rate constant of type Ⅰ collagen self-assembly from tilapia skin at different temperatures
不同溶液pH下,罗非鱼皮Ⅰ型胶原自聚集动力学拟合曲线如图3(a)和表3所示,可以看出胶原在pH5.4~9.4的范围内均能够发生明显的自聚集,与牛皮Ⅰ型胶原的研究结果一致[18]。采用式(2)对拟合曲线进行分析,结果如图3(b)和表3所示。当溶液pH为7.4、8.4和9.4时,胶原的成核时间明显短于pH为5.4和6.4时;随着溶液pH由5.4增大到9.4,胶原自聚集成核阶段的速率常数逐渐增大,生长阶段的速率常数先增大后降低,在pH7.4时达到最大值。上述结果表明罗非鱼皮胶原在碱性条件下自聚集能力较强,这主要与其等电点有关[3]。

图3 不同pH下罗非鱼皮Ⅰ型胶原自聚集动力学曲线(a)及线性拟合关系(b)Fig.3 The kinetic self-assembly curves(a)and linear fitting relationships(b)of typeⅠcollagen from tilapia skin at different pH values
2.4 溶液离子强度对罗非鱼皮Ⅰ型胶原自聚集动力学的影响
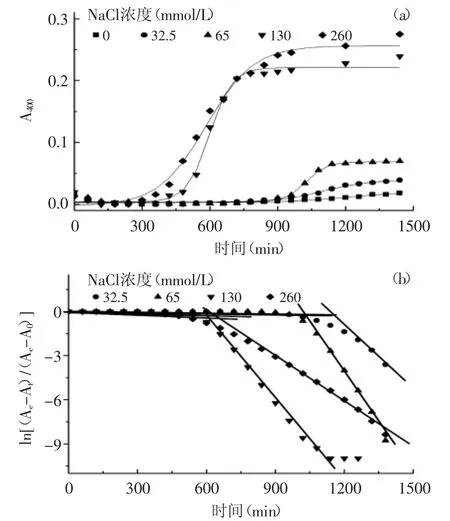
图4 不同NaCl浓度下罗非鱼皮Ⅰ型胶原自聚集动力学曲线(a)及线性拟合关系(b)Fig.4 The kinetic self-assembly curves(a)and linear fitting relationships(b)of typeⅠcollagen from tilapia skin at different NaCl concentrations
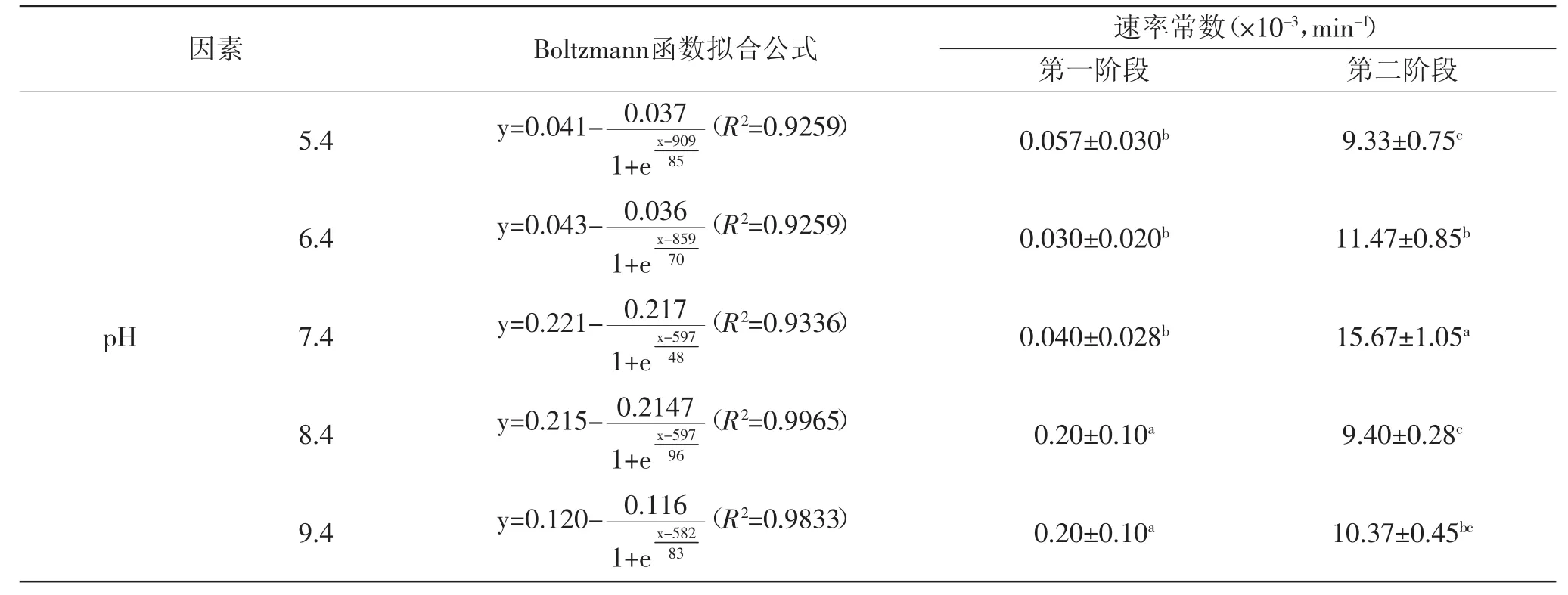
表3 不同pH下罗非鱼皮Ⅰ型胶原自聚集速率常数Table3 The rate constant of type Ⅰ collagen self-assembly from tilapia skin at different pH values
在不同离子强度(NaCl浓度)下,罗非鱼皮Ⅰ型胶原自聚集动力学曲线如图4(a)所示,拟合Boltzmann函数如表4所示。可以看出当自聚集溶液中有NaCl存在时,胶原表现明显的自聚集现象(R2>0.9),但是若溶液中没有NaCl存在,胶原并未表现明显的自聚集过程(R2=0.66)。由此可以得出:NaCl在胶原的自聚集过程中发挥重要作用,这与Li和Douglas在牛胶原自聚集性上的研究结果类似[13],但是与狭鳕鱼皮胶原上的结果不同[7],可能是由聚集温度不同导致的。利用式(2)对胶原自聚集动力学曲线进行分析,结果见图4(b)和表4。随着溶液中NaCl浓度的增大,胶原的成核时间明显缩短,原因可能是NaCl通过屏蔽带电基团而降低了胶原分子间的斥力[19]。另外,随着溶液中NaCl浓度的增大,胶原自聚集成核阶段的速率常数是逐渐增大的;而生长阶段的速率常数在NaCl浓度由32.5 mmol/L增大到130 mmol/L时是增大的,但是继续增大NaCl浓度,其值是降低的,表明在聚集溶液中适度加入NaCl有利于胶原的自聚集,但是过量的NaCl却阻碍了胶原纤维的生长。

表4 不同NaCl浓度下罗非鱼皮Ⅰ型胶原自聚集速率常数Table4 The rate constant of type Ⅰ collagen self-assembly from tilapia skin at different NaCl concentrations
3 结论
罗非鱼皮Ⅰ型胶原具有体外自聚集能力,其自聚集过程表现为两个阶段:成核阶段和生长阶段。胶原浓度、温度、溶液pH和离子强度(NaCl浓度)均能够影响到罗非鱼皮Ⅰ型胶原的自聚集动力学。胶原或NaCl浓度越高越有利于胶原晶核的形成,但是浓度过高却对胶原纤维的生长有阻碍作用;聚集温度越接近胶原来源原料的生活温度或溶液pH偏碱性,胶原越容易自聚集。因此可通过调控胶原的聚集条件来调控其自聚集过程,进一步对聚集体形态进行调控,这对于海洋Ⅰ型胶原生物材料和食品包装材料的研究和开发具有非常重要的意义。后续研究将着重探讨聚集条件对胶原聚集体形态和功能的调控作用。
[1]Reese S P,Underwood C J,Weiss J A.Effects of decorin proteoglycan on fibrillogenesis,ultrastructure,and mechanics of typeⅠcollagen gels[J].Matrix Biology,2013,32:414-423.
[2]赵燕,鲁亮,杨玲,等.草鱼皮胶原的体外自组装动力学研究[J].食品科学,2014,35(11):21-26.
[3]Noitup P,Morrissey M T,Garnjanagoonchorn W.In vitro selfassembly of silver-line grunt type Ⅰ collagen:Effects of collagen concentrations,pH and temperatures on collagen self-assembly [J].Journal of Food Biochemistry,2006,30:547-555.
[4]He J,Su Y,Huang T,et al.Effects of material and surface functional group on collagen self-assembly and subsequent cell adhesion behaviors[J].Colloids and Surfaces B:Biointerfaces,2014,116:303-308.
[5]Yang Y,Sun C,Wilhelm M E,et al.Influence of chondroitin sulfate and hyaluronic acid on structure,mechanical properties,and glioma invasion of collagenⅠ gels[J].Biomaterials,2011,32:7932-7940.
[6]Zeugolis D I,Paul R G,Attenburrow G.Factors influencing the properties of reconstituted collagen fibers prior to selfassembly:Animal species and collagen extraction method[J].Journal of Biomedical Materials Research Part A,2008,86A (4):892-904.
[7]Yan M,Li B,Zhao X,et al.Effect of concentration,pH and ionic strength on the kinetic self-assembly of acid-soluble collagen from walleye pollock(Theragra chalcogramma)skin[J].Food Hydrocolloids,2012,29:199-204.
[8]Yunoki S,Nagai N,Suzuki T,et al.Novel biochemical from reinforced salmon collagen gel prepared by fibril formation and cross-linking[J].Journal of bioscience and bioengineering,2004,98:40-47.
[9]梁艳萍,王艳,汪海波,等.草鱼鱼鳞胶原蛋白体外自组装行为的研究[J].食品科学,2011,3(23):15-20.
[10]赵燕,鲁亮,杨玲,等.草鱼和乌鳢鱼皮胶原体外自组装过程中的凝胶化行为比较研究[J].食品科学,2014,35(19):34-38.
[11]Fessler J H.Self-assembly of collagen[J].Journal of Supra molecular Structure,1974,2:99-102.
[12]Huang Y,Shiau C,Chen H,et al.Isolation and characterization of acid and pepsin-solubilized collagens from the skin of balloon fish(Diodon holocanthus)[J].Food Hydrocolloids,2011,25:1507-1513.
[13]Li Y,Douglas E P.Effects of various salts on structural polymorphism of reconstituted type Ⅰ collagen fibrils[J].Colloids and Surfaces B:Biointerfaces,2013,112:42-50.
[14]Kadler K E,Hojima Y,Prockop D J.Assembly of collagen fibrils de novo by cleavage of the type I pC-collagen with procollagen C-proteinase.Assay of critical concentration demonstrates that collagen self-assembly is a classical example of an entropy-driven process[J].Journal of Biological Chemistry,1987,262:15696-15701.
[15]Na G C,Butz L J,Bailey D G,et al.In vitro collagen fibril assembly in glycerol solution:evidence for a helical cooperative mechanism involving microfibrils[J].Biochemistry,1986,25:958-966.
[16]Wood G C.The formation of fibrils from collagen solutions:a mechanism of collagen fibril formation[J].Biochemical Journal,1960,75:598-605.
[17]强俊,任洪涛,徐跑,等.温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活力的协同影响[J].应用生态学报,2012,2(1):255-263.
[18]Li Y,Asadi A,Monroe M R,et al.pH effects on collagen fibrillogenesis in vitro:Electrostatic interactions and phosphate binding[J].Materials Science and Engineering C,2009,29:1643-1649.
[19]Li X,Li Y,Hua Y,et al.Effect of concentration,ionic strength and freeze-drying on the heat-induced aggregation of soy proteins [J].Food Chemistry,2007,104:1410-1417.
Effect of the aggregation conditions on the kinetic self-assembly of typeⅠcollagen from tilapia(Oreochromis niloticus)skin
YAN Ming-yan,QIN Song*
(Yantai Institute of Coastal Zone Research,Chinese Academy of Sciences,Yantai 264003,China)
The effects of collagen concentration,temperature,pH value and ionic strength on the kinetic self-assembly of type Ⅰ collagen from tilapia(Oreochromis niloticus)skin were investigated by Boltzmann function and a two-phase kinetic self-assembly model(nucleation phase and growth phase).It showed that the kinetic self-assembly of collagen could be modulated by collagen concentration,temperature,pH value and ionic strength.The marked self-assembly was formed when the concentration of collagen reaching and above 0.34 mg/mL from the fitted kinetic self-assembly curve.More of collagen molecules were beneficial for the formation of nucleus,but excess would inhibit the growth of fibril.Collagens were more likely to self-assemble when the temperature was close to the environmental temperature for samples or in the alkaline solution.Finally,the collagen self-assembly could be modulated by NaCl concentration.The higher NaCl concentration was beneficial to the formation of nucleus,but the superabundant of NaCl would inhibit the growth of fibril.
collagen;self-assembly;tilapia;fish skin;kinetic
TS201.1
A
1002-0306(2016)02-0093-06
10.13386/j.issn1002-0306.2016.02.010
2015-05-06
闫鸣艳(1980-),女,博士,助理研究员,研究方向:海洋生物活性物质及其功能特性研究,E-mail:mingyan012003@163.com。
*通讯作者:秦松(1968-),男,博士,研究员,研究方向:海岸带生物活性物质及其功能特性研究,E-mail:sqin@yic.ac.cn。
国家自然科学基金(31201455,41576155);山东省海洋经济创新发展区域示范产业项目(海洋活性蛋白及其功能制品的开发与产业化)。

