急性痛风性关节炎患者治疗前后外周血单核细胞NLRP3炎性体mRNA表达及血清IL-6水平的研究
丁焕发,韦涌涛,刘淑娟,徐晓辰,兰立强,王尚云.青岛市第八人民医院内分泌科,山东青岛 6600;.青岛市第八人民医院检验科,山东青岛 6600
急性痛风性关节炎患者治疗前后外周血单核细胞NLRP3炎性体mRNA表达及血清IL-6水平的研究
丁焕发1,韦涌涛2,刘淑娟1,徐晓辰1,兰立强1,王尚云2
1.青岛市第八人民医院内分泌科,山东青岛266100;2.青岛市第八人民医院检验科,山东青岛 266100
目的检测急性痛风性关节炎(acute gouty arthritis,AGA)患者治疗前后外周血单核细胞(peripheral blood monocytes,PBMCs)中NLRP3炎性体[NLRP3、凋亡相关斑点样蛋白(ASC)、半胱天冬酶-1(caspase-1)]mRNA表达水平及血清白介素(IL)-6水平的变化,探讨该炎性体及IL-6在AGA发病中可能的作用机制。方法 根据美国风湿病协会(ACR)1997年制定的诊断标准,随机选取来自该院2014年8月—2016年2月的门诊AGA患者100例(观察组,T),同时随机选取相同时间段青岛本地居民健康查体者100名 (对照组,C)。用RT-PCR法检测对照组和观察组治疗前(D0)及应用药物治疗后第3天(D3)、第7天(D7)、第14(D14)天NLRP3炎性体mRNA表达水平,同时用ELISA法测定相应IL-6水平。结果 与对照组(0.130±0.070)相比,NLRP3 mRNA表达水平在D0(0.077±0.039)、D3(0.086±0.046)及D7(0.103±0.054)均显著降低,差异有统计学意义(P<0.01);与对照组(0.011±0.006)相比,观察组各阶段ASC mRNA表达水平均显著升高,差异有统计学意义,其中D0(0.028±0.016)、D3(0.030±0.020)及D7(0.017±0.012)vs C(P<0.01)、D14(0.013±0.007)vs C(P<0.05);与对照组(0.119±0.061)相比,caspase-1 mRNA表达水平在D0(0.047±0.030)及D3 (0.052±0.030)显著降低,差异有统计学意义(P<0.01)。观察组血清IL-6水平(pg/ml)与对照组(10.21±3.62)相比在各阶段均显著升高,差异有统计学意义,其中D0(48.87±19.25)、D3(49.84±21.14)、D7(43.81±18.30)vs C(P<0.01),D14 (11.40±4.55)vs C(P<0.05)。结论NLRP3炎性体及IL-6在AGA患者治疗过程中水平异常,提示它们在AGA发病中参与了炎症反应过程,在炎症机制中可能发挥了重要作用。
凋亡相关斑点样蛋白;半胱天冬酶-1;NLRP3;炎性体;痛风性关节炎
[Abstract]Objective To study the expression level of NLRP3(NLR family,pyrin domain containing 3)inflammasome(NL-RP3,ASC,caspase-1)mRNA in peripheral blood monocytes(PBMCs)and serum level of interleukin-6(IL-6)of patients with acute gouty arthritis(AGA)in the course of it,and the roles of them in pathogenesis in AGA.Methods According to the standards of American College of Rheumatology(ACR)in 1997,100 outpatients who had acute gouty arthritis(AGA)were selected as test group(T).All patients came from Department of Endocrinology of Qingdao Eighth People's Hospital from August 2014 to February 2016.At the same time,100 healthy subjects were selected as control group(C)who were local residents of Qingdao came from Health Examination Center of our hospital.NLRP3 inflammasome mRNA was measured using reverse transcription-polymerase chain reaction(RT-PCR)in PBMCs.The expression of NLRP3 inflammasome mRNA in PBMCs was compared between T and C.T consisted of four stages of disease process Θ:pretherapy(D0),3rd day after medications(D3),7th day after medications(D7)and 14th day after medications(D14).IL-6was measured accordingly using Enzyme-linked immunosorbent assay(ELISA)in the two groups.Results The expression of NLRP3 mRNA in D0 (0.077±0.039),D3(0.086±0.046)and D7(0.103±0.054)reduced significantly when compared to C(0.130±0.070)(P<0.01). The expression of ASC mRNA in AGA increased significantly when compared to healthy controls.D0(0.028±0.016),D3 (0.030±0.020)and D7(0.017±0.012)vs C(0.011±0.006)(P<0.01),D14(0.013±0.007)vs C(P<0.05).The expression of caspase-1 mRNA in D0(0.047±0.030)and D3(0.052±0.030)reduced significantly when compared to C(0.119±0.061)(P<0.01). Serum level of IL-6(pg/ml)in D0(48.87±19.25),D3(49.84±21.14)and D7(43.81±18.30)increased significantly when compared to C(10.21±3.62)(P<0.01),and there was a significant increase in D14(11.40±4.55)vs C(P<0.05).Conclusion Dysregulated expression of the NLRP3 inflammasome and IL-6 level are involved in the inflammatory response and play key roles in the pathogenesis of the process of AGA.
[Key words]Apoptosis-associated speck-like protein;Caspase-1;NLRP3;Inflamm–asome;Arthritis gouty
目前急性痛风性关节炎 (acute gouty arthritis,AGA)患病率随人们年龄的增长有逐渐增高的趋势,且常伴有多种慢性病,发病高峰年龄为40岁左右,临床上以男性患者多见,女性约占5%,且多为绝经期后妇女。近年来研究发现单核/巨噬细胞系统在AGA启动、进展及缓解中均发挥了关键作用,其中IL-1β是单钠尿酸盐(Monosodium urate,MSU)晶体诱导炎症的关键因子,NLRP3炎性体通过促进IL-1β的生成在AGA发作中发挥不可替代的作用[1]。同时多种促炎性细胞因子参与了AGA的发病过程,IL-6就是其中非常重要的一个。当AGA发生时,血清与关节液中IL-6水平升高。该研究根据美国风湿病协会(ACR)1997年制定的诊断标准,随机选取来自该院2014年8月—2016年2月的门诊AGA患者100例进行研究,探讨NLRP3炎性体及IL-6在AGA发病中可能的作用机制,以发现该炎性体及细胞因子在AGA病程发展各个阶段表达水平的变化及意义,指导AGA的早期防治及优化治疗方案。
1 资料与方法
1.1一般资料
观察组(T):随机选取符合以下诊断标准和剔除标准的患者100例(男95例,女5例),年龄(47.25±10.99)岁,全部来自该院的门诊患者。⑴急性痛风性关节炎诊断标准:应用美国风湿病协会(ACR)1997年制定的诊断标准。⑵入选和剔除标准:①符合ACR诊断标准的急性原发性痛风性关节炎;②排除心血管、肾脏、血液疾病、肿瘤疾病引起的继发性痛风;③排除合并感染性疾病患者;④排除自身免疫性疾病及全身系统疾病患者;⑤年龄18~75岁之间;⑥一般情况良好;⑦未服用降尿酸药物治疗者。对照组(C):随机选取青岛本地居民健康查体者100名 (男95名,女5名),年龄 (46.15± 11.80)岁,排除高尿酸血症患者。高尿酸血症的诊断标准:是指正常嘌呤饮食状态下,非同日2次空腹血清尿酸水平 (37℃)男性>420 μmol/L,绝经前女性>360 μmol/L,绝经后女性的诊断标准同男性。两组人群性别、年龄差异无统计学意义(P>0.05)。该研究得到青岛市第八人民医院伦理委员会批准,所有研究对象均知情同意。
1.2治疗方案
AGA发病时的一线镇痛药物包括非甾体类消炎药(NSAIDs)、COX-2抑制剂、秋水仙碱或类固醇药物[2],首选秋水仙碱及NSAIDs[3],通过降低患者血清及关节液中IL-1β、TNF-α、环氧化酶-2等的水平发挥作[4]。观察组治疗方案:在低嘌呤饮食、足量饮水前提下,给予:①镇痛:为主要治疗措施。秋水仙碱片 (国药准字:H53021369;批号:140109;有效期:36个月),服药疗程14 d:前3 d0.5 mg/次,3次/d,餐后服;然后0.5 mg/次,2次/d,餐后服,连续用药7 d;后4 d0.5 mg/次,1次/晚,睡前服。依托考昔片[5-8](安康信,Merck Sharp&Dohme Corp;进口药品注册证号:注册证号H20130299;批准文号:国药准字J20130133;批号:Y1981,服药疗程 10 d:前 3 d120 mg/次,1次/d,餐后服;3 d后60 mg/次,1次/d,餐后服,连续用药7 d。②碱化尿液:抑制尿酸在肾脏形成晶体,促进尿酸肾脏排泄。尿pH值维持在6.2~6.8。给予口服枸橼酸钾钠颗粒(逍适柠,国药准字H20103086;产品批号:20150501)2.5 g/次,4次/d(三餐后及睡前)。治疗过程中若出现肝、肾功能异常及胃肠道反应则予以排除。
1.3观测指标
①测定两组的一般生理指标:年龄 (Age)、身高(BH)、体重(BW)、收缩压/舒张压(SBP/DBP)、腰围(WC)、臀围(HC)。计算腰臀比(WHR)及体质量指数(BMI)。BMI=体重(kg)/身高(m)2。
②测定两组的空腹血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿酸(UA)、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、C-反应蛋白(CRP)、肌酐(Cr)、尿素氮(BUN)。测定两组全血白细胞总数(WBC)、中性粒细胞数(NEUT)、中性粒细胞百分比(NEUT%)。
③测定观察组治疗前 (第0天,D0)及治疗后第3天(D3)、第7天(D7)、第14天(D14)PBMCs中NLRP3 mRNA、ASC mRNA及caspase-1 mRNA。测定相应时间点的空腹血清IL-6水平。同时测定对照组上述指标,与观察组治疗前指标进行比较研究。
1.4主要检测方法
所有入选者由专人进行一般生理指标测量并记录。实验中血清ALT、AST、UA、FPG、TG、TC、LDL-C、HDL-C、CRP、Cr、BUN的检测用全自动生化分析仪,IL-6的检测采用ELISA试剂盒。PBMCs中NLRP3、ASC 及caspase-1 mRNA采用RT-PCR检测。血分析采用SYSMEX XT-2000i全自动血液分析仪检测。
1.5统计方法
采用IBM SPSS 19.0软件包对所有数据进行统计学分析,观察组与对照组NLRP3炎性体mRNA比较采用独立样本t检验,一般生理指标、血生化指标及全血分析白细胞数等用独立样本t检验,计数资料采用χ2检验。计量资料用(±s)表示。以P<0.05为差异有统计学意义。
2 结果
2.1一般临床资料及实验室检查指标比较
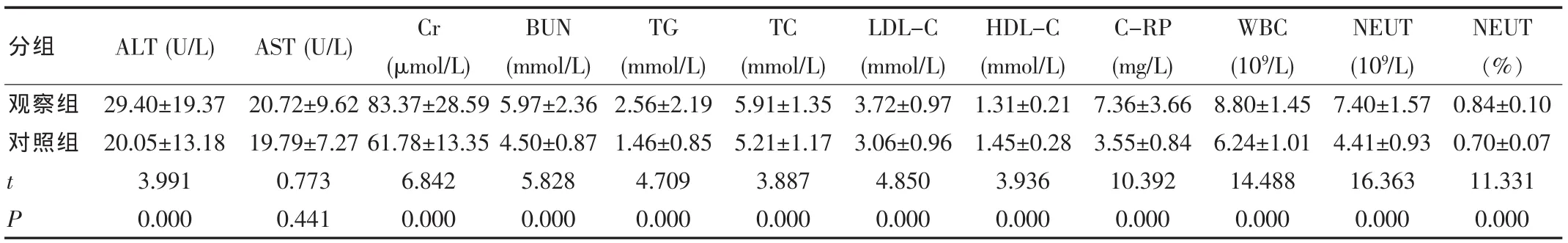
观察组与对照组比较,两组性别、Age、AST差异无统计学意义(P>0.05);与对照组相比,观察组BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、C-RP、WBC、NEUT、NEUT%均明显升高,HDL-C降低,差异有统计学意义(P<0.05~0.01)(表1)。
2.2两组NLRP3 mRNA表达水平比较
观察组NLRP3 mRNA表达水平D0、D3及D7vs C显著升高降低,差异有统计学意义(P<0.01),D14 vs C差异无统计学意义(P>0.05);观察组各阶段ASC mRNA表达水平与对照组相比显著升高,差异均有统计学意义,其中D0、D3及D7 vs C(P<0.01)、D14 vs C(P<0.05);观察组caspase-1 mRNA表达水平,D0及D3 vs C显著降低,差异有统计学意义(P<0.01),D7及D14 vs C差异无统计学意义(P>0.05)。(表2)。
表1 两组一般资料及实验室检查指标水平(±s)
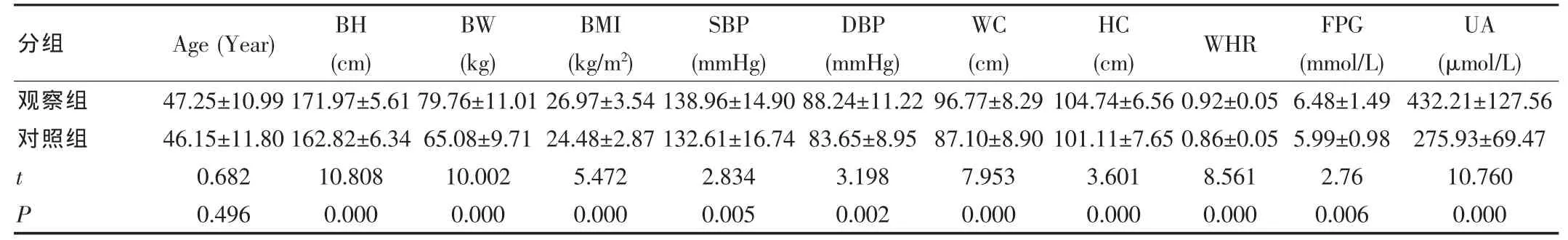
表1 两组一般资料及实验室检查指标水平(±s)
注:观察组与对照组相比,差异有统计学意义P<0.05。
分组 Age(Year) BH (cm)UA (μmol/L)观察组对照组BW (kg)BMI (kg/m2)SBP (mmHg)DBP (mmHg)WC (cm) (cm) WHR FPG (mmol/L)HC t P 47.25±10.99 46.15±11.80 0.682 0.496 171.97±5.61 162.82±6.34 10.808 0.000 79.76±11.01 65.08±9.71 10.002 0.000 26.97±3.54 24.48±2.87 5.472 0.000 138.96±14.90 132.61±16.74 2.834 0.005 88.24±11.22 83.65±8.95 3.198 0.002 96.77±8.29 87.10±8.90 7.953 0.000 104.74±6.56 101.11±7.65 3.601 0.000 0.92±0.05 0.86±0.05 8.561 0.000 6.48±1.49 5.99±0.98 2.76 0.006 432.21±127.56 275.93±69.47 10.760 0.000
续表1
表2 两组NLRP3炎性体mRNA表达水平(±s)
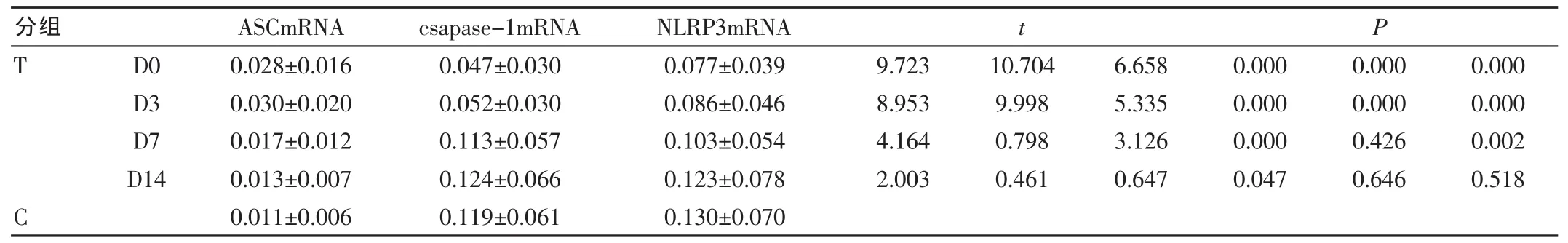
表2 两组NLRP3炎性体mRNA表达水平(±s)
注:观察组与对照组相比(T vs C)以P<0.05差异有统计学意义。
分组 ASCmRNA csapase-1mRNA NLRP3mRNA T t P D0 D3 D7 D14 9.723 8.953 4.164 2.003 0.028±0.016 0.030±0.020 0.017±0.012 0.013±0.007 0.011±0.006 0.047±0.030 0.052±0.030 0.113±0.057 0.124±0.066 0.119±0.061 0.077±0.039 0.086±0.046 0.103±0.054 0.123±0.078 0.130±0.070 10.704 9.998 0.798 0.461 6.658 5.335 3.126 0.647 0.000 0.000 0.000 0.047 0.000 0.000 0.426 0.646 0.000 0.000 0.002 0.518 C
2.3两组IL-6水平比较
观察组各阶段血清IL-6水平与对照组相比显著升高,差异有统计学意义,其中D0、D3、D7 vs C(P<0.01),D14 vs C(P<0.05)。(表3)。
表3 两组IL-6水平比较(±s)
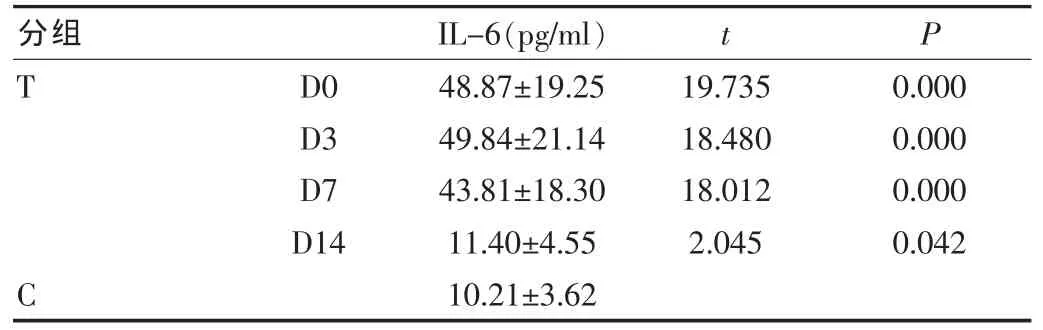
表3 两组IL-6水平比较(±s)
注:观察组与对照组相比(T vs C)以P<0.05差异有统计学意义。
分组IL-6(pg/ml)t P T D0 D3 D7 D14 19.735 18.480 18.012 2.045 0.000 0.000 0.000 0.042 C 48.87±19.25 49.84±21.14 43.81±18.30 11.40±4.55 10.21±3.62
3 讨论
痛风(Gout)是因嘌呤代谢障碍和/或尿酸排泄减少、血UA持续升高而导致MSU晶体析出并沉积于组织或器官引起的一组临床症候群,属于代谢性风湿病。报道显示,国内痛风的患病率目前在1%~3%,2009年山东沿海地区当地居民痛风患病率为1.96%,2007-2008年美国痛风患病率上升至3.9%。AGA可发生于任何年龄,发病高峰年龄为40岁左右,且常伴有糖尿病、肥胖、心脑血管病、肾脏病等,患病率随年龄的增长有逐渐增高的趋势。该研究中,与对照组相比,观察组BH、BW、BMI、SBP、DBP、WC、HC、WHR、FPG、UA、ALT、Cr、BUN、TG、TC、LDL-C、HDL-C均明显升高(P<0.01)亦支持上述观点。AGA临床上以男性患者多见,女性约占5%,且多为绝经期后妇女。AGA发作时疼痛剧烈,患者异常痛苦,严重影响日常工作和生活。近年来研究发现单核/巨噬细胞系统在AGA启动、进展及缓解中均发挥了关键作用,发作涉及IL-1β、IL-6、IL-18、TNF-α等多种炎症因子,其中IL-1β是MSU晶体诱导炎症的关键因子,大量的IL-6及其他因子释放到循环中,刺激机体的全身急性时相反应,致AGA患者发热、全身不适,及WBC升高。NLRP3炎性体,即Nod样受体蛋白3(Nodlike receptor protein 3,NLRP3)炎性体是位于细胞内的一种蛋白质复合体,主要功能为活化半胱氨酸天冬氨酸蛋白酶1(Caspase-1)以间接调控IL-lβ、IL-18[9]、和IL-33等的成熟和分泌,具有调控机体炎症反应的功能。NLRP3炎性体是由核苷酸结合寡聚化结构域样受体 (nucleotide-binding oligomerization domain-like re-ceptors,NLRs)家族成员NLRP3(NLR family,pyrin domain containing 3)、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和半胱氨酸天冬氨酸蛋白酶1(cysteine-requiring aspartate protease-1,caspase-1)组成的复合体,是内源性或外源性危险信号的胞质内感受器,是活化caspase-1的分子平台,调控IL-lβ和白介素18(IL-18)等促炎细胞因子的成熟和分泌。IL-lβ是一个经典的促炎性细胞因子,活化的IL-lβ与靶细胞上的IL-1受体结合,激活IL-1信号通路和髓样分化因子 (myeloid differentiation factor,MyD88)依赖的NF-κB通路,促进IL-1等促炎因子转录,诱导机体炎症反应。研究证实,IL-lβ是促进多种代谢性疾病发生发展的重要炎症因子,阻断其生物学效应能有效缓解代谢性疾病的进展。NLRP3是模式识别胞内受体Nod样受体蛋白家族的成员,广泛表达于树突细胞、单核细胞和巨噬细胞,具有识别病原体的功能。ASC是NLRP3炎性体的双重衔接蛋白,能够以某种桥梁的形式将NLRP3和caspase-1前体连接起来,最终形成具有酶活性的异二聚体caspase-1。caspase-1作为炎性体的效应蛋白,能够将无活性的IL-18和IL-1β前体剪切为成熟的IL-18和IL-1β,促进其成熟分泌。
目前研究认为,NLRP3炎性体是MSU导致痛风的核心机制[10]。Martinon等[11]研究显示,NLRP3介导MSU诱导痛风发生发展,其机制可能与MSU诱导K+外流有关,还可能与线粒体来源的活性氧(reactiveoxygenspecies,ROS)释放有关,溶酶体破裂也可能是MSU激活NLRP3炎性小体的机制之一。该研究结果显示,AGA发病时及治疗后第3天,ASCmRNA表达水平 (0.028±0.016、0.030± 0.020)均显著高于对照组(0.011±0.006)(P<0.01);NLRP3 mRNA表达水平(0.077±0.039、0.086±0.046)及caspase-1 mRNA表达水平(0.047±0.030、0.052±0.030)均显著低于对照组(0.130±0.070、0.119±0.061)(P<0.01),说明在炎症早期,NLRP3炎性体参与了疾病过程。治疗后第7天,患者NLRP3 mRNA表达水平(0.103±0.054)仍低于对照组(P<0.01),ASC mRNA表达水平(0.017±0.012)仍高于对照组 (P<0.01),caspase-1 mRNA表达水平与对照组差异无统计学意义,提示在炎症持续存在期间,NLRP3炎性体持续参与炎症过程,随病程进行,炎症消退过程中,抑制炎症的调控因素可能逐渐出现。治疗第14天ASC mRNA表达水平(0.013±0.007)仍高于对照组 (P<0.05),较前已明显降低,NLRP3 mRNA及caspase-1 mRNA表达水平与对照组差异无统计学意义,结果显示AGA炎症消退,趋于正常,ASC表达可能存在其他途径及意义。该研究显示,在AGA病程中ASC mRNA表达水平始终高于对照组,与国内相关研究结果一致[12]。NLRP3 mRNA及caspase-1 mRNA表达水平在第一周均低于对照组,到第二周时与对照组差异无统计学意义。NLRP3炎性体表达水平在病程中的此种变化,可能与药物干预及多种调节因子共同作用有关。国内相关研究[13]亦显示,NLRP3 mRNA在AGA患者中表达水平低于健康对照组,ASC mRNA及caspase-1 mRNA表达水平在AGA组高于健康对照组,研究者认为NLRP3 mRNA表达在痛风性关节炎患者炎症过程中可能发挥负调控作用,ASC mRNA及caspase-1 mRNA表达在此过程中主要发挥协同作用。这与该研究部分结果相一致,因为无具体治疗方案,无法判断其他因素的影响。
AGA的前炎症介质来源于常驻的滑膜细胞和迁移的单核巨噬细胞,而NEUT的侵入和活化是最重要的环节。发病时关节滑液和滑膜中出现的大量NEUT甚至可与急性化脓性关节炎时相当[14]。该研究中,发病时的WBC、NEUT、NEUT%及CRP[15]均显著高于对照组,提示AGA发病时WBC及NEUT在炎症初期就参与了反应。IL-6是AGA的重要炎症因子,发病时关节液及血清中IL-6水平明显升高[16-17]。国内党万太等研究显示,AGA组患者血清IL-6表达水平(76.2±29.6pg/mL)显著高于健康对照组(35.0±27.0)pg/mL(P<0.01),认为其可以间接提示NLRP3炎性体的活化在痛风性关节炎各种致炎因子成熟和释放过程中的重要性。该研究中,观察组各阶段血清IL-6水平(pg/mL)与对照组相比显著升高,差异有统计学意义,其中 D0(48.87±19.25)、D3(49.84± 21.14)、D7(43.81±18.30)vs C(10.21±3.62)(P<0.01),D14(11.40±4.55)vs C(P<0.05),表明IL-6在AGA炎症过程中发挥重要作用,且在发病高峰时浓度最高,随炎症缓解水平逐渐降低。与国内研究显示AGA致炎性因子IL-6表达显著升高相一致[11]。IL-6主要由Th2细胞产生,单核/巨噬细胞、成纤维细胞、内皮细胞、肥大细胞等亦可产生。IL-1可刺激单核/巨噬细胞等合成IL-6。IL-6有多种生物活性,参与多种疾病的炎症反应,可抑制炎症反应的许多方面,如减少中性粒细胞,单核/巨噬细胞在脂多糖诱导下的IL-1、TNF的合成;增加IL-1Ra合成;促进IL-1β及TNF受体释放;减少IL-8等炎症趋化因子的表达。在痛风性关节炎患者滑液中发现IL-6水平升高。有报道称,当痛风性关节炎等病情活动或关节破坏严重时,血清与关节液中IL-6水平升高。有学者将IL-6作为判断痛风性关节炎等疾病活动性和严重程度的指标。
总之,该研究结果表明,NLRP3炎性体及IL-6在AGA患者发病及治疗过程中水平异常,提示它们在AGA发病中参与了炎症反应过程,在炎症机制中可能发挥了重要作用。结果亦提示,NLRP3炎性体及IL-6在炎症过程存在与多种炎性因子的共同作用,相互影响,亦存在相关负向调节,它们在炎症发生、进展及缓解中的负面作用亦可能存在,需要在今后的研究中进一步探讨。
[1]Sidiropoulos PI,Goulielmos G,Voloudakis GK,et a1.Inflammasomes and rheumatic diseases:evolving concepts[J]. Ann Rheum Dis,2008,67:1382-1389.
[2]中华医学会内分泌学分会.高尿酸血症和痛风治疗中国专家共识[C]//中华医学会第十二次全国内分泌学学术会议,2013.
[3]袁艳平,李长贵.急性痛风性关节炎的规范化治疗[J].医学综述,2014,20(21):3902-3905.
[4]袁艳平,李长贵.痛风性关节炎患者血清白细胞介素-1β、肿瘤坏死因子-α、环氧化酶-2水平的动态变化研究[J].中华风湿病学杂志,2013,17(12):818-822.
[5]潘奇,陈黔.依托考昔治疗急性重度痛风性关节炎的疗效研究[J].中国医药指南,2016,14(8):107-108.
[6]王珉,何雅楠,仝磊.依托考昔片治疗痛风性关节炎59例疗效评价[J].新疆医学,2015,45(8):1128-1130.
[7]陆建立.依托考昔治疗急性痛风性关节炎的临床观察[J].实用药物与临床,2014,17(4):451-454.
[8]郭迪斌,居艳娟,李荣平,等.依托考昔和美洛昔康治疗急性痛风的临床效果以及安全性分析[J].2014,21(30):68-69,72.
[9]Akahoshi T.Pathologicalmechanisms of gouty arthritis[J]. Nihon Rinsho,2008,66(4):705-710.
[10]L'homme L,Esser N,RivaL,et al.Unsaturated fatty acids prevent activation of NLRP3 inflammasome in human monocytes/macrophages[J].J Lipid Res,2013,54(11):2998-3008.
[11]Martinon F,Petrilli V,Mayor A,et al.Gout-associated uric acid crystals activate the NALP3 inflammasome[J].Nature, 2006,440(7081):237-241.
[12]田岚.痛风性关节炎患者外周血单个核细胞中TRF1、TRF2及NLRP3炎性体的变化[J].中国医药导报,2015,12 (34):82-85.
[13]党万太,周京国,谢文光,等.NLRP3炎性体在痛风性关节炎患者炎症反应中的机制研究[J].中国免疫学杂志, 2014,30(3):373-377,382.
[14]伍沪生.痛风与晶体性关节病[M].北京:人民卫生出版社, 2014:62.
[15]陈坚,丁振华.类风湿、风湿热和痛风患者C-反应蛋白检测的临床意义[J].浙江临床医学,2013,15(10):1512-1513.
[16]梁翼,李敏,吴晓惠,等.IL-1β、IL-6、TNF-α与急性痛风性关节炎的相关性研究[J].中国中医骨伤科杂志,2014, 22(9):14-16.
[17]彭勇,陈勇,邬秀娣.痛风患者血清P2X7 R水平的检测及其与炎症因子的相关性研究[J].浙江医学,2014(19):1597-1600.
Expression of NLRP3 Inflammasome mRNA in PBMCs and Serum Level of Interleukin-6 of Patients with Acute Gouty Arthritis in the Course of Disease Process
DING Huan-fa1,WEI Yong-tao2,LIU Shu-juan1,XU Xiao-chen1,LAN Li-qiang1,WANG Shang-yun2
1.Department of Endocrinology,Qingdao Eighth People's Hospital,Qingdao,Shandong Province,266100 China;2.Laboratory Department,Qingdao Eighth People's Hospital,Qingdao,Shandong Province,266100 China
R4
A
1674-0742(2016)08(b)-0004-06
10.16662/j.cnki.1674-0742.2016.23.004
青岛市卫生科技发展计划项目(2014-WJZD103)。
丁焕发(1970.12-),男,山东青岛人,硕士,主治医师,研究方向:高尿酸血症与痛风,糖尿病,肥胖与脂代谢。
2016-05-15)

