番茄黄化曲叶病毒的鉴定与群体进化分析
周 莹, 尚巧霞, 罗 晨, 乔广行, 刘 梅, 张 玮, 燕继晔*
(1.北京市农林科学院植物保护环境保护研究所, 北京 100097; 2.北京农学院植物科学技术学院, 北京 102206)
番茄黄化曲叶病毒的鉴定与群体进化分析
周莹1,尚巧霞2,罗晨1,乔广行1,刘梅1,张玮1,燕继晔1*
(1.北京市农林科学院植物保护环境保护研究所, 北京100097; 2.北京农学院植物科学技术学院, 北京102206)
番茄黄化曲叶病(tomatoyellowleafcurldisease,TYLCD)是番茄上的重要病害,可由多种双生病毒引起。为了明确北京地区番茄黄化曲叶病的病毒种类和病毒基因组变异情况,本研究收集了51个采自北京不同区县的病毒疑似样品,进行了双生病毒的检测及分离物的基因组分析。经双生病毒简并引物检测25个样品呈阳性;扩增获得10个代表性分离物的全基因组,大小均为2 781bp,共含有6个开放阅读框;经比对,10个分离物与Tomato yellow leaf curl virus-Israel(TYLCV-IL)同源率大于99%;基于我国TYLCV分离物全基因组序列的变异分析表明,TYLCV在进化上比较保守,整个基因组上的变异是不均匀的;系统发育树显示我国TYLCV分离物在进化树上可分为3个组群,分析了我国TYLCV群体进化情况。
双生病毒鉴定;基因组变异;系统发育
番茄黄化曲叶病(tomatoyellowleafcurldisease,TYLCD)是世界范围内引起番茄严重减产的重要病害,该病害由双生病毒科病毒侵染引起。双生病毒科(Geminiviridae)病毒是一类具有孪生颗粒形态的单链环状DNA病毒,国际病毒分类委员会(InternationalCommitteeonTaxonomyofViruses,ICTV)第九次报告中将双生病毒科病毒分成7个属[1],其中菜豆金色黄花叶病毒属(Begomovirus)的成员最多。该属成员多数为双组分基因组,含有2条大小为2.5~3.0kb的DNA分子,即DNA-A和DNA-B;少数成员为单组分,其基因组结构类似于双组分的DNA-A,大小约2.8kb[2],单个组分就能侵染致病,如番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)[3];还有一些单组分的病毒伴随有一种卫星分子DNAβ,两者必须共同侵染才能引起典型症状[4-5]。
番茄被双生病毒侵染后,主要表现为曲叶、斑驳、黄化、节间缩短以及植株矮化等症状。即使症状相似,引起番茄黄化曲叶病的病原也可能不同;引起番茄黄化曲叶的病毒种类较为复杂,同一地区的番茄往往被多种双生病毒所侵染。Fauquet等报道番茄至少受到60多种双生病毒的侵染[6],在我国侵染番茄的双生病毒至少有9种,包括番茄黄化曲叶病毒(TYLCV)[7]、中国番茄黄化曲叶病毒(Tomato yellow leaf curl China virus,TYLCCNV)[5]、广东番茄黄化曲叶病毒(Tomato yellow leaf curl Guangdong virus,ToYLCGDV)[8]、泰国番茄黄化曲叶病毒(Tomato yellow leaf curl Thailand virus,TYLCTHV)[9],中国番茄曲叶病毒(Tomato leaf curl China virus,ToLCCNV)[10],海南番茄曲叶病毒(Tomato leaf curl Hainan virus,ToLCHnV)[11],台湾番茄曲叶病毒(Tomato leaf curl Taiwan virus,ToLCTWV)[12]、中国番木瓜曲叶病毒(Papaya leaf curl China virus,PaLCuCNV)[13]和烟草曲茎病毒(Tobacco curly shoot virus,TbCSV)[14]等。
TYLCV是番茄上发生很普遍的一种双生病毒,我国于2006年在上海首次发现[7],随后由南向北扩散[15-20],给番茄生产造成了严重影响。国际病毒委员会根据地区和序列的不同将TYLCV分为以下几个株系:Tomato yellow leaf curl virus-Gezira(TYLCV-Gez)、Tomato yellow leaf curl virus-Mild(TYLCV-MLD)、Tomato yellow leaf curl virus-Iran(TYLCV-IR)、Tomato yellow leaf curl virus-Israel(TYLCV-IL)和Tomato yellow leaf curl virus-Oman(TYLCV-OM)[6]。2009年北京地区首次报道了TYLCD的发生[16],随后宋晰等确定北京的优势株系为TYLCV-IL株系[21]。为进一步明晰近几年北京地区TYLCD病原种类变化以及病毒基因组变异进化等情况,我们于2011年-2013年分别在北京不同区县采集TYLCD疑似病株,进行了病毒鉴定及分离物基因组序列分析。
1 材料与方法
1.1样品采集
2011年-2013年分别在北京延庆、平谷、顺义、大兴、房山以及通州的日光温室和大棚中采集表现疑似病毒症状的番茄叶片,保存于-80℃冰箱。样品编号详见结果部分。
1.2方法
1.2.1主要试剂
基因组DNA快速提取试剂盒和琼脂糖凝胶DNA快速纯化回收试剂盒;dNTPs、ExTaqDNA聚合酶、载体pMD18-T、连接酶、大肠杆菌(Escherichia coli )DH5α为TaKaRa公司产品。
1.2.2番茄样品总DNA的提取
样品DNA使用TaKaRaMiniBESTPlantGenomicDNAExtractionKit提取,按照试剂盒说明书操作。
1.2.3引物合成
参照GenBank中报道的危害番茄的双生病毒DNA-A序列,通过Blastn比对,根据其序列保守区,设计了3对扩增引物,F1/R1用于检测或扩增DNA-A部分区域,与F6/R6扩增片段拼接获得全长;F4/R5可扩增DNA-A全长。引物由上海生工生物技术有限公司合成。引物序列见表1。

表1 用于检测和扩增双生病毒序列的引物1)Table 1 Primers used for detection andamplification of geminiviruses
1)R=A/G,W=A/T,D=A/G/T。
1.2.4PCR扩增、克隆及测序
PCR反应体系:10×PCR反应缓冲液5μL,2.5mmol/LdNTPs4μL,20μmol/L上下游引物各2μL,ExTaq酶0.5μL,基因组DNA1μL,加ddH2O至总体积到50μL。充分混匀后于PCR仪上进行反应。引物F1和R1PCR程序:94℃预变性4min;94℃变性45s,53℃退火30s,72℃延伸45s,30个循环;72℃延伸5min。引物F6和R6的PCR程序:94℃预变性4min;94℃变性45s,60℃退火45s,72℃延伸45s,30个循环; 72℃延伸10min。引物F4和R5的PCR程序:94℃预变性4min;94℃变性45s,53℃退火45s,72℃延伸90s,30个循环;72℃延伸10min。PCR反应以测序样品为阳性对照,以健康植株为阴性对照。
将PCR产物回收克隆到载体pMD18-T上,筛选阳性克隆,委托博迈德科技发展有限公司测序。
1.2.5序列分析
引物F1/R1的扩增片段与引物F6/R6扩增片段利用DNAMAN软件(Version6.0)拼接获得基因组全长序列;DnaSP软件(Version5)进行分离物全基因组序列的变异分析;进化树采用MEGA(Version5.05)软件neighbor-joining方法构建。用于序列分析的GenBank序列见表2。

表2 用于系统进化及同源性分析的双生病毒来源及基因组序列Table 2 GenBank sequences used in phylogenetic and homology analysis
2 结果与分析
2.1样品检测
以番茄叶片总DNA为模板,利用引物F1/R1对采集的51个样品进行PCR检测,其中25个样品扩增得到约660bp特异条带,检出率为49%(表1)。
2.2DNA全序列特征及北京地区优势株系初步分析
选择代表性样品YQ11-1、PG11-4、SY13-2、DX13-1、DX13-9、FS13-2、FS13-3、FS13-5、FS13-10和TZ13-1等10个分离物进行全基因组序列测定,通过PCR扩增、克隆及测序,10个分离物基因组大小均为2 781bp(登录号见表4),具有典型的双生病毒基因组特征:闭合环状的单链DNA,共编码6个开放阅读框(ORF)。10个病毒分离物间同源率为99.41%,通过NCBI比对,与TYLCV同源性很高;经与TYLCV主要株系进行同源性比对发现(图1),这些来源于北京不同区县的病毒分离物与TYLCV-IL株系同源率高达99%,推断目前北京地区引起TYLCD的病原为TYLCV,优势株系为TYLCV-IL。

表3 样品采集信息及带毒情况Table 3 Sampling details and detection results of collected samples

表4 TYLCV北京分离物GenBank登录信息Table 4 GenBank accession numbers ofTYLCV isolates from Beijing

图1 TYLCV北京分离物与TYLCV主要株系的同源性分析Fig.1 Homology analysis between Beijing isolates and main overseas strains of TYLCV
2.3我国TYLCV分离物进化变异分析
将来自北京的10个TYLCV分离物全序列与我国其他地区TYLCV分离物全序列进行比对,发现其同源率高达98.94%,说明TYLCV在进化上比较保守。为进一步分析我国TYLCV分离物基因组变异情况,用DnaSP(Version5)对45个我国TYLCV分离物进行了全基因组的序列变异分析,发现整个基因组上的变异是不均匀的,最大变异峰值在IR区,另外1个变异峰值位于AC2和AC3的ORF的交叠处,最保守区段位于AC1ORF中间区域(图2)。

图2 我国TYLCV全基因组核苷酸变异分析Fig.2 Distribution of genetic variation estimated by nucleotide diversity(Pi)of TYLCV isolates in China
我国番茄黄化曲叶病毒病发生地域广,发生时间也各异,为进一步分析我国番茄黄化曲叶病毒的来源和进化情况,选择国内主要发病省市的TYLCV分离物、其他代表性的番茄双生病毒分离物以及国外代表性的TYLCV-Israel分离物,利用MEGA(Version5.05)软件neighbor-joining方法构建了系统进化树(图3)。
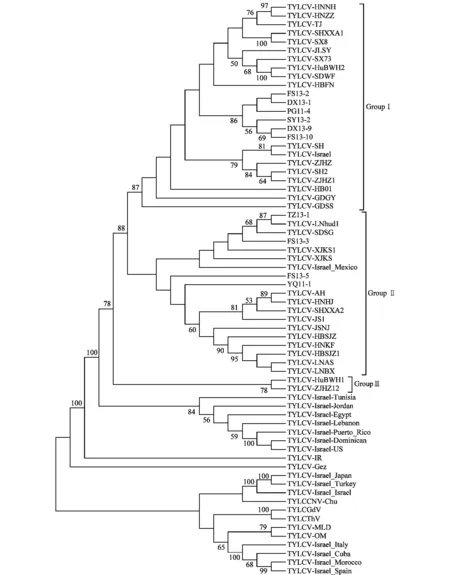
图3 基于侵染番茄的番茄黄化曲成病毒基因组序列构建的系统进化树Fig.3 Phylogenetic tree of the genomic sequences of TYLCV-infecting tomato isolates from China and other countries
从进化树看出:我国TYLCV分离物与TYLCV-IL株系处于同一分支,在进化树上可分为3个组群,从每个组群包括的不同地理区域初步分析出TYLCV入境我国的2条路线,第一条由广东一带入境,经过上海、浙江,逐步传入内陆湖北、河南、山东、河北、山西、北京及天津等地,第二条由江苏一带入境,逐步传入内陆安徽、河南、河北、山东、北京、辽宁、新疆等地;我国TYLCV分离物与墨西哥分离物(TYLCV-Israel_Mexico)亲缘关系最近,与亚洲国家约旦、黎巴嫩、非洲国家突尼斯、埃及、美洲波多黎各、多米尼加以及美国TYLCV-Israel分离物亲缘关系次之。我国另外3种重要的番茄双生病毒中,中国番茄黄化曲叶病毒云南分离物(TYLCCNV-Chu)与日本、土耳其以及以色列TYLCV-Israel分离物亲缘关系最近,广东番茄黄化曲叶病毒(TYLCGdV)广东分离物和泰国番茄黄化曲叶病毒(TYLCThV)云南分离物与TYLCV-MLD分离物、TYLCV-OM分离物、意大利、古巴、摩洛哥以及西班牙TYLCV-Israel分离物亲缘关系最近。
3 讨论
本试验对2011年-2013年采自于北京不同区县的疑似病毒感染的51个番茄样品进行了双生病毒的检测,阳性率为49%,说明北京地区番茄双生病毒危害依然很普遍;对部分代表性阳性样品进行了病毒全基因组扩增和序列测定,获得10个病毒分离物,序列分析显示,这些来源于北京不同区县的病毒分离物均与TYLCV-Israel株系同源性高,推测目前北京地区引起TYLCD的病原为TYLCV,优势株系为TYLCV-Israel株系。
北京的10个TYLCV分离物全序列与我国其他地区的35个TYLCV分离物全序列同源率为98.94%,利用DnaSP对共计45个TYLCV分离物进行全基因组序列变异分析后发现,TYLCV在进化上比较保守,而且整个基因组上的变异是不均匀的,最大变异峰值在IR区,另外1个变异峰值位于AC2和AC3的ORF的交叠处,最保守区段位于AC1ORF中间区域。
系统进化树中我国TYLCV分离物与TYLCV-IL株系处于同一分支,表明目前我国TYLCV种群仍以TYLCV-IL为优势株系;我国TYLCV分离物在进化树上可分为3个组群,从地理区域角度分析TYLCV入境我国的2条路线:广东路线和江苏路线,均由东部沿海一带入境,沿邻近省市向内陆蔓延,反映出依靠烟粉虱的迁徙以及频繁的苗木调运等由我国东南沿海地区向中部内陆逐渐扩散的过程;对于北京各区县的TYLCV毒源分析,大部分可能来源于广东路线,小部分来源于江苏路线;对我国TYLCV分离物与其他国家TYLCV分离物亲缘关系分析发现,我国TYLCV分离物与墨西哥分离物(TYLCV-Israel_Mexico)亲缘关系最近,与亚洲国家约旦、黎巴嫩、非洲国家突尼斯、埃及、美洲波多黎各、多米尼加以及美国TYLCV-Israel分离物关系次之,反映了TYLCV-IL种群的进化过程,由此也推测国家之间频繁的经济贸易可能是此类病毒长距离传播最为重要的一种方式。而对我国另外3种重要的番茄双生病毒亲缘关系分析中,中国番茄黄化曲叶病毒云南分离物(TYLCCNV-Chu)与日本、土耳其以及以色列TYLCV-Israel分离物亲缘关系最近,广东番茄黄化曲叶病毒(TYLCGdV)和泰国番茄黄化曲叶病毒(TYLCThV)云南分离物与TYLCV-MLD分离物、TYLCV-OM分离物、意大利、古巴、摩洛哥以及西班牙的TYLCV-Israel分离物亲缘关系最近,以上结果是否能反映侵染番茄的不同双生病毒间的变异演化过程,有待于进一步分析。
综上所述,TYLCV的发展与烟粉虱的迁徙和苗木贸易关系密切,因此加强苗木的检测和烟粉虱的防治对于控制该病害具有非常重要的意义。
[1]VarsaniA,Navas-CastilloJ,MorionesE,etal.EstablishmentofthreenewgenerainthefamilyGeminiviridae: Becurtovirus, EragrovirusandTurncurtovirus [J].ArchivesofVirology, 2014, 159(8): 2193-2203.
[2]LazarowitzSG,ShepherdRJ.Geminiviruses:Genomestructureandgenefunction[J].CriticalReviewsinPlantSciences, 1992, 11(4): 327-349.
[3]MorionesE,Navas-CastilloJ.Tomato yellow leaf curl virus,anemergingviruscomplexcausingepidemicsworldwide[J].VirusResearch, 2000, 71(1-2): 123-134.
[4]ZhouXueping,XieYan,TaoXiaorong,etal.CharacterizationofDNAβassociatedwithBegomovirusesinChinaandevidenceforco-evlutionwiththeircognateviralDNA-A[J].JournalofGeneralVirology, 2003, 84(1): 237-247.
[5]CuiXiaofeng,TaoXiaorong,XieYan,etal.ADNAβassociatedwithTomato yellow leaf curl China virusisrequiredforsymptominduction[J].JournalofVirology, 2004, 78(24): 13966-13974.
[6]FauquetC.M,BriddonR.W,BrownJ.K,etal.Geminivirusstraindemarcationandnomenclature[J].ArchivesofVirology, 2008, 153(4): 783-821.
[7]WuJianbing,DaiFuming,ZhouXueping.FirstreportofTomato yellow leaf curl virusinChina[J].PlantDisease, 2006, 90(10): 1359.
[8]何自福,虞皓,罗方芳.广东番茄曲叶病毒G3分离物基因组DNA-A的分子特征[J].植物病理学报,2005,35(3):208-213.
[9]GuoWei,YangXiuling,XieYan,etal.Tomato yellow leaf curl Thailand virus-[Y72]fromYunnanisamonopartiteBegomovirusassociatedwithDNAβ[J].VirusGenes, 2009, 38(2): 328-333.
[10]YangXiuling,GuoWei,MaXinying,etal.MolecularcharacterizationofTomato leaf curl China virus,infectingtomatoplantsinChina,andfunctionalanalysesofitsassociatedbetasatellite[J].AppliedandEnvironmentalMicrobiology, 2011, 77(9): 3092-3101.
[11]ZhangHui,HuGaojie,ZhouXueping.MolecularcharacterizationofTomato leaf curl Hainan virus,anewBegomovirusandevidenceforrecombination[J].JournalofPhytopathology, 2010, 158(11/12): 829-832.
[12]MugiiraRB,LiuShusheng,ZhouXueping.Tomato yellow leaf curl virusandTomato leaf curl Taiwan virusinvadeSouth-eastcoastofChina[J].JournalofPhytopathology, 2008, 156(4): 217-221.
[13]ZhangHui,MaXinying,QianYajuan,etal.MolecularcharacterizationandinfectivityofPapaya leaf curl China virusinfectingtomatoinChina[J].JournalofZhejiangUniversity(ScienceB), 2010, 11(2): 109-114.
[14]LiZhenghe,ZhouXueping,ZhangXi,etal.Molecularcharacterizationoftomato-infectingbegomovirusesinYunnan,China[J].ArchivesofVirology, 2004, 149(9): 1721-1732.
[15]赵统敏,余文贵,周益军,等.江苏省番茄黄化曲叶病毒病(TYLCD)的发生与诊断初报[J].江苏农业学报, 2007, 23(6): 654-655.
[16]李明远.黄化曲叶病毒病传入北京,番茄生产面临威胁[J].植物保护, 2009, 35(6): 179-180.
[17]余文贵,赵统敏,杨玛丽,等.山东、安徽两省栽培番茄烟粉虱传双生病毒的PCR检测及序列分析[J].江苏农业学报, 2009, 25(4): 747-751.
[18]周莹,李兴红,刘建华,等.河北省番茄黄化曲叶病毒病的分子鉴定初报[J].植物保护, 2010, 36(1): 60-64.
[19]金凤媚,薛俊,郏艳红,等.天津地区番茄黄化曲叶病毒DNA-A的克隆和序列分析[J].华北农学报, 2011, 26(1): 58-62.
[20]熊艳,杨帅,青玲,等.四川番茄黄化曲叶病病原分子鉴定及变异分析[J].中国农业科学, 2011, 44(3): 477-484.
[21]宋晰,师迎春,张世晨,等.北京地区番茄黄化曲叶病病毒分离物测定及株系的初步鉴定[J].植物病理学报, 2013, 43(2): 113-119.
(责任编辑:杨明丽)
IdentificationandevolutionaryanalysisofTomato yellow leaf curl virusisolatesinChina
ZhouYing1,ShangQiaoxia2,LuoChen1,QiaoGuanghang1,LiuMei1,ZhangWei1,YanJiye1
(1.InstituteofPlantandEnvironmentalProtection,BeijingAcademyofAgricultureandForestrySciences,Beijing100097,China; 2.PlantScienceandTechnologyCollege,BeijingUniversityofAgriculture,Beijing102206,China)
Tomatoyellowleafcurldisease(TYLCD)isanimportantdiseaseoftomatocausedbymanygeminiviruses.Ageminiviruswasfoundin25ofthe51samplescollectedinBeijing,andcompletegenomesequencesof10isolatesweredetermined.Allofthesequencescontained2 781nucleotidesencodingsixproteinsandsharedmorethan99%nucleotideidentitywithTomato yellow leaf curl virus-Israel(TYLCV-IL).GeneticanalysisbasedonthegenomesequenceofTYLCVisolatesinChinarevealedthatTYLCVhadlittlegeneticvariability,andphylogeneticanalysesshowedthattheyclusteredintothreegroups.
identificationofgeminivirus;geneticvariationofgenome;phylogeneticanalysis
2015-01-15
2015-03-25
公益性行业(农业)科研专项(201003065);北京市农林科学院青年科研基金(QNJJ201320)
E-mail:jiyeyan@gmail.com
S432.4
ADOI:10.3969/j.issn.0529-1542.2016.01.018

