延胡索内生真菌的分离鉴定及产功能酶菌株的初步筛选
马韦韦, 邓百万,2, 陈文强,2
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西省食药用菌工程技术研究中心, 陕西 汉中 723000)
延胡索内生真菌的分离鉴定及产功能酶菌株的初步筛选
马韦韦1,邓百万1,2,陈文强1,2
(1.陕西理工大学 生物科学与工程学院, 陕西 汉中 723000;2.陕西省食药用菌工程技术研究中心, 陕西 汉中 723000)
采用纯培养分离方式获得纯化延胡索内生真菌菌株,通过形态学特征、ITS rDNA序列分析对分离菌株进行鉴定,利用6种培养基筛选出代谢产功能酶菌株。分离获得312株内生真菌,可归类于9个属,其中镰刀菌属是优势类群。对已测序的30株内生真菌产酶活性研究表明20株试验菌株产纤溶酶,18株产复合酶,16株产碱性蛋白酶,10株产接触酶,1株产纤维素酶;其中4株内生真菌可代谢产生4种不同功能酶,为代谢产多酶系菌株。延胡索内生真菌的分离鉴定及产功能酶菌株的筛选不仅丰富了内生真菌资源,而且也为获得新颖结构化合物提供理论基础。
延胡索;内生真菌;分离鉴定;功能酶
延胡索(Corydalisyanhusuo)又名延胡、玄胡索、元胡索等,罂粟科、紫堇属多年生草本植物,块茎球形,花瓣紫红色,蒴果圆柱形,两端渐狭,夏季开花,性味辛、苦、温,入肝、胃经,有活血、散瘀、理气、止痛功效[1]。
植物内生真菌(Endophyte fungi)是指在某一时期生活在植物各种组织和器官的细胞间或细胞内,但对宿主植物组织不引起明显病害症状的、与宿主植物建立和谐关系的一类真菌[2]。植物与内生真菌之间是互惠共生关系,一方面植物为内生真菌提供光合产物和矿物;另一方面内生真菌的代谢物能刺激植物的生长发育,提高宿主植物对生物胁迫和非生物胁迫的抵抗能力[3]。植物内生真菌早已成为当代微生物资源研究的热点[4]。相关研究表明内生真菌可代谢产生一些具有抗癌、抑菌、抗氧化等生物活性物质,以及酶活性物质[5]。另有研究发现植物内生真菌生产次生代谢产物的优势可消除植物资源生产周期长、产量低、不可再生的限制[6]。目前,关于其应用的研究主要集中在活性物质生产、经济作物种植、环境保护、卫生保健等方面[7],对于内生真菌产酶活性方面的研究甚少。植物内生真菌的系统研究,不仅有助于丰富内生真菌资源,而且有助于拓展我国尚处于基础阶段内生真菌应用的研究,保护野生植物资源[8-9]。近年来,森林砍伐,生态环境遭到破坏,使野生延胡索的栖息地逐渐缩小,其赖以生存的条件正逐渐丧失[10]。野生延胡索资源的急剧减少也意味着内生真菌资源将会大量消失。
本研究以野生延胡索为实验材料,对其内生真菌进行分离鉴定,并以内生真菌生物活性和功能酶的初步筛选为主要研究内容,为开发利用其潜在价值奠定理论基础。
1 材料与方法
1.1材料
1.1.1样品采集
2014年8月采自陕西城固野生延胡索全株,取其块茎,晾干后放入密封袋内4 ℃低温冷藏备用。
1.1.2培养基
(1)分离培养基:综合马铃薯培养基(g/L):马铃薯200.0,葡萄糖20.0,MgSO4·7H2O 3.0,KH2PO45.0,维生素B1 0.01,琼脂20.0,pH自然。
(2)产功能酶筛选培养基:
①纤溶酶筛选培养基[11](g/L):麦芽糖15.0,酪蛋白10.0,NaCl 15.0,琼脂20.0,pH 7.2~7.4。
②接触酶筛选培养基[12](g/L):马铃薯200.0,葡萄糖20.0,MgSO4·7H2O 3.0,KH2PO45.0,维生素B1 0.01,琼脂20.0,pH自然,灭菌后冷却至50 ℃,加入过氧化氢溶液至浓度为5.0 mmol/L。
③羧甲基纤维素钠(CMC-Na)培养基(g/L)[13]:CMC-Na 10.0,MgSO4·7H2O 0.5,KH2PO41.0,Na2HPO41.0,蛋白胨10.0,酵母浸粉5.0,pH 7.2~7.4。染色液:1.0mol/L刚果红溶液;脱色液:1.0 mol/L NaCl溶液。
④壳聚糖酶筛选培养基[14](g/L):水溶性壳聚糖10.0,(NH4)2SO45.0,酵母提取物1.0,K2HPO4·3H2O 20.0,MgSO4·7H2O 1.0,NaCl 5.0,琼脂20.0,pH 6.5。
⑤碱性蛋白酶筛选培养基[15-17](g/L):蛋白胨10.0,葡萄糖1.0,CaCl20.1,酪氨酸0.1,酪素5.0,琼脂22.0,pH 8.5~9.0。
⑥复合酶筛选培养基[18](g/L):NaNO33.0,KCl 0.5,FeSO4·7H2O 0.01,K2HPO41.0,MgSO4·H2O 0.5,蔗糖30.0,干酪素10.0,琼脂15.0,pH 6.0~6.5。
1.1.3试剂与仪器
DNA marker(DL2000)、2×Taq PCR Mix,上海生工;其他试剂均为国产分析纯。全自动化学发光和荧光凝胶成像系统(Alliance 4.7),英国UVItec公司;PCR扩增仪(Mycycler),美国Bio-Rad;高级研究显微镜(E600),日本Nikon公司,移液器,游标卡尺,解剖刀等。
1.2方法
1.2.1菌株分离保藏
采集无霉变野生延胡索块茎自来水冲洗干净晾干,进行表面消毒(75%酒精漂洗30 s,无菌水洗4次;10% NaClO溶液漂洗3 min,无菌水冲洗4次;重复第一步操作),移液器吸取200 μL最后一次洗涤水涂布到综合马铃薯培养基平板上,28 ℃培养7 d,观察是否有菌落长出,以检测消毒效果是否彻底。
用无菌滤纸吸干延胡索块茎表面水分后,将其切成1 mm×5 mm×5 mm的组织块,每3块做一次重复接种到综合马铃薯培养基平板上。每隔8 h观察菌落形态变化,应用组织分离法,根据菌落形态、颜色、生长速度对延胡索内生真菌进行分离,直至获得单一纯化菌株,保藏到PDA斜面,4 ℃保藏备用。
1.2.2内生真菌分类鉴定及系统发育树的构建
利用综合马铃薯培养基进行菌株活化复壮,28 ℃倒置培养4~5 d,观察菌丝颜色、菌落大小、菌落边缘、基质颜色等特征。应用插片法,经乳酸石炭酸棉兰染色后,在显微镜下观察菌丝有无横隔、孢子形态、产孢结构特征等微观特征,进行初步形态学鉴定。
选取培养4~5 d的菌株,应用CTAB法[19]提取基因组总DNA。选用ITS1、ITS4引物,通过PCR扩增rDNA ITS基因片段。PCR扩增体系为25 μL体系:2×PCR Mix试剂15.0 μL、引物(10 μmol/L)各1.0 μL、无菌超纯水10.0 μL、模板3.0 μL。PCR扩增反应条件:95 ℃,4 min;94 ℃,1 min;55 ℃,40 s;72 ℃,1 min,33个循环;72 ℃,10 min;4 ℃,60 min。PCR扩增产物经1%琼脂糖凝胶电泳检测后,样品送交上海生工生物科技有限公司进行正向测序。
测序所得菌株18S rDNA ITS序列提交到GeneBank进行BLAST比对,确定与测序菌株亲缘关系最近的种属,并选取同源性最高的菌株,应用Mega 6.06软件进行ClustalW比对分析,参考张丽娜等[20]的邻接法构建系统发育树。
1.2.3产功能酶菌株的初步筛选
采用透明圈法,应用纤溶酶、纤维素酶、碱性蛋白酶、复合酶、接触酶、壳聚糖酶培养基筛选代谢产功能酶菌株。每个培养基平板接种两块大小相同的活化菌块,每个菌株做3次平行对照,28 ℃培养24 h。分别测量记录透明圈直径与菌落直径,计算两者差值D。
2 结果与分析
2.1表面消毒效果检测
采用1.2.1菌株分离保藏中所述表面消毒方法,表面消毒效果检测结果如表1所示。

表1 表面消毒效果检测
注:*表示难以计数;+++表示10个菌落以上;++表示5—10个菌落;+表示
5个菌落以内;-表示无菌落。
表1结果显示,随着消毒时间的延长或消毒剂浓度的增加,消毒效果越明显;使用质量分数为3.0%、5.0% NaClO溶液消毒,接种最后一次洗涤水,结果显示杂菌落数量均在5个以上,对消除野生延胡索表面附生菌的效果不佳;当NaClO溶液质量分数为10.0%时间延长到3.0 min时,无杂菌长出,为最佳消毒方法。
2.2延胡索内生真菌的分离及鉴定
对30株不同形态菌株显微观察结果显示,野生延胡索内生真菌菌丝体发达,多分枝,多为深色菌丝,其中22株内生真菌具有隔菌丝,11株内生真菌产有隔分生孢子,分生孢子座多呈球状。结合18S rDNA ITS序列分析可知30株野生延胡索内生真菌中半知菌类(Deuteromycetes)20株,约占66.67%,子囊菌纲(Ascomycetes)5株,约占16.67%,接合菌纲(Zygomycetes)2株,约占6.67%,异担子菌纲(Heterobasidiomycees)、粪球壳纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)各1株,分别约占3.33%。具体形态特征见表2。
2.3基于18S rDNA ITS序列的系统发育分析
野生延胡索内生真菌ITS序列与NCBI数据库已知ITS序列同源性均在99%~100%之间,可以归类于子囊菌门、担子菌门、接合菌门、半知菌类中的9个属。其中镰刀菌属(Fusarium)为优势类群,约占73.68%,其次为曲霉属(Aspergillus)约占7.69%,赤壳属(Nectria)、毛霉属(Mucor)、木耳属(Auricularia)、青霉属(Penicillium)、链格孢属(Alternaria)、根霉属(Rhizopus)、散囊菌属(Eurotiomycetes)均约占2.66%。系统发育树中可见编号为YH-65(KP903486)、YH-132(KP903496)、YH-135(KP903498)的延胡索内生真菌分属于木耳属、根霉属、毛霉属,处于相同分类地位,具有高度同源性;同时可见YH-102(KP995447)、YH-214(KP903538)共同形成一个较大的分支,显示了高度同源性;此外,YH-203(KP903533)、YH-215(KP903539)可归类于子囊菌纲,又分别与Eurotiomycetessp.TC50a、Aspergillusflavus聚在一枝,表明高等真菌进化地位越高,同源性差异越明显。系统发育树见图1。
2.4延胡索内生真菌产酶活性研究
野生延胡索内生真菌多数具有良好的代谢产酶活性,部分菌株具有代谢产多酶系特性,筛选到的功能酶有纤溶酶、纤维素酶、碱性蛋白酶、复合酶、接触酶,研究中未发现产壳聚糖酶菌株。30株研究菌株有20株代谢产纤溶酶,分别各有1株菌株可归类于根霉属、赤壳属、散囊菌属,2株曲霉属内生真菌,15株镰刀菌属内生真菌;18株代谢产复合酶的内生真菌包括1株木耳属内生真菌,1株赤壳属内生真菌,2株曲霉属内生真菌,14株是镰刀菌属内生真菌;产碱性蛋白酶菌株有16株,其中1株曲霉属内生真菌,1株根霉属内生真菌,14株镰刀菌属内生真菌;10株代谢产接触酶,链格孢属、毛霉属、曲霉属各有1株,7株属于镰刀菌属;1株青霉属内生真菌在纤维素酶初筛中出现明显透明圈。编号为YH-159、YH-206、YH-214、YH-217的镰刀菌属真菌(Fusarium)代谢产多酶系,筛选结果显示均可产4种不同的功能酶。30株野生延胡索内生真菌产酶活性筛选结果见表3。
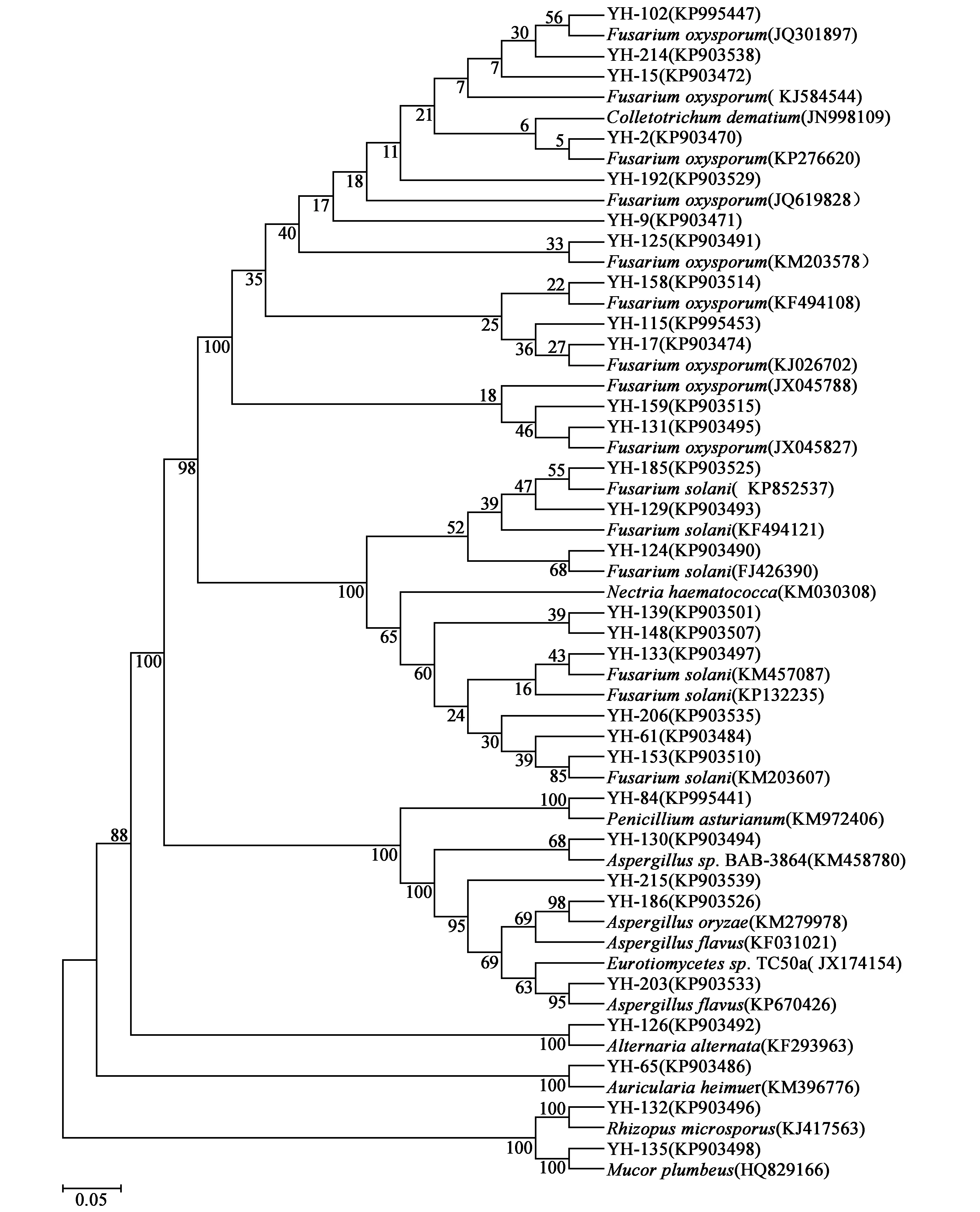
注:发育树节点数值表示Brootstrap值,括号中为各菌种的GeneBank登录号,线段0.05表示序列差异的分支长度。图1 基于野生延胡索30株内生真菌rDNA ITS序列构建的系统发育树
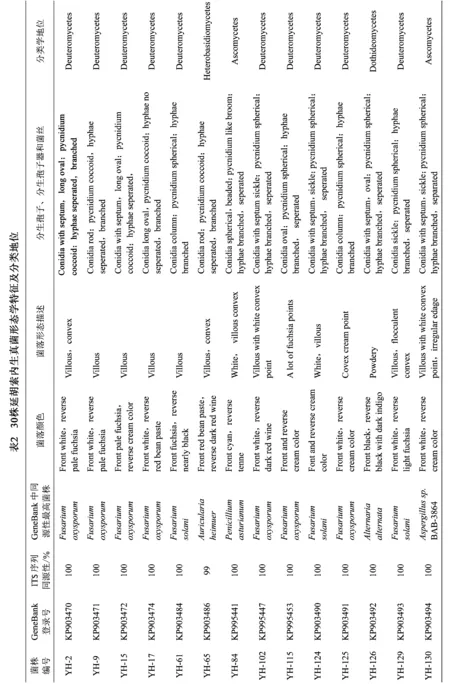
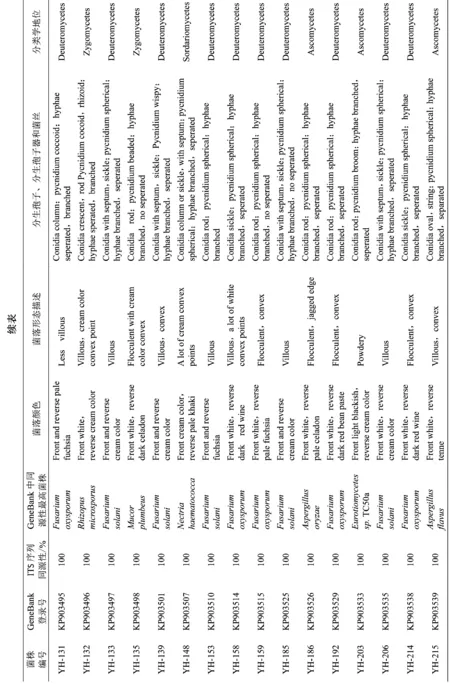

表3 产功能酶菌株透明圈测量数值
注:+表示0 表示15 本研究共分离获得野生延胡索内生真菌312株,经形态学特征和18S rDNA-ITS序列分析,可归类为9个属,每个属产功能酶情况各不相同。代谢产功能酶菌株筛选结果表明,野生延胡索内生真菌具有优良的产酶特性。高占争等[21]的报道显示国内外对纤溶酶的研究多集中于霉菌、枯草芽孢杆菌等,研究发现镰刀菌属植物内生真菌也代谢产纤溶酶。曲霉属、青霉属真菌[22]是研究纤维素酶的热点,野生延胡索内生真菌中简青霉(Penicilliumasturianum)代谢产纤维素酶活性较强。王栋等[23]研究米曲霉可产中性蛋白酶,此次分离到的米曲霉具有较高代谢产碱性蛋白酶活性,同曲霉属另一株曲霉在初筛中显示出更高的碱性蛋白酶活力。国内对根霉产蛋白酶的报道多集中于酸性蛋白酶[24],野生延胡索根霉分离株可代谢产碱性蛋白酶,并且多数镰刀菌属内生真菌代谢产碱性蛋白酶。复合酶是与单一酶相对的概念,是工业生产中应用广泛的催化剂,陈国参等[25]研究发现一株代谢产复合酶黑曲霉菌株,这种酶也是野生延胡索镰刀菌属内生真菌所产主要功能酶之一,此前国内尚无关于植物内生真菌代谢产复合酶的报道。笔者实验中改进了张增祥等[12]的研究方法,筛选出镰刀菌属内生真菌代谢产接触酶的菌株。 综上所述,笔者应用组织分离方法,结合形态学和ITS rDNA序列分析将30株研究菌株归类到9个属,接下来将进一步开展野生延胡索内生真菌次生代谢产物研究,以期能够早日实现野生延胡索内生真菌潜在价值的应用。 [1]张宏达,黄云晖,缪汝槐,等.种子植物系统学[M].北京:科学出版社,2006:172. [2]STIERLE A,STROBELG,STIERLE D.Waxol and taxane production by Taxom yces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260:214-216. [3]任安芝,高玉葆.植物内生真菌——一类应用前景广阔的资源微生物[J].微生物学通报,2001,28(6):90-93. [4]王志伟,纪燕玲,陈永敢,等.禾本科植物内生真菌资源及其物种多样性[J].生态学报,2010,30(17):4771-4781. [5]曾培源,吴锦忠.国外植物内生真菌活性物质的研究进展[J].海峡药学,2010,22(11):9-13. [6]孙奎.药用植物内生真菌的研究进展[J].青海农林科技,2010(1):26-28. [7]徐玲玲,单庆红,郭斌.植物内生菌研究进展及应用展望[J].安徽农业科学,2013,41(13):5641-5643. [8]STROBEL G,DAISY B.Bioprospecting for microbial endophytes and their natural products[J].Microbiology and Molecular Biology Reviews,2003,67(4):491-502. [9]姚玉秀,魏希颖.药用植物内生真菌生物活性及其活性成分研究[J].药物生物技术,2011,18(2):185-188. [10]许翔鸿,余国奠,王峥涛.野生延胡索种质资源现状及其质量评价[J].中国中药杂志,2004,29(5):399-401. [11]刘彩萍.产纤溶酶菌DC-YJ11的筛选鉴定,混合发酵优化及纤溶酶的分离纯化[D].广州:华南理工大学,2011. [12]张增祥,王伟,郝建华,等.产过氧化氢酶菌株CE-1的筛选与鉴定[J].海洋科学,2010,34(11):54-58. [13]王贤丰,单洪伟,张家松,等.从海水环境分离筛选甘蔗渣纤维素降解菌[J].微生物学通报,2015,42(6):981-989. [14]王艳君,卓少玲,陈盛,等.产壳聚糖酶菌株的筛选、鉴定及酶学特性分析[J].微生物学通报,2012,39(12):1734-1745. [15]黄继翔.产碱性蛋白酶芽孢杆菌的鉴定[J].微生物学通报,2011,38(2):157-163. [16]梅承芳.产碱性蛋白酶菌株VibriometschnikoviiDL 33-51[D].青岛:中国海洋大学,2004. [17]张剑,赵雷敏,康林霞.碱性蛋白酶活力分析方法研究[J].日用化学工业,2012,42(3):192-195. [18]曲佳,刘开辉,丁小维,等.南海局部海洋沉积物中真菌多样性及产酶活性[J].微生物学报,2014,54(5):552-562. [19]陈锋菊,李百元,杨冰,等.一种经济快速提取丝状真菌基因组DNA的方法[J].生命科学研究,2010,14(2):122-124. [20]张丽娜,荣昌鹤,何远,等.常用系统发育树构建算法和软件鸟瞰[J].动物学研究,2013,34(6):640-650. [21]高占争.微生物产纤溶酶的研究[D].无锡:江南大学,2006. [22]麦国琴,许晓萍,余翠媚,等.产木聚糖酶和纤维素酶真菌的酶学性质分析[J].食品研究与开发,2011,32(9):179-183. [23]王栋,冯杰,郑志永,等.酱油发酵用2种米曲霉中性蛋白酶的酶学性质比较[J].食品与生物技术学报,2012,31(5):473-485. [24]张美香.根霉源酸性蛋白酶的初步研究[D].郑州:河南工业大学,2011. [25]陈国参,刘德海,解复红,等.一株产复合酶真菌菌株的筛选、鉴定及发酵产酶研究[J].中国酿造,2012,31(9):70-74. [责任编辑:张存凤] Preliminary screening of endophyte fungi with functional enzyme activity inCorydalisyanhusuo MA Wei-wei1,DENG Bai-wan1,2,CHEN Wen-qiang1,2 (1.School of Bioscience and Engineering, Shaanxi Sci-Tech University, Hanzhong 723000, China;2.Engineering Technology Research Center of Edible and Medicinal Fungi in Shaanxi Province,Hanzhong 723000,China) The isolation and identification of endophyte fungi inCorydalisyanhusuo, preliminary screening of strains functional enzyme activity. Strains were isolated by pure culture method and classified on the basis of morphological characters and 18S rDNA gene sequence analysis. The total number of isolates was 312. Morphology and ITS sequence analysis classified these stains into 9 genera, of which the dominant population wasFusarium. Research on functional enzyme activity displayed 20 strains with fibrinolytic enzyme activity, 18 strains with compound enzyme activity, 16 strains with alkaline protease activity, 10 strains with catalase activity, 1 strains with cellulase activity, but no strains with chitosanase activity. It was worthy to say 4 strains with 4 kinds of different functional enzyme activity were high efficient enzyme production strains. The isolation and identification of endophytic fungi withinCorydalisyanhusuo, screening of strains enzyme activity did not only enrich the resources of endophyte fungi, but also provided basis for mining novel stunctional compound. Corydalisyanhusuo;endophyte fungi;isolation and identification;functional enzyme 1673-2944(2016)04-0065-08 2016-03-17 2016-06-13 陕西省“13115”科技创新工程计划项目(2008ZDGC-04) 马韦韦(1989—),女,山东省邹平县人,陕西理工大学硕士研究生,主要研究方向为微生物种质资源的保护与开发利用;[通信作者]邓百万(1963—),男,陕西省眉县人,陕西理工大学教授,硕士生导师,主要研究方向为微生物种质资源的保护与开发利用;陈文强(1956—),男,陕西省洋县人,陕西理工大学教授,硕士生导师,主要研究方向为微生物资源的保护与利用。 Q949.32 A3 讨 论

