棕榈酸与油酸影响肝细胞功能的比较研究
刘 萌,吴永沛,刘翼翔,陈海秀
(集美大学食品与生物工程学院,福建厦门 361021)
棕榈酸与油酸影响肝细胞功能的比较研究
刘萌,吴永沛,刘翼翔*,陈海秀
(集美大学食品与生物工程学院,福建厦门 361021)
膳食中不平衡的脂肪酸摄入导致一系列慢性代谢综合征的产生,严重威胁人体健康。以体外肝细胞模型为研究对象,以细胞增殖、细胞膜完整性、炎症产生水平及胞内脂质累积为指标,通过比较油酸和棕榈酸对肝细胞功能的影响,以期评估过量膳食脂质对人体健康的影响,减少慢性病的产生。结果表明不同膳食脂肪酸对肝细胞的影响明显不同:棕榈酸的细胞毒性大,抑制细胞的增殖,破坏细胞膜的完整性,容易导致肝炎发生;油酸则更容易导致肝细胞脂质累积,引起脂代谢异常;复合脂肪酸(油酸∶棕榈酸的摩尔比为2∶1)的细胞毒性有所下降,但仍然容易导致肝细胞脂肪变性。实验结果为合理的膳食摄入油脂提供了理论依据。
脂肪酸,肝细胞,脂质累积,油酸,棕榈酸
近年来我国居民生活水平不断提高,膳食中杂粮摄入量减少,油脂摄入量明显增高,不平衡的油脂摄入致使脂代谢紊乱,肥胖、脂肪肝、心血管疾病等健康问题日益明显。研究表明[1],过量油脂摄入会引起血浆脂肪酸水平升高,刺激脂质合成基因表达,导致肝细胞脂质过量蓄积而形成脂肪肝。
大量研究表明[2],不同脂肪酸对人体健康有着不同的影响。日常饮食中存在最多的脂肪酸是棕榈酸(palmitic acid,PA,16∶0)和油酸(oleic acid,OA,18∶1)[3]。PA多存在于动物性脂肪中,如牛油、奶油、猪油和黄油等。PA对胰腺β细胞、心肌细胞、乳腺癌细胞等有较强的脂毒性,可启动内质网应激诱导细胞凋亡[4]。OA几乎存在于所有的植物油和动物脂肪中,其中以红花籽油、橄榄油、棕榈油、低芥酸菜子油、花生油、茶籽油、杏仁油和鱼油中含量最高。OA具有降低血液总胆固醇和低密度脂蛋白胆固醇、升高高密度脂蛋白胆固醇的生理功能。然而,过量OA也会导致肝细胞脂质累积[5]。
虽然人们在膳食脂肪酸的脂代谢途径方面进行了大量的研究[6-7],但忽视了脂肪酸对肝细胞功能的影响。因此,本实验以常见膳食油脂中的主要脂肪酸为研究对象,从膳食营养角度评估脂肪酸对肝细胞增殖能力、细胞膜完整性、炎症产生情况及胞内脂质累积方面的影响,为居民膳食油脂的合理摄入提供理论依据。
1 材料与方法
1.1材料和仪器
HepG 2细胞株厦门大学生命科学学院,实验所用其它试剂均购自Sigma公司。谷丙转氨酶(ALT)试剂盒、谷草转氨酶(AST)试剂盒、甘油三酯(TG)含量试剂盒南京建成;乳酸脱氢酶(LDH)试剂盒、蛋白浓度试剂盒碧云天试剂公司;油红O阿拉丁网站。
二氧化碳培养箱Thermo公司;酶标仪Tecan公司;漩涡震荡仪IKA公司。
1.2实验方法
1.2.1细胞培养HepG 2细胞用含10%胎牛血清的DMEM高糖培养基培养,置于37 ℃,5%二氧化碳培养箱中,隔天换液,细胞铺满瓶底80%左右,用0.25%胰酶消化传代。调整细胞密度后接于96孔板和24孔板,待细胞长至80%左右,以不同浓度脂肪酸诱导处理24 h,然后测定细胞存活率,ALT、AST释放量,细胞TG累积程度,并用油红O染色观察细胞内脂滴形态。
1.2.2脂肪酸的配制由于OA与PA在日常饮食中主要以2∶1的比例存在[3],因此将复合脂肪酸FA中的OA与PA的摩尔比定为2∶1。将所需剂量的脂肪酸用乙醇助溶,溶于pH为10的含一定量牛血清白蛋白的不完全DMEM培养基中,超声溶解,最后将复合物溶液pH调为7.4,0.22 μm膜过滤分装,-20 ℃贮存。
1.2.3细胞存活率的测定24 h培养后,移去上清,于各孔加入一定量的0.5 mg/mL的MTT溶液,之后继续置于37 ℃的培养箱中培养4 h,加入DMSO终止反应,震荡培养板,酶标仪测定OD570值,以OD620值为参考。以正常对照组细胞活力设为100%,各处理组与对照组的比值为细胞存活率。
1.2.4LDH含量的测定LDH释放被看做细胞膜完整性的重要指标,细胞凋亡或坏死而造成细胞膜结构的破坏会导致细胞浆内的酶释放到培养液中[8]。采用商业LDH试剂盒测定,并按试剂盒操作步骤测定细胞上清液中LDH含量,结果以OD值表示。
1.2.5细胞ALT、AST的测定参照试剂盒测定方法,做出标准曲线,结果以U/L表示。
1.2.6尼罗红荧光测定TG累积参照Donato[9]的方法,并进行改进。24 h培养后,移去上清,以PBS冲洗2次,0.25%胰酶消化,消化完全后加入完全培养基,吹打细胞,3000 r/min离心5 min,弃上清,加适量1 μmol/L的尼罗红溶液,充分混匀,避光37 ℃孵育15 min,3000 r/min离心5 min,弃上清,加适量PBS,混匀,在激发波长488 nm,发射波长550 nm处测定荧光值。
4D技术是将模型同施工有效连接起来,利用立体模型对整个施工流程实施模拟操作,将各环节施工模型和施工计划导入到系统中,实行施工进度的模拟分析,这样一方面能够及时调整施工计划,另一方面也便于工作人员掌握施工预算等信息。
1.2.7油红O染色染色液的配制:称取一定量油红O溶于异丙醇中,室温静置2 h后过滤,配制成0.5%的油红O贮备液。使用前按照油红O和蒸馏水的比例为3∶2的比例稀释贮备液,室温静置后过滤两次,即为油红O染色液。
24 h培养后,移去上清,以PBS冲洗2次,75%酒精固定15 min,再用PBS冲洗2次,用60%异丙醇媒染1~2 min,用油红O染色30 min,蒸馏水冲洗2次,于倒置显微镜下观察拍照。
1.2.8数据分析通过excel软件对数据进行分析作图,实验结果以平均值±标准误差(Mean±SD)表示。
2 结果与分析
2.1脂肪酸处理对细胞增殖的影响
活细胞线粒体中的琥珀酸脱氧酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能。DMSO能溶解细胞中的甲瓒,通过测定其光吸收值,可间接反映活细胞数量[10]。我们评价样品处理浓度对细胞增殖的影响遵从以下几个条件:处理组和对照组的存活率差异在10%以内时即大于90%时,则认为处理组浓度对细胞增殖无影响,存活率在80%~90%范围内认为处理组浓度对细胞是有一定影响,如果存活率低于80%时认为处理组浓度对细胞有毒害作用[11]。从图1中可以看出,细胞增殖率随着OA、FA浓度的增加而逐渐增加,在OA浓度为0.50 mmol/L时达到了96.90%,FA诱导浓度为0.25 mmol/L时,细胞存活率达到了95.35%,对细胞均无毒性影响。然而细胞增殖率则随着PA浓度的增加而降低,即使是在PA较低浓度0.10 mmol/L时,增殖率也只有82.25%,活细胞数明显减少,对于细胞增殖有一定影响。这一点与田晓媛[1]研究结果相似。同一处理浓度下,单不饱和脂肪酸OA诱导的细胞存活率要远高于饱和脂肪酸PA诱导的存活率,这也从侧面一定程度上证明了摄入过多的脂肪酸时,PA的毒性要大于OA。
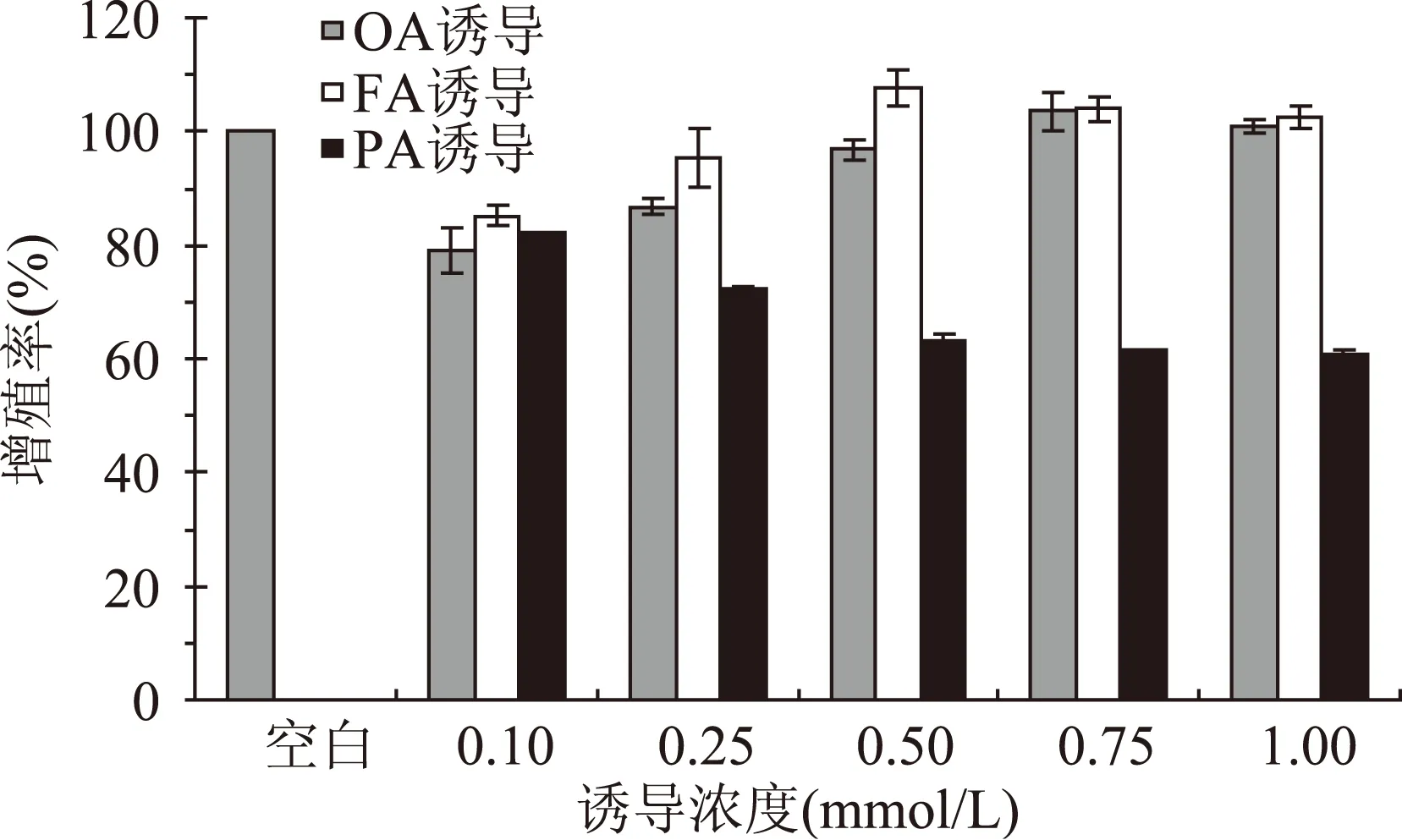
图1 脂肪酸处理下的细胞增殖情况Fig.1 The effect of fatty acid treatment to cell proliferation(n=5)
2.2细胞膜完整性的测定

图2 细胞膜完整性的测定Fig.2 The integrity of cell membrane(n=5)
2.3细胞内炎症水平的产生测定
ALT主要存在于肝细胞浆内,只要有1%的肝细胞坏死,就可以使血清酶增高一倍。因此,ALT被世界卫生组织推荐为肝功能损害最敏感的检测指标。AST则主要存在于肝细胞线粒体内,当肝脏细胞发生严重坏死或破坏时,血清AST水平显著升高。因此,ALT和AST水平是用于判定肝细胞炎症发生的关键生化指标[12]。表1表明,与空白组相比,OA组在0.1~0.75 mmol/L各浓度范围内ALT和AST水平均无显著性差异;当诱导浓度达到1.00 mmol/L时,细胞培养液中ALT水平提高了14.30%。PA处理中,当诱导浓度在0.10 mmol/L时,ALT水平已经达到空白组的1.14倍,AST达到空白组1.40倍,表明细胞已经出现炎症。对于OA与PA以摩尔比1∶2混合得到的复合脂肪酸FA,当诱导浓度≤0.75 mmol/L时,细胞上清液ALT水平变化不明显,仅在1.00 mmol/L的浓度下AST水平显著增高。对比三种脂肪酸处理,可明显看出PA更易使肝细胞出现炎症,这一点与Ricchi[13]等人报道一致。

表1 ALT和AST水平Table 1 The content of ALT and AST(n=5)
注:a,b,c,d代表显著性差异(p<0.05),相同字母则表示没有显著性差异。
2.4脂肪酸处理对胞内TG累积影响
在临床上,TG累积常作为脂肪肝病理发生的关键指标。实验中我们采用改良后的尼罗红染色荧光测定胞内TG累积作为量化标准。尼罗红是一种重要的亲脂性染料,能够与活体细胞内的中性脂或其他脂类物质发生反应,经常被用做胞内脂肪含量的荧光检测染色,与细胞中中性脂反应后,在激发光波长450~550 nm,发射光波长大于528 nm时,在荧光显微镜下观测到的是金黄色荧光;极性脂与尼罗红反应后,在激发光波长515~560 nm,发射光波长大于590 nm时,可观测到红色荧光[14]。

图3 细胞内TG累积Fig.3 Intracellular accumulation of TG(n=5)注:上图为OA和FA诱导的细胞内TG累积, 下图为PA诱导的胞内TG累积。
实验测得脂肪酸诱导处理后各组细胞内TG水平如图3所示。上图显示,在0.01~0.50 mmol/L浓度范围,随着OA与FA诱导浓度的增大,所测得的荧光强度逐渐上升,表明胞内TG累积量增加,表现出剂量依赖性。OA处理组在0.50 mmol/L诱导浓度下,TG累积的荧光强度是空白的6倍,FA处理组在0.50 mmol/L诱导浓度下,TG累积的荧光强度是空白的5倍。当OA与FA的诱导浓度升高至1.00 mmol/L时,荧光强度出现下降,这可能是由于高剂量OA与FA导致肝细胞数量下降的原因造成的。而PA处理组在0.01 mmol/L诱导浓度下,TG累积的荧光强度是空白的1.40倍。随着诱导浓度升高,TG累积并没有明显变化。

图4 脂肪酸浓度对细胞脂滴沉积影响Fig.4 The effect of fatty acid concentrations to cell lipid droplets deposition
有研究表明,在高血脂、肥胖、糖尿病等疾病状态下,人体血浆自由脂肪酸的浓度在0.5 mmol/L以上[15],通过以上研究比较,我们发现对细胞内脂质累积影响最大的是0.50 mmol/L的OA处理组,与报道基本一致[16]。
2.5脂肪酸处理后的油红染色细胞形态学观察
肝细胞经脂肪酸诱导处理后采用油红O染色,置于400倍倒置显微镜下观察,结果如图4所示。空白组中细胞边缘清晰,胞浆丰富,核膜完整,未见有红色脂滴沉积。随着诱导浓度的增大,细胞内红色脂滴数量逐渐增多。在0.50 mmol/L各处理组中,均可见明显的红色脂滴环绕于细胞周围,继续增大诱导浓度,则发现PA诱导组视野里的细胞数逐渐减少,这与细胞存活率和LDH、ALT和AST含量变化规律一致,证明了PA有较大的毒性,抑制了细胞的生长,加速了细胞的破裂。在0.75 mmol/L各处理组中,红色脂滴数量增多,部分胞内红色脂滴融合变大,脂滴呈现典型的印戎样,细胞轮廓较为清晰。在1.00 mmol/L各处理组中,视野内细胞有些减少,脂滴仍然大量累积变大,细胞边缘模糊,此时胞内脂肪变性。
3 结论
实验结果表明,膳食中的饱和脂肪酸PA对肝脏细胞的毒性要远大于单不饱和脂肪酸OA和复合脂肪酸FA。过量PA能抑制肝细胞生长,使细胞膜破裂,导致肝细胞TG累积和炎症的产生。相对PA而言,OA和FA则对肝细胞没有明显毒害作用,但更易导致胞内脂质累积,说明过量单不饱和脂肪酸会加重肝细胞脂代谢负担,导致脂肪肝的发生。因此,健康膳食油脂中应减少饱和脂肪酸PA的比例,控制单不饱和脂肪酸的摄入量,使各种脂肪酸达到合理的比例,从而避免对肝细胞功能造成伤害。
[1]田晓媛. SREBP-1c在膳食脂肪酸调节肝细胞脂代谢中的作用[D]. 重庆:第三军医大学,2012.
[2]Storlien LH,Higgins JA,Thomas TC,et al. Diet composition and insulin action in animal models[J]. Journal of Nutritional Biochemistry,2000,83 Suppl 1:S85-90.
[3]Baylin A,Kabagambe EK,Siles X,et al. Adipose tissue biomarkers of fatty acid intake[J]. The American Journal Clinical Nutrition,2002,76:750-757.
[4]Fan JG,Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China[J]. Journal of Hepatology,2009,50:204-210.
[5]Rivellese AA,Maffettone A,Vessby B,et al. Effects of dietary saturated,monoun-saturated and n-3 fatty acids on fasting lipoproteins,LDL size and post-prandial lipid metabolism in healthy subjects[J]. Atherosclerosis,2003,167(1):149-158.
[6]Okamoto Y,Shinobu T,Yoshimasa H,et al. Enhanced GLUT2 gene expression in an oleic-inducedinvitrofatty liver model[J]. Hepatology Research,2002,23(2):138-144.
[7]Fujimoto Y,Onoduka J,Homma KJ,et al. Long-chain fatty acids induce lipid droplet formation in a cultured human hepatocyte in a manner dependent of Acyl-CoA synthetase[J]. Biological and Pharmaceutical Bulletin,2006,29(10):2174-2180.
[8]殷锦锦. 护肝清脂片对肝脂肪变性L02细胞模型的药理作用及机制研究[D]. 广州:南方医科大学,2014.
[9]Donato MT,Lahoz A,Jim′enez N,et al. Potential impact of steatosis on cytochrome P450 enzymes of human hepatocytes isolated from fatty liver grafts[J]. European Journal of Drug
Metabolism and Pharmacokinetics,2006,34:1556-1562.
[10]李慧. 杜仲木脂素对HepG2细胞甘油三酯聚集的影响[D]. 长沙:中南大学,2013.
[11]Hwang YJ,Lee EJ,Kim HR,et al. NF-κB-targeted anti-inflammatory activity of Prunella vulgaris var. lilacina in macrophages RAW 264.7[J]. International Journal of Molecular Sciences,2013,14:21489-21503.
[12]Sherman KE. Alanine aminotransferase in clinical practice[J]. Archives of Internal Madicine,1991,151(2):260-265.
[13]Ricchi M,Odoardi MR,Carulli L,et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J]. Journal of Gastroenterology and Hepatology,2009,24:830-840.
[14]Liu ZY,Wang GC,Zhou BC. Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J]. Bioresource Technology,2008,99:1717-1722.
[15]Karpe F,Dickmann JR,Frayn KN. Fatty acids,obesity,and insulin resistance:time for a revaluation[J]. Diabetes,2011,60(10):2441-2449.
[16]Niu Y,Li S,Na L,et al. Mangiferin decreases plasma free fatty acids through promoting its catabolism in liver by activation of AMPK[J]. Public Library of Science,2012,7(l):3078-3082.
A comparative study of palmitic acid and oleic acid on liver cell function
LIU Meng,WU Yong-pei,LIU Yi-xiang*,CHEN Hai-xiu
(College of Food and Biological Engineering,Jimei University,Xiamen 361021,China)
Imbalance of fatty acids in dietary intake is one of the main causes of inducing chronic metabolic syndrome,which threatened the health of mankind. Theinvitrocellular model was employed and the evaluation indexes,including cell proliferation,cell membrane integrity,inflammatory factor,and intracellular lipid accumulation,were detected. Therefore,the dietary fatty acids,oleic acid,palmitic acid,as well as the two fatty acids’ complex,were selected to assess how the excess dietary lipids influence on liver health in this work. This study demonstrated that the different dietary fatty acids exhibited different effects on liver cells. Palmitic acid shows higher cytotoxicity than oleic acid. Palmitic acid can induce cell apoptosis and disrupt the cell membrane integrity at lower doses. However,oleic acid,with the lower cytotoxicity,can cause the lipid accumulation in liver cells more easily. As far as the mixed fatty acids(oleic acid/palmitic acid,2∶1 ratio),although they exhibit lower cytotoxicity,inducing the lipid steatosis easily in liver cells was also observed. The experimental results for provides theory basis for reasonable dietary fat intake.
fatty acids;liver cells;lipid accumulation;oleic acid;palmitic acid
2015-08-11
刘萌(1992-),女,研究生,研究方向:功能性食品开发,E-mail:873675645@qq.com。
刘翼翔(1982-),男,博士,副教授,研究方向:海洋生物活性物质利用与开发,E-mail:lyxjmu@163.com。
国家海洋局公益项目(201205022-6);福建省自然科学基金(2015J01139);厦门市科技计划项目(3502Z20143019)。
TS254.5
A
1002-0306(2016)03-0347-05
10.13386/j.issn1002-0306.2016.03.064

