鲜切生菜致腐霉菌的分离鉴定
刘程惠,胡文忠,王艳颖,田密霞,孙 录
(大连民族大学生命科学学院,辽宁大连 116600)
鲜切生菜致腐霉菌的分离鉴定
刘程惠,胡文忠*,王艳颖,田密霞,孙录
(大连民族大学生命科学学院,辽宁大连 116600)
对引起鲜切生菜腐败的霉菌进行分离鉴定。通过形态学鉴定方法,从鲜切生菜中分离出46株霉菌,其中青霉菌属(Penicillium)28株,曲霉属(Aspergillus)13株,枝孢属(Cladosporium)3株,镰孢属(Fusarium)2株。根据不同属在不同培养基上的性状,通过在察氏琼脂培养基(CA)、察氏酵母膏琼脂培养基(CYA)、查氏酵母浸出液加蔗糖培养基(CY20S)、25%甘油硝酸盐琼脂培养基(G25N)和玉米粉琼脂培养基(CMA)等鉴定培养基上的特征及显微镜观察,将28株青霉菌属鉴定为三种:橘灰青霉(P.aurantiogriseum)、鲜绿青霉(P.viridicatum)、草酸青霉(P.oxalicum)。13株曲霉属鉴定为两种:泡盛曲霉(A.awamori)、蜂蜜曲霉(A.melleus)。枝孢属鉴定为一种:枝孢样枝孢霉(C.cladosporioides)。
鲜切生菜,霉菌,青霉,曲霉,鉴定
鲜切蔬菜(Fresh-cut vegetables)既可保持蔬菜产品的新鲜质地和营养价值,又有方便和环保的特点,具有很大的开发潜力。但切割加工导致蔬菜原有的组织与细胞结构受到破坏,营养成分随着细胞液外流,容易招致微生物侵染引起腐败。蔬菜的pH在5~7,营养成分很适合霉菌的生长,鲜切蔬菜中常见的腐败霉菌有青霉(Penicillium)、灰色葡萄孢霉(Botrytiscinerea)、链格孢霉属(Alternaria)、曲霉(Aspergillus)等[1-2]。目前,大多数关于鲜切果蔬的研究都是从生理生化变化[3]、抑制褐变[4]和防腐保鲜[5]进行,但对微生物,尤其是致腐霉菌的研究较少。一般情况下致病菌在鲜切果蔬上很少存在,存在的大都是腐败菌,腐败菌引起的产品腐败变质会造成巨大的经济损失,也是严重制约鲜切产业发展的主要因素。因此,对引起鲜切产品腐败的主要致腐菌进行分离鉴定,研究它们的生长特性及侵染机理并进一步对其防治方法是很有必要的。本研究对鲜切生菜中的致腐霉菌进行分离鉴定,旨在为鲜切生菜的防腐保鲜技术研究奠定基础。
1 材料与方法
1.1材料与仪器
生菜大连新玛特超市,选择新鲜的,无损伤的生菜作为实验材料。
马铃薯葡萄糖琼脂培养基(PDA)、CA培养基、CYA培养基、G25N培养基、CY20s培养基、CMA培养基,以上培养基的配方及配制方法参照《中国真菌志》[6-7]。
VS-1300超净工作台苏州市苏信净化设备厂;OLYMPUS BX51偏光显微镜Philippines公司。
1.2实验方法

表1 霉菌菌落及分生孢子结构特征Table 1 Characteristics of mold colonies and conidium structure
1.2.1样品处理新鲜生菜用自来水清洗,切成1 cm细丝,装入保鲜盒中,保鲜膜封装,常温放置2~4 d,准备分菌。切割器具采用200 ppm的次氯酸钠溶液浸泡10 min清洗消毒。保鲜盒及刀具全部经高压灭菌处理。
1.2.2鲜切生菜中霉菌的分离纯化倒混菌平板法[8]:制备鲜切生菜菌悬液,进行10倍梯度稀释,稀释倍数为10-1、10-2、10-3、10-4、10-5,分别取稀释液1mL,与已融化并冷却至50 ℃左右的无菌PDA(含抗生素)混合,摇匀后,倒入培养皿中,待琼脂凝固后,制成实验所需的平板。每个稀释倍数做三个平行样,在28 ℃下培养3~5 d。
平板划线法:倒混菌平板法培养3~5 d后,用接种环挑取外观为丝状的单菌落,在无菌PDA平板上进行交叉划线分离得到纯菌种。稀释平板法:28 ℃培养3~5 d。
用接种环挑取外观是丝状的单菌落,三点法接种到CA上进行纯化培养,重复接种三代。将纯化菌种于4 ℃保存。
1.2.3属的鉴定对纯化得到的菌株进行插片培养,28 ℃培养3~5 d后进行镜检观察,结合菌落形态特征,依据鉴定文献[9-11]进行鉴定。
1.2.4种的鉴定将所分离到的青霉菌点接种到CA、CYA、G25N培养基上,在25~28 ℃下培养,CA培养基上培养观察12 d,CYA、G25N培养基上培养观察7 d。将分离到的曲霉用三点法接种到CA、CYA、CY20s三种培养基上,在CA培养基上28 ℃培养观察12 d,在CYA和CY20s培养基上28 ℃培养观察7 d;将枝孢属用三点法接种到CA、CMA、CYA三种培养基上,在CA培养基上28 ℃培养观察12 d,在CYA和CMA培养基上28 ℃培养观察7 d;将镰孢属用三点法接种到CA、CYA、CMA三种培养基上,在CA培养基上28 ℃培养观察12 d,在CYA和CMA培养基上28 ℃培养观察7 d。分别记录不同菌株在不同培养基上的菌落大小、颜色、质地以及生长速度等特征,在显微镜(40倍)中观察它的产孢结构,主要形态、分生孢子的位置、形状等特征。
2 结果与讨论
2.1分离纯化结果
按照稀释平板梯度筛选法,观察选出46株不同菌落特征的菌株,依次编号,进行属的鉴定。
2.2属的鉴定结果
46株霉菌插片培养,对玻片进行镜检观察,结合菌落特征,参照真菌分类鉴定方法[6,11],分离到4个属的霉菌,分别是28株青霉属,13株曲霉属,3株枝孢属,2株镰孢属。见表1。
2.3青霉菌种的鉴定结果
依据Pitt[11]和孔华忠[6]的鉴定文献,结合各菌株在CA、CYA、G25N培养基上的菌落特征和镜检观察结果,根据菌种在不同培养基上的特性,将28株青霉菌鉴定为3种:橘灰青霉(Penicilliumaurantiogriseum)、鲜绿青霉(Penicilliumviridicatum)、草酸青霉(Penicilliumoxalicum)。具体种的描述如下:
2.3.1橘灰青霉(Penicilliumaurantiogriseum)橘灰青霉的菌落特征及分生孢子形态见图1。CA培养基上28 ℃培养12 d,直径14~18 mm,有少量的放射状皱纹,菌落近于平坦,质地粉末状兼绒状,有少许颗粒状,分生孢子呈蓝绿色,中心面上有暗绿色,接近于暗橄榄绿,菌丝体为白色。反面为黄褐色,有褶皱。
CYA培养基上28 ℃培养7 d,直径32~42 mm,菌落较平坦,中心有脐状突起,有较少的放射状皱纹,质地为粉末状和绒状。有肉眼可见的幼龄孢梗束,分生孢子结构较多,菌丝体为白色,有渗出液。菌落反面为黄褐色,有褶皱。
G25N培养基上28 ℃培养7 d,直径34~38 mm,菌落的中心较厚,且有脐状突起,菌落外沿有少量放射状,质地呈绒状偶有颗粒状,分生孢子结构较多,呈黄绿色和蓝绿色,菌落背面呈黄褐色,有褶皱。
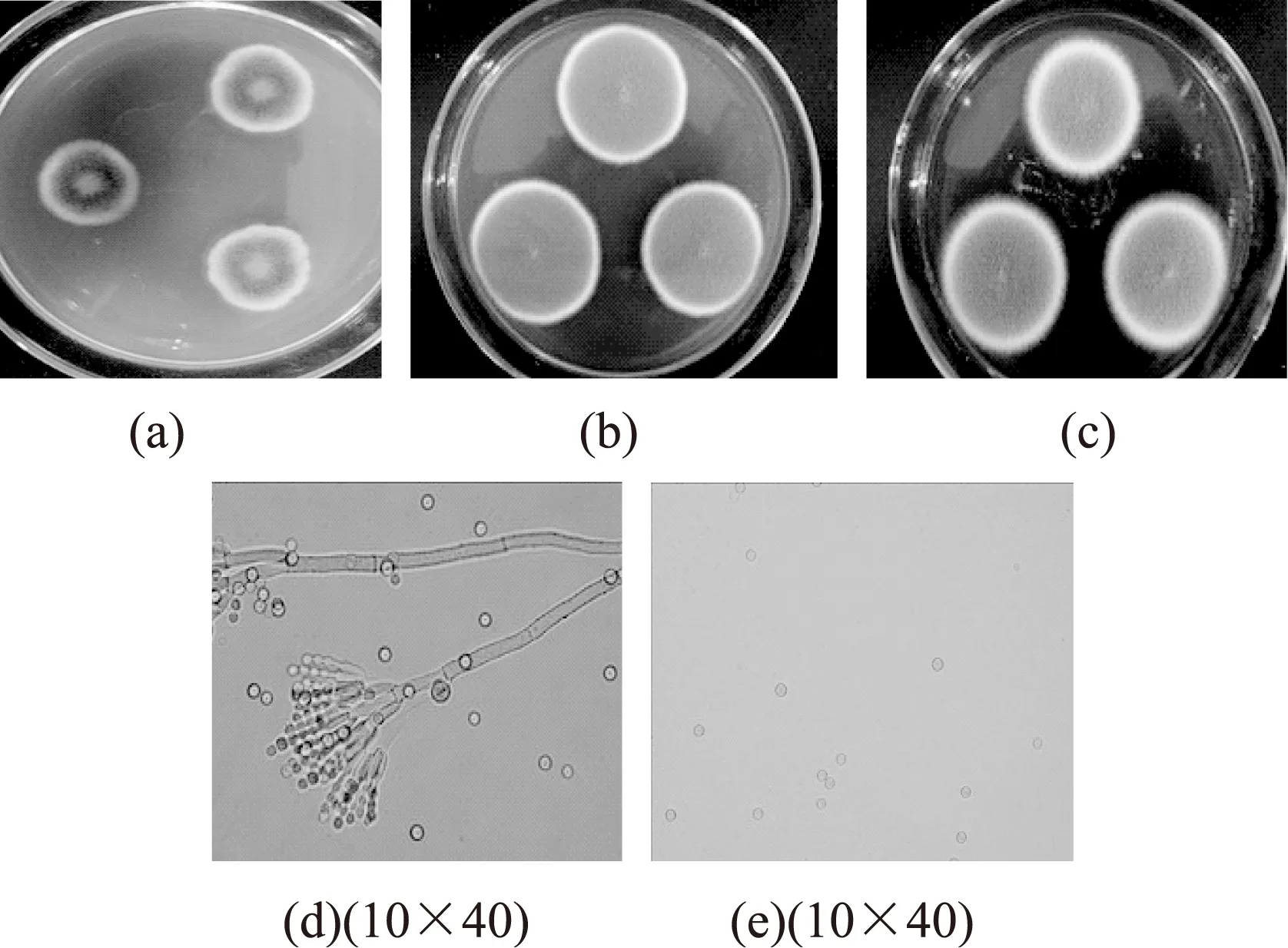
图1 橘灰青霉的菌落特征及分生孢子形态Fig.1 Colony characteristic and conidium morphology of P.aurantiogriseum注:(a)、(b)、(c)分别为CA、CYA、G25N培养基上的菌落, (d)为分生孢子头形态,(e)为分生孢子形态,图2,图3同。
2.3.2鲜绿青霉(Penicilliumviridicatum)鲜绿青霉的菌落特征及分生孢子形态见图2。CA培养基上28 ℃培养12 d,直径16~20 mm,菌落有放射状褶皱,偶有同心环纹,质地为绒状兼颗粒状,分生孢子结构产生于菌落边缘,黄绿色,菌丝体为白色,中部略呈黄白色,有少量透明渗出液,菌落背面为黄褐色,有褶皱。
CYA培养基上28 ℃培养7 d,直径29~34 mm,菌落中间有脐状突起,外沿接近平坦,质地绒状偶有颗粒状,分生孢子结构较多,绿色和黄绿色,菌丝体接近于白色,有大量的渗出液产生,菌落背面为黄褐色,有褶皱。
G25N培养基上28 ℃培养7 d,直径28~32 mm,菌落表面较为平坦,质地为绒状,也有少许的粉末状。分生孢子结构不多,呈黄绿色和蓝绿色,没有渗出液产生,菌落背面为黄绿色,无褶皱。

图2 鲜绿青霉的菌落特征及分生孢子形态Fig.2 Colony characteristic and conidium morphologyof P.viridicatum
2.3.3草酸青霉(Penicilliumoxalicum)草酸青霉的菌落特征及分生孢子形态见图3。CA培养基上28 ℃培养12 d,直径10~14 mm,菌落表面较为平坦,分生孢子易脱落,质地为绒状偶有絮状。分生孢子较多,呈灰绿色和暗绿色,菌丝体为微黄色,没有渗出液,菌落背面为橙黄色。
CYA培养基上28 ℃培养7 d,直径38~45 mm,菌落接近于平坦,中心有脐状突起,外沿有少许放射纹,分生孢子易脱落,质地为绒状偶有絮状,分生孢子结构较多,呈暗绿色和灰绿色,菌丝体为白色和近于白色,也有的在表面中心呈灰黄色,几乎没有渗出液,菌落反面为绿褐色。
G25N培养基上28 ℃培养7 d,直径28~34 mm,菌落质地为绒状,中心有脐状突起,其它部分较为平坦,偶有放射纹。分生孢子产量较大,呈暗绿色,没有渗出液产生,菌落背面有部分粉黄色,略带淡绿色。
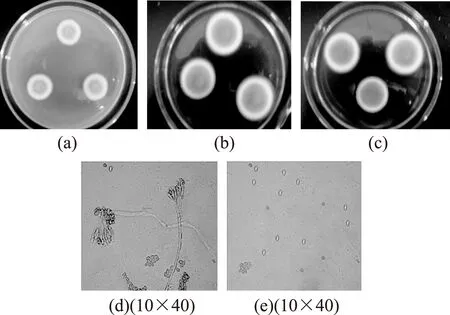
图3 草酸青霉的菌落特征及分生孢子形态Fig.3 Colony characteristic and conidium morphologyof P.oxalicum
2.4曲霉菌种的鉴定结果
根据菌种在不同培养基上的特性[7],将13株曲霉菌归为2种:泡盛曲霉(Aspergillusawamori)、蜂蜜曲霉(Aspergillusmelleus)。
2.4.1泡盛曲霉(Aspergillusawamori)泡盛曲霉的菌落特征及分生孢子形态见图4。CA培养基上28 ℃培养7 d,菌落生长迅速,直径达到35~38 mm左右,菌落有辐射状沟纹,较为平坦。质地为絮状和绒状,分生孢子产量很大,在菌落边缘较密集,呈灰褐色近于黑色。分生孢子头开始时呈辐射形,渐渐疏松且成为圆柱状结构。分生孢子呈球形,壁平滑,产孢结构双层。菌落背面呈黄褐色,有明显的褶皱。
CYA培养基上28 ℃培养7 d,直径55~59 mm,生长速度很快,有很明显的辐射状沟纹,质地为绒状,分生孢子产量较大,呈深褐色和黑色,没有渗出液产生,菌落背面中心呈紫褐色,四周是灰黄色。
CY20S培养基上28 ℃培养7 d,直径60~64 mm,菌落较为平坦,略有辐射状沟纹,质地为绒状,分生孢子结构产量很大,呈暗褐色和黑色,没有气味,没有渗出液产生,菌落背面呈橙黄色和黄褐色。
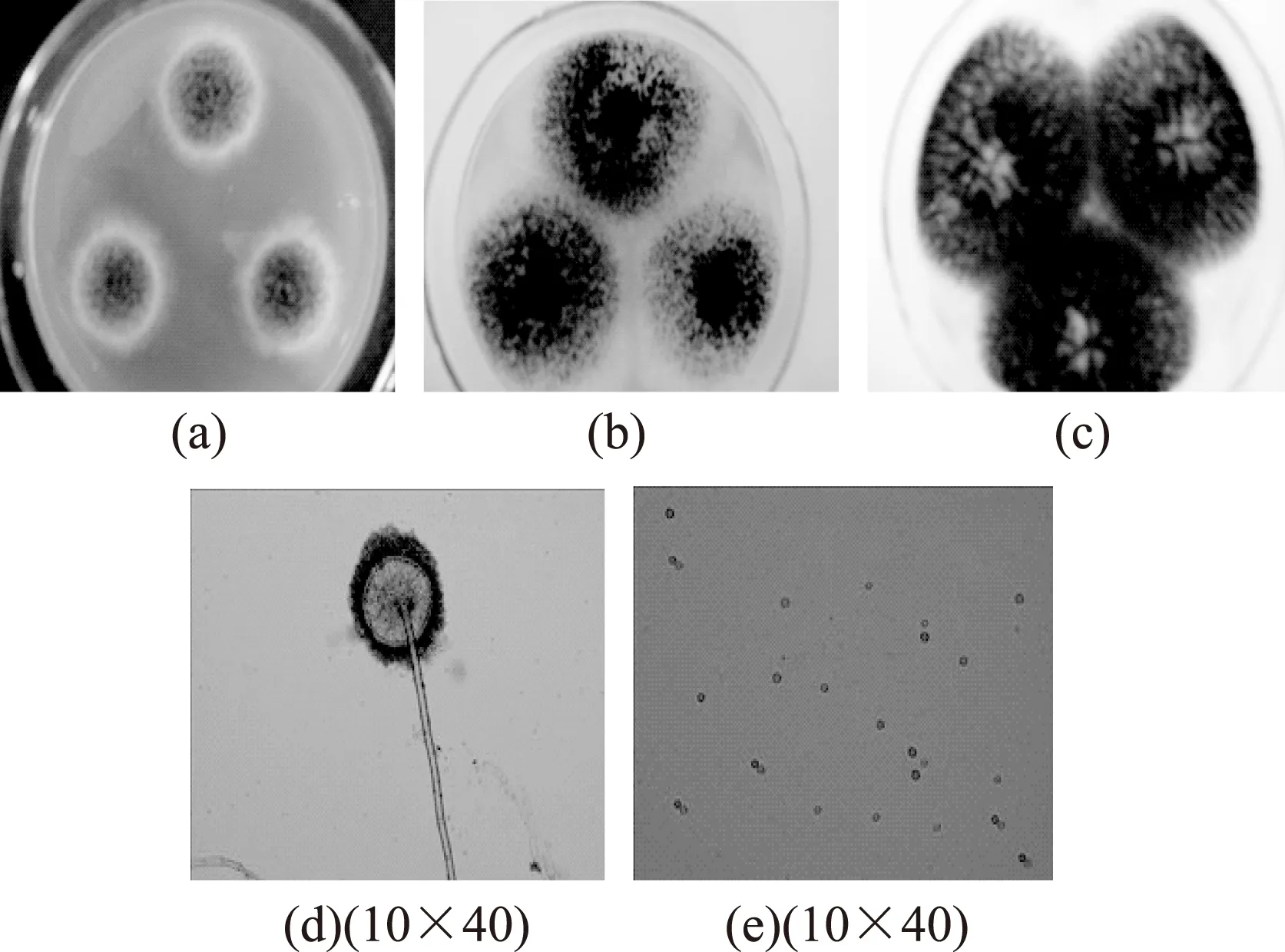
图4 泡盛曲霉的菌落特征及分生孢子形态Fig.4 Colony characteristic and conidium morphologyof A.awamori注:(a)、(b)、(c)分别为CA、CYA、CY20S培养基上的菌落, (d)为分生孢子头形态,(e)为分生孢子形态,图5、图6同。
2.4.2蜂蜜曲霉(Aspergillusmelleus)蜂蜜曲霉的菌落特征及分生孢子形态见图5。CA培养基上28 ℃培养12 d,直径30~35 mm,质地为颗粒状和絮状,气生菌丝少,初为粉红色,后成为黄色并有光泽。分生孢子结构较少,中心相对较多,没有渗出液产生,分生孢子头近球形,直径约200 μm,渐渐发展成柱状体。顶囊为球形,产孢结构双层。菌落背面为浅褐色,有明显褶皱。
CYA培养基上28 ℃培养7 d,直径45~52 mm,质地为颗粒状兼绒状。菌落有少量的放射状沟纹,中心略有突起,产生大量菌核,呈红褐色。分生孢子结构很少,中心较多,为浅黄色。没有气味,没有渗出液。菌落背面为紫红色,有皱纹。
CY20S培养基上28 ℃培养7 d,菌落中部较厚,直径为50~60 mm,质地为絮状兼颗粒状,分生孢子结构较多,呈蜜黄色,边缘的分生孢子逐渐减少。没有渗出液,具有轻微霉味,菌落反面为黄褐色,有褶皱。
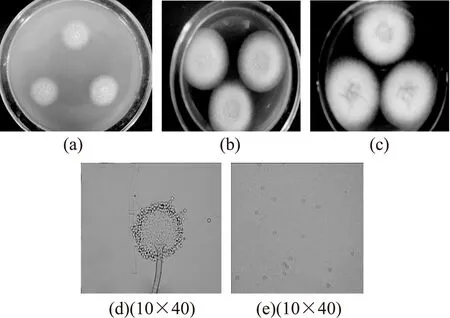
图5 蜂蜜曲霉的菌落特征及分生孢子形态Fig.5 Colony characteristic and conidium morphologyof A.melleus
2.5枝孢属菌种的鉴定结果
根据菌种在不同培养基上的特性[12],将3株枝孢属鉴定为枝状枝孢(Cladosporiumcladosporioides),见图6。
CA培养基上28 ℃培养12 d,直径15~20 mm,质地绒状和粉末状。菌落呈淡绿色,由中间到外沿绿色逐渐加深。气生菌丝比较暗,直径约为4.5~8.2 um,菌落背面为黑绿色,无气味,无渗出液。
CYA培养基上28 ℃培养10 d,直径18~22 mm,质地主要为粉末状。菌落呈橄榄绿色,菌丝无色,直径为5.5~8.5 μm,分生孢子不膨大,较平滑。没有渗出液,没有气味,菌落背面呈黑绿色,有褶皱。
CMA培养基上28 ℃培养10 d,直径17~19 mm,质地为粉末状,有少许绒状。菌落呈橄榄绿色,气生菌丝较暗,直径约为4.2~8.5 μm,分生孢子梗不分枝,产孢后不再延伸,不膨大,具有孢痕。没有渗出液,没有气味,菌落背面为黑绿色,有褶皱。

图6 枝孢样枝孢霉的菌落特征及分生孢子形态Fig.6 Colony characteristic and conidium morphologyof C.cladosporioides
3 结论
从鲜切生菜中分离鉴定得到青霉菌属(Penicillium)、曲霉属(Aspergillus)、枝孢属(Cladosporium)、镰孢属(Fusarium)四个属,其中青霉菌占大多数,分别为橘灰青霉(P.aurantiogriseum)、鲜绿青霉(P.viridicatum)、草酸青霉(P.oxalicum)。曲霉属鉴定为两种:泡盛曲霉(A.awamori)、蜂蜜曲霉(A.melleus)。枝孢属鉴定为一种:枝孢样枝孢霉(C.cladosporioides)。霉菌在蔬菜表面破损处繁殖,侵入蔬菜组织后,组织壁的纤维素先被破坏,进而果胶、蛋白质、有机酸、糖类被分解,继而酵母菌和细菌开始繁殖[13]。由于生菜经过切割后,组织被破坏更容易招致霉菌侵染,霉菌大量繁殖导致蔬菜外观有深色的斑点,组织变得松软、发绵、凹陷、变形,逐渐变成浆液状甚至水液状,并产生霉腐气味。因此,鲜切生菜霉菌的研究显得更加重要,本实验为鲜切生菜贮藏过程中微生物病害防治提供了参考依据。
[1]Tournas VH. Moulds and yeasts in fresh and minimally processed vegetables,and sprouts[J]. International Journal of Food Microbiology,2005,99(1):71-77.
[2]冮洁,胡文忠. 鲜切果蔬的微生物污染及其杀菌技术[J].食品工业科技,2009,30(6):319-324.
[3]Hu WZ.,Jiang AL,Tian MX,et al. Effect of ethanol treatment on physiological and quality attributes of fresh-cut eggplant[J]. J Sci Food Agric. 2010,90:1323-1326.
[4]Xing YG,Li XH,Xu QL,et al. Effects of chitosan-based maize starches[J]. Eur J Pharm Biopharm,2009,72(3):574-586.
[18]Xu J,Zhao W X,Ning Y W,et al. Comparative study of spring dextrin impact on amylose retrogradation[J]. J Agric Food Chem,2012,60(19):4970-4976.
[19]Flores-Morales A,Jiménez-Estrada M,Mora-Escobedo R.
coating and modified atmosphere packaging(MAP)on browning and shelf life of fresh-cut lotus root(Nelumbo nucifera Gaerth)[J]. Innovative Food Science and Emerging Technologies,2010,11:684-689.
[5]Gómez PL,Alzamora SM,Castro MA,et al. Effect of ultraviolet-C light dose on quality of cut-apple:Microorganism,color and compression behavior[J]. Journal of Food Engineering,2010,98:60-70.
[6]孔华忠. 中国真菌志.第三十五卷(青霉属及其相关有性型属)[M]. 北京:科学出版社,2007.
[7]孔华忠. 中国真菌志.第五卷(曲霉属及其相关有性型属)[M]. 北京:科学出版社,2007.
[8]杨文博. 微生物学实验[M]. 北京:化学工业出版社,2004.
[9]魏景超. 真菌鉴定手册[M].上海:科学技术出版社,1986.
[10]中国科学院微生物研究室. 常见与常用真菌[M].北京:科学出版社,1978.
[11]Pitt J I. A laboratory guide common penicillium species[M]. North Ryde:Division of Food Processing,1988.
[12]孔华忠. 中国真菌志.第十四卷(枝孢属、黑星孢属、梨孢属)[M]. 北京:科学出版社,2007.
[13]胡文忠. 鲜切果蔬科学与技术[M]. 北京:化学工业出版社,2009.
Isolation and identification of spoilage molds from fresh-cut lettuce
LIU Cheng-hui,HU Wen-zhong*,WANG Yan-ying,TIAN Mi-xia,SUN Lu
(College of Life Science,Dalian Nationalities University,Dalian 116600)
The spoilage molds which cause fresh-cut lettuce corruption were identified. According to morphological character method,46 strains of molds were isolated from fresh-cut lettuce,in which there were 28Penicilliumstrains,13Aspergillusstrains,3Cladosporiumstrains and 2Fusariumstrains. The different molds were identified by the cultivation characters and microscopic examination in different medium including CA,CYA,CY20S,G25N,and CMA. The results showed that 3 kinds ofPenicilliumwere identified,includingP.aurantiogriseum,P.viridicatum,P.oxalicum. 2 kinds ofAspergilluswereA.awamoriandA.melleus. 1 kind ofCladosporiumwasC.cladosporioides.
fresh-cut lettuce;mold;Penicillium;Aspergillus;identification
2015-06-05
刘程惠(1979-),女,博士研究生,研究方向:食品科学与工程,E-mail:liuchenghui@dlnu.edu.cn。
胡文忠(1959-),男,博士,教授,研究方向:食品科学,E-mail:hwz@dlnu.edu.cn。
“十二五”国家科技支撑计划项目(2012BAD38B05);中央高校基本科研业务费专项资助项目(DC201502020402)。
TS255.1
A
1002-0306(2016)03-0135-05
10.13386/j.issn1002-0306.2016.03.020

