黄瓜靶斑病菌致病性鉴定及药剂筛选
徐丽慧,高士刚,曾 蓉,戴富明(上海市农业科学院生态环境保护研究所,上海市设施园艺重点实验室,上海 201403)
黄瓜靶斑病菌致病性鉴定及药剂筛选
徐丽慧,高士刚,曾 蓉,戴富明*
(上海市农业科学院生态环境保护研究所,上海市设施园艺重点实验室,上海201403)
采用喷雾接种的方法,对来自上海、山东、辽宁和广东等地黄瓜上分离的9个靶斑病菌(Corynespora cassiicola)菌株在黄瓜不同品种上的致病性进行了鉴定;并通过测定菌丝生长速率和田间试验,对常用杀菌剂进行了活性与防效的评价。结果表明:来源于不同地区的菌株对黄瓜的致病力存在差异,但未发现致病力的分化。10个主栽黄瓜品种对黄瓜靶斑病的抗性差异明显,其中‘碧玉’抗性最强,而‘春五’‘申青一号’的抗性较差。室内活性及室外药效试验结果表明,430g/L戊唑醇悬浮剂、45%咪鲜胺乳油对黄瓜靶斑病有较好的防治效果。
黄瓜靶斑病;多主棒孢菌;致病性;药剂防治
黄瓜靶斑病(Cucumber target leafspot)又称黄瓜棒孢叶斑病、褐斑病,由多主棒孢菌[Corynespora cassiicola(Berk&Kert)Wei]引起,是近年来黄瓜生产上的重要病害之一。该病田间叶片发病率一般为10%—25%,严重时高达60%—70%,甚至100%[1-2]。多主棒孢菌侵染破坏力强,极易变异[3]。高苇等[4]报道多主棒孢菌寄主来源与致病力分化之间具有显著的相关性,认为多主棒孢菌的种内菌株间存在寄主专化性的现象,并且,相同寄主和相同地理来源的病原菌群体中致病力也存在显著差异。然而,不同地域相同寄主来源的病原菌对同一寄主不同品种是否存在致病力分化即生理小种的分化尚未明确。品种抗性利用是病害综合防控的主要措施之一[5],国内也有黄瓜对靶斑病抗性的鉴定报道,但多数采用苗期鉴定,且选用的是津研类型和华南类型的黄瓜品种,缺少荷兰型黄瓜品种[6-8]。目前,关于黄瓜靶斑病防治药剂的研究以室内离体活性筛选居多[9],田间防效试验偏少,据报道百菌清[10]、氟菌·肟菌酯[11]等杀菌剂在田间对黄瓜靶斑病有效。
本研究对来源于不同地区的黄瓜多主棒孢菌在黄瓜上致病力以及不同类型的主栽黄瓜品种的田间抗性进行鉴定,同时对黄瓜靶斑病防治药剂进行室内筛选与田间防效评价,以期为黄瓜靶斑病的田间防治与抗病育种提供技术支持。
1 材料与方法
1.1供试黄瓜品种
‘申青一号’(上海富农种业有限公司)、‘南杂二号’(上海兴绿蔬菜种苗研究所)、‘沪杂六号’(上海市农业科学院设施园艺研究所)、‘春秋王’(上海市农业科学院设施园艺研究所)、‘春五’(天津市东丽区环农润丰种业有限公司)、‘碧玉’(上海富农种业有限公司)、‘新四号’(宁阳县阳光种子有限公司)、‘抗热先锋’(天津市宏程芹菜研究所)、‘九龙四零一’(青岛胶州市九龙种苗繁育场)和‘新津研四号’(天津市中天种业有限公司)。
1.2供试菌株
多主棒孢菌HGPD、HGJS、HGSJ、HGFX菌株分别从上海市浦东新区、金山区、松江区、奉贤区采集的黄瓜靶斑病病叶上分离;HGSG菌株由潍坊科技学院刘永光老师提供;HGSD1、HGSD2菌株由山东省农业科学院植物保护研究所李长松老师提供;HGLN菌株由沈阳农业大学植物保护学院刘志恒老师提供;HGGD菌株由广东省农业科学院植物保护研究所蓝国兵老师提供。
1.3供试药剂
毒力测定药剂:97%戊唑醇原药(上海生农生化制品有限公司),98%咪鲜胺原药(江苏辉丰农化股份有限公司),98%啶酰菌胺原药(上海悦联化工有限公司),97%肟菌酯原药(江苏南通泰禾化工有限公司),95%苯醚甲环唑原药(上海生农生化制品有限公司),98%嘧菌酯原药(京博农化科技股份有限公司),98%多菌灵原药(江苏蓝丰生物化工股份有限公司),98%腐霉利原药(江西禾益化工股份有限公司),96%异菌脲原药(上海悦联化工有限公司)。
田间试验药剂:430g/L戊唑醇悬浮剂(拜耳作物科学公司),45%咪鲜胺乳油(北京中农研创高科技有限公司),50%啶酰菌胺水分散粒剂(巴斯夫欧洲公司),10%苯醚甲环唑水分散粒剂(瑞士先正达作物保护有限公司),50%多菌灵可湿性粉剂(上海悦联化工有限公司)。
1.4药剂室内筛选
1.4.1药剂初筛
将9种杀菌剂分别配制成终质量浓度分别为1μg/mL和50μg/mL的PDA含药培养基平板,每个浓度处理设置5个重复。将活化后的黄瓜靶斑病菌强致病力菌株HGFX的菌饼接种至含药培养基平板中央,28℃、黑暗条件下培养7d后测量菌落直径。
1.4.2EC50测定
初筛后活性高的杀菌剂进行EC50的测定。根据初筛试验中杀菌剂的活性高低,将候选的杀菌剂分别制成不同系列终浓度的PDA含药培养基平板,活化后菌株HGFX的菌饼接种至药皿中央,28℃、黑暗条件下培养7d后测量菌落直径。
1.5病菌田间接种
将黄瓜靶斑病菌株转接到PDA培养基上,28℃、黑暗条件下培养20d后,培养物用无菌水配成分生孢子含量为106个/mL的孢子悬浮液,全株性喷雾接种后沟灌补水,闭棚保湿1d后恢复正常管理。
1.6抗病性鉴定
在2013年秋季,10个黄瓜品种按照随机区组排列进行移栽定植,每个品种4次重复。在开花结瓜期,按照1.5节方法进行病菌(菌株HGFX)的人工接种,接种后10d调查靶斑病的病情指数。
1.7致病力评价
选择靶斑病抗性强(‘碧玉’)和抗性弱(‘申青一号’)的2个黄瓜品种进行9个黄瓜靶斑病菌的致病力差异测定。不同菌株接种处理随机区组排列,4次重复。在开花结瓜期,按照1.5节方法进行病菌的人工接种,接种10d后进行靶斑病的病情指数调查。
1.8药剂田间防治黄瓜靶斑病的效果评价
根据杀菌剂室内毒力的测定,选择活性较高的5种杀菌剂在保护地大棚栽培黄瓜‘申青一号’上进行靶斑病田间防效试验。试验设置430g/L戊唑醇悬浮剂1 000倍液、45%咪鲜胺乳油2 000倍液、50%啶酰菌胺水分散粒剂1 000倍液、10%苯醚甲环唑水分散粒剂1 000倍液和50%多菌灵可湿性粉剂1000倍液5个药剂处理和1个不施药空白对照。试验处理随机区组排列,4次重复。在黄瓜开花结瓜期,靶斑病未发生之前进行第一次药剂全株性喷雾预防,药后第2天按照1.5节方法进行病原菌人工接种,7d后进行第二次药剂预防,第二次施药后10d进行靶斑病病情调查。
1.9病情和防效调查
1.9.1病害调查
每小区随机调查4点,每点2株,共8株,每株调查全部叶片,以每片叶上的病斑面积占整个叶面积的百分率来分级。试验依据GB/T17980.112—2004第112部分:杀菌剂防治瓜类炭疽病药效试验中的分级标准,拟定黄瓜靶斑病严重度分级标准。分级标准为,0级:无病斑;1级:病斑面积占整个叶面积的5%以下;3级:病斑面积占6%—10%;5级:病斑面积占11%—25%;7级:病斑面积占26%—50%;9级:病斑面积达50%以上。

1.9.2防效计算

采用SPSS 18.0统计软件对病情指数鉴定结果及防治效果进行方差分析,多重比较采用Duncan’s新复极差检验(LSR test)。
2 结果与分析
2.1药剂室内毒力测定
在1μg/mL质量浓度下,9种供试杀菌剂中,戊唑醇、咪鲜胺、啶酰菌胺、苯醚甲环唑表现出27.7%—61.5%的抑菌率,其他5种杀菌剂对菌丝生长的抑制率在12.3%以下;在50μg/mL质量浓度下,戊唑醇、咪鲜胺、啶酰菌胺、苯醚甲环唑、多菌灵和腐霉利对菌丝生长的抑制率超过50%(供试杀菌剂间具有显著性差异P<0.05,n=4)(图1)。
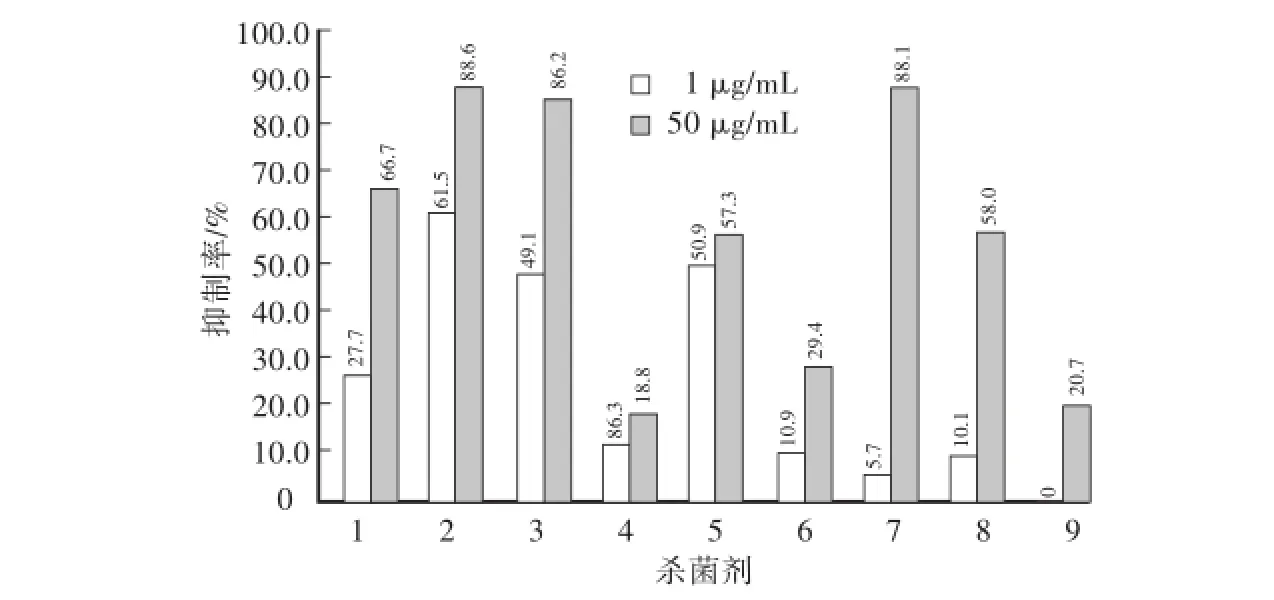
图1 9种杀菌剂对黄瓜靶斑病菌的抑菌活性测定Fig.1 Inhibitory activity of 9 fungicides against Corynespora cassiicola
综合分析2个浓度下抑菌效果,选择戊唑醇、咪鲜胺、啶酰菌胺、苯醚甲环唑和多菌灵进行EC50的测定。咪鲜胺的抑菌活性最强,其EC50为0.07μg/mL;戊唑醇的抑菌活性最弱,其EC50为14.93μg/mL(表1)。
2.2黄瓜品种对黄瓜靶斑病的抗病性评价
用黄瓜靶斑病菌强致病力菌株HGFX接种10个不同黄瓜品种后7d,靶斑病的病情指数见图2。不同黄瓜品种之间对靶斑病抗性的差异显著,其中‘申青一号’‘春五’‘新四号’‘抗热先锋’‘新津研四号’抗性较差,病情指数均超过了40;‘南杂二号’‘沪杂六号’‘春秋王’‘九龙四零一’抗性居中,病情指数在15—35;‘碧玉’抗性最强,病情指数仅为8.16。

表 1 5种杀菌剂抑制黄瓜靶斑病菌菌丝生长的EC50测定Table 1 EC50of 5 fungicides against mycelialgrowth of Corynespora cassiicola

图2 黄瓜不同品种对黄瓜靶斑病的抗性鉴定Fig.2 Resistance ofdifferent cucumber varieties to cucumber target leafspot
2.3黄瓜上多主棒孢菌菌株的致病力测定
通过大棚内成株期黄瓜的人工接种,测定了来自辽宁沈阳、山东寿光、广东广州以及上海浦东、奉贤、金山、松江等地黄瓜上分离的9个多主棒孢菌菌株在‘碧玉’(抗病较强)和‘申青一号’(抗性较差)的致病力(田间效果如图3所示)。9个菌株对‘申青一号’黄瓜品种的致病力都很强,而对‘碧玉’黄瓜品种的致病力都很弱,在同一品种上虽然有致病性差异,但差异不显著(图4),说明不同来源的株系间不存在致病性分化。

图3 黄瓜多主棒孢菌菌株在不同黄瓜品种上的田间症状Fig.3 Symptoms on leaves ofdifferent cucumber varieties caused by artificial inoculation of Corynespora cassiicola
2.4黄瓜靶斑病防治的田间药效试验评价
5种药剂对黄瓜靶斑病的田间防治效果在57.69%—74.11%,其中430g/L戊唑醇悬浮剂1 000倍液防治效果最好(74.11%),其次是45%咪鲜胺乳油2 000倍液(70.55%),再次为10%苯醚甲环唑水分散粒剂1 000倍液(61.92%),50%多菌灵可湿性粉剂1 000倍液防效为59.18%,50%啶酰菌胺水分散粒剂1 000倍液防盗为57.69%,不同药剂之间的防效差异不显著。

图4 黄瓜上多主棒孢菌菌株在黄瓜抗病品种(‘碧玉’)、感病品种(‘申青一号’)上的致病力测定Fig.4 Pathogenicity of the Corynespora cassiicola isolates on resistant(‘Biyu’)andsusceptible(‘Shenqing No.1’)varieties of cucumber
3 结论与讨论
多主棒孢菌可以危害黄瓜、番茄、茄子、橡胶等,寄主广泛[1,12-13]。不同寄主来源的多主棒孢菌在不同种或属的寄主植物间存在着明显的致病力分化[4,14]。不同地域同一寄主来源的病原菌对同一寄主不同品种是否存在致病力分化即生理小种的分化目前尚无报道。本研究中黄瓜品种‘碧玉’对来自不同地域的多主棒孢菌均表现出很强的抗性,而‘申青一号’的抗性较差,表明多主棒孢菌在黄瓜上没有出现生理小种的分化,而黄瓜对黄瓜靶斑病的抗性可能属于水平抗性,因本试验菌株数量偏少,需要更大范围源自黄瓜的靶斑病菌作进一步佐证。
目前,关于黄瓜抗靶斑病性鉴定研究报道较少,王惠哲等[6]和蓝国兵等[7]评价了当地主要黄瓜栽培品种的抗性,筛选出了高抗品种,但是仅为采用1—2个当地菌株的人工接种获得的结果,这些品种在我国其他疫区是否也表现为高抗还不能确定。本研究通过田间黄瓜成株期抗性鉴定,也认为不同黄瓜品种之间对黄瓜靶斑病抗性存在显著差异,高抗品种对来自当地上海地区和辽宁、山东、广东等地的黄瓜靶斑病菌均表现出高抗。曾蓉等[15]首次在黄瓜有刺品种上发现黄瓜靶斑病,近几年的田间观察表明水果型(光皮)黄瓜品种抗性明显强于长果型(有刺)黄瓜品种,但抗病机制仍不清楚。据王惠哲等[16]报道,黄瓜种质资源中蕴涵着潜在的改良黄瓜褐斑病抗性基因,因此采用抗病品种是目前防治黄瓜靶斑病最切实可行且有效的技术措施。
本研究表明戊唑醇、咪鲜胺等对黄瓜靶斑病具有较好的防治效果,纪明山等[17]室内测定也表明黄瓜棒孢叶斑病菌对咪鲜胺敏感。除了靶斑病之外,戊唑醇和咪鲜胺分别对黄瓜白粉病和炭疽病具有良好的防治作用,因此具有较好的兼治作用。药剂的兼治作用是在制定病害综合防控策略时必须考虑的重要因素之一,也是减少田间化学农药的投入、提高农产品安全性的重要措施之一。另外,据国外报道,黄瓜靶斑病菌对苯菌灵、甲基硫菌灵、乙霉威、嘧菌酯、啶酰菌胺等杀菌剂出现抗性[18-21],造成药效降低或丧失,本研究中啶酰菌胺相比其他杀菌剂的田间防效较差,可能产生了一定的抗药性。因而,需定时对当地的黄瓜靶斑病菌株进行抗性检测,以期做出准确的防治措施。
本研究结果在黄瓜抗靶斑病性鉴定、抗性种质资源创新、黄瓜靶斑病综合防治等方面具有重要的应用价值。
[1]李宝聚,赵彦杰,于淑晶,等.2008年秋季河北青县黄瓜棒孢叶斑病大发生[J].中国蔬菜,2008(11):51-52.
[2]杨双娟,顾兴芳,张圣平,等.黄瓜棒孢叶斑病(Corynespora cassiicola)的研究概况[J].中国蔬菜,2012(4):1-9.
[3]李宝聚,高苇,石延霞,等.多主棒孢和棒孢叶斑病的研究进展[J].植物保护学报,2012,39(2):171-176.
[4]高苇,李宝聚,石延霞,等.多主棒孢菌在黄瓜、番茄和茄子寄主上致病力的分化[J].园艺学报,2011,38(3):465-470.
[5]于淑晶,王满意,田芳,等.黄瓜棒孢叶斑病的防治及抗药性研究进展[J].农药,2014,53(1):7-11.
[6]王惠哲,李淑菊,管炜.黄瓜褐斑病抗病性鉴定技术及品种抗病性鉴定[J].中国蔬菜,2008(10):26-27.
[7]蓝国兵,何自福,罗方芳,等.广东黄瓜棒孢叶斑病(褐斑病)的发生及品种抗病性鉴定[J].中国蔬菜,2012(11):30-31.
[8]陆宁海,吴利民,田雪亮,等.黄瓜褐斑病菌侵染条件及致病性研究[J].安徽农业科学,2006,34(10):2186-2187.
[9]纪军建,张小风,王文桥,等.黄瓜褐斑病化学药剂防治研究进展[J].河北农业科学,2010,1(8):28-31.
[10]阚琳娜,李宝聚,纪明山,等.黄瓜褐斑病防治药剂的活体筛选[J].中国蔬菜,2007(4):22-24.
[11]潘好芹,夏海波,王守明,等.3种药剂对黄瓜靶斑病的田间防效试验[J].江苏农业科学,2014,42(10):137-138.
[12]蔡吉苗,陈瑶,潘羡心,等.海南橡胶棒孢霉落叶病病情调查与病原鉴定[J].热带农业科学,2008,28(5):1-10.
[13]SMITH L J,SATNOFF L E,PERNEZNY K L,et al.Phylogenetic and pathogenic characterization of Corynespora cassiicola isolates[J].ISHS Acta Horticulturae,2009,808:51-56.
[14]CUTRIM F A,SIVLAgs.Pathogenicity of Corynespora cassiicola todifferent plantspecies[J].Fitopatologia Brasileira,2003,28(2):193-194.
[15]曾蓉,陆金萍,戴富明.上海地区黄瓜靶斑病病原鉴定及ITS的分析[J].上海交通大学学报(农业科学版),2011,29(4):13-16.
[16]王惠哲,李淑菊,管炜.黄瓜褐斑病抗源鉴定与抗性遗传分析[J].中国瓜菜,2010(1):24-25.
[17]纪明山,龙怡云,祁之秋.辽宁省黄瓜褐斑病菌对咪鲜胺的敏感性检测[J].江苏农业科学,2010(2):127-128.
[18]MIURA Y,KUSUNOKI M,SOGOU K.Occurrence of benomyl-resistantstrains of cucumber anthracnose and Corynespora leafspot fungi and control of the bothdiseases bydiethofencarb[J].Bull Kagawa Agricultural Expendstation,1994,45:59-62.
[19]DATE H,KATAOKA E,TANINA K,et al.Sensitivity of Corynespora cassicola,causal agent of Corynespora leafspot of cucumber,to thiophanatemethyl,diethofencarb and azoxystrobin[J].Japanese Journal of Phytopathology,2004,70(1):10-13.
[20]TAKEUCHI T,KUBO C,ISHII H.Sensitivity of Chiba Prefecture isolates of Corynespora cassiicola,the cause of Corynespora leafspot on cucumber,toseveral fungicides[J].Annual Report of the Kanto-Tosan Plant Protectionsociety,2006,53:55-60.
[21]MIYAMOTO T,ISHII H,SEKO T,et al.Occurrence of Corynespora cassiicola isolates resistant to boscalid on cucumber in Ibaraki Prefecture,Japan[J].Plant Pathology,2009,58(6):1144-1151.
(责任编辑:闫其涛)
Pathogenicity identification and fungicidescreening of Corynespora cassiicola in cucumber
XU Li-hui,GAOshi-gang,ZENG Rong,DAI Fu-ming*
(Institute of Eco-environmental Protection,Shanghai Academy of Agriculturalsciences;Shanghai Key Laboratory of Protected Horticultural Technology,Shanghai 201403,China)
The pathogenicity identification of 9strains of Corynespora cassiicola isolated from cucumber inshanghai,Shandong,Liaoning andguangdong were carried out usingspray inoculation method ingreenhouse.The activity and control effect of commonly used fungicides were evaluated by measuring thegrowth rate of mycelium and field test.The resultsshowed that the pathogenicity of the isolates from thesame host indifferent regions hadsignificantdifferences,however,the pathogenicitydifferentiation of races todifferent varieties were not found among thestrains.The resistance of 10 leading varieties to cucumber target leafspotshowedsignificantdifferences.The variety‘Biyu’showed highest resistance,while‘Chunwu’and‘Shenqing No.1’showed rather low resistance.Thedisease could be effectively controlled by 430g/L TebuconazolesC or 45%Prochloraz EC in bioassay and field trial.
Cucumber target leafspot;Corynespora cassiicola;Pathogenicity;Chemical control
S436.421
A
1000-3924(2016)04-116-06
2015-08-10
上海市科技兴农重点攻关项目[沪农科攻字(2012)第2-10号];上海市科技兴农重大项目[沪农科重字(2010)第4-1号];上海市农业科学院科学技术发展基金项目[农科发2013(11)]
徐丽慧(1982—),女,博士,助理研究员,主要从事植物病理学研究
,Tel:021-52210082,E-mail:fumingdai@163.com

