Gorham-Stout综合征临床特征分析
刘书中,周 熹,宋 桉,王以朋,刘 勇*
(1.中国医学科学院 北京协和医学院 北京协和医院 骨科, 北京100730;2.中国医学科学院 北京协和医学院 北京协和医院 内分泌科, 北京100730)
Gorham-Stout综合征临床特征分析
刘书中1,周熹1,宋桉2,王以朋1,刘勇1*
(1.中国医学科学院 北京协和医学院 北京协和医院 骨科, 北京100730;2.中国医学科学院 北京协和医学院 北京协和医院 内分泌科, 北京100730)
Gorham-Stout综合征(Gorham-Stoutsyndrome,GSS)又称大块骨溶解症,是一种以特发性、进行性骨质溶解、吸收为特征的骨代谢疾病。GSS临床罕见,目前世界报道200余例,该病可发生于全身任何骨骼,多为单发,亦可多发,且症状多样,极易漏诊和误诊。GSS患者可有周围肌肉、结缔组织及脏器的受累,部分患者可合并胸腔或腹腔积液,病理学特点早期以骨小梁减少、髓腔扩大、毛细血管或毛细淋巴管瘤样扩张为主要特征,晚期主要表现为髓腔内纤维组织增生。到目前为止,GSS尚无确切有效的治疗方法,部分患者的病情呈自限性,从现有的临床病例资料分析,合并胸腔积液、腹腔积液、累及脊柱以及有周围软组织、脏器受累的患者预后较差。现将我科收治的2例GSS患者与我院病例库中其余5例GSS患者的临床资料做一回顾性分析,以提高对本病的认识。
1 资料与方法
1980年1月至2016年1月我院病例库内共查找到GSS病例7例,其中男性3例,女性4例,年龄范围15-37岁,平均年龄为30.3岁[1]。所有纳入分析病例均通过临床、影像学及病理学资料证实并经多科会诊后确立诊断,纳入分析病例资料详见表1。

表1 我院病例库中7例GSS患者临床特征
2 结果
2.1临床表现
7例患者均有不同部位、不同程度的骨痛症状,其中多处肋骨受累3例,胸骨受累3例,肩胛骨受累2例,骨盆受累2例,肱骨受累1例,锁骨受累1例,脊柱受累1例,股骨受累1例。7例患者中4例合并有呼吸困难,均有单侧或双侧大量胸腔积液,其中3例患者的胸腔积液乳糜试验阳性,胸腔积液送检瘤细胞、抗酸杆菌均阴性。2例有咳嗽、咳痰及痰中带血,其余患者均无咳嗽、咳痰、咯血等呼吸系统症状。2例患者有明显腹胀表现,经腹腔穿刺送检提示乳糜腹。仅1例患者有明显的胸前皮肤萎缩、色素沉着。所有纳入分析患者均无显著发热表现。
2.2辅助检查
纳入分析7例GSS患者的血、尿、粪便常规及肝肾功能检查均无明显异常,自身抗体系列、肿瘤指标均阴性,甲状腺功能、钙磷代谢指标均正常。4例合并胸腔积液患者有不同程度的低蛋白血症。3例患者有轻度血沉增快,所有患者的骨髓活检结果均未见异常。影像学检查方面,7例患者均有不同程度的骨质吸收、破坏(图1,2)。5例患者胸腹盆CT未见明确的实质性脏器病变,2例患者可见明确脾脏多发占位(图3)。6例患者行淋巴管造影检查,2例有明确的示踪剂经胸导管渗漏。骨扫描可示受累部位放射性物质浓聚或分布不均。6例患者接受病变部位骨活检,均未见肿瘤细胞,其中2例仅有局部穿刺标本少许,未见典型的GSS病理学表现,其余5例均与典型GSS病理学特点相符:骨小梁稀疏,髓腔明显扩大,髓腔内纤维组织增生,无明显成骨反应,在纤维结缔组织及髓腔的脂肪组织内可见扩张的毛细血管及淋巴管(图4)。
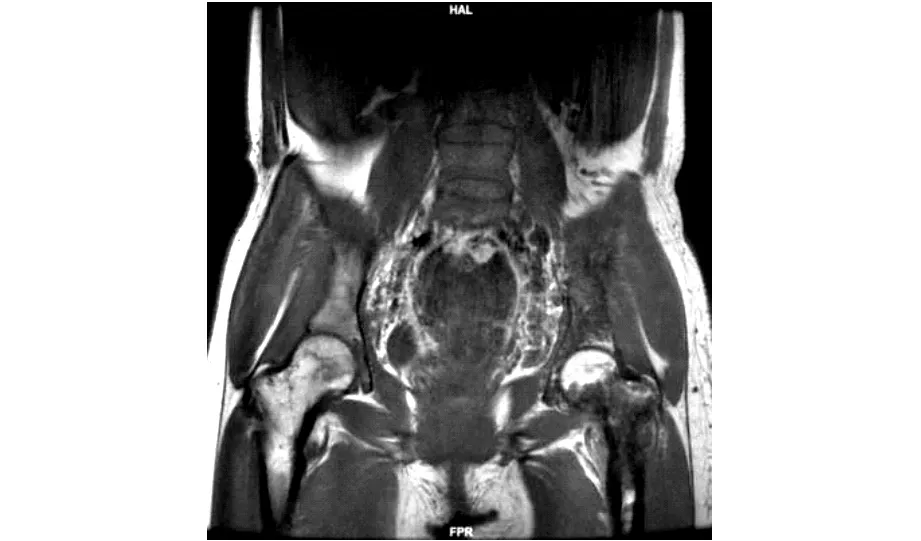
图1 病例6骨盆MRI冠状面T1WI序列

图2 病例6骨盆MRI横轴面T1WI序列

图3 病例6腹部CT示脾脏多发结节
2.3诊疗及随访
纳入分析的7例患者均在就诊过程中进行肿瘤筛查,并经内科、骨科、内分泌科、放射科、病理科等多科会诊,再结合临床资料及文献报道最终确立诊断。治疗方面,3例接受二膦酸盐治疗,4例接受钙剂+活性维生素D治疗,1例接受病变部位放疗,2例病程中予以胸导管结扎治疗;4例合并胸腔积液患者,因单侧或双侧胸腔积液,住院期间需反复胸腔穿刺引流胸腔积液以减轻临床症状。到目前为止,我科诊治的GSS患者定期门诊随诊,病情相对平稳。

图4 病例6术后病理:破碎骨及骨髓组织,骨小梁间见纤维组织及扩张的淋巴管(箭头),D2-40(+)。
3 讨论
3.1病因及发病机制
Gorham-Stout综合征,由Gorham及Stout于1955年首先报道。GSS的病因及发病机制至今尚未阐明。有学者提出以下GSS发生的相关因素:(1)感染,如骨关节炎;(2)中枢神经系统疾病;(3)骨无菌性坏死;(4)血管瘤病等;(5)机械性损伤[2]。GSS发生机制包括:(1)遗传、肿瘤、辐射等诱因,引发破骨细胞的分化及功能调节出现病理性紊乱;(2)骨内淋巴管或血管增殖,富血管组织耗氧增加导致骨吸收增加,引起大块骨质溶解;(3)机械性压迫作用,但近年来研究表明,其发病机制主要倾向于血管和淋巴管瘤性增生而引起骨质溶解,机械性刺激也可起一定作用,但破骨细胞的作用则不明显[2,3]。
3.2临床表现
GSS多见于青年人群,高龄患者少见,无明显遗传及性别倾向[3]。纳入分析的GSS病例中,平均年龄为30.3岁,男∶女为2∶3,均无确切家族史,该临床特点与文献报道一致。GSS病程一般较长,但在疾病早期骨质吸收较快,可单发,也可多发,多发者可跨越关节侵犯邻近骨骼。查阅相关文献报道,发病骨骼由多到少依次为上下肢带骨、长管状骨、扁骨及不规则骨、颅盖骨,常累及的关节有:锁骨-肩胛骨-肱骨、肋骨-椎骨,股骨-盆骨等,累及脊柱者极为少见[4]。本组中肱骨受累1例,肩胛骨受累2例,锁骨受累1例,多处肋骨受累3例,胸骨受累3例,骨盆受累2例,股骨受累1例,脊柱受累1例,与文献描述大致相符。
GSS患者临床表现多样,主要表现为患处疼痛和功能障碍,多以外伤、病理性骨折等原因就诊。血常规、血沉、肝功、电解质等结果多正常,亦有报道GSS患者出现血沉异常增快和碱性磷酸酶水平异常增高[5]。GSS尚可引起相应的并发症,如累及胸壁或肋骨可发生胸导管阻塞继发乳糜胸,而出现乳糜胸者,死亡率高达53%[6]。
3.3影像学检查
本病X线表现为病变骨大量骨质吸收、消失,但无骨质增生硬化,无骨膜反应,无软组织肿物,无瘤骨形成。早期在骨皮质及其下方的髓腔内可见散在、界限不清的骨小梁吸收区,密度减低呈小孔状透亮带,逐渐融合扩大,伴骨皮质变薄、吸收;后期骨小梁吸收区扩大,同时变薄的骨皮质向髓腔内塌陷,进而发生骨组织完全溶解消失。CT检查能更早、更好地反映皮质骨骨质的细微变化及其下方的骨缺损情况,在显示扁骨骨质溶解、早期发现邻近骨的侵犯与蔓延方面具有重要诊断价值[7]。MRI中T1WI和T2WI显示病变处正常骨髓信号被异常信号所取代,早期T1WI呈与肌肉信号相近的低信号,T2WI呈明显的高信号,T1WI强化明显,提示病灶内血管丰富。后期病变静止,纤维组织逐渐取代血管组织,T1WI和T2WI均呈低信号。MRI的信号变化对确定疾病分期、了解病灶活动程度以及预后判断具有重要的指导意义[4]。
3.4病理特点
GSS是一种特异性骨吸收疾病,其骨质溶解与炎症、恶性肿瘤引起的溶骨性骨质破坏在病理特点上存在本质区别,可根据镜下病理特征与骨血管瘤病、骨囊性淋巴管瘤、骨囊肿、组织细胞增生症及恶性溶骨性骨肿瘤等相鉴别。病理学方面主要表现为溶骨而无新生骨及骨膜反应出现,无瘤细胞。有学者提出GSS早期以血管、淋巴管增生为主,后期以纤维组织增生为主并逐渐替代骨组织,最后骨质完全消失,留下一薄层纤维组织包绕髓腔,本组患者的病理结果也支持此观点[8,9]。
3.5治疗
治疗方面,首先应确定疾病累及部位及病变程度。目前尚无确切的治疗方法,主要有内科药物治疗、外科手术及放疗等方法,一般建议病变部位早期制动,避免负重,视情况给予支具保护。适当使用抑制骨吸收的药物,如双磷酸盐、降钙素等,但疗效尚待进一步观察,若患者出现病变累及部位功能障碍,可行内固定术、骨水泥重建术、假体置换术等外科治疗[4,10,11]。放疗用于治疗局部骨破坏或合并乳糜性胸腔积液者,这类患者常因一般情况欠佳或病变弥漫无法耐受手术。有文献报道有效放疗方案为:总剂量40-45Gy,1.8-2.0Gy/次[12]。本组1例接受放疗治疗骨破坏,方案与文献报道一致,目前该例患者病情仍平稳,在内分泌科门诊随诊。GSS一般具自限性,但骨质溶解后多无再生能力,因此可能遗留畸形,导致病变部位功能障碍。
综上,GSS是一种罕见的骨代谢疾病,临床医师应提高对该病的认识,结合临床表现、影像学检查、病理诊断等手段提高诊断的准确性并采取合理的治疗方案改善预后。关于GSS的病因、发病机制、诊疗及预后尚需进一步深入研究,期待为更多的患者带来福音。
[1]黄慧,徐作军,王立,等.Gorham-Stout综合征五例临床分析并文献复习[J].中华内科杂志,2009,48(1):23.
[2]DellingerMT,GargN,OlsenBR.ViewpointsonvesselsandvanishingbonesinGorham-Stoutdisease[J].Bone,2014,63:47.
[3]HuP,YuanXG,HuXY.Gorham-StoutsyndromeinmainlandChina:acaseseriesof67patientsandreviewoftheliterature[J].JZhejiangUnivSciB,2013,14(8):729.
[4]SekharappaV,ArockiarajJ,AmritanandR,etal.Gorham'sDiseaseofSpine[J].AsianSpineJ,2013,7(3):242.
[5]牟宇科,尉建杰,宋军川.大块骨溶解症[J].中国骨肿瘤骨病,2009,8(2):101.
[6]BrodszkiN,LnsbergJK,DictorM,etal.AnoveltreatmentapproachforpaediatricGorham-Stoutsyndromewithchylothorax[J].ActaPaediatr,2011,100(11):1448.
[7]CeroniD,DeCoulonG,RegusciM,etal.Gorham-Stoutdiseaseofcosto-vertebrallocalization:radiographic,scintigraphic,computedtomography,andmagneticresonanceimagingfindings[J].ActaRadiol,2004,45(4):464.
[8]LiuY,ZhongDR,ZhouPR,etal.Gorham-Stoutdisease:radiological,histological,andclinicalfeaturesof12casesandreviewofliterature[J].ClinRheumatol,2016,35(3):813.
[9]NikolaouVS,ChytasD,KorresD,etal.Vanishingbonedisease(Gorham-Stoutsyndrome):Areviewofarareentity[J].WorldJOrthop,2014,5(5):694.
[10]CarbóE,Riquelme,GarcíaA,etal.Vertebroplastyina10-year-oldboywithGorham-Stoutsyndrome[J].EurSpineJ,2015,24(Suppl4):S590.
[11]HagendoornJ,YockTI,BorelRinkesIH,etal.NovelmolecularpathwaysinGorhamdisease:implicationsfortreatment[J].PediatrBloodCancer,2014,61(3):401.
[12]DuffyBM,ManonR,Pate1RR,etal.AcaseofGorham’sdiseasewithchylothoraxtreatedcurativelywithradiationtherapy[J].ClinMedRes,2005,3:83.
1007-4287(2016)08-1346-03
2016-03-15)

