乳腺癌细胞三维培养模型构建及其药物敏感性研究
姜昊声 曹 燕 吴绍秋 刘冰妍 贾一平 王振磊 尚鸣异
·基础研究·
乳腺癌细胞三维培养模型构建及其药物敏感性研究
姜昊声曹燕吴绍秋刘冰妍贾一平王振磊尚鸣异
目的观察乳腺癌MCF-7细胞在3D与2D培养模式下对阿霉素的敏感性。方法应用模板印制凝胶微孔支架技术建立体外3D细胞培养模型,通过倒置显微镜等方法观察3D细胞球的生长特性;采用AlamarBlue法获得不同培养模式下药物阿霉素作用的细胞抑制率;采用流式细胞术比较2D培养和3D培养细胞周期、细胞凋亡的差异。结果3D与2D培养相比,G1/G0期胞增多,S期、G2/M期细胞减少,细胞周期受阻滞,具有统计学差异(P<0.05);活细胞减少,早期凋亡、晚期凋亡、坏死细胞比例增大(P<0.05)。阿霉素作用3 d后,3D培养细胞的IC50值为23.77 μg/ml [95% CI 15.80~35.77],2D培养细胞的IC50值为0.46 μg/ml (95% CI 0.28~0.75),MCRI为51.7。结论3D培养MCF-7细胞在细胞周期、细胞凋亡等方面与2D培养细胞存在明显差异,可能是导致乳腺癌多细胞耐药的重要原因。
乳腺癌;肿瘤多细胞球;3D培养;阿霉素;抗药性
(ThePracticalJournalofCancer,2016,31:871~874)
近年来,3D细胞培养在药物研究和生物学研究中的应用越来越广泛。研究表明,相比于传统的2D平面培养,在3D立体培养状态中细胞的形态和功能更加贴近动物体内活细胞的真实生长状况,能够更好的模拟药物和肿瘤作用的真实情况。肿瘤多细胞球(multicellular tumor spheroids,MCTs)是1种经典的3D细胞培养模型,近似于肿瘤发生早期的无血管瘤或实体瘤组织中远离血管的区域,其通过模拟肿瘤异质性结构、细胞与细胞、细胞与基质之间的相互作用,从而能模拟肿瘤组织的生理学特征[1-3]。MCTs已广泛的应用于药物筛选与作用机制研究。目前3D培养已有多种技术,如旋转瓶技术(spinner flask)、生物反应器技术(bioreactor)[4]、琼脂-液体覆盖法(soft agar-liquid overlay)[5]、悬滴法(hanging drop)[6]、3D多孔支架(porous 3-D scaffold)等[7-8],但这些方法存在一定的局限性,产生的细胞球大小差异大、大规模制备受限、细胞球收集困难,或者需要较先进的设备等。
本文中,利用凝胶微孔支架技术构建得到了MCTs,系统性观察细胞球的生长变化,检测乳腺癌MCF-7多细胞球的形成对阿霉素敏感性的影响,以及观察细胞周期分布,细胞凋亡对肿瘤多细胞球耐药产生的影响。
1 材料与方法
1.1试剂和仪器
胰蛋白酶、高糖DMEM培养基、青霉素/链霉素、胎牛血清(Hyclone,美国);阿霉素(Sigma,美国);琼脂糖、AlamarBlue细胞活性试剂盒(Invitrogen,美国);细胞周期检测试剂盒(碧云天,中国);细胞凋亡检测试剂盒(南京建成生物工程研究所,中国);倒置相差显微镜(Nikon,日本);酶标仪(TECAN,瑞士);流式细胞检测仪(BD,美国);CO2培养箱(Thermo Fisher,美国)。人乳腺癌细胞系MCF-7由上海交通大学医学院中心实验室提供。
1.2方法
1.2.13D立体凝胶微孔支架的制备采用高分子材料模板[9]来制备3D立体凝胶微孔支架。主要步骤为:以灭菌后的2%琼脂糖平铺于培养板孔底部,再将模板印置于其上,待冷却后移除模板,培养板孔底部遂形成含有大量一致孔径的凝胶层,见图1。细胞培养板紫外光照射2 h以备用。

A为制备凝胶微孔支架的模板,B为凝胶微孔支架,C为3D细胞球培养板
图13D立体凝胶微孔支架制备
1.2.2细胞培养单层培养采用常规贴壁法,3D多细胞球培养应用凝胶微孔支架技术,主要步骤为:①消化对数期平面培养MCF-7细胞,制成4×105/ml的单细胞悬液;②用PBS和完全培养基依次润洗3D细胞球培养板,排除微孔内气泡;③取2 ml细胞悬液加入已用凝胶微孔支架铺底的3D多细胞球培养板,置37 ℃、5% CO2、饱和湿度培养箱内培养;④隔天换液。
1.2.3多细胞球生长观察使用倒置显微镜观察并照像记录,应用ImageJ软件进行多细胞球直径(n=30)的计算。
1.2.4药物敏感性测定收集对数期平面培养MCF-7细胞,调整单细胞悬液浓度,按2×104/cm2的密度接种于96孔板,每孔加完全培养基100 μL,置于孵箱中培养24 h。3D多细胞球按上述凝胶微孔支架方法,培养3 d。2D和3D培养系统各分为10组,每组4孔。对照组换普通培养液,9个实验组各孔分别换含10-3、10-2、10-1、1、5、10、20、40、60 μg/ml阿霉素的培养液。于加药后3 d行AlamarBlue检测。各组分别更换培养液,每孔加入含10% AlamarBlue完全培养基,继续孵育2 h。用荧光酶标仪测量各孔的荧光强度。根据测得的数值,以浓度为横坐标,荧光强度为纵坐标,应用GraphPad Prism 5.0软件绘制药物剂量反应曲线,计算50%抑制浓度(50% inhibition concentration,IC50)和多细胞耐药指数(multicellular resistance index,MCRI)。
1.2.5细胞周期和细胞凋亡的测定将MCF-7细胞2D平面培养3 d,凝胶微孔支架培养6 d,分别酶解成单个细胞,收集,用预冷70%乙醇4 ℃固定12 h,碘化丙啶37 ℃避光温浴染色30 min,流式检测和FlowJo分析细胞周期分布。将2D平面培养3 d的MCF-7细胞,凝胶微孔支架培养8 d的MCF-7细胞球,分别酶解成单个细胞,收集,用500 μl结合液重悬细胞,加入5 μl Annexin V-FITC,轻轻混匀后再加入5 μl的碘化丙啶,轻轻混匀,室温避光孵育10 min,流式检测和FlowJo分析细胞凋亡率。
1.3统计学分析
应用SPSS 16.0软件进行统计分析,数据以平均值±标准差形式呈现,采用独立样本t检验分析组间差异,P<0.05时具有统计学意义。
2 结果
2.1MCF-7细胞球的生长特点
用预制的模板来制备凝胶微孔支架,这一支架含有大量孔径一致的微孔。当单细胞悬液均匀接种于凝胶微孔支架铺底的3D多细胞球培养板时,细胞在微孔中相互聚集,形成多细胞聚集体,多个细胞聚集体在细胞连接的作用下开始融合,形成边界光滑连续的多细胞球;随着培养时间的加长,细胞球外层细胞的增殖,球体边缘开始变毛糙,球体体积逐渐增大;培养7 d后,大多数细胞球直径和形态不再发生明显的变化(图2)。图3显示的是细胞球直径变化曲线图。细胞球形成后,直径经过一个短暂的减小后逐渐的增大,大约一周后,直径进入平台期,不再明显增大。应用凝胶微孔支架技术制备出的细胞球,大小较一致(SD≤ 10%),且细胞连接牢固,可以通过移液枪吹打来大量的收集。图4显示的是培养3 d后收集的细胞球。

图2 MCF-7细胞球生长变化图
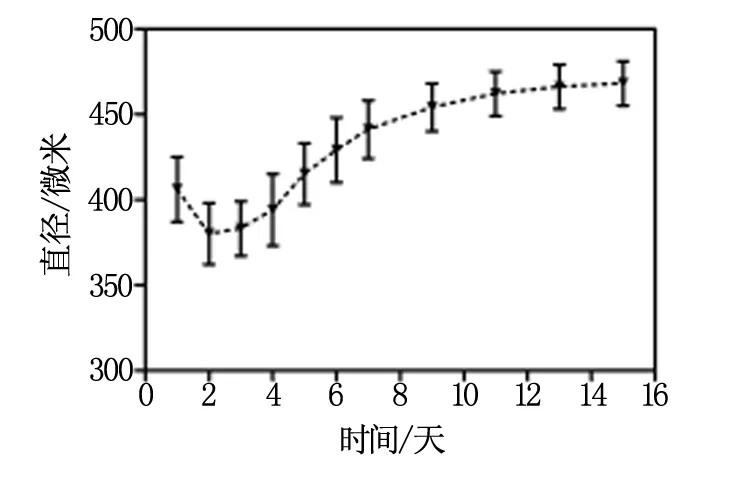
图3 细胞球直径变化曲线图
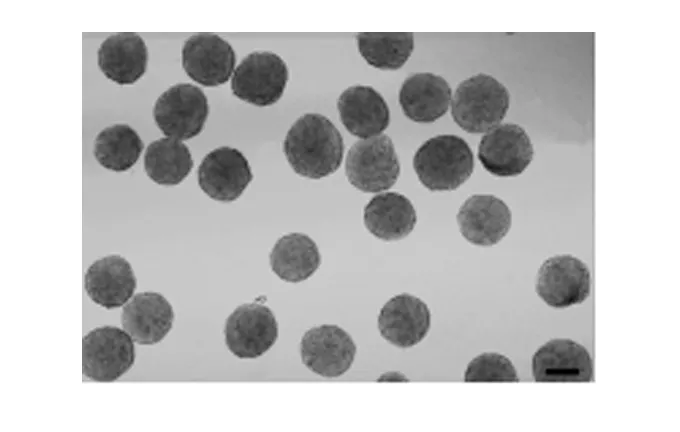
图4 凝胶支架上收集到的大量培养3 d后的MCF-7细胞球
2.23D与2D培养MCF-7细胞对阿霉素的敏感性
阿霉素对3D与2D培养MCF-7细胞剂量反应结果见图5。与2D培养相比,各浓度组3D培养MCF-7细胞对阿霉素的药物敏感性明显降低,二者有显著性差异(P<0.05)。随着药物浓度加大,3D与2D培养细胞抑制率都明显升高。阿霉素作用3 d后,3D培养细胞的IC50值为23.77 μg/ml[95% CI 15.80~35.77],2D培养细胞的IC50值为0.46 μg/ml (95% CI 0.28~0.75),MCRI 为51.7,可见3D培养细胞对阿霉素的耐药性增加,这一结果与Håkanson 等[10-11]学者的研究结果一致。
2.33D与2D培养MCF-7细胞的细胞周期分布
应用流式细胞仪检测2种培养系统下MCF-7细胞周期的分布,3D培养与2D培养相比,存在细胞阻滞,G1/G0期细胞增多,S期、G2/M期细胞减少,具有统计学差异(P<0.05)(表1)。
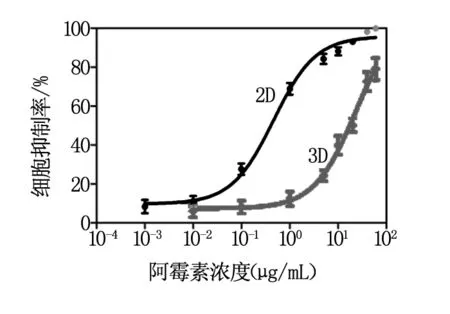
图5 阿霉素对3D与2D培养MCF-7细胞剂量反应曲线

培养系统G1/G0SG2/M2D40.76±1.9049.44±2.635.81±0.303D59.48±3.10*30.70±2.52*4.42±0.17*
注:与2D平面培养比较,*为P<0.05。
2.43D与2D培养MCF-7细胞的细胞凋亡比较
应用流式细胞仪检测2种培养系统下MCF-7细胞凋亡,3D培养与2D培养相比,活细胞减少,早期凋亡、晚期凋亡、坏死细胞比例增大,具有统计学差异(P<0.05),见表2。

表2 3D立体和2D平面培养MCF-7细胞凋亡率比较/%
注:与2D平面培养比较,*P<0.05。
3 讨论
目前,进行体外药物敏感实验一般采用传统的平面培养,而体内药物的作用靶点通常是具有一定组织结构的实体瘤,瘤体内细胞异质性明显,在细胞与细胞、细胞与基质之间存在着广泛的相互作用和相互影响,因而与单层培养的肿瘤细胞的生长状态存在差异。肿瘤细胞体外三维培养可得到近似于体内肿瘤的组织结构,能够更好的模拟药物和肿瘤作用的真实情况。而肿瘤多细胞球作为一种经典的3D细胞培养模型越来越受学者们的重视。本研究采用预制的模板制备立体凝胶微孔支架,对乳腺癌MCF-7细胞进行3D培养。当单细胞悬液接种于凝胶微孔支架铺底的3D细胞球培养板时,细胞在微孔中相互聚集、融合,短时间内(24 h)就能自发形成肿瘤多细胞球。形成的细胞球大小也较一致(SD≤10%),这对于在药物研究中获得可重复的结果非常重要。因制备的细胞球具有牢固的三维立体结构,我们能够轻松的通过移液枪冲洗来收集,并对单个细胞球进行定性或者定量的分析。这一经凝胶微孔支架铺底的3D细胞球培养板,能够大规模的制备多细胞球,在高效药物筛选中具有广泛的应用前景,可进行商业化的生产。
肿瘤细胞耐药是影响化疗疗效和患者预后的重要因素之一。本实验结果显示:阿霉素作用3 d后,3D培养细胞的IC50值为23.77 μg/ml,2D培养细胞的IC50值为0.46 μg/ml。3D培养MCF-7细胞对阿霉素的多细胞耐药指数为51.7,与2D培养细胞相比,对化疗药物阿霉素明显耐药,表明实验所建立的乳腺癌多细胞耐药模型是成功的。
3D培养MCF-7细胞与2D培养细胞相比,细胞周期明显阻滞于G1/G0期,可能是导致乳腺癌多细胞耐药的重要原因。肿瘤多细胞球(直径>200 μm)可分为边缘增殖细胞区,中间静止细胞区、中心坏死区[12],这种异质性的细胞分布以及球样体内的物质梯度极其类似于体内肿瘤微转移灶、局部无血管肿瘤组织和实体瘤组织中远离血管的区域。然而,MCTs内大量肿瘤细胞滞留在细胞周期某个时相点,除导致一些细胞周期特异性化疗药物失效外,由于其增殖缓慢,处于相对静止或者静止状态,极易对其他许多化疗药物产生耐受[13]。结果还显示,3D培养MCF-7细胞细胞凋亡率明显升高,这一结果与Kim 等[13]学者的研究结果不一致。我们主要考虑以下原因:在培养8 d后进行凋亡检测的细胞球直径已经达到450 μm左右,球体直径较大,球体中心区缺乏氧气、营养、代谢产物堆积和低pH值,细胞发生较多的凋亡和坏死。
综上所述,本实验采用凝胶微孔支架技术,成功的建立了乳腺癌多细胞耐药模型。近年来,许多对单层培养肿瘤细胞有较强杀伤作用的化疗药物在进行临床试验时往往不能达到理想效果,而MCTs中细胞形态和功能更加贴近动物体内活细胞的真实生长状况,能够更好的模拟药物和肿瘤作用的真实情况,在药敏研究中应用前景光明。实验中,发现3D培养乳腺癌细胞生物学特性和2D培养细胞相比发生明显改变,特别是球体样三维结构以及细胞间的相互作用可能是诱导多细胞耐药的重要原因,其相关的机制有待进一步的研究。
[1]Pampaloni F,Reynaud EG,Stelzer EH.The third dimension bridges the gap between cell culture and live tissue〔J〕.Nat Rev Mol Cell Biol,2007,8(10):839-845.
[2]Abbott A.Cell culture:biology's new dimension〔J〕.Nature,2003,424(6951):870-872.
[3]Schmeichel KL,Bissell MJ.Modeling tissue-specific signaling and organ function in three dimensions〔J〕.J Cell Sci,2003,116(Pt 12):2377-2388.
[4]Matsuura T.Bioreactors for 3-dimensional high-density culture of human cells〔J〕.Hum Cell,2006,19(1):11-16.
[5]Ivascu A,Kubbies M.Rapid generation of single-tumor sp-
heroids for high-throughput cell function and toxicity analysis〔J〕.J Biomol Screen,2006,11(8):922-932.
[6]Kelm JM,Timmins NE,Brown CJ,et al.Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types〔J〕.Biotechnol Bioeng,2003,83(2):173-180.
[7]Yang J,Goto M,Ise H,Cho CS,at al.Galactosylated alginate as a scaffold for hepatocytes entrapment〔J〕.Biomaterials,2002,23(2):471-479.
[8]Underhill GH,Chen AA,Albrecht DR,Bhatia SN.Assessment of hepatocellular function within PEG hydrogels〔J〕.Biomaterials,2007,28(2):256-270.
[9]Whatley BR1,Li X,Zhang N,at al.Magnetic-directed patterning of cell spheroids〔J〕.J Biomed Mater Res A,2014,102(5):1537-1547.
[10]Håkanson M,Kobel S,Lutolf MP,et al.Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses〔J〕.PLoS One,2012,7(6):e40141.
[11]Fischbach C,Chen R,Matsumoto T,et al.Engineering tum-
ors with 3D scaffolds〔J〕.Nat Methods,2007,4(10):855-860.
[12]Hamilton G.Multicellular spheroids as an in vitro tumor -
model〔J〕.Cancer Lett,1998,131(1):29-34.
[13]Kim JW,Ho WJ,Wu BM.The role of the 3D environment in hypoxia-induced drug and apoptosis resistance〔J〕.Anticancer Res,2011,31(10):3237-3245.
(编辑:吴小红)
Fabrication of Three Dimensional Cell Culture Model of Breast Adenocarcinoma and Detection of Its Drug Resistance
JIANGHaosheng,CAOYan,WUShaoqiu,etal.
TongrenHospital,ShanghaiJiaotongUniversityofMedicine,Shanghai,200072
ObjectiveTo observe the changes of sensitivity to doxorubicin on breast adenocarcinoma MCF-7 cells cultured as 3 dimensional model or monolayer.MethodsMCF-7 cells were cultured as 3 dimensional model using agarose scaffolds with highly ordered micro-wells.The spheroid growth characterization was observed by invert microscope.The sensitivity to doxorubicin on MCF-7 spheroids or monolayers was determined by AlamarBlue assay respectively.Cell cycle and apoptotic rate were detected by flow cytometry.ResultsFor 3D spheroid culture,the proportion of cells in G0~G1phase was higher,while the proportion of cells in S phase and G2-M phase were lower than the 2D culture(P<0.05).The cell viability declined in 3D culture than the 2D control,and the proportion of cells in the early-apoptotic,late-apoptotic phase increased significantly(P<0.05).After 3 days of DOX treatment,the IC50value obtained for spheroid culture was 23.77 μg/ml [95% CI 15.80~35.77],relative to 0.46 μg/ml (95% CI 0.28~0.75) for the monolayer culture.The MCRI value was 51.7.ConclusionThere are significant differences in cell cycle and apoptotic rate between MCF-7 spheroids and monolayer,which may be the important causes of the multicellular resistance of breast carcinoma.
Breast adenocarcinoma;Multicellular tumor spheroids;Three dimensional cell culture;Doxorubicin;Drug resistance
200072 上海交通大学医学院附属同仁医院
尚鸣异
10.3969/j.issn.1001-5930.2016.06.001
R737.9
A
1001-5930(2016)06-0871-04
2016-04-01
2016-04-24)

