不同干制方法对金丝小枣中糖类物质的影响
丁胜华,王蓉蓉,李高阳,吕慧英,肖 轲,单 杨,*
(1.湖南省农业科学院,农产品加工研究所,湖南长沙 410125;2.湖南农业大学,食品科学技术学院,湖南长沙 410128)
不同干制方法对金丝小枣中糖类物质的影响
丁胜华1,王蓉蓉2,李高阳1,吕慧英1,肖轲1,单杨1,*
(1.湖南省农业科学院,农产品加工研究所,湖南长沙 410125;2.湖南农业大学,食品科学技术学院,湖南长沙 410128)
本文分别采用热风干燥法、日晒法和微波干燥法对金丝小枣进行干制,研究以上三种方法对红枣中可溶性糖、果胶含量及果胶分子量分布的影响。结果表明:与新鲜枣果相比,所有干制处理均导致山梨醇和蔗糖含量显著降低(p<0.05),其中微波和日晒处理枣果的蔗糖保留率比热风处理组高,但其果糖与葡萄糖含量低于热风处理组。干制处理导致枣果细胞壁、水溶性果胶和溶于Na2CO3型果胶含量显著下降(p<0.05),而其螯合性果胶含量显著增加(p<0.05)。干制导致枣果果胶分子量显现不同趋势的变化。水溶性果胶组分:热风70 ℃或日光晾晒处理均导致高分子端组分的减少,热风50 ℃处理其分子量分布最为集中;溶于Na2CO3型果胶组分:干制导致高分子端果胶组分的增加,低分子端组分则发生降解。
干制,枣果,可溶性糖,果胶,分子量分布
红枣(Zizyphus jujuba dates)是鼠李科枣属植物枣树的果实。枣果具有很高的营养与功效,是一种天然的药食两用同源的食品。国内外对枣果化学成分的研究表明,枣果含有丰富的糖类、氨基酸、有机酸、维生素C、矿物质、酚类化合物、萜类化合物和环核苷酸等[1]。
我国具有丰富的枣资源,但由于红枣集中上市又极易腐败,易失去商品价值,每年约20%~30%红枣因滞销而腐烂掉,损失严重。干制作为其传统加工方法,能够降低水分活度,防止微生物生长和繁殖,降低内部生化反应速率,从而延长货架期,达到贮藏的目的。它既是一个降低水分的物理单元操作,也是发生复杂反应的生化过程。Yi等[2]研究枣果的薄层干燥特性并建立其干燥模型,发现Weibull分布模型对于预测实验结果优于其它薄层干燥模型。Wang等[3]研究了不同干燥方式对金丝小枣抗氧化能力、多酚、环核苷酸以及挥发性成分的影响。金丝小枣核小皮薄,肉质细腻,种植适应性强,是一种鲜食加工兼用品种,在北京、河北、山东等省市广泛种植。关于枣果干制干燥动力学以及品质特性变化已有较多报道,但关于金丝小枣干制过程中可溶性糖和果胶多糖的变化规律的报道还较少。因此,本文以金丝小枣为研究对象,研究不同干制方法对可溶性糖、果胶多糖含量以及果胶多糖的分子量分布的影响,旨在为金丝小枣的干制加工及其资源的高效利用提供基础资料和参考依据。
1 材料与方法
1.1材料与仪器
金丝小枣九月下旬于北京市门头沟区斋堂镇王龙口村采集,全红果50 kg,选择大小均一,无机械伤和无病虫害的全红枣果作为实验原料。
乙二酸四乙酸钙盐、葡萄糖、果糖、山梨醇和蔗糖等,为色谱纯购自Sigma-Aldrich上海贸易有限公司;葡聚糖系列标品,色谱纯购自昭和电工科学仪器有限公司;乙醇、甲醇、氯仿、丙酮、二甲基亚砜、二乙胺四乙酸、碳酸钠、硼氢化钠、醋酸钠、亚硝酸钠分析纯购自北京化学试剂厂。
紫外分光光度计(T6)北京普析通用有限责任公司;冷冻干燥机(LGJ-25C)北京四环科学仪器厂;高速冷冻离心机(CR21GIII)日本HITACHI公司;高效液相色谱(K1001)德国Knauer仪器有限公司。
1.2实验方法
1.2.1枣果干燥实验
1.2.1.1热风干制(AD)实验将挑选、清洗的金丝小枣(1 kg)平铺于电热恒温干制箱中,风速为0.75 m/s,分别设置热风干制温度为50 ℃(AD50)、60 ℃(AD60)和70 ℃(AD70),枣果的干制终点的含水量为18.66%±0.03%。
1.2.1.2日晒(SD)实验将挑选、清洗的金丝小枣(1 kg)平铺于实验托盘中,置于阳台上,风干约12 d。枣果的最终含水量为20.10%±0.20%。
1.2.1.3微波干制(MD)实验将挑选、清洗的金丝小枣(500 g)平铺于塑料容器中,设置微波功率为150 W,干制的水分终点为19.05%±0.41%。
1.2.2可溶性糖的测定将枣果于打浆机中打碎,称取8 g枣果,加50 mL蒸馏水常温下超声辅助提取30 min,9000×g下离心15 min,收集上清液,滤渣重复提取1次,合并滤液,过0.45 μm滤膜待测。蔗糖、葡萄糖、果糖和山梨醇采用HPLC法进行测定[4]。结果以毫克每克干重计(mg/g DW)。
1.2.3细胞壁物质(CWM)的制备取去核鲜枣40 g或干果20 g置于200 mL烧杯,根据枣果不同的水分含量,加入80%(v/v)乙醇,然后将烧杯置于沸水浴,煮沸20 min以破坏细胞壁钝化酶,取出冷却后用400目滤布过滤,收集滤渣,重复上述步骤三次。滤渣残留物用100 mL 90%二甲基亚砜水溶液(9∶1,v/v)在4 ℃过夜除淀粉。滤渣加入100 mL氯仿甲醇溶液中(2∶1,v/v)溶解10 min,用丙酮洗涤直至样品变白,残留物即为CWM,35 ℃烘干至恒重[5]。结果以毫克每克干重计(mg/g DW)。
1.2.4果胶组分的制备过程参考Sila等[6]的方法。CWM(1.0 g)加入120 mL去离子水,在25 ℃振荡溶解4 h,然后400目的尼龙纱布过滤,残渣重复加去离子水提取2次。收集滤液,用分子截流量为3000 u的透析膜透析24 h后定容。取部分果胶溶液经冻干后放入干燥器中备用,即为水溶性果胶(WSP)。残渣再用120 mL 0.05 mol/L的二乙胺四乙酸溶液(含0.1 mol/L的醋酸钠,pH=6.5)在25 ℃振荡溶解4 h,按上述条件提取过滤两次,合并滤液,透析24 h,后定容。取部分果胶溶液经冻干放入干燥器中备用,即为螯合溶质果胶(CSP)。滤渣再用20 mL 50 mmol/L Na2CO3溶液(含20 mmol/L NaBH4)在25 ℃振荡溶解4 h,按上述条件提取过滤两次,透析24 h后定容,取部分果胶溶液经冻干后放入干燥器中备用,即为溶于Na2CO3果胶(SSP)。
1.2.5果胶含量的测定采用分光光度法,以半乳糖醛酸作为标准物质测定[7],结果以毫克每100 g鲜重计(mg/100 g FW)。
1.2.6果胶分子量的测定按照Guo等[8]的方法采用体积排阻色谱法(HPSEC)测定果胶分子量。将果胶溶液和标准品经过0.45 μm滤膜进行色谱分析,以不同分子量的葡聚糖标准品制作标准曲线。根据不同葡聚糖标品在HPSEC色谱图保留时间与其对应分子量的对数lg(Mp)作出相应的标准曲线,样品按照上述方法测定其保留时间,然后根据保留时间计算峰位分子量。
1.3数据统计与分析
采用Origin 8.0统计分析数据,结果以平均值±标准差表示,进行单因素方差分析,采用t检验,当p<0.05,表示差异显著。
2 结果与分析
2.1不同干制方式对枣果中可溶性糖含量的影响
表1是不同干制方法对枣果中果糖、葡萄糖、山梨醇和蔗糖的影响。由表1可知,鲜枣经脱水处理后,其可溶性糖的含量发生了不同程度的变化。其中经热风干制处理(AD50、AD60和AD70)的枣果中果糖和葡萄糖的含量均显著升高(p<0.05);而经MD处理后,枣果中蔗糖与葡萄糖均显著降低(p<0.05),而果糖含量变化不显著(p>0.05)。干制后枣果的蔗糖含量均显著降低(p<0.05),且不同干制处理间枣果的蔗糖含量差异显著(p<0.05),其中经AD50处理的枣果中蔗糖含量最低,为52.67 mg/g DW。蔗糖含量的减少可能与枣果中存在的蔗糖酶(SS)以及蔗糖转化酶(Ivr)有关。枣果经干制处理时,SS和Ivr并未被立即钝化,枣果的细胞结构被破坏,SS和Ivr和蔗糖接触机率增加,从而水解蔗糖生成葡糖糖和果糖,因此导致了枣果中蔗糖含量的降低,导致葡萄糖和果糖含量升高。而经MD处理的枣果,其蔗糖保留率比热风干制的高,葡萄糖和果糖的含量则分别比热风干制(AD50、AD60和AD70)含量低,其原因一方面是由于MD处理对枣果中酶类如蔗糖转化酶有钝化作用,蔗糖相对被水解得少,导致葡萄糖和果糖生成少;另一方面,MD处理过程时,枣果中的还原糖和游离氨基酸等物质发生美拉德反应。枣果经不同干制方法脱水处理后,枣果中的山梨醇含量显著降低,含量最低的是经SD处理的枣果,其山梨醇含量为0.11 mg/g DW。

表1 不同干制方法对枣果中果糖、葡萄糖、蔗糖和山梨醇含量的影响Table 1 Fructose,glucose,and sucrose,and sorbitol profile of jujubes dehydrated by different drying methods
注:同一类指标进行单因素方差分析多重比较,t检验;表中不同字母表示有显著差异(p<0.05)。
2.2不同干制方法对枣果中CWM的影响
鲜枣和经不同干制方法处理的枣果其CWM含量如图1。鲜枣和干枣其CWM的含量范围为115.32~151.73 mg/g DW。金丝小枣经干制后,其CWM含量显著下降(p<0.05),但干制方式对枣果中的CWM含量呈现不同影响。其中经AD50处理的枣果其CWM含量在干枣中最高,为138.08 mg/g DW;而经MD处理的枣果其CWM含量最低,为115.32 mg/g DW。采用不同AD温度(50~70 ℃)处理得到枣果其CWM含量之间差异不显著(p>0.05),但分别与MD、SD处理之间存在显著差异(p<0.05)。枣果在SD处理时,其温度较低,枣果中的聚半乳糖醛酸酶未被钝化,枣果CWM中的果胶可能在聚半乳糖醛酸酶作用下发生解聚,产生溶于水的小分子物质,从而导致CWM含量下降。而枣果在MD处理过程中,其温度较高,可能导致CWM中果胶物质发生β-消除反应,从而发生导致枣果CWM含量下降。Garau等[9]研究干制温度对柑橘副产物理化特性的影响时发现,经干制后的柑橘副产物CWM的含量均显现降低趋势。
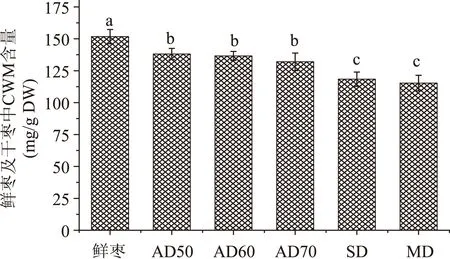
图1 不同干制方法对枣果中CWM含量的影响Fig.1 CWM content of jujubes dehydrated by different drying methods
2.3不同干制方法对枣果中WSP、CSP和SSP的影响

图2 不同干制方法对枣果中果胶含量的影响Fig.2 Pectin content of jujubes dehydrated by different drying methods
由图2可知,枣果经干制后各果胶组分含量均发生显著变化(p<0.05),其中WSP和SSP含量下降,而CSP含量上升。鲜枣其WSP、CSP和SSP含量分别为682.16 mg/100 g FW、22.34 mg/100 g FW、387.79 mg/100 g FW;经干制后,WSP、CSP和SSP含量范围分别为556.70~634.61 mg/100 g FW、32.81~113.91 mg/100 g FW和147.72~215.43 mg/100 g FW。不同干制方法对枣果果胶各组分含量具有不同的影响,与AD50、AD60处理组相比,AD70、SD或MD处理均导致WSP和SSP组分更严重的降解(图2)。AD60处理组枣果的WSP含量最高,为634.61 mg/100 g FW,AD50和AD60处理组其WSP含量则差异不显著(p>0.05),而其余处理组WSP与AD60存在显著差异(p<0.05)。SSP与WSP降解趋势呈现相似规律。与WSP、SSP不同,枣果经脱水处理后,与成熟枣果相比,各处理组枣果CSP含量均呈现增加趋势,且各处理组(隐AD50和SD之间外)间枣果CSP含量存在显著差异(p<0.05),其中AD70处理组含量最高,为113.91 mg/100 g FW,显著高于其余干制处理组枣果中CSP含量(p<0.05)。Plat等[10]研究了胡萝卜经热烫与未经热烫处理干制后其果胶的变化,发现热烫组与未经热烫组其果胶含量比对照组含量显著下降(p<0.05),并且未经热烫组其果胶含量比热烫组更低,并且发现干制处理组出现了新的螯合性果胶组分。本文的实验结果与上述文献报道的结论相类似。当枣果被暴露于干制环境中,干制前期过程实质上是一个水分胁迫和温度胁迫的逆境过程,枣果依然是一个活体,进行着相关代谢。随着干制过程的进行,枣果的细胞结构被破坏,纤维素酶、聚半乳糖酸酶和相应底物接触发生催化水解的几率增大,从而导致纤维素和果胶分子链的缩短,导致可溶性物质的增加;另一方面,一般认为热处理富含果胶组分的材料会发生β-消除反应和酸水解,也会导致果胶物质的降解[11]。而微波辐照物料时,因其偶极子转动和离子传导作用,物料中的极性分子和非极性分子电解质被快速反复极化,发生“取向”和“弛豫”状态,从而发生大量的摩擦、碰撞,产生“摩擦效应”,物料升温,大分子被降解。
2.4不同干制方法枣果中果胶Mw分布的影响
图3为葡聚糖标准品的峰位分子量(Mp)与保留时间(RT)的关系图。从图中可知,葡聚糖的lg(Mp)与葡聚糖的保留时间呈现较好的线性关系,其线性方程为lg(Mp)=0.291RT+9.195,R2=0.992。由于枣果的在干制过程中,其WSP、CSP和SSP均发生了相应的变化。图4是不同干制处理枣果中WSP、CSP和SSP的分子量分布信息图。从图4a可以看出,除AD50处理组外,对照组与其余干制处理组均出现两个色谱峰(色谱峰1和色谱峰2),其相应的Mp在表2中。与对照组相比,干制处理导致了高分子端组分向低分子端组分移动,而原来对照组低分子端发生降解,因此在干制过后,只剩下由高分子端组分降解生成的组分。不同干制处理也会对枣果的WSP组分造成不同影响,其中MD与SD处理其“色谱峰1”的响应值明显低于AD处理组;而且不同AD温度处理,其“色谱峰1”的响应值也不同,AD温度越高,“色谱峰1”的响应值越低。AD50处理干制,并未出现明显的“色谱峰2”,而AD60处理其色谱峰的峰型类似,但其出现了明显的“色谱峰2”;与AD60处理相比,AD70、SD、与MD处理都将导致“色谱峰2”向低分子端移动。这说明,高温处理或者低温处理均会导致WSP的降解,其中高温降解的原因可能是发生了β-消除反应,从而导致分子量的降低;而在SD处理时,由于枣果中PG和果胶甲酯酶在此过程中并未钝化,使得枣果的WSP发生解聚,分子量降低。
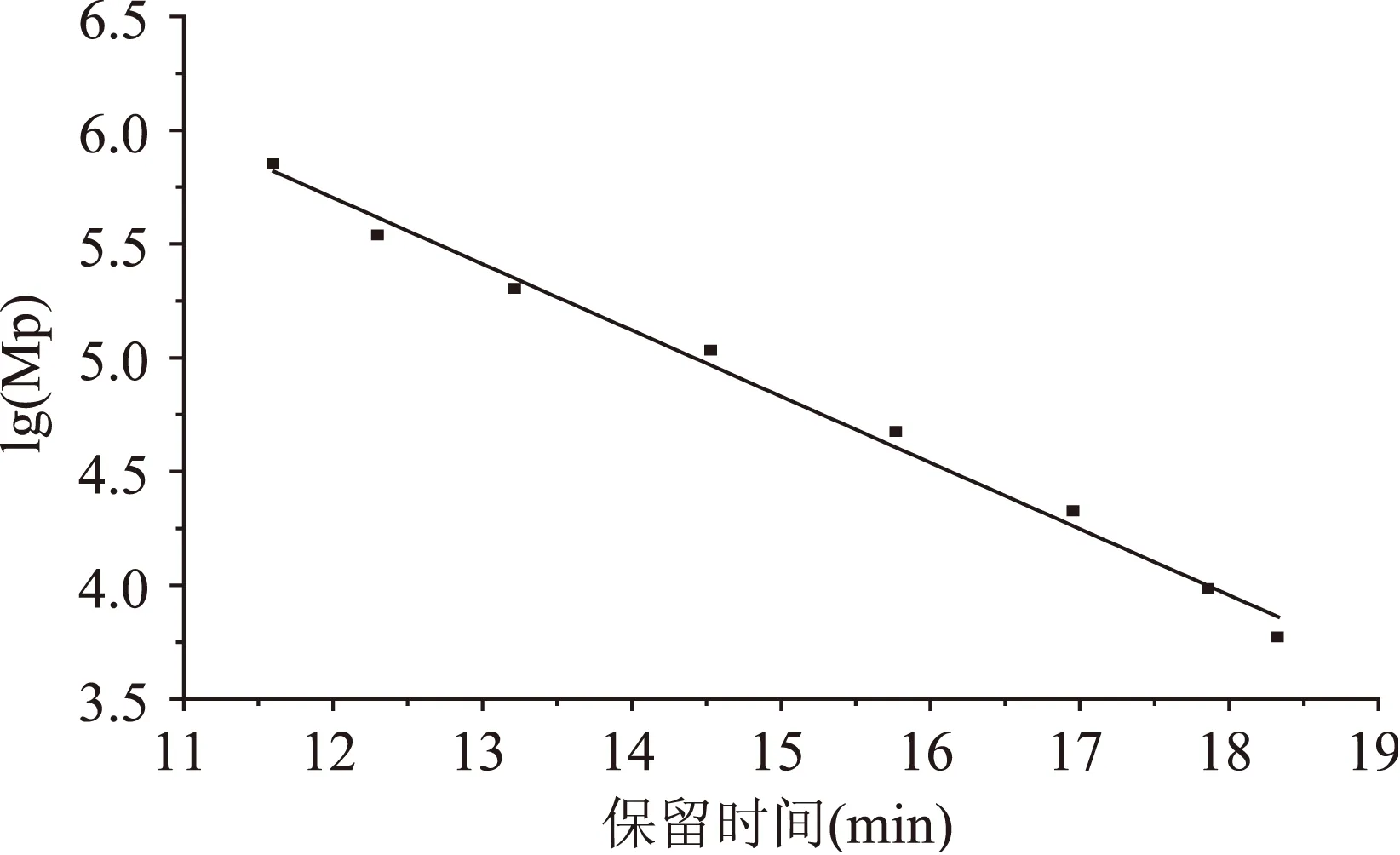
图3 葡聚糖标准品的峰位分子量与保留时间的关系图Fig.3 Relationship between lg(Mp)and RT of glucan
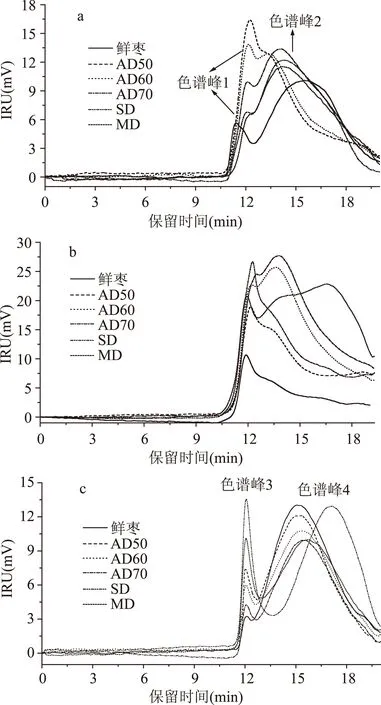
图4 不同干制方法对枣果中果胶组分分子量分布的影响Fig.4 Mw distribution of pectins from jujubes dehydrated by different drying methods注:(a)WSP;(b)CSP;(c)SSP。
图4b是对照组与不同干制处理组枣果CSP组分的HPSEC色谱图。从图4b可以看出,枣果经干制处理后,其CSP响应显著升高;其中对照组、AD50和SD处理其CSP只出现一个色谱峰,而AD60、AD70和MD处理组其CSP出现了两个明显的色谱峰,而且AD60与AD70处理组峰型相似,且AD70处理组响应更高,但其分子量分布更靠向低分子端。MD是各处理组分子量分布最宽的,低分子端出现强烈响应,表明MD处理组其CSP组分的分子量更小。从表2中可以看出,新鲜枣果CSP的Mp,为568.59 ku,且显著高于其余处理组枣果CSP的Mp(p<0.05)。AD60与AD70处理分别出现一个较大的色谱峰,其Mp分别为453.97 ku和442.11 ku,并且差异显著(p<0.05)。这说明,处理温度越高,CSP色谱图向低分子端移动,表明高温更能引起CSP的降解。

表2 不同干制方法的枣果中WSP、CSP和SSP的色谱峰保留时间及其峰位分子量Table 2 RT and Mp of WSP,CSP,and SSP from jujubes dehydrated by different drying methods
图4c是对照组与不同干制处理的枣果SSP组分的HPSEC色谱图。从图4c可以看出,新鲜枣果与干枣中SSP组分均呈现两个色谱峰(色谱峰3和色谱峰4),这说明鲜枣和干枣SSP分别由两种不同分子量的果胶组分组成。其中“色谱峰3”峰型尖锐,RT小,出峰时间短,均为11.99 min左右,这说明“色谱峰3”所对应的组分经不同处理后,其Mp分子量并未发生变化,而只是含量上发生了变化;而“色谱峰4”出峰晚,RT相对长,峰型较宽,出峰时间长,这说明“色谱峰4”所对应的组分随枣果经不同干制,其含量与Mp分子量均发生了变化。比较各干制处理组与对照组“色谱峰3”的峰高响应值,发现鲜枣经干制处理后,“色谱峰3”的响应值明显增大,但其RT并无变化,其响应值从高到低依次为SD、MD、AD50、AD60、AD70和对照组,即处理温度越低,响应值越高。这可能使由于干制处理破坏了枣果的细胞壁结构,使得原来不能被Na2CO3溶液提取的SSP组分转化为可被Na2CO3溶液提取。表2列出了对照组与不同干制处理的枣果SSP的Mp分布。从表2可知,对照组与各干制处理组其“色谱峰3”的Mp不存在显著差异(p>0.05),其Mp主要分布在502.14~506.02 ku之间。比较对照组与各干制处理枣果SSP中“色谱峰4”的出峰峰宽、峰高响应值以及RT(表2)发现:与对照组相比,除AD50处理外,其余各干制处理组其“色谱峰4”整体向低分子端移动,相应的RT也增大,因而其Mp显著降低(p<0.05)(表2)。其中SD处理最为明显,其次是MD处理,其Mp分子量分别为16.83 ku与41.56 ku。不同AD处理之间,枣果的“色谱峰4”的Mp之间也存在显著差异(p<0.05),且AD温度越高,“色谱峰4”的Mp越小,AD50、AD60与AD70处理组枣果“色谱峰4”的Mp分别为61.31、52.86、49.67 ku。
3 结论
与鲜枣相比,所有干制处理均导致山梨醇含量的降低;干制处理均导致枣果中蔗糖含量的显著下降(p<0.05),其中MD和SD处理蔗糖保留率比AD处理组高,但其果糖与葡萄糖含量低于AD处理组。
干制处理导致枣果CWM、WSP和SSP含量显著下降(p<0.05)而其CSP含量显著增加(p<0.05);高温或低温处理均导致枣果中CWM、WSP和SSP含量的更严重的降低。
干制导致枣果果胶分子量显现不同趋势的变化。WSP组分:高温或低温处理均导致高分子端组分的减少,AD50处理其分子量分布最为集中;SSP组分:干制导致高分子端果胶组分的增加,低分子端则发生降解,并且高温或者低温都导致低分子端果胶更为严重的降解。
[1]丁胜华,王蓉蓉,吴继红,等. 枣果实生物活性成分与生物活性的研究进展[J]. 现代食品科技,2016,32(5):331-350.
[2]Yi X K,Wu W F,Zhang Y Q,et al. Thin-layer drying characteristics and modeling of Chinese jujubes[J]. Mathematical Problems in Engineering,2012,2012:1-18.
[3]Wang R R,Ding S H,Zhao D D,et al. Effect of dehydration methods on antioxidant activities,phenolic contents,cyclic nucleotides,and volatiles of jujube fruits[J]. Food Science and Biotechnology,2016,25(1):137-143.
[4]Liu F,Fu S,Bi X,et al. Physico-chemical and antioxidant properties of four mango(MangiferaindicaL.)cultivars in China[J]. Food Chemistry,2013,138(1):396-405.
[5]Zhang F,Dong P,Feng L,et al. Textural changes of yellow peach in pouches processed by high hydrostatic pressure and thermal processing during storage[J]. Food and Bioprocess Technology,2012,5(8):3170-3180.
[6]Sila D N,Doungla E,Smout C,et al. Pectin fraction interconversions:insight into understanding texture evolution of thermally processed carrots[J]. Journal of Agricultural and Food Chemistry,2006,54(22):8471-8479.
[7]Blumenkrantz N,Asboe-Hansen G. A new method for quantitative determination of two uronic acids[J]. Analytical Biochemistry,1973,54(2):484-489.
[8]Guo X F,Zhao W T,Pang X L,et al. Emulsion stabilizing properties of pectins extracted by high hydrostatic pressure,high-speed shearing homogenization and traditional thermal methods:A comparative study[J]. Food Hydrocolloids,35:217-225.
[9]Garau M C,Simal S,Rosselló C,et al. Effect of air-drying
temperature on physico-chemical properties of dietary fiber and antioxidant capacity of orange(Citrusaurantiumv. Canoneta)by-products[J]. Food Chemistry,2007,104(3):1014-1024.
[10]Plat D,Ben-Shalom N,Levi A. Changes in pectic substances in carrots during dehydration with and without blanching[J]. Food Chemistry,1991,39(1):1-12.
[11]Van Buggenhout S,Sila D N,Duvetter T,et al. Pectins in processed fruits and vegetables:part III—texture engineering[J]. Comprehensive Reviews in Food Science and Food Safety,2009,8(2):105-117.
Effect of different drying methods on the saccharides of jujube fruits cvjinsixiaozao
DING Sheng-hua1,WANG Rong-rong2,LI Gao-yang1,LV Hui-ying1,XIAO Ke1,SHAN Yang1,*
(1.Agricultural Product Processing Institute,Hunan Academy of Agricultural Sciences,Changsha 410125,China;2.College of Food Science and Technology,Hunan Agricultural University,Changsha 410128,China)
The effects of different drying methods(air drying,sunlight drying,and microwave drying)on the soluble sugars content,pectin fraction content,and pectin molecular weight distribution of jujube fruits were determined. The results showed that content of sucrose and sorbitol of jujube fruits was significantly decreased after dehydration. The retention rate of sucrose of jujube fruits dried by microwave and sunlight drying was significantly higher than that of air dried jujube fruits,however,the retention rate of glucose and fructose microwave or sunlight dried jujube fruits was lower than that of air dried jujube fruits. Dehydration of jujube fruit cause a significant decrease of cell wall materials,water soluble pectin,and Na2CO3soluble pectin content while introduced a significant increase of chelate soluble pectin content of jujube fruits. Air drying at 70 ℃ or sunlight drying could led to a more serious depolymerization of high molecular weight segment in WSP and AD at 50 ℃ treatment of jujube fruit introduced a more centralized molecular weight distribution of WSP. However,dehydration of jujube fruits could led to an increase of high molecular weight segment in SSP while introduced a decrease of low molecular weight segment in SSP.
drying;jujube;soluble sugars;pectin;molecular weight distribution
2016-01-27
丁胜华(1985-),男,博士,助理研究员,主要从事果蔬加工技术研究,E-mail:shhding@hotmail.com。
单杨(1963-),男,博士,研究员,主要从事果蔬加工理论与技术研究,E-mail:sy6302@sohu.com。
国家自然科学基金(31501543)。
TS255
A
1002-0306(2016)15-0129-05
10.13386/j.issn1002-0306.2016.15.017

