慢性低灌注对大鼠脑白质血管生成与血脑屏障的影响
林琅,黎红华,武强,吴乐
·论著·
慢性低灌注对大鼠脑白质血管生成与血脑屏障的影响
林琅,黎红华,武强,吴乐
目的:观察慢性低灌注状态下大鼠脑白质区域血管生成及血脑屏障破坏状况及其可能联系。方法:96只大鼠随机分为假手术组、缺血1周组、缺血2周组、缺血4周组各24只,缺血组大鼠结扎双侧颈总动脉构建慢性低灌注模型,假手术组不结扎。在相应时间点检测各组大鼠脑白质区域微血管密度、血管内皮细胞生长因子(VEGF)mRNA表达水平及伊文思蓝(EB)静脉注射后脑组织内EB浓度。结果:各缺血组白质区域血管网密度较假手术组高(P<0.01),血管密度在缺血2周组中达高峰。各缺血组VEGF mRNA表达水平均较假手术组增高(P<0.05),缺血2周及缺血4周组的VEGF mRNA表达水平较缺血1周组降低(P<0.05)。各缺血组EB浓度均较假手术组增高(P<0.01),缺血2周及缺血4周组EB浓度较缺血1周组增高(P<0.05)。结论:慢性低灌注状态可诱导VEGF表达、促进血管生成,这种血管生成可能参与脑白质区域血脑屏障破坏机制。
脑缺血;血脑屏障;血管生成;白质损害
慢性低灌注状态被认为是引起脑白质疏松、血管性痴呆的原因之一[1,2]。有研究表明,血脑屏障破坏可能参与缺血状态下脑组织损伤机制[3,4]。但慢性低灌注状态引起血脑屏障破坏的机制目前尚未完全阐明。研究表明,血管生成(angiogenesis)与血脑屏障破坏有密切联系,血管生成过程中的许多重要因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)、金属基质蛋白酶等均可显著升高脑血管内皮细胞的通透性[5,6]。缺血缺氧是诱导血管生成的重要因素[7],但慢性低灌注状态下血管生成是否参与血脑屏障破坏尚无相关研究。本研究探讨慢性低灌注状态下血管生成是否启动,及其对血脑屏障的可能影响。
1 材料与方法
1.1材料
1.1.1实验动物 雄性SPF级Wistar大鼠96只,体质量250~350 g,购自军事医学科学院。
1.1.2主要试剂与仪器 葡聚糖(购于美国Sigma公司),伊文思蓝(Evans blue,EB)购于北京化学试剂公司),RNAiso试剂盒、Prime-Script试剂盒、TaKaRa Taq试剂盒(购于大连宝生物公司),C1-SI激光扫描共聚焦显微镜(购于日本Nikon公司),VT1000S振动切片机(购于德国Leica公司)
1.2方法
1.2.1大鼠分组及干预96只大鼠随机分为假手术组、缺血1周组、缺血2周组、缺血4周组,每组各24只,每组用于检测血管密度、血脑屏障破坏及RT-PCR各8只。将大鼠用戊巴比妥钠(40 mg/kg)腹腔注射麻醉,仰卧位固定,颈正中切口切开皮肤,剥离肌肉,暴露颈总、颈内、颈外动脉,并分离颈总动脉和迷走神经。缺血组结扎颈总动脉,假手术组不结扎,缝合皮肤。术后4组大鼠同条件饲养,假手术组于术后4周处死,缺血1周组、缺血2周组、缺血4周组分别于术后1、2、4周处死并进行不同检测。
1.2.2血管密度检测 大鼠处死前予荧光素异硫氰酸酯标记的葡聚糖50 mg静脉注射,1 h后迅速断头取脑,4%多聚甲醛溶液内保存24 h后,取前囟前2~4 mm区域脑组织振动切片机冠状位切片,片厚100 μm。按Paxinos和Watson《大鼠脑立体定位图谱》确定脑深部白质区域,激光扫描共聚焦显微镜下对脑深部白质取600×600 μm区域行逐层扫描,每层间隔1 μm,共扫描50层。将扫描图像导入3D Doctor 3.5图像分析软件,利用该软件进行三维重建并计算三维空间内血管容积,将血管容积除以三维空间总容积得到血管密度。
1.2.3RT-PCR检测 大鼠脑组织加入液氮研碎,转移入匀浆器,按照RNAiso试剂盒说明书操作提取脑组织总RNA,按PrimeScript试剂盒说明书进行RNA逆转录操作,取逆转录产物0.5 μL作为模板,按TaKaRa Taq试剂盒说明书进行PCR操作。PCR反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,共30个循环;72℃延伸5 min。取10 μL PCR产物加入2 μL溴酚蓝,在1.8%琼脂糖凝胶上电泳,在凝胶图像分析仪上进行吸光度扫描,测定条带的光密度,并计算ROCK与β-actin的光密度比值。PCR引物采用Primer 5软件根据目的序列自行设计,由大连宝生物公司合成。PCR采用β-actin作为内参照,引物序列:VEGF上游引物:5'-GAC CCT GGT GGA CAT CTT CCA GGA-3',下游引物5'-GGT GAG AGG TCT AGT TCC CGA-3';β-actin上游引物:5'-AAC CCT AAG GCC AAC CGT GAA A-3',下游引物:5'-TCA TGA GGT AGT CTG TCA GGT C-3'。
1.2.4血脑屏障破坏检测 大鼠处死前予2%EB (4 mL/kg)静脉注射,6 h后经左心室予0.9%氯化钠注射液500 mL快速灌注,断头取脑,取前囟后2~4 mm处脑组织,称重后置入1 mL 50%三氯乙酸溶液内,经匀浆、离心后,上清液予3 mL无水乙醇稀释,采用荧光分光光度计测定其荧光强度(激发波长620 nm,释放波长680 nm),根据预先测定的标准曲线测定EB浓度,并计算脑组织内EB浓度。
1.3统计学处理
2 结果
2.1血管密度测定
各缺血组血管密度均较假手术组增高(P<0.01),血管密度在缺血2周组中达高峰,但各缺血组间差异无统计学意义(P>0.05),见图1、表1。
2.2VEGF mRNA表达测定
各缺血组VEGF mRNA表达水平均较假手术组增高(P<0.05),缺血2周及缺血4周组的VEGF mRNA表达水平较缺血1周组降低(P<0.05),见图2、表1。
2.3血脑屏障破坏检测
各缺血组EB浓度均假手术组增高(P<0.01),缺血2周及缺血4周组的EB浓度较缺血1周组增高(P< 0.05),缺血2周及缺血4周组的EB浓度差异无统计学意义,见表1。
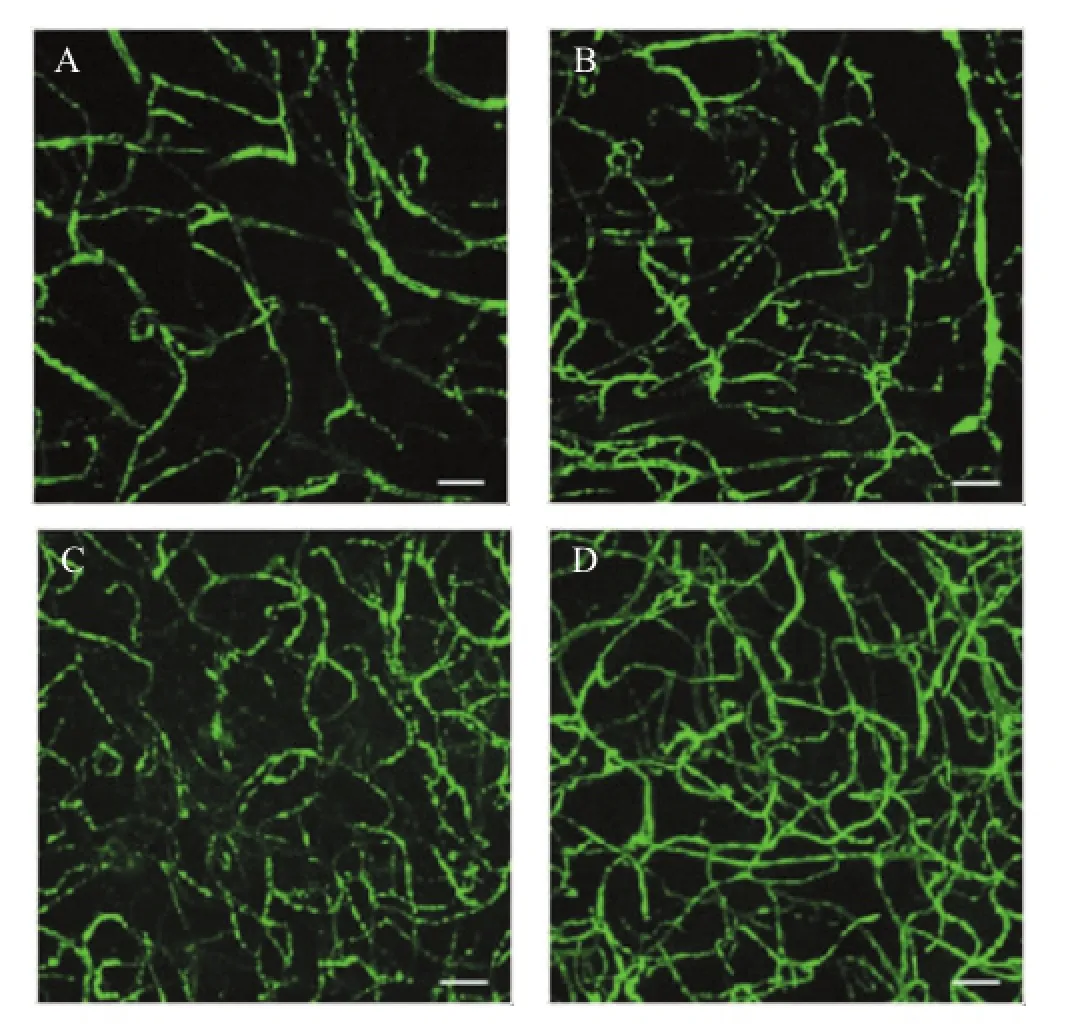
图1 各组大鼠血管密度(异硫氰酸酯荧光素标记)
表1 4组大鼠相关检测指标比较()
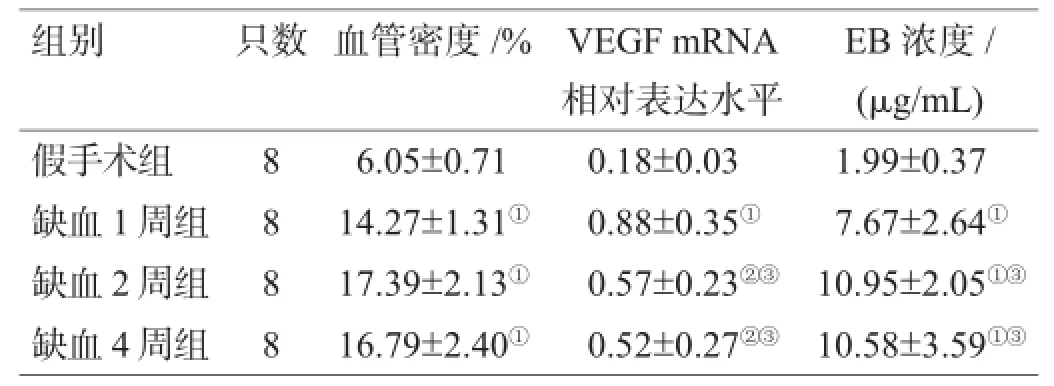
表1 4组大鼠相关检测指标比较()
注:与对照组相比,①P<0.01;与对照组相比,②P<0.05;与缺血1周组相比,③P<0.05
组别 只数 血管密度/% VEGF mRNA相对表达水平EB浓度/ (μg/mL)假手术组 8 6.05±0.71 0.18±0.03 1.99±0.37缺血1周组 8 14.27±1.31① 0.88±0.35① 7.67±2.64①缺血2周组 8 17.39±2.13① 0.57±0.23②③ 10.95±2.05①③缺血4周组 8 16.79±2.40① 0.52±0.27②③ 10.58±3.59①③
图2 各组大鼠VEGF mRNA表达
3 讨论
慢性低灌注是引起脑组织损害的常见病理状态,常被认为是白质疏松等病理损害的基础[8]。目前对缺血性白质损害的机制尚未取得一致认识,但血脑屏障破坏可能是缺血性白质损害的重要原因[9]。脑部的缺血性损害将导致血脑屏障开放,从而使炎性物质、淀粉样前体蛋白等毒性物质在白质积聚,引起脑部的白质改变。
血管生成在缺血性血脑屏障破坏的发生机制中有重要地位。作为血管生成的关键因子之一,VEGF和血脑屏障开放密切相关[10]。在急性缺血性疾病中,脑内VEGF表达上调和血脑屏障通透性的破坏有密切联系,抑制VEGF的信号通道可减轻血脑屏障通透性的破坏[11]。VEGF不仅和缺血状态下的血脑屏障破坏有关,还和肿瘤、颅内感染等病理状态下的血脑屏障破坏相关[6],这提示血脑屏障的破坏可能有共同的发病环节。此外,血管生成过程的另一类重要因子,金属基质蛋白酶也与急性脑缺血时血脑屏障的破坏有密切联系[12]。
缺血缺氧是引起血管生成的主要始动因素,因此慢性低灌注状态下血管生成水平很可能被上调,从而成为慢性低灌注状态下血脑屏障破坏的机制之一。然而,目前对于慢性低灌注状态下血管生成研究甚少,有关慢性低灌注状态下血管生成与血脑屏障破坏间联系的研究更付阙如。大鼠双侧颈内动脉结扎模型自被发明以来,被验证为一种成熟可靠的脑慢性低灌注模型并得到广泛应用。多项研究证实在双侧颈内动脉结扎所致的慢性低灌注情况下,大鼠脑白质会明显脱髓鞘[13,14],并可引起认知功能损害[15]。本研究发现,在慢性低灌注状态下,大鼠脑内VEGF表达水平升高,微血管密度增多,表明慢性低灌注状态可上调血管生成水平。大鼠脑组织内EB浓度水平上升,则表明慢性低灌注状态下血脑屏障破坏,这种破坏与血管生成具有时间上的一致性,可能存在密切联系,有待进一步研究。
[1]Thomas T,Miners S,Love S.Post-mortem assessment of hypoperfusion of cerebral cortex in Alzheimer's disease and vascular dementia[J].Brain, 2015,138:1059-1069.
[2]Kandiah N,Goh O,Mak E,et al.Carotid stenosis:a risk factor for cerebral white-matter disease[J].J Stroke Cerebrovasc Dis,2014,23:136-139.
[3]Schreiber S,Bueche CZ,Garz C,et al.Blood brain barrier breakdown as the starting point of cerebral small vessel disease?-New insights from a rat model[J].Exp Transl Stroke Med,2013,5:4.
[4]Yang Y,Rosenberg GA.Blood-brain barrier breakdown in acute and chronic cerebrovascular disease[J].Stroke,2011,42:3323-3328.
[5]Easton AS.Regulation of permeability across the blood-brain barrier[J]. Adv Exp Med Biol,2012,763:1-19.
[6]Chapouly C,Tadesse Argaw A,Horng S,et al.Astrocytic TYMP and VEGFA drive blood-brain barrier opening in inflammatory central nervous system lesions[J].Brain,2015,138:1548-1567.
[7]Tsipis CP,Sun X,Xu K,et al.Hypoxia-induced angiogenesis and capillary density determination[J].Methods Mol Biol,2014,1135:69-80.
[8]Gurol ME.Cerebral hypoperfusion and white matter disease in healthy elderly and patients with Alzheimer's disease[J].Eur J Neurol,2013,20: 214-215.
[9]Bridges LR,Andoh J,Lawrence AJ,et al.Blood-brain barrier dysfunction and cerebral small vessel disease(arteriolosclerosis)in brains of older people[J].J Neuropathol Exp Neurol,2014,73:1026-1033.
[10]Bai Y,Zhu X,Chao J,et al.Pericytes Contribute to the Disruption of the Cerebral Endothelial Barrier via Increasing VEGF Expression:Implications for Stroke[J].PLoS One,2015,10:e0124362.
[11]Reeson P,Tennant KA,Gerrow K,et al.Delayed inhibition of VEGF signaling after stroke attenuates blood-brain barrier breakdown and improves functional recovery in a comorbidity-dependent manner[J].J Neurosci,2015, 35:5128-5143.
[12]Yang Y,Rosenberg GA.Matrix metalloproteinases as therapeutic targets for stroke[J].Brain Res,2015,1623:30-38.
[13]Kim SK,Cho KO,Kim SY.The plasticity of posterior communicating artery influences on the outcome of white matter injury induced by chronic cerebral hypoperfusion in rats[J].Neurol Res,2009,31:245-250.
[14]林琅,张微微,黄勇华,等.Rho激酶抑制剂对缺血性脑白质损伤的实验性干预研究[J].中华老年心脑血管病杂志,2009,11:980-983.
[15]林琅,张微微,黄勇华,等.法舒地尔对慢性低灌注大鼠认知功能、Rho激酶表达及海马一氧化氮合酶阳性神经元的影响[J].神经损伤与功能重建,2009,4:241-243.
(本文编辑:王晶)
·论著·
Effect of Chronic Cerebral Hypoperfusion on Angiogenesis and Blood-brain Barrier in WhiteMatter
LIN Lang,LI Hong-hua,WU Qiang,WU Le.Department of Neurology,Wuhan General Hospital ofGuangzhou Army,Wuhan 430070,China
AbstractObjective:To explore angiogenesis and blood-brain barrier(BBB)disruption under chronic cerebral hypoperfusion status in white matter areas.Methods:Ninty-six male Wistar rats were divided into groups of sham-operated,ischemia 1 week,ischemia 2 weeks and ischemia 4 weeks(n=24 in each group).Permanent,bilateral common carotid artery occlusion was used to induce hypoperfusion in forebrain of the rats,and the shamoperated group was not ligated.Capillary density was used to assess the angiogenic level.Quantitative measurement of Evans Blue was used to assess the BBB function.Reverse transcription polymerase chain reaction(RT-PCR) was used to evaluate the expression of vascular endothelial growth factor(VEGF)mRNA.Results:The vessel density in the white matter of the ischemia groups were increased than that of the sham-operated group(P<0.01), and the vessel density of the ischemia 2 weeks group was highest.The VEGF mRNA expression of the ischemia groups was higher than that in the sham-operated group(P<0.05),and the VEGF mRNA expression in the ischemia 2,4 weeks groups were decreased compared with that in the ischemia 1 week group(P<0.05).The Evans Blue concentrations of the ischemia groups were increased in comparison with that in the sham-operated group(P<0.05), and the Evans Blue concentrations in the ischemia 2,4 weeks groups were higher than that in the ischemia 1 week group(P<0.05).Conclusion:Chronic cerebral hypoperfusion can induce angiogenesis which may contribute to BBB disruption in white matter areas.
brain ischemia;blood-brain barrier;angiogenesis;white matter impairment
R741;R741.05
A
10.16780/j.cnki.sjssgncj.2016.01.003
广州军区武汉总医院神经内科
武汉430070
2015-07-02
林琅
plexor@163.com

