虾酱罐头在不同的贮藏温度和时间下菌落总数和挥发性物质的变化
戴 娟,马 莉,李 晔
(宁波大学海洋学院 浙江宁波 315211)
虾酱罐头在不同的贮藏温度和时间下菌落总数和挥发性物质的变化
戴娟,马莉,李晔*
(宁波大学海洋学院 浙江宁波 315211)
目的:研究贮藏温度与时间对虾酱罐头菌落总数和挥发性物质的影响。方法:3M试纸检测虾酱罐头在不同温度下(4、16、30 ℃)贮藏一定时间后菌落总数的变化;电子鼻结合顶空固相微萃取(HS-SPME)和气相色谱-质谱(GC-MS)联用技术,分析不同贮藏条件下虾酱挥发性成分。结果:在4、16、30 ℃下贮藏,实验周期内菌落总数分别达到103、105、107数量级。随着菌落数的增加,电子鼻对挥发性物质的检测信号也发生显著变化。由GC-MS分析结果可知,虾酱中主要有醛类、醇类、酮类等挥发性成分,不同贮藏条件下这些挥发性物质的种类和相对含量具有较大的差异。结论:结果表明贮藏温度对虾酱中菌落总数和挥发性物质的影响较大。贮藏温度与时间的不同直接导致了菌落总数的变化,从而影响了微生物的代谢作用,进一步改变了虾酱挥发性物质种类和相对含量。
虾酱罐头,微生物,电子鼻,菌落,挥发性物质
随着中国社会经济的不断发展,人们生活水平的逐渐提高,方便、健康、营养、安全的罐头食品正越来越受到消费者的认可。然而微生物作用引起的腐败问题作为罐头食品食用安全性的主要问题也开始层出不穷,其主要是由于杀菌不足或在杀菌后罐头密封不良而遭受外界污染所造成的[1]。目前,国内外对罐头食品中微生物的检测主要是运用传统的微生物学检测方法,而传统的方法实验步骤繁琐、周期长。因此,找出一种能够准确、快速检测罐头食品微生物的方法具有重要意义。
电子鼻检测过程简单、快速,结果更为客观、准确、稳定,因此电子鼻在食品分析等领域得到广泛的应用[2]。电子鼻作为一种新型技术手段,已被广泛用于食品中的微生物检测。Cincina等[3]用电子鼻系统能够正确检测番茄是否腐败。Falasconi 等[4]利用真菌的顶空挥发性化合物作为其毒素的标记物,用电子鼻嗅觉系统检测玉米中产毒素的镰刀菌株。Horvath 等[5]利用电子鼻系统评估了猪肉排骨的细菌腐败情况。Keshri 等[6]利用电子鼻对从谷物粮食中分离的不同菌株挥发性气味进行分析,建立了五种真菌的电子鼻鉴别模型。
气-质联用仪(GC-MS)主要用于混合样品的分离及定性、定量分析,现已广泛应用于生命科学、环保、材料、食品、药物开发等领域。在早期研究中,已有学者们利用顶空技术结合气相色谱和质谱仪(GC-MS)对微生物的挥发性代谢产物进行了一定的分析[7-10]。
本文以罐装虾酱为实验材料,用3M试纸检测不同贮藏条件下菌落总数的变化情况,通过电子鼻检测确定虾酱中挥发性物质的指纹图谱,并利用GC-MS进一步验证挥发性物质的具体变化,从而建立菌落总数与挥发性物质变化的关联性,探讨利用电子鼻准确、快速检测罐头食品中微生物的可行性。
1 材料与方法
1.1材料与仪器
虾酱罐头(陆龙兄弟)保质期前期,宁波镇海庄市乐购超市。
PEN3便携式电子鼻德国Airsense公司;65 μm聚二甲基硅氧烷萃取头美国Supelco公司;7890/M7-80EI气质联用仪美国Agilent公司、北京普析通用仪器有限责任公司;DB-5毛细管色谱柱(30 m×0.25 mm×2.5 μm)美国Agilent公司。
1.2样品处理
将虾酱罐头分成3组,分别放在3台恒温培养箱中,温度各设定为4、16、30 ℃,在2、4、8、10、12、24 d取样。在无菌环境下对各组罐头进行取样,分别用于微生物检测、电子鼻检测和GC-MS测定。
1.3微生物检测
根据SN/T 1897-2007[11],采用菌落总数Petrifilm TM测试片法。以无菌操作取25 g样品,加入225 mL无菌水中,于8000 r/min均质2 min,制成1∶10的样品匀液。用灭菌吸管准确吸取1∶10的样品液10 mL,放入装有90 mL无菌水的稀释瓶中,迅速振摇混匀样品,制成1∶100的样品稀释液。分别用灭菌吸管按上述方法将样品液依次10倍递增稀释,释至10-10倍。吸取10-1~10-10梯度的稀释液1 mL分别均涂于3M试纸并标记,置于恒温箱中过夜培养,进行菌落计数。
1.4电子鼻测定
准确称取1.0 g样品于15 mL螺纹口样品瓶中,用电子鼻进行检测。检测条件:测试时间300 s,传感器清洗时间200 s,数据采集时间为第250 s。
1.5GC-MS测定
取4、16、30 ℃温度下贮藏24 d的虾酱1.0 g于15 mL螺纹口样品瓶。
固相微萃取条件:将萃取头在气相色谱的进样口进行老化,250 ℃老化45 min。将老化后的萃取头插入样品瓶中,于50 ℃浴吸附30 min后取下,将其插入气质联用仪,进样口220 ℃解吸2 min,启动气质联用仪采集数据。
色谱条件:载气He,流速1 mL/min;不分流模式进样,进样口温度和传输线温度均为220 ℃。程序升温:起始柱温50 ℃,以5 ℃/min升至200 ℃,保留5 min,再以10 ℃/min升至250 ℃,保持2 min。
质谱条件:离子源为电子轰击源(EI),电离电压70 eV,离子源温度230 ℃,扫描范围45~400 u。
1.6数据分析
利用PEN3内部WinMuster 软件对电子鼻测得数据进行主成分分析(Principal Components Analysis,PCA),总贡献率超过70%即可[12]。
利用GC-MS对不同温度下贮藏24 d的虾酱进行具体挥发成分分析,检测结果通过计算机检索,利用NIST和WILEY谱库相互匹配进行定性分析。本文对谱库中化合物相似度低于80(最大值为100)的组分标为未鉴定出,各组分相对百分含量按照峰面积归一化法计算。
2 结果与分析
2.1虾酱在不同贮藏条件下微生物的变化
从图1可以看出,虾酱菌落总数随着贮藏时间的延长而增加;贮藏温度越高,菌落总数增加越快。在4、16、30 ℃条件下,贮藏24 d的虾酱的菌落总数由原来的2.48×102cfu/g,分别增加至7.48×103、6.25×105、8.52×107cfu/g。在实验周期内,0~6 d菌落数增加比较明显,6 d 以后增加速度比较缓慢。30 ℃的虾酱在2~4 d,菌落总数从3.51×103cfu/g急剧增加到7.51×106cfu/g。虾酱在16 ℃贮藏4~6 d菌落总数增加较快。在4 ℃下,24 d的实验周期内,菌落总数变化不大,仅增加了一个数量级。结果表明贮藏温度对虾酱内菌落总数的影响较大,不同温度下贮藏相同时间的虾酱菌落总数差异较大。
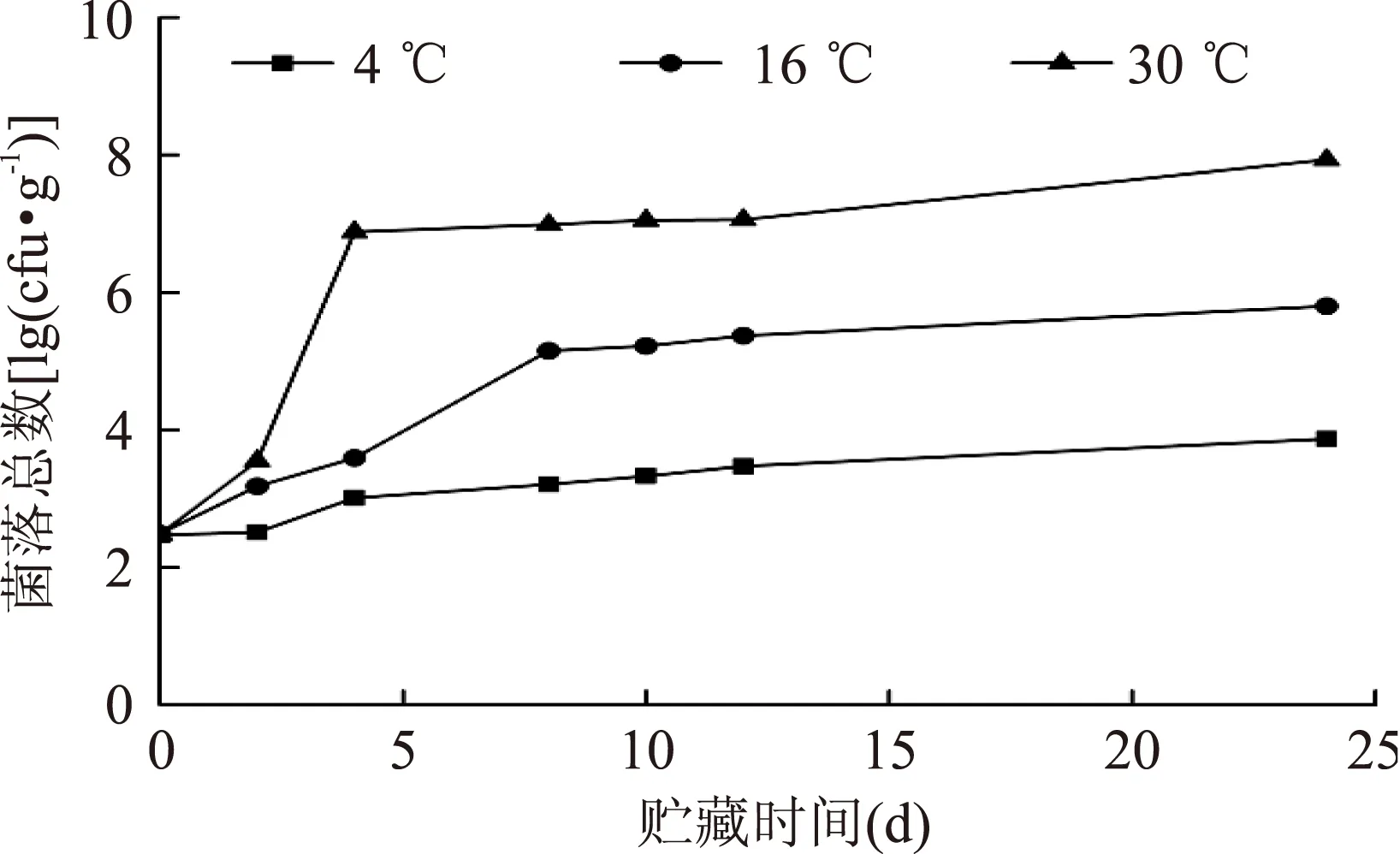
图1 虾酱在不同贮藏条件下菌落总数的变化Fig.1 Changes of total bacterial count in shrimp sauceunder different conditions
2.2虾酱挥发性物质的电子鼻检测
图2是不同贮藏条件虾酱电子鼻PCA分析结果,图中每个椭圆代表不同贮藏温度和时间虾酱的数据采集点。对虾酱挥发性成分做PCA分析,结果PC1贡献率为76.87%,PC1、PC2的总贡献率为95.30%,可见PCA分析可用于区分不同贮藏条件下虾酱的风味。贮藏温度和时间的改变导致了菌落总数的变化,从而影响了虾酱内部挥发性成分的改变。运用电子鼻可以区分不同贮藏条件下虾酱挥发性成分的差异,且体现出一定的变化趋势。因此,电子鼻结果在一定程度上体现了产品被微生物污染程度。
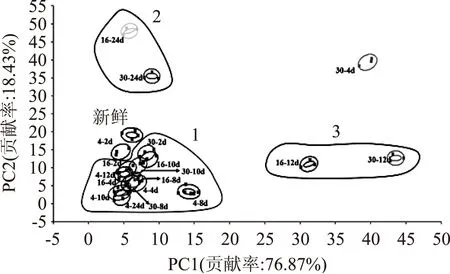
图2 虾酱不同贮藏条件的 PCA分析图Fig.2 The PCA of shrimp paste storged at different conditions注:“16~24 d”表示16 ℃贮藏24 d,以此类推。
由图可以看出,经过不同贮藏温度和时间虾酱的气味发生了变化,在PCA 分析图中呈现一定的聚类特性。如图中所圈示1,在2~10 d,不同贮藏温度(4、16、30 ℃)虾酱的指纹图谱呈现一定的聚类,分布的区域相对比较集中,且有部分重叠。而4 ℃贮藏2 d的虾酱气味指纹和新鲜虾酱的指纹则分开,且距离较近。由图中所示(2、3)可见,在12 d和24 d时,不同温度下的虾酱分布在不同的位置,挥发性气味基本没有重叠得到了较好的区分,且16 ℃和30 ℃气味指纹距离较近,4 ℃与16、30 ℃较远。说明贮藏较长时间(12、24 d)不同温度下虾酱内挥发性气味物质发生了较大的变化。结合菌落总数变化的研究,实验运用GC-MS对不同温度下贮藏24 d的虾酱挥发性物质做进一步分析和鉴定。
2.3虾酱主要挥发性成分的GC-MS分析
经GC-MS 分析鉴定,虾酱在4、16、30 ℃下贮藏24 d分别鉴定出30、22和15 种挥发性化合物,包括烃类、醇类、醛类、酮类、酯类、等其他类化合物,各组分结果见表2。
由表1可以看出,4 ℃虾酱的主要挥发性物质是醛类,相对含量达31.86%,共计8 种。其中相对含量较多的有(E,E)-2,4-庚二烯醛(14.93%)、苯乙醛(6.19%)、庚醛(3.24%)等都是腥味物质[13-14],这几种醛也是导致虾酱腥味的主要物质。(E,E)-2,4-庚二烯醛具有青香、蘑菇似香气,苯乙醛具有类似风信子的香气,赋予水果甜香气,庚醛具有强烈的油脂气味和鱼腥味[15]。(E,E)-2,4-庚二烯醛相对含量很高,推测其跟虾酱的风味有关。醛类的阈值一般较低,醛类物质可能是虾酱中的多不饱和脂肪酸在酶和微生物的作用下发生氧化降解而生成[16],它们产生青香或类黄瓜的气味[17]。醛具有清香和似植物的气味,在各种水产品中都有大量报道,如沙丁鱼、对虾、小龙虾、海蟹和鱿鱼[18]。检测出烃类6 种,相对含量为25.57%,仅次于醛类。酮类共检测出7 种,含量达23.94%,相对含量较多的是3,5-辛二烯-2-酮(9.07%)、1-苯基-1,2-丙二酮(6.11%)、2-壬酮(2.99%)等。此外还含相对含量较多的2-乙基呋喃(1.04%)。
16 ℃贮藏的虾酱主要挥发性物质为烃类,相对含量很高达53.00%。醛类的相对含量降低到12.96%,其中庚醛(4.49%)、苯乙醛(4.62%)相对含量较多。与4 ℃贮藏的虾酱相比,炔烃和烯烃的含量明显增加,其中炔烃含量最多。新检出了糠醇、3-乙基苯甲醛、5-己烯-3-酮、6-辛烯-2-酮、2-乙基环丁酮、丁脒等物质。酮类的阈值比醛类高,酮类物质多由不饱和脂肪酸自动氧化、受热分解、氨基酸降解或微生物作用产生。酮类对食品常常贡献甜的花香和果香风味[19]。烯酮类检出较多,其中3,5-辛二烯-2-酮在4 ℃和16 ℃贮藏的虾酱中均被检出,其为多不饱和脂肪酸自动氧化的产物,30 ℃温度较高,微生物的作用发生了改变。甲基酮类具有独特的青香和果香,并且随着碳链的延长贡献更强花香特征[20]。烯酮类是在加热期间通过脂质氧化生成的产物,具有似玫瑰叶香。
30 ℃贮藏的虾酱主要挥发性物质为烃类和醇类,其中醇类含量上升至22.79%,异戊醇(16.47%)是醇类中含量最多的。醇类由于其较高的阈值,对风味的贡献较小。醇类主要由微生物发酵产生,由于贮藏温度的变化,醇类物质发生了一定改变。30 ℃主要挥发性物质的种类相对较少,其中烃类、醇类、醛类、酮类的种类均有所减少。新增挥发性物质有亚硝酸环己酯、3-己烯-1-醇、3-戊酮、1-氯环己烯。酯类赋予食品甜的果香味,水产品中很少存在小分子脂肪酸酯。发酵肉制品时,酵母菌分解代谢糖类产生的醇与乳酸菌发酵产生的酸反应生成酯类,赋予产品特殊的酯香味,能显著提高产品的香气指数[21]。目前酯类在许多发酵水产品中检出[22]。实验中检测的酯类物质种类较少,主要为己酸乙酯,主要赋予虾酱果香味。
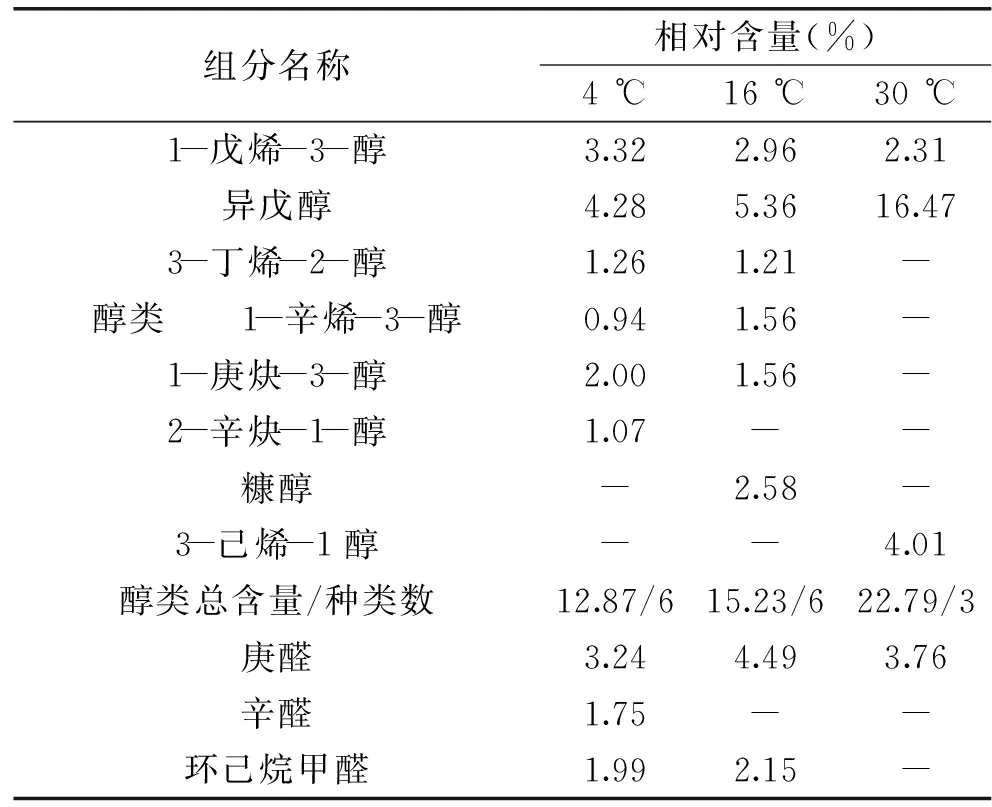
表1 不同贮藏温度下虾酱挥发性物质GC-MS分析Table 1 Volatile substances of shrimp paste GC-MS analysis at different temperatures
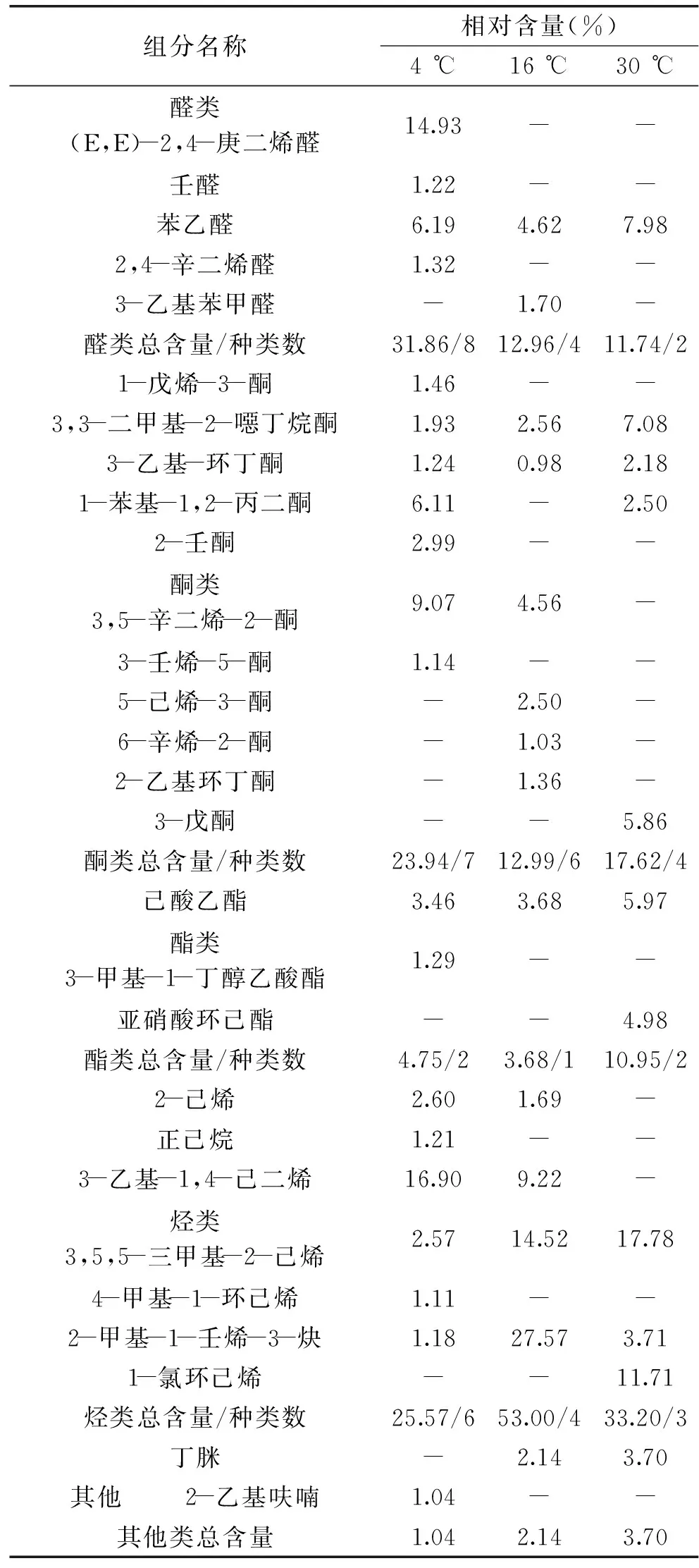
续表
注:“-”表示未检出。
通过GC-MS分析发现,随着贮藏温度的升高挥发性物质种类和含量变化较大。醛类物质的种类和相对含量均减少。实验过程中共检测出9 种醛类物质,其中4 ℃贮藏条件下的虾酱中检测出8种,且随着贮藏温度的升高,相对含量明显减少,从31.86%分别减少至12.96%,11.74%。与4 ℃相比,经16、30 ℃贮藏的虾酱,烃类物质的相对含量大幅度增加,从25.57%增加至53.00%,30 ℃有所下降至33.20%。4 ℃和16 ℃贮藏的虾酱醇类物质种类较30 ℃多,但相对含量却随着贮藏温度的升高逐渐增加,从12.87%逐渐增加至15.23%、22.79%。酮类物质相对含量先减少后增加,从23.94%减少至12.99%,30 ℃有所增加至17.62%。酯类物质相对含量变化趋势与酮类物质相同,从4.75%减少至3.68%,后增加至10.95%。其他类物质相对含量有所增加。实验结果表明贮藏温度的改变影响了微生物的代谢作用,从而导致了虾酱挥发性风味物质种类及含量的变化。由以上分析可知,虾酱在不同贮藏温度下挥发成分发生了变化,其中醇类物质、酮类物质、醛类物质变化较大,因此这三类物质可以作为检测微生物变化的参考指标。
3 结论
本研究利用电子鼻对不同贮藏温度和时间的虾酱进行检测,分析电子鼻数据得出,虾酱内部挥发性气味发生了改变。用GC-MS对不同温度(4、16、30 ℃)下贮藏24 d的虾酱挥发性成分进行分析发现,不同贮藏温度挥发性物质的种类和相对含量均发生了较明显的变化。实验结果表明贮藏温度和时间对虾酱罐头中菌落总数的影响较大。贮藏温度和时间的不同直接导致了菌落总数的改变,影响了微生物的代谢作用,从而导致了虾酱挥发性物质种类和相对含量的变化。同一贮藏温度下随着贮藏时间的增加,虾酱在微生物和酶等因素的作用下,蛋白质发生催化降解,导致挥发性物质发生了显著变化。通过菌落总数结果结合电子鼻和GC-MS 分析结果发现,电子鼻和GC-MS能反映出虾酱不同贮藏温度同一时间点的微生物情况。因此,电子鼻和GC-MS可以作为一种虾酱类罐装食品的微生物检验评价方法,从而达到快速、准确的效果。
[1]杜红利,刘畅.罐头制品中微生物检测方法[J].肉类工业,2008(11):40-42.
[2]柴春祥,凌云.电子鼻检测虾新鲜度的研究[J].食品科技,2010,35(2):246-249.
[3]Concina I,Falasconi M,Gobbi E,et al.Early detection of microbial contamination in processed tomatoes by electronic nose[J].Food Control,2009,20(10):873-880.
[4]Falasconi M,Gobbi E,Pardo M,et al.Detection of toxigenic strains of Fusarium verticillioides in corn by electronic olfactory system[J].Sensors and Actuators B:Chemical,2005,108(1):250-257.
[5]Horváth K M,Seregely Z S,Dalmadi I,et al.Estimation of bacteriological spoilage of pork cutlets by electronic nose[J].Acta microbiologica et immunologica hungarica,2007,54(2):179-194.
[6]Keshri G,Magan N,Voysey P.Use of an electronic nose for the early detection and differentiation between spoilage fungi[J]. Letters in applied Microbiology,1998,27(5):261-264.
[7]Tracey R P,Britz T J.Freon 11 extraction of volatile metabolites formed by certain lactic acid bacteria[J].Applied and environmental microbiology,1989,55(6):1617-1623.
[8]Zechman J M,Aldinger S,Labows J N.Characterization of pathogenic bacteria by automated headspace concentration-gas chromatography[J].Journal of Chromatography B:Biomedical Sciences and Applications,1986,377:49-57.
[9]杨秀琴,邹奇波,黄卫宁.酵母菌对自然发酵酸面团面包中风味物质影响的研究[J].食品与机械,2006,22(3):37-40.
[10]马瑜璐,朱斌,张雷,等.顶空固相微萃取-气质联用检测猪肉新鲜度[J].食品科学,2011,32(14):253-256.
[11]SN/T 1897-2007.食品中菌落总数的测定 PetrifilmTM 测试片法[S].2007
[12]全晶晶,侯云丹,黄健,等.加工温度对鲣鱼挥发性成分的影响[J].中国食品学报,2012,12(8):221-228.
[13]谢主兰,何晓丽,王美华.低盐虾酱在不同温度下贮藏的品质变化与货架期[J].中国酿造,2012,31(2):173-177.
[14]游丽君,赵谋明.鱼肉制品腥昧物质形成及脱除的研究进展[J].食品与发酵工业,2008,34(2):117-120.
[15]裘爱泳,宋健.鱼油脂肪酸酯挥发性组分的检测[J].无锡轻工大学学报:食品与生物技术,1997,16(3):20-25.
[16]Iglesias J,Medina I,Bianchi F,et al.Study of the volatile compounds useful for the characterisation of fresh and frozen-thawed cultured gilthead sea bream fish by solid-phase microextraction gas chromatography-mass spectrometry[J].Food chemistry,2009,115(4):1473-1478.
[17]Josephson D B,Lindsay R C,Stuiber D A.Volatile compounds characterizing the aroma of fresh Atlantic and Pacific oysters[J].Journal of food science,1985,50(1):5-9.
[18]曾绍东,吴建中,欧仕益,等.罗非鱼酶解液中挥发性成分分析[J].食品科学,2010(18):342-346.
[19]Kim HR,Baek HH,Meyers SP,et al.Crayfish Hepatopancreatic Extract Improves Flavor Extractability from a Crab Processing By-product[J].Journal of food science,1994,59(1):91-95.
[20]郑平安,黄健,孙静,等.HS-SPME 结合 GC-MS 法分析鲐鱼肉加热前后挥发性成分变化[J].食品科学,2012,33(14):242-246.
[21]王卫.发酵香肠的加工工艺及微生物特性[J].肉类研究,2002(3):10-13.
[22]Sanceda N G,Sanceda M F,Encanto V S,et al.Sensory evaluation of fish sauces[J].Food quality and preference,1994,5(3):179-184.
Changes of the bacterial colonies and volatile substances in shrimp paste at different temperature and time
DAI Juan,MA li,LI ye*
(Shool of marine sciences,Ningbo University,Ningbo 315211,China)
Objective:Study the effects of temperature and time on the bacterial colonies and volatile substances in shrimp paste.Methods:Using 3M Petrifilm plate to detect microorganism of shrimp paste in different temperature(4,16,30 ℃)at a certain time.The electronic nose(E-nose)and headspace solid phase micro extraction(HS-SPME)combined with gas chromatography-mass spectrometry(GC-MS)were used to analyze the volatile compounds in shrimp paste at different conditions.Correlation between the changes of volatile compounds and the total numbers of colony was established in shrimp paste.Results:The total numbers of colony was respectively 103,105,107in the experimental period under the storage temperature of 4,16,30 ℃.The detection signal of volatile substances of E-nose dates changed significantly with the increase of the bacterial colonies.The results of GC-MS showed that the shrimp paste mainly contained aldehydes,alcohols,ketones and other volatile compounds.These compounds had a significant difference in variety and relative content in different conditions.Conclusion:The results showed that the temperature had a great influence on total numbers of colony and volatile compounds in the shrimp paste.Temperature and time led to the changes of the total number of colonies,thus affecting the microbial metabolism and changing the varieties and relative contents of the volatile substances in shrimp paste.
shrimp paste canned food;microbe;electronic nose;colony;volatile substances
2015-11-05
戴娟(1990-),女,硕士研究生,研究方向:食品科学,E-mail:13484278003@163.com。
李晔(1980-),女,博士,讲师,研究方向:食品质量与安全,E-mail:liye@nbu.edu.cn。
国家自然科学基金(F01424145100)。
TS295.4
A
1002-0306(2016)09-0335-05
10.13386/j.issn1002-0306.2016.09.057

