改善牦牛曲拉精制干酪素色泽品质的研究
武 悦,韩 玲,*,纪银莉,王琳琳,韩 爽
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃华羚生物技术研究中心,甘肃兰州 730000)
改善牦牛曲拉精制干酪素色泽品质的研究
武悦1,韩玲1,*,纪银莉2,王琳琳1,韩爽1
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃华羚生物技术研究中心,甘肃兰州 730000)
本文以“曲拉”为原料生产干酪素,以干燥后干酪素的色度值(L*、a*、b*)为目标,利用数据标准化综合评分法对目标评分。在溶解条件单因素实验的基础上,根据响应面法对曲拉溶解pH、溶解温度、溶解时间进行优化;并在干燥前对干酪素湿凝块进行不同压力梯度的挤压预脱水处理。结果表明,3因素对干酪素色度综合分的影响大小顺序为:溶解pH、溶解温度、溶解时间;曲拉溶解最佳条件为:pH9.37,温度54.21 ℃,时间29.73 min;最佳预脱水压力为850 N,干燥后产品色度L*值为91.95,a*值为0.13,b*值为6.27,产品色泽得到良好改善,且显著优于工业一级干酪素。
曲拉,干酪素,色泽,溶解条件,预脱水,响应面
干酪素是种重要的食品、化工原料和生物制品,可以作为食品添加剂或品质改良剂用于食品、化妆品、医药、烟草、皮革、造纸、轻纺等行业中,国内外市场对干酪素需求量较大,发展前景广阔[1]。
在中国乃至世界,只有甘青川地区牧民有将牦牛乳制成“曲拉”的生活习惯,是中国独有的资源[2-5]。牧民在制做“曲拉”时,由于生产环境卫生条件差,进行粗放式的接种发酵,微生物区系十分复杂,且发酵温度无法有效控制,适宜生长的微生物很多,除进行乳酸发酵外,还有其他微生物作用,使得“曲拉”在干燥前已有微红色。干燥过程中,杂质混入,阳光下发生褐变,以及有少量脂肪发生氧化,从而使奶渣呈黄色或褐色。
以“曲拉”为原料生产的干酪素存在色泽暗黄,粘度低,气味不佳等问题,不能满足市场对高品质干酪素的需求[6]。干酪素色泽发黄发褐的主要原因为原料“曲拉”制备过程中产生了不良的有色物质,其次是干酪素生产过程中发生了褐变。在干酪素生产工艺过程中,用碱溶解“曲拉”时发生了褐变(主要是美拉德反应)产生了有色物质。影响美拉德反应的主要因素是pH、温度、氧气、水分活度、底物浓度等。在干酪素生产的过程中,蛋白质、乳糖、氨基酸等均易发生美拉德反应,为抑制褐变发生,必须在美拉德反应发生的初始阶段抑制其发生[6-7]。
本实验以“曲拉”为原料,针对曲拉干酪素颜色暗黄等问题,通过优化“曲拉”溶解条件,以及进行预脱水处理,研究其对曲拉干酪素色泽改善的效果,为改善干酪素色泽提供理论依据。
1 材料和方法
1.1材料与仪器
曲拉采自甘肃省甘南藏族自治州牧区,避光条件下装入恒温采样箱,带回实验室进行真空避光包装,4 ℃条件下保藏待用;工业一级干酪素采自甘肃华羚酪蛋白股份有限公司,带回实验室,4 ℃条件下保藏待用。
NaOH天津市光复精细化工研究所、HCl珠海市华成达化工有限公司(以上试剂均为分析纯)。
TGL-24MC台式高速冷冻离心机长沙平凡仪器仪表有限公司;L500台式低速离心机长沙湘仪离心机仪器有限公司;HP-200色差仪常州锐品精密仪器有限公司;BSA224S型电子天平赛多利斯科学仪器有限公司;WK-200B小型高速粉碎机青州市富尔康制药机械有限公司;PHS-3C型pH计上海雷磁;HH-2型电热恒温水浴锅北京科伟永兴仪器有限公司;WW-3型应变式无侧限压缩仪南京土壤仪器厂;DHG-9123A型电热恒温鼓风干燥箱上海精宏实验设备有限公司。
1.2实验方法
1.2.1干酪素加工工艺流程原料检验→粉碎→溶解搅拌→离心脱脂→过滤→点酸沉淀→洗涤→预脱水→干燥→检验→包装→成品。
1.2.2工艺操作要点原料粉碎:将曲拉经过挑选除杂,弃去劣质原料等,用粉碎机粉碎,过60目分析筛后备用。
溶解:曲拉与水以一定比例在一定温度下混合,搅拌均匀后缓慢滴入质量分数20%的NaOH溶液,当pH调节到一定值,停止加碱,保温搅拌一段时间使其充分溶解。溶解过程中要不断观察pH的变化,让溶液始终保持指定pH。
离心、过滤:将溶解完全的样品在50 ℃左右进行离心脱脂[8],离心后取出离心管,用200目分析筛弃去滤渣。
点酸沉淀、洗涤:将滤液在37~38 ℃下水浴5 min,然后向溶液中缓慢滴加2 mol·L-1的HCl,调至pH4.6,使酪蛋白充分凝聚沉淀;用200目分析筛过滤得凝固物,用蒸馏水洗涤3次。
预脱水、造粒:湿凝块入离心机,在4 ℃、7000 r/min下离心脱水10 min后,用滤布包裹,外加若干层滤纸用应变式无侧限压缩仪挤压,使水分充分挤出,再用20目筛揉搓造粒。
干燥:将湿干酪素置于电热鼓风干燥箱内于42 ℃温度下干燥30 min左右[9],即得成品。
1.2.3不同溶解条件对曲拉溶解效果及干酪素色泽的影响
1.2.3.1单因素效果分析通过单因素实验对pH、溶解温度以及溶解时间进行确定。以色差L*、a*、b*值和溶解度作为评价指标,衡量不同pH、溶解温度以及溶解时间对曲拉溶解效果及干酪素色泽的影响。
溶解pH的单因素分析:分别选取pH6.5、7.5、8.5、9.5、10.5,溶解温度为55 ℃,溶解时间30 min时,研究溶解pH对曲拉溶解效果及干酪素色泽的影响。
溶解温度的单因素分析:分别选取溶解温度25、35、45、55、65 ℃,溶解pH为9.5,溶解时间30 min时,研究溶解温度对曲拉溶解效果及干酪素色泽的影响。
溶解时间的单因素分析:分别选取溶解时间10、20、30、40、50 min,溶解pH为9.5,溶解温度为55 ℃时,研究溶解时间对曲拉溶解效果及干酪素色泽的影响。
1.2.3.2响应面实验设计利用响应面分析法,以色度值为响应值,根据Box-Benhnken模型的中心组合实验设计原理,综合单因素实验结果,采用响应面分析法优化溶解条件参数。

表1 Box-Benhnken实验因素水平表Table 1 Factors and levels in the central composite design
1.2.3.3干酪素色度(L*、a*、b*值)测定及标准化处理L*、a*、b*值测定:用色差仪测定干燥后干酪素的L*、a*、b*值。L*值越高说明干酪素色泽亮度越大,a*值越高说明其红色度越大,b*值越高说明其黄色度越大,以此来判断美拉德反应等因素造成的样品褐变程度。
标准化处理[9]:利用数据标准化的综合评分方法,将干酪素干燥后色度的L*、a*、b*值3项指标对干酪素溶解条件优化后的工艺进行综合评分。a*、b*值越低,说明干酪素的品质越好,其标准化过程按公式(1)计算。
式(1)
式中:la、lb分别为干酪素干燥后a*值、b*值的标准化结果;ci分别为a*、b*值的实验测定值;cmax为指标测定最大值;cmin为指标测定最小值。
L*值越高,干酪素品质越好,因此其标准化过程按公式(2)计算。
式(2)
式中ci为指标L*的实验测定值;cmax为指标最大值;cmin为指标最小值。
按公式(3)进行加权得到干酪素色度的综合分
S=QLlL+Qala+Qblb
式(3)
式中lL、la、lb分别为干燥后物料a*、b*、L*值的标准化结果;QL、Qa、Qb分别为a*、b*、L*值的权重。
本文考虑到以a*值、b*值为主要指标,L*值为次要指标,于是取权重QL=0.2,Qa=0.4,Qb=0.4。在具体应用中可以根据不同要求取相应的权重,只需满足QL+Qa+Qb=l即可[10]。
1.2.4预脱水对曲拉干酪素色泽的影响对经溶解、点酸沉淀、洗涤后的干酪素湿凝块进行预脱水实验,用应变式无侧限压缩仪脱去湿干酪素中的水分,设定不同的预脱水压力梯度。预脱水后将不同压力梯度的湿干酪素置于42 ℃的热风干燥箱内干燥一定时间,再选取一组未进行预脱水处理的直接干燥的干酪素作为对照组,利用色差计测定最终产品色度(L*、a*、b*值),衡量干燥前不同水分含量对曲拉干酪素色泽的影响。
预脱水压力梯度为:250、400、550、700、850 N。
1.3数据处理方法
实验中所有测定数据,采用Microsoft Excel 2007进行整理,SPSS19.0软件以及Design Expert 8.05b软件进行数据处理及分析。
2 结果与讨论
2.1单因素实验
2.1.1pH对曲拉溶解度及干酪素色泽的影响由图1A可知,随着pH的升高,溶解度也随之增大。pH为6.5时,曲拉的溶解度只有72.4%,当pH为9.5时,溶解度达到88.3%,pH达到10.5时,曲拉的溶解度可达97.1%,由此可得知碱性环境有利于曲拉溶解。由图1B可以看出,溶解温度和时间一定时,随着pH的增大,曲拉干酪素色度的a*值、b*值均呈现出上升的趋势,当pH在6.5~9.5范围内增大时,a*值、b*值上升趋势平缓;当pH超过9.5时,a*值、b*值显著增大(p<0.05)。L*值随着pH的升高而降低,当pH在小于9.5的范围内增大时,L*值平缓下降;当pH超过9.5时,L*值显著降低(p<0.05),干酪素色泽品质受到影响。初始pH会对美拉德反应产物的抗氧化活性产生影响,并且pH对未缩合的氨基酸的比例有很大的影响,因此,美拉德反应最初的缩合程度随初始pH的增加而增大[11-12]。该结果与吴惠玲[13]在研究影响美拉德反应的几种因素中的结果相近。

图1 pH对曲拉溶解度 和曲拉干酪素色度(L*、a*、b*)的影响Fig.1 Effect of pH on solubility of dissolved Qula and chroma values(L*、a*、b*)of casein
因此,当其他条件不变,pH为6.5时,干酪素a*、b*值最低,L*值最高,产品色泽最佳,但是此时原料的利用率最低,而pH为9.5时,曲拉溶解度较大,原料利用率高,综合该条件下生产的干酪素色度a*值、b*值较低,L*较高,产品色泽较好,选择溶解pH为9.5为宜。
2.1.2温度对曲拉溶解度及干酪素色泽的影响由图2A可以看出,随着温度的升高,溶解度随之增大。当温度为25 ℃时,曲拉的溶解度为80.7%,温度达到65 ℃时,曲拉的溶解度可达95.1%,由此可知较高的温度有利于曲拉溶解。由图2B可知,溶解pH和溶解时间一定时,随温度升高,曲拉干酪素色度a*值、b*值呈现出平缓上升的趋势;当溶解温度超过55 ℃时,b*值显著增大(p<0.05)。L*值随着溶解温度的升高呈现出先上升后下降的趋势,当溶解温度在小于35 ℃的范围内增大时,L*值随之增高;当溶解温度在35~55 ℃之间升高时,L*值变化趋于平缓;当溶解温度高于55 ℃后,L*值显著降低(p<0.05),干酪素色泽品质受到影响。造成这种情况的原因可能是:溶解温度过高加速了美拉德反应的发生。美拉德反应的褐变速度受温度影响较大,温度越高则褐变速度越快,温度每升高10 ℃,反应速度大约增加3~5倍[14]。
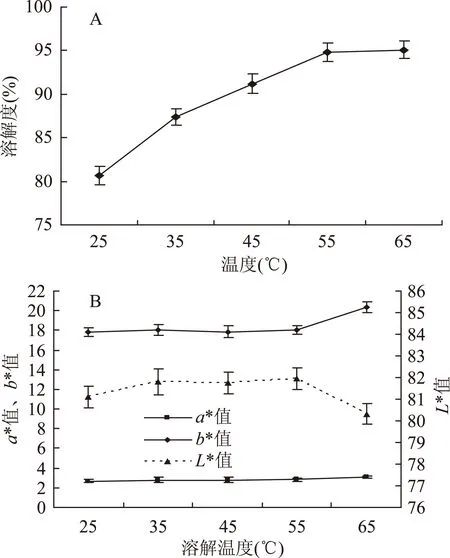
图2 温度对曲拉溶解度 和曲拉干酪素色度(L*、a*、b*)的影响Fig.2 Effect of temperature on solubility of dissolved Qula and chroma values(L*、a*、b*)of casein
因此,当其他条件不变,溶解温度为25~35 ℃时,干酪素a*、b*值低,L*值高,产品色泽最佳,但是此时原料的利用率只有80.7%,而溶解温度为55 ℃时,曲拉溶解度高达94.8%,原料利用率高,综合该条件下生产的干酪素色度a*值、b*值较低,L*较高,产品色泽较好,综合考虑,选择溶解温度为55 ℃。

表2 响应面实验的Box-Behnken设计及结果Table 2 Experimental design and result of response surface analysis
2.1.3时间对曲拉干酪素色泽的影响图3A表明,随溶解时间的增长,曲拉的溶解度随之增大。在溶解时间10~30 min内,曲拉的溶解度由87.2%较快上升到95.7%,当溶解时间超过30 min后,曲拉的溶解度缓慢增大,溶解50 min时,曲拉溶解度达到97.0%。从图3B可知,当其他条件一定,在溶解时间为10~30 min时,b*值呈平缓上升趋势,当溶解时间超过30 min后,b*值显著增大(p<0.05);随溶解时间的延长,曲拉干酪素a*值缓慢升高;L*值呈现出先增大再减小的变化趋势,当溶解时间为30 min时,L*值达到最高,此时产品色泽较好,当溶解时间达到50 min时,L*值显著下降(p<0.05)。加热时间是美拉德反应的一个重要影响因素[15]。色度值呈现出这种变化趋势,可能是由于室温下氧气的存在对美拉德反应的褐变速度起促进作用,从而加速了美拉德反应的发生[16]。并且由于溶解时间过长,增加了物料与氧气接触的时间,还可能加速了脂肪氧化的发生,使产品颜色发生劣变。
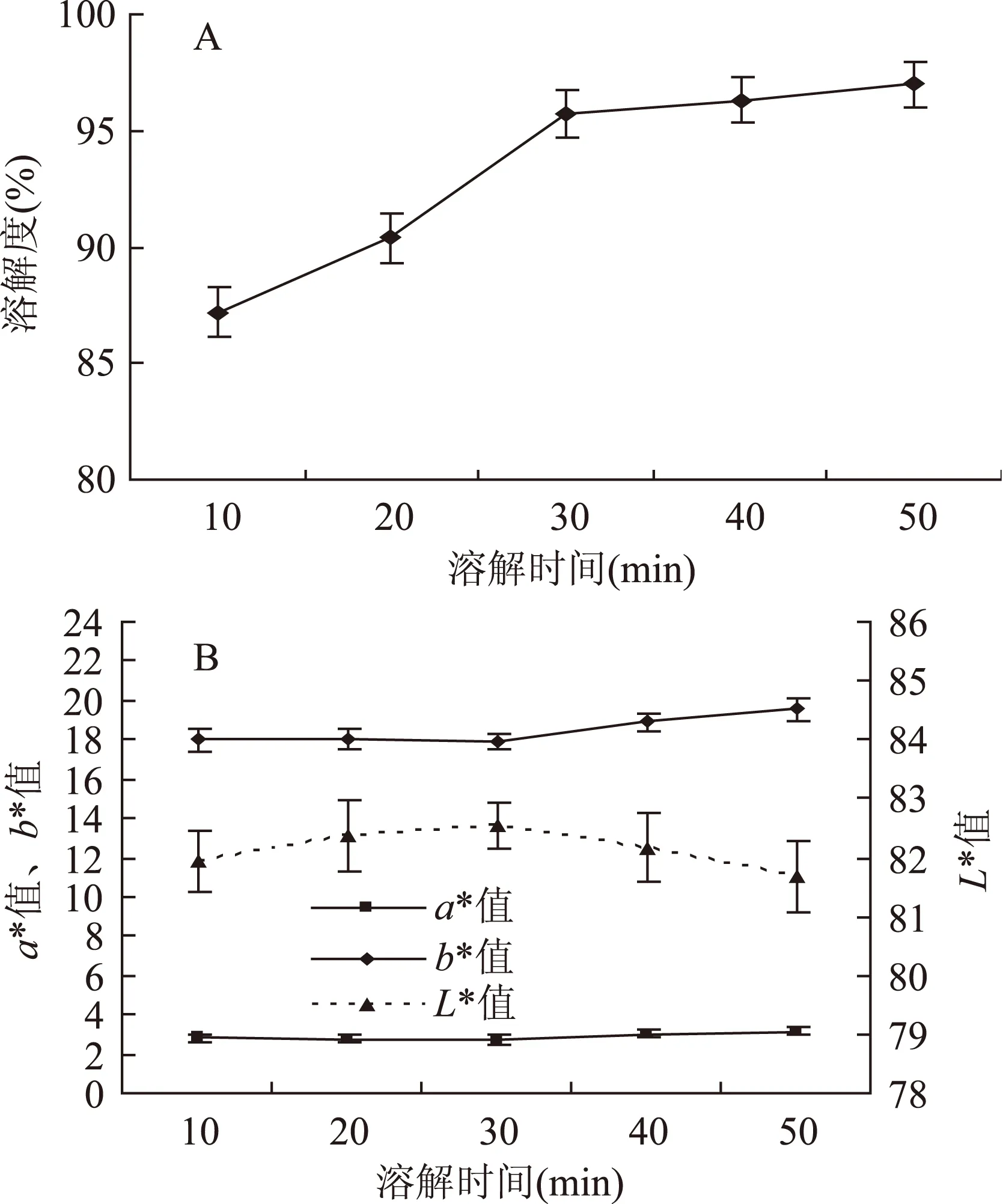
图3 时间对曲拉溶解度 和曲拉干酪素色度(L*、a*、b*)的影响Fig.3 Effect of time on solubility of dissolved Qula and chroma values(L*、a*、b*)of casein
因此,当其他条件不变,溶解时间为30 min时,干酪素a*、b*值较低,L*值最高,产品色泽最佳,且曲拉溶解度高达95.7%,原料利用率高,综合考虑,选择溶解时间为30 min。
2.2响应面优化实验结果
根据单因素实验结果,得到曲拉溶解的最佳条件分别为:溶解pH为9.5,溶解温度为55 ℃,溶解时间为30 min。在单因素实验的基础上,进行三因素三水平的Box-Benhnken实验,进一步优化筛选最佳的溶解条件。
本实验选用3因子的Box-Behnken响应面[17-18]三水平设计,共有17个实验点,其中12个为分析因子,5个为零点,响应值Y为感官评定分值,实验结果如表2所示。
利用Design Expert对表3中得到的感官评分进行回归分析,得到如下回归方程:
Y=0.80-0.029X1-0.020X2-3.750E-004X3-0.026X1X2+0.039X1X3-2.500E-004X2X3-0.11X12-0.11X22-0.10X32
对回归方程进行方差分析,结果如表3所示。
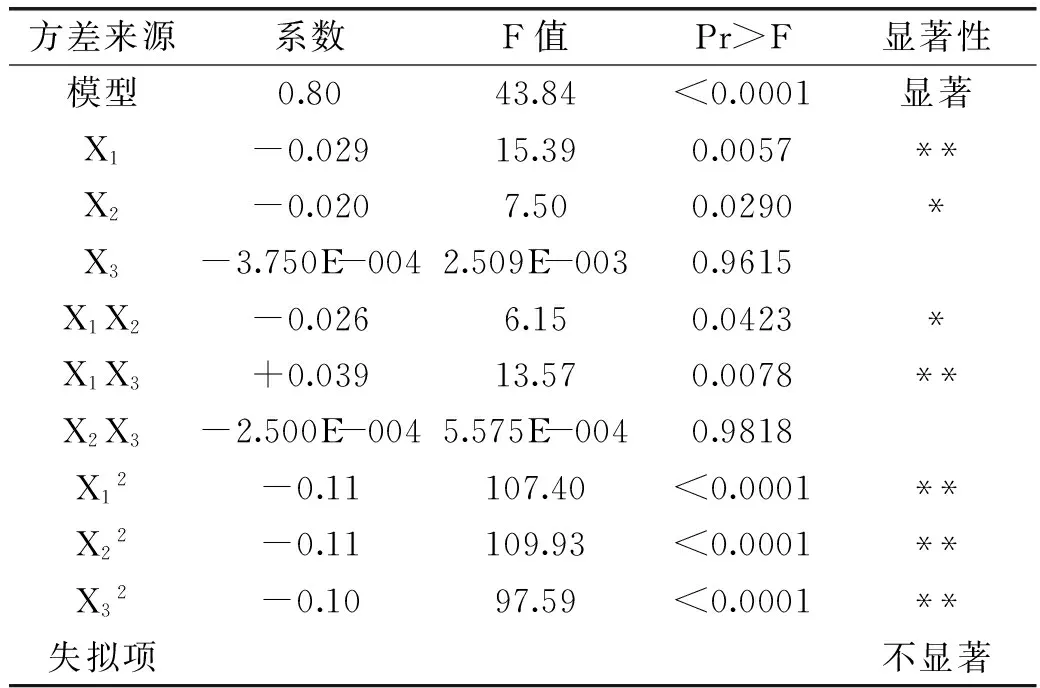
表3 回归模型及因素的方差分析Table 3 Regression model and factor analysis of variance
注:*差异显著(p<0.05);**差异极显著(p<0.01)。
由表3可知,对干酪素色度评分所建立的回归方程进行显著性检验,F=43.84,p<0.01,表明该方程极显著。模型的失拟项p>0.05,不显著,说明回归方程较好的拟合了实验数据,实验误差小。模型的多元相关系数R2=0.9826,说明3因素对干酪素色度标准化综合分中98.26%的实验数据变异性可以用此模型解释。进一步对方程中回归项系数进行显著性检验,X1对方程影响极显著(p<0.01),X2对方程影响显著(p<0.05),X3对方程影响不显著(p>0.05);因素X12、X22、X32对方程影响极显著(p<0.01);交互项X1X2对方程影响显著(p<0.05),X1X3对方程影响极显著(p<0.01),X2X3对方程影响不显著(p>0.05)。实验所选参试因子对标准化综合分影响大小顺序为:溶解pH>溶解温度>溶解时间。溶解pH和溶解温度对综合分有显著影响(p<0.01,p<0.05),溶解pH与溶解温度的交互作用对综合分影响显著(p<0.05)、溶解pH与溶解时间的交互作用对综合分影响极显著(p<0.01),溶解温度与溶解时间的交互作用对综合分影响不显著(p>0.05)。
2.3响应面分析及最佳溶解条件的确定
通过回归曲线绘制出响应曲面图和等高线图,可以直观的考察出各因素对干酪素色度标准化综合分的影响。
由图4等高线可以看出,溶解pH与溶解温度之间的交互作用显著(p<0.05),对干酪素色度标准化综合分影响较大。由响应面可以看出,随溶解温度的升高,色度综合分先上升后缓慢下降,在溶解温度达到55 ℃左右时,综合分达到最高,说明此时干酪素色泽品质较好;溶解pH对综合分影响极显著,当pH由8.5上升至9.5时,综合分明显上升,并达到峰值,当pH高于9.5时,综合分开始下降。这可能是由于pH和温度过高,促进了溶解过程中美拉德反应的发生,使干酪素产品色泽发生褐变。

图4 溶解pH和溶解温度 对干酪素色度综合分影响的响应面Fig.4 Response surface showing the effects of pH and temperature value on chroma values of casein
由图5等高线可以看出,溶解pH和溶解时间之间的交互作用对干酪素色度综合分影响较大。由响应面图可知,溶解pH和溶解时间对色度评分值有一定影响。pH在8.5~9.5范围内,随着pH的升高,综合分随之上升,当溶解pH为9.5左右时,综合分达到最高,随后开始下降。当溶解时间在20~30 min时,综合分随溶解时间的延长而上升,并在溶解时间为30 min时,综合分达到峰值,当溶解时间在30 min以上时,干酪素色度综合分开始下降。

图5 溶解pH和溶解时间 对干酪素色度综合分影响的响应面Fig.5 Response surface showing the effects of pH and time on chroma values of casein
由图6可知,溶解温度和溶解时间对干酪素色度综合分影响的等高线呈椭圆形,故二者之间的交互作用对综合分有一定的影响。当溶解温度低于55 ℃时,综合分随着溶解温度的升高而缓慢增加,并在55 ℃处达到峰值,当溶解温度高于55 ℃时,综合分随之下降。当溶解时间在20~30 min内时,干酪素色度综合分随溶解时间增长而上升,当溶解时间在30 min以上时,综合分开始下降。

表4 干酪素湿凝块预脱水不同压力对曲拉干酪素产品色泽影响的比较Table 4 Casein wet clot to compare the different effect of water content on casein products color
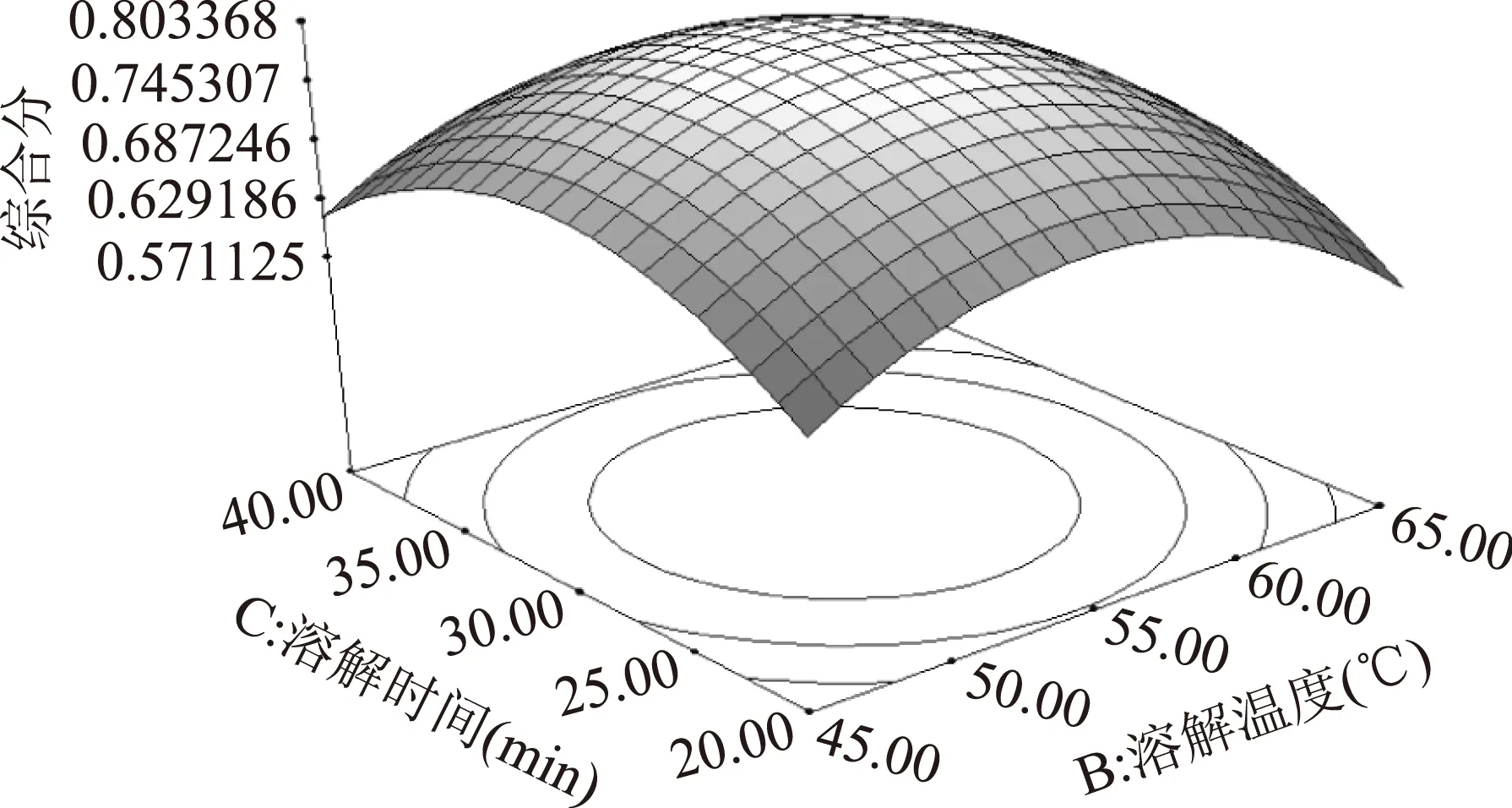
图6 溶解温度和溶解时间 对干酪素色度综合分影响的响应面Fig.6 Response surface showing the effects of temperature and time on chroma values of casein
注:结果为平均值±标准误差,不同字母代表不同处理时间之间的差异显著(p<0.05)。
综上可知,各因素响应曲面和等高线证实了拟合面评分最高点的存在,每个因素都有各自的最优值。利用Design Expert软件获得各因素最佳条件:溶解pH为9.37,溶解温度为54.21 ℃,溶解时间为29.73 min,干酪素色度标准化综合分为0.805。在各因素最佳条件下对响应面分析结果进行验证,实验进行五次,最终得到综合分平均值为0.803分,误差为0.25%。
2.4预脱水对曲拉干酪素色泽的影响
干酪素湿凝块预脱水压力不同,对干燥后产品色泽的影响见表4。
由表4可以看出,对干酪素湿凝块预脱水施加不同的压力,最后的干酪素产品的色度值(L*、a*、b*值)之间存在显著差异。随着干酪素湿凝块预脱水压力的增大,干酪素产品的色泽越好,色度亮度值L*值越高,红度值a*值、黄度值b*值越低。当湿凝块预脱水压力达到850 N时,干酪素色度L*值为91.95,与工艺一级干酪素L*值差异不显著;a*值为0.13,极显著的低于工艺一级干酪素的a*值;b*值为6.27,极显著的低于工艺一级干酪素的b*值,此时产品色泽相对最佳。这可能是由于预脱水降低湿凝块的水分活度,且缩短了产品干燥时间,有效抑制了干燥过程中褐变反应的发生。
3 结论
根据响应面Box-Behnken设计理论进行曲拉溶解条件参数的优化,实验结果为:3个因素对曲拉干酪素色度标准化综合分的影响大小依次为溶解pH、溶解温度和溶解时间;且分析了因素交互项的影响,得出溶解pH与溶解温度的交互作用对色度综合分影响显著,溶解pH与溶解时间的交互作用对综合分影响极显著,溶解温度和溶解时间的交互作用不显著。
建立了曲拉干酪素色度标准化综合分与溶解pH、溶解温度、溶解时间的二次多项式回归模型,得到最佳曲拉溶解条件。经验证,溶解pH为9.37,溶解温度为54.21 ℃,溶解时间为29.73 min,此时得到的最大色度综合分为0.805,相对误差为0.25%。实验值与理论值吻合,模型可靠。
酪蛋白完全凝聚沉降后,对湿凝块进行预脱水处理,压力越大凝块水分含量越低,越能有效抑制美拉德反应发生。当预脱水压力达到850 N时,干燥后产品色度L*值为91.95,a*值为0.13,b*值为4.27,曲拉干酪素产品色泽显著优于工业一级干酪素。
[1]Zhimin H E,Wei Q I,Mingxia H E.A novel exponential kinetic model for casein tryptic hydrolysis to prepare active peptides[J].Chinese J Chen Eng,2002,10(5):562-566.
[2]余群力,甘伯中,敏文祥,等.白牦牛乳营养成分及风味物质分析[J].营养学报,2005,27(4):333-335.
[3]韩玲,许敬东,张福娟,等.牦牛“曲拉”乳酸干酪素生产工艺研究[J].中国乳品工业,2006,34(2):36-39.
[4]甘伯中,常海军,余群力,等.牦牛曲拉干酪素脱色工艺优化[J].农业工程学报,2006,22(10):203-207.
[5]Mao X Y,Ni J R,Sun W L,et al.Value-added utilization of yak milk casein for the production of angiotensin-I -converting enzyme inhibitory peptides[J].Food Chemistry,2007,103(4):1282-1287.
[6]余群力,甘伯中,敏文祥,等.牦牛“曲拉”精致干酪素工艺研究[J].农业工程学报,2005,21(7):140-144.
[7]甘伯中,敏文祥,侯晓东,等.改善工业级干酪素色泽的研究[J].食品与发酵工业,2005,31(9):49-52.
[8]甘伯中,常海军,余群力,等.抗氧化剂在工业级干酪素色泽改善中的应用研究[J].食品工业科技,2006,27(1):63-65.
[9]王军,王琳琳,韩玲,等.曲拉热风干燥工艺参数筛选及色泽品质评[J].农业工程学报,2014,30(16):296-304.
[10]张黎骅,张文,吕珍珍,等.响应面法优化酒糟微波间歇干燥工艺[J].农业工程学报,2011,27(3):369-374.
[11]Morales F J,Jimenez-Perez S.Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J].Food Chemistry,2001,72(1):119-125.
[12]Lertittikul W,Benjakul S,Tanaka M.Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J].Food Chemistry,2007,100(2):669-677.
[13]吴惠玲,王志强,韩春,等.影响美拉德反应的几种因素研究[J].现代食品科技,2010,26(5):441-444.
[14]龚巧玲,张建友,刘书来,等.食品中的美拉德反应及其影响[J].食品工业科技,2009,30(2):330-334,338.
[15]孔保华,李菁,刘骞.美拉德反应产物抗氧化机理及影响因素的研究进展[J].东北农业大学学报,2011,42(11):9-13.
[16]李林,卢家炯.美拉德反应的抑制及消除方法[J].广西轻
工业,2000,30(4):16-18.
[17]Feng Y L,Li W Q,Wu X Q,et al.Statistical optimization of media for mycelial growth and exo-polysaccharide production by Lentinus edodes and a kinetic model study of two growth morphologies[J].Biochemical Engineering Journal,2010,49(1):104-112.
[18]Ghosh D,Hallenbeck P C.Response surface methodology for process parameter optimization of hydrogen yield by the metabolically engineered strainEscherichiacoliDJT135[J]. Bioresource Technology,2010,101(6):1820-1825.
Study on improving color quality of purifying casein made from Yak Qula
WU Yue1,HAN Ling1,*,JI Yin-li2,WANG Lin-lin1,HAN Shuang1
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Gansu Hualing Biotechnical Research Center,Lanzhou 730000,China)
“Qula” was used as raw material for the production of casein,the chroma value(L*,a*,b*)of dried products were taken as target parameters,and the three factors were scored by the comprehensive evaluation using the data standardization method.Based on the single factor test,the response surface methodology was adopted to discuss the influence caused by the dissolution pH,the dissolution temperature and the dissolution time.Before drying different pressure gradients were put on wet casein clot to complete the pre-dewatering process.The results showed that orders of significance among these three factors were:dissolution pH,dissolution temperature,dissolution time.“Qula” dissolved optimum condition was that the dissolution pH was 9.37,the dissolution temperature was 54.21 ℃,and the dissolution time was 29.73 min.The optimal pre-dehydration pressure was 850 N,at this pressure theL*value was 91.95,thea*value was 0.13,theb*value was 6.27.The casein color quality was improved,and the casein color was significantly better than the industry level.
Qula;casein;colour quality;dissolution condition;pre-dehydration;response surface
2015-10-14
武悦(1986-),女,硕士研究生,研究方向:乳及乳制品加工的研究,E-mail:wuyue613@yeah.net。
韩玲(1963-),女,教授,主要从事畜产品加工及贮藏研究,E-mail:hanl@gsau.edu.cn。
公益性行业(农业)科研专项经费项目(201303085)。
TS255.44
A
1002-0306(2016)09-0106-07
10.13386/j.issn1002-0306.2016.09.013

