鸡重组α-干扰素冻干粉剂的冻干保护剂的筛选
姜正军,康 梅,王少娟,黄 金,2,*
(1.山东华辰生物科技有限公司,山东潍坊 261061;2.浙江工业大学药学院,浙江杭州 310014)
鸡重组α-干扰素冻干粉剂的冻干保护剂的筛选
姜正军1,康梅1,王少娟1,黄金1,2,*
(1.山东华辰生物科技有限公司,山东潍坊 261061;2.浙江工业大学药学院,浙江杭州 310014)
以获得适宜于制备鸡重组α-干扰素冻干粉剂的冻干保护剂为目标,通过冻干保护剂的筛选及冻干保护剂浓度的优化,确定了最优的冻干保护剂配方和装液量等工艺参数。结果显示:在最优配方(甘露醇(3%)+PEG(3%))和最佳的装液量(40%)条件下,冻干粉剂外观呈海绵状、表面平整、体积与冻结时的体积基本一致,颜色均匀,无起泡现象,复水迅速而完全。通过生物活性稳定性实验,证明在最优条件下制备的鸡重组α-干扰素冻干粉的生物学效价较为稳定(40 ℃条件下贮藏12个月,生物活性无变化)。最终获得的冻干保护工艺,对鸡重组α-干扰素冻干粉剂工业化生产具有一定的指导和借鉴意义。
鸡α-干扰素,冻干保护剂,优化,筛选
干扰素(Interferon)是一类由病毒诱导机体产生的,具有干扰病毒在感染和非感染组织中复制的一类小分子蛋白,具有广谱、高效和非特异性的作用特点。自从1957年Isaacs等在病毒感染的鸡胚中发现了干扰素,到目前为止,干扰素一直是抗肿瘤和非特异性治疗和抑制病毒的首选药[1]。随着我国畜禽养殖业的发展和兽药研究的不断深入,干扰素已普遍应用于畜禽各种疾病感染治疗和预防。
研究已经证实:冻干粉剂具备价格低、药效迅速、使用方便等生物新剂型特点,研制和开发冻干粉剂已成为畜禽用干扰素的发展趋势[2-4]。不同生物制剂中活性成分的分子结构各不相同,所要求的冻干保护剂种类与浓度也各不相同,保护剂的种类与浓度决定着冻干产品的有效性和稳定性[5-7]。到目前为止,尚未寻找到通用的冻干保护剂,能适用于所有生物制剂的冻干。目前,生物药品冻干常用的冻干保护剂主要有蛋白质类(人血清蛋白、白明胶)、氨基酸类(甘氨酸、精氨酸、丙氨酸)、醇类(甘露醇、聚乙二醇)、碳水化合物类(单糖、双糖和多聚糖)和其他(矿物质、表面活性剂、多聚物、缓冲盐)[8-9]。
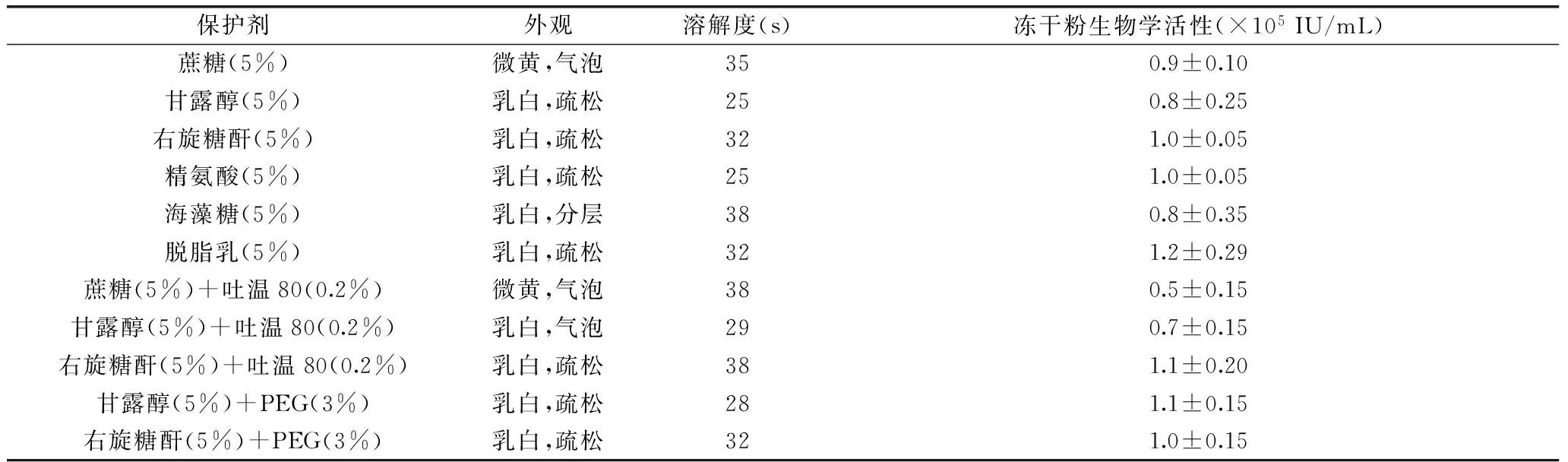
表1 单一和复合保护剂的筛选Table 1 Screening of the lyophilized protective
本研究通过冻干保护剂的筛选及冻干保护剂浓度的优化,确定冻干保护剂的最优配方。继而通过装液量的优化和生物活性稳定性实验,最终获得冻干保护工艺,以期解决制约鸡重组α-干扰素冻干粉剂制备的难题,对鸡重组α-干扰素冻干粉剂工业化生产具有一定的指导和借鉴意义。
1 材料与方法
1.1材料与仪器
鸡重组α-干扰素原液山东华辰生物科技有限公司;水泡性口炎病毒(VSV)病毒株山东华辰生物科技有限公司研发中心;SPF鸡胚山东华辰生物科技有限公司;冻干保护剂蔗糖、甘露醇、右旋糖酐、精氨酸、海藻糖、吐温80、PEG及其他化学试剂均为化学纯国药集团化学试剂有限公司;脱脂乳蒙牛乳业集团。
LaboGene CoolSafe 110-4冷冻干燥机丹麦LaboGene公司;DNP-9082电热恒温培养箱上海精宏实验设备有限公司;BHC-1300IIB2超净工作台苏州安泰空气技术有限公司。
1.2冻干方法
将一定浓度的冻干保护剂加入0.9%的氯化钠溶液中进行溶解,进行过滤除菌,进行单独或混合配制成不同成分及含量的保护剂。冻干方法参照参考文献[2],并有所改进。在超净工作台内,将一定量的预先制备的保护剂与干扰素样品按1∶1比例加入西林瓶中(干扰素的抗病毒活性为1×105IU/mL,初始总体积为1.0 mL/瓶),置-50 ℃预冻4~6 h,-40~-7 ℃自然抽真空干燥24 h,再逐渐升温至10 ℃,保持3 h。
1.3分析方法
1.3.1溶解度测定每批样品各取3支,分别向每支制剂中加入1 mL蒸馏水,记录从开始至透明且无不溶物的时间。
1.3.2生物学活性测定以抗病毒活性为其生物活性测定的目标,所用细胞和病毒由南京农业大学赠送,细胞为鸡胚成纤维细胞(CEF),病毒为水泡性口炎病毒(VSV)。测定方法参照参考文献[10]的抗病毒活性测定方法。
2 结果与讨论
2.1冻干保护剂的筛选
在已有报道的冻干保护剂中选取蔗糖、甘露醇、右旋糖酐、精氨酸、海藻糖、脱脂乳作为单一保护剂,选取蔗糖、甘露醇、右旋糖酐与PEG或吐温进行复配制成复合保护剂,进行了冻干保护剂的筛选,结果如表1所示。经冻干后,从外观来看蔗糖、海藻糖、蔗糖+吐温80、甘露醇+吐温80外观均出现不同程度的气泡或分层现象。从抗病毒活性角度看,右旋糖酐、精氨酸、脱脂乳、右旋糖酐(5%)+吐温80(0.2%)、甘露醇(5%)+PEG(3%)、右旋糖酐(5%)+PEG(3%)的保护效果较好,冻干粉生物学活性显著高于其他保护剂(p<0.05)。但从外观、溶解度和冻干粉的生物学活性角度综合考虑,最终选择甘露醇和PEG的复合保护剂作为冻干保护剂。
2.2冻干保护剂浓度及装液量的优化
冻干保护剂中的低分子物质可有效缓解水分子对生物活性物质的副作用[11-12],并能使冻干生物制品仍含有一定量水分,还可促进高分子物质形成骨架,使冻干制品呈多孔的海绵状,从而增加溶解度。低分子物质主要包括糖类和氨基酸类等。高分子物质在冻干生物制品中主要起骨架作用,防止低分子物质的碳化和氧化,保护活性物质不受加热的影响,使冻干制品形成多孔性,疏松的海绵状物,从而使溶解度增加,如聚乙二醇等聚合物。冻干保护剂浓度及西林瓶装液量直接影响冻干后制品的外观和溶解度等,并最终影响生物活性。基于此,在确定甘露醇和PEG的复合保护剂为冻干保护剂的基础上,进行了冻干保护剂配比浓度和西林瓶(20 mL)装液量的优化。
首先从产品成本控制角度对冻干保护剂配比浓度进行分组(如表2所示),继而进行冻干实验,结果如图1所示。结果表明:与对照组比较,随着甘露醇和PEG的浓度降低,冻干粉的生物活性在不断降低,与对照组比较,甘露醇(3%)+PEG(3%)组的生物活性较对照组活性降低幅度不显著(p>0.05)因此从产品成本控制角度,选择的冻干保护剂配比浓度。

表2 冻干保护剂配比浓度分组Table 2 Definition the lyophilized protective concentration
注:从产品成本控制角度进行分组。
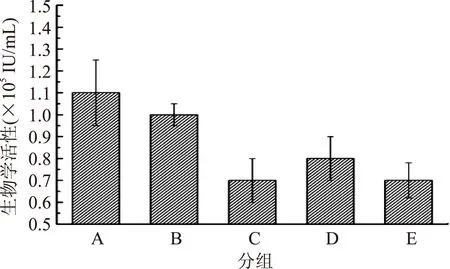
图1 冻干保护剂浓度 对鸡重组α-干扰素冻干粉剂制备的影响Fig.1 Effects of the lyophilized protectant concentration on the production of lyophilized recombinant chicken α-interferon
其次,在冻干保护剂配方确定的基础上,对西林瓶的装液量进行了优化。由图2可看出,装液量在30%和40%,生物学活性变化不显著(p>0.05),但30%装液量的冻干粉剂有明显的挂壁现象,产品外观存在明显缺陷,不适宜进行市场销售。随着装液量的增加冻干粉的生物学活性有了大幅度下降,因此选择40%作为最终的装液量标准。从最终冻干粉剂的外观来看(如图3所示),均呈现海绵状、表面平整、体积与冻结时的体积基本一致,颜色均匀,无起泡现象,复水迅速而完全(30 s内复水为合格)。
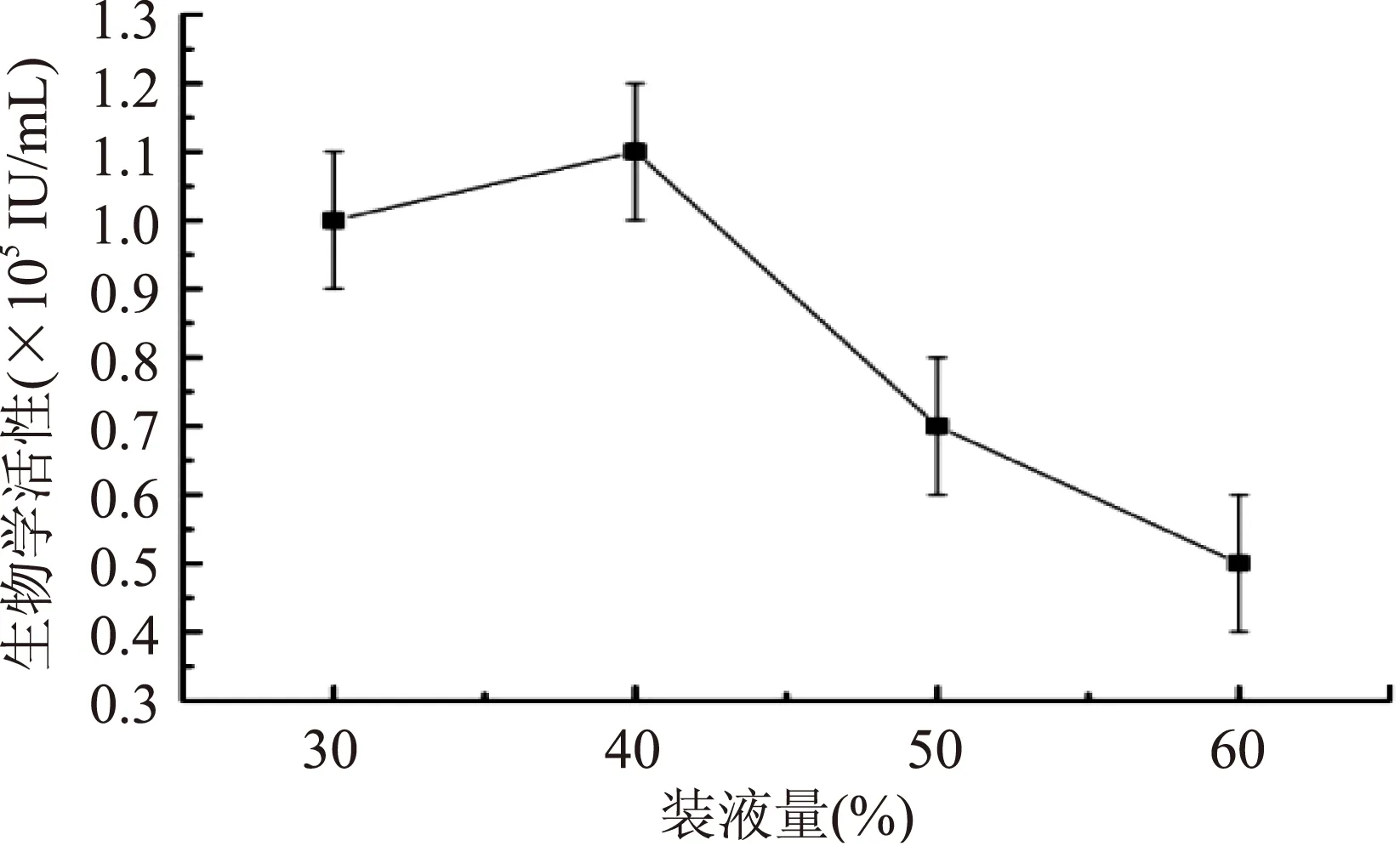
图2 装液量对鸡重组α-干扰素冻干粉剂制备的影响Fig.2 Effects of medium volume on the production of lyophilized recombinant chicken α-interferon

图3 鸡重组α-干扰素冻干粉剂外观图Fig.3 Lyophilized power image of recombinant chicken α-interferon
2.3生物活性稳定性实验
将冻干后的样品,分别置于4、37、40 ℃条件下进行生物活性稳定性追踪实验,结果如表3所示,从定期取样测定生物活性的结果可以看出,一年内,无论在4 ℃还是在40 ℃(常规加速实验温度),样品的生物活性均变化不显著(p>0.05),该结果亦表明冻干保护剂的选择是恰当的。

表3 冻干样品的生物活性稳定性考察Table 3 Biological activity stability of lyophilized recombinant chicken α-interferon
3 结论
本研究通过冻干保护剂的筛选及冻干保护剂浓度的优化,确定冻干保护剂的最终配方(甘露醇(3%)+PEG(3%)),继而确定了最佳的装液量(40%)。冻干粉剂外观呈海绵状、表面平整、体积与冻结时的体积基本一致,颜色均匀,无起泡现象,复水迅速而完全(30 s内复水为合格)。通过生物活性稳定性实验,40 ℃条件下贮藏12个月,生物活性无明显变化,证明冻干保护剂的选择是恰当的。最终获得的冻干保护工艺对鸡重组α-干扰素冻干粉剂工业化生产具有一定的指导和借鉴意义。
[1]要瑞丽,注射用鸡重组干扰素γ冻干粉针的开发及发展[J]. 中国动物保健,2013,15(3):32-33.
[2]蔡家利,尹忠宝,朱广倍,等. 重组猪α干扰素的体外活性测定和冻干保护剂的筛选[J]. 重庆理工大学学报,2014,28(4):58-61.
[3]董世娟,朱于敏,于瑞嵩,等. 重组猪α干扰素冻干保护剂的筛选[J].中国兽药杂志,2010,44(3):37-40.
[4]蔡家利,尹忠宝,朱广倍,等. 重组猪α干扰素的体外活性测定和冻干保护剂的筛选[J]. 重庆理工大学学报,2014,28(4):58-61.
[5]林彤慧,李世旭. 冻干过程中常见异常现象的处理[J]. 中国药业,2002,11(11):44.
[6]Zhao G,Zhang G. Effect of protective agents,freezing temperature,rehydration media on viability of malolactic bacteria subjected to freeze-drying[J]. Journal of Applied Microbiology,2005,99(2):333-338.
[7]Virgilio TJ,Duclerc FP,Bronislaw P,et al. Effect of lyophilization on the structure and phase changes of PEGylated-bovine serum albumin[J]. Int. J. Pharm,2005,304(1-2):124-134.
[8]Hamrang Z,Rattray N J W,Pluen A. Proteins behaving badly:emerging technologies in profiling biopharmaceutical aggregation[J]. Trends in Biotechnology,2013,31(8):448-458.
[9]Silva J P S E,Freitas A C,Probiotic Bacteria:Fundamentals,Therapy,and Technological Aspects[M]. Crc Press. 2014.
[10]蔡梅红,曹瑞兵,曹景立,等. 重组酵母鸡干扰素的诱导表达及其抗MDV、NDV能力[J]. 西北农林科技大学学报,2010,38(9):37-41.
[11]Telikepalli S N,Kumru O S,Kalonia C,et al. Structural characterization of IgG1 mAb aggregates and particles generated under various stress conditions[J]. Journal of Pharmaceutical Sciences,2014,103(3):796-809.
[12]Mendoza G M,Pasteris S E,Otero M C,et al. Survival and beneficial properties of lactic acid bacteria from raniculture subjected to freeze-drying and storage[J]. Journal of Applied Microbiology,2014,116(1):157-166.
Screening of the lyophilized protectant for recombinant chicken alpha-interferon preparation
JIANG Zheng-jun1,KANG Mei1,WANG Shao-juan1,HUANG Jin1,2,*
(1.Shandong Huachen Bio-tech Co.,Ltd,Weifang 261061,China;2.Zhejiang University of Technology,Hangzhou 310014,China)
In order to achieve excellent component of lyophilized protectant for chicken alpha-interferon production,lyophilized protectants were screened at first. Secondly,the concentration of protectants and the medium volume were optimized. As the results showed,the mannitol and PEG were selected as the best lyophilized multi-protectants and the concentrations were defined as 3% and 3% respectively. And with the optimized medium volume of 40%,the physical appearance was sponginess and uniform,tabulated,bubble-free and quickly soluble. Under the optimized conditions,the lyophilized recombinant chicken alpha interferon was harvested. The anti-virus activity of alpha-interferon showed no significant difference after 12 months under the temperature at about 40 ℃. This process was successfully established and could be advantageous to its application for chicken alpha interferon production.
chicken alpha-interferon;lyophilized protectant;optimization;screening
2015-08-31
姜正军(1971-),男,硕士,高级工程师,研究方向:E-mail:sinostar5555@gmail.com。
黄金(1979-),男,博士,副教授,研究方向:蛋白类药物,E-mail:huangjin979@zjut.edu.cn。
山东省2011年科技发展计划资助项目(2011GGH22109)。
TS201.1
A
1002-0306(2016)09-0089-04
10.13386/j.issn1002-0306.2016.09.009

