通用转录因子GTFⅡF2对食管癌细胞增殖、迁移的影响
陈丹丹,耿慧武,潘林鑫,刘晓颖,范礼斌
通用转录因子GTFⅡF2对食管癌细胞增殖、迁移的影响
陈丹丹,耿慧武,潘林鑫,刘晓颖,范礼斌
目的 研究通用转录因子ⅡF多肽2(GTFⅡF2)的表达对食管癌细胞增殖及迁移的影响。方法 人工合成靶向GTFⅡF2基因的siRNA序列和阴性对照siRNA序列及质粒pcDNA3.1-GTFⅡF2-FLAG,分别转染至食管癌细胞中,采用克隆形成实验和细胞划痕实验观察其对食管癌细胞增殖和迁移的影响。结果 RNA干扰技术靶向沉默GTFⅡF2基因表达后,食管癌细胞增殖和迁移均明显受到了抑制,而过表达GTFⅡF2对食管癌细胞的增殖和迁移无明显影响。结论GTFⅡF2基因在食管癌细胞TE-1、ECA-109的增殖和迁移过程中发挥重要作用,为进一步了解GTFⅡF2基因抑制TE-1、ECA-109细胞增殖和迁移的机制提供了基础。
GTFⅡF2;基因表达;RNA干扰;细胞增殖;细胞迁移
网络出版时间:2016-6-6 13:52:32 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.028.html
通用转录因子ⅡF多肽2(general transcription factorⅡF subunit 2,GTFⅡF2)由Sopta et al[1]从HeLa细胞提取,在早幼粒细胞性白血病细胞HL60 cDNA文库中筛选表达生成的相关蛋白。人的GTF ⅡF2基因位于染色体13q14上,全长750 bp,包含8个外显子和7个内含子,编码249个氨基酸残基,相对分子质量约为28 ku。GTFⅡF参与基因转录的起始、启动子清除、延伸过程,是由GTFⅡF2的N-末端和GTFⅡF1两种亚基组成的四聚体分子。GTFⅡF2中间部分通过RPB5结合到RNA聚合酶Ⅱ,对转录延伸过程起到重要作用。GTFⅡF2的C-末端包含一个非特异性的DNA结合结构域,该蛋白有特有的依赖 ATP的DNA解旋酶活性[1],很多重要的转录因子以GTFⅡF2为靶分子,通过与其相互作用影响转录起始复合物的形成,影响并调节转录过程,因此GTFⅡF2被认为是转录过程中重要的基本转录因子。研究[2-3]证实GTFⅡF2功能发生变化将导致严重的疾病。该研究主要借助RNA干扰技术对GTFⅡF2基因表达进行沉默以及过表达GTFⅡF2,研究其表达对食管癌细胞TE-1、ECA-109的增殖和迁移的影响。
1 材料与方法
1.1质粒、菌株和细胞 pcDNA3.1-GTFⅡF2-FLAG质粒、TG1感受态细胞、食管癌细胞株 TE-1和ECA-109均由安徽医科大学生物实验室保存。
1.2主要试剂与仪器 结晶紫、台盼蓝购自上海生工生物有限公司;siRNA的序列由通用生物系统(安徽)有限公司合成;Gibco胎牛血清、LipofectamineTM2000 Reagent、Opti-MEM Reduced serum Medium购自美国Invitrogen公司;EcoRⅠ、EcoRⅤ限制性内切酶及Lambda DNA EcoRⅠ+HindⅢMarker均购自加拿大Fermentas公司;改良型RPMI-1640培养基、胎牛血清和分光光度计NanoDrop 2000购自赛默飞世尔生物化学制品(北京)有限公司;Western及IP细胞裂解液和一抗、二抗稀释液以及Bradford蛋白浓度测定试剂盒均购自上海碧云天公司;GTFⅡF2(H-148)抗体购自美国Santa Cruz公司;β-actin购自美国Sigma公司;辣根过氧化物酶标记的山羊抗兔IgG购自北京中杉金桥生物技术有限公司;ECL显色试剂盒购自美国Pierce公司;Countstar自动细胞计数仪购自上海睿钰生物科技有限公司;PVDF膜购自美国Millipore公司。
1.3方法
1.3.1细胞转染 已设计并且合成两对GTFⅡF2 siRNA序列,即GTFⅡF2 siRNA1:正义链为5′-GUCACAGCAAUGGGCUAAAdTdT-3′,反义链为 5′-UUUAGCCCAUUGCUGUGACdTdT-3′;GTFⅡF2 siRNA2:正义链为5′-GUGUUGGAGGACAGACAUUdTdT-3′,反义链为5′-AAUGUCUGUCCUCCAACACdTdT-3′。
转染前1 d,胰酶消化对数生长期的细胞并计数,将细胞接种于600~800 μl无抗生素培养基的24孔培养板中,转染siRNA和pcDNA3.1-GTFⅡF2-FLAG每孔分别为4×104和2×105个细胞。铺板次日,转染siRNA细胞贴壁生长汇合至30%~40%,过表达细胞汇合度80%~90%,进行siRNA和过表达GTFⅡF2-FLAG转染实验。其中siRNA的终浓度拟设定为50 nmol/L,pcDNA3.1-GTFⅡF2-FLAG转染1 μg,每组2个复孔。按LipofectamineTM2000说明书转染siRNA和pcDNA3.1-GTFⅡF2-FLAG质粒。将转染后的培养板放入CO2培养箱中孵育6 h,换新鲜不含抗生素的改良型RPMI-1640培养液。37℃、5%CO2培养孵育48 h,收集并且裂解细胞进行GTFⅡF2基因表达后的检测。
1.3.2Western blot检测 细胞转染后约48 h,用含蛋白酶抑制剂PMSF的Western细胞裂解液将TE-1、ECA-109细胞冰上裂解约0.5 h,收集细胞;4℃、14 000 r/min离心20 min,使用 Bradford蛋白浓度测定试剂盒对上清液进行蛋白定量;取30 μg与等体积2×SDS上样缓冲液混合,沸水浴5 min,冰浴3 min后,进行12%SDS-PAGE电泳约2 h;转移至PVDF膜,100 V恒压电转1 h,用含5%脱脂奶粉的TBST溶液封闭2 h,0.05%Tween-20的TBST洗涤PVDF膜3次;GTFⅡF2一抗(1∶500,用一抗稀释液稀释)4℃过夜孵育,TBST洗膜后与辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000,用含5%脱脂奶粉的TBST溶液稀释)室温孵育约2 h;TBST洗膜后用ECL试剂盒显色,在暗室中用X光片曝光并显影和定影,X光片晾干后扫描。
1.3.3克隆形成实验 通过克隆形成实验检测GTFⅡF2 siRNA和过表达GTFⅡF2对食管癌细胞抗恶性细胞增生的影响。GTFⅡ F2 siRNA和pcDNA3.1-GTFⅡF2-FLAG在转染48 h后,胰酶消化对数生长期的细胞并计数,2 000个细胞接种于6孔板中,轻轻晃动,使细胞分散均匀。置37℃、5% CO2及饱和湿度的细胞培养箱中培养10~12 d,期间经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。将培养皿置于冰上,弃去上清液,用预冷的PBS小心浸洗2次。加约500 μl的-20℃预冷甲醇,固定细胞10 min。弃固定液,加适量0.5%结晶紫(25%甲醇配制)染色液在室温下孵育15~20 min,然后用蒸馏水洗去染液,空气干燥,之后拍照分析。
1.3.4细胞迁移实验 先用Marker笔在24孔板背后,均匀划横线,约每隔0.5~1.0 cm一条,横穿过孔。每孔至少穿过3条线。在孔中加入约5×105个细胞,具体数量因细胞不同而异,以过夜能铺满为标准。第二天用100 μl枪头,垂直于背面的横线于汇合完全的单细胞层中划线。用PBS洗细胞3次,以去除划下的细胞,加入无血清培养基,每组2个复孔,常规放入 37℃、5%CO2培养箱,培养。按 0、24、48 h取样拍照。
2 结果
2.1Western blot分析GTFⅡF2蛋白表达水平
siRNA1、siRNA2和pcDNA3.1-GTFⅡ F2-FLAG分别转染于TE-1、ECA-109细胞48 h后提取总蛋白,Western blot法检测GTFⅡF2蛋白表达情况。转染阴性对照siRNA和GTFⅡF2 siRNA1细胞GTFⅡF2蛋白表达水平与未转染的基本一致,而转染GTFⅡF2 siRNA2细胞GTFⅡF2蛋白表达水平显著低于未转染、转染阴性对照siRNA和GTFⅡF2 siRNA1细胞。GTFⅡF2 siRNA2基因表达抑制率达到90%,表明该GTFⅡF2靶向siRNA2能够有效沉默食管癌细胞中GTFⅡF2基因的表达(P <0.01)。见图1。而过表达GTFⅡF2无明显影响。见图2。
2.2GTFⅡF2表达对食管癌细胞增殖的影响用于克隆形成实验剩余的细胞再经Western blot法分析GTFⅡF2蛋白表达情况,再次证实转染阴性对照siRNA与未转染的基本一致,而转染GTFⅡF2 siRNA2细胞GTFⅡF2蛋白表达水平显著低于未转染、转染阴性对照siRNA(P<0.01)。见图3。
经结晶紫染色后,转染阴性对照siRNA与未转染平均细胞量的基本一致,而转染GTFⅡF2 siR NA2平均细胞量显著低于未转染、转染阴性对照siRNA。表明该GTFⅡF2靶向siRNA2能够有效抑制食管癌细胞TE-1、ECA-109的增殖(P<0.01)。见图4。对GTFⅡF2的过表达进行同样的研究,结果显示对食管癌的增殖并无明显影响。见图5。

图1 Western blot法分析knockdown GTFⅡF2蛋白表达水平

图2 Western blot法分析过表达GTFⅡF2蛋白表达水平

图3 Western blot法分析knockdownGTFⅡF2蛋白表达水平
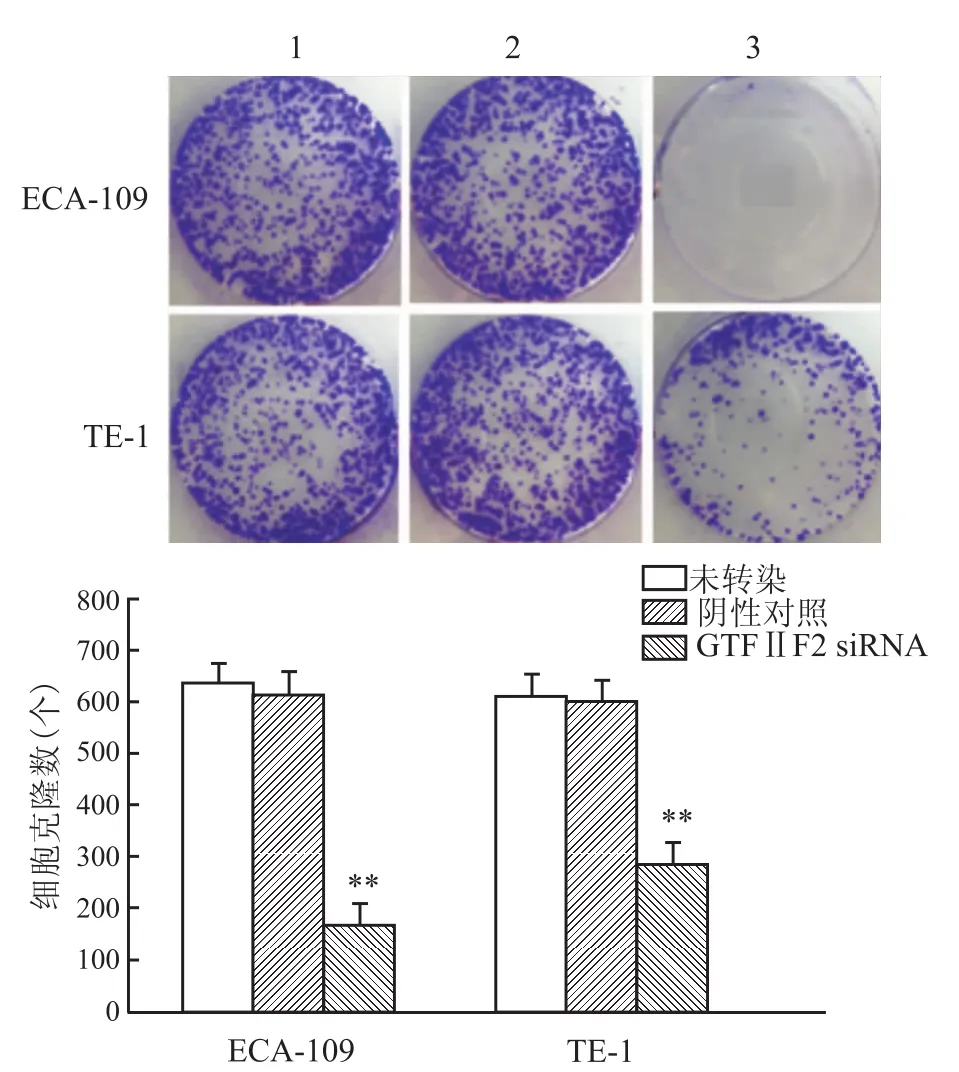
图4 GTFIIF2 siRNA2对食管癌细胞增殖的影响

图5 GTFⅡF2过表达对食管癌细胞增殖的影响
2.3GTFⅡF2表达对食管癌细胞迁移的影响在细胞层上用枪头划痕,转染GTFⅡF2 siRNA2的细胞迁移受到抑制,差异有统计学意义(P<0.01)。见图6、表1。而转染阴性对照siRNA和未转染的细胞保持了原有的迁移能力,48 h后通过迁移将划痕部分掩盖,对GTFⅡF2的过表达进行同样的研究,结果显示对食管癌的迁移并无明显影响,见图7、表2。

图6 GTFⅡF2 siRNA2对ECA-109细胞迁移的影响 ×100

图7 GTFⅡF2 siRNA2对 TE-1细胞迁移的影响×100
表1 GTFⅡF2 siRNA对食管癌细胞迁移的影响(±s)

表1 GTFⅡF2 siRNA对食管癌细胞迁移的影响(±s)
项目 未转染 阴性对照siRNA GTFⅡF2 siRNA2 F值 P值ECA-109 24 h 59.30±13.15 51.44±11.29 19.92±5.14 15.949 0.001 48 h 56.46±12.73 50.83±10.71 17.32±4.47 18.107 0.001 TE-1 24 h 64.11±16.77 60.06±14.91 26.89±7.87 8.849 0.007 48 h 61.03±15.75 59.11±14.07 23.23±6.05 11.271 0.003
表2 过表达 GTFⅡF2对食管癌细胞迁移的影响(±s)

表2 过表达 GTFⅡF2对食管癌细胞迁移的影响(±s)
项目 未转染 阴性对照pcDNA3.1 FLAGGTFⅡF2 F值 P值ECA-109 24 h 59.30±13.15 58.64±13.02 59.55±14.12 0.005 0.995 48 h 56.46±12.73 55.25±12.44 54.87±12.13 0.018 0.982 TE-1 24 h 64.11±16.77 63.42±17.74 62.98±16.48 0.004 0.995 48 h 61.03±15.75 60.23±14.93 61.47±15.82 0.006 0.993
3 讨论
GTFⅡF2通过在mRNA合成的起始和延长过程中控制着RNA聚合酶Ⅱ的活性,影响转录的过程。从哺乳动物细胞内纯化的GTFⅡF2被广泛磷酸化[4],磷酸化酪氨酸可激活多种信号转导途径[5],影响疾病的发生与发展。已有研究[6]表明GTFⅡF2突变体对亨廷顿疾病的发生也存在一定的影响。因此探讨GTFⅡF2在致病中的作用机制有非常重要的意义。
为了研究GTFⅡF2基因在食管癌 TE-1、ECA-109细胞中的生物学作用,本实验采用RNA干扰和转染技术分别使细胞中GTFⅡF2基因进行靶向沉默和过表达,对细胞增殖和迁移进行一系列的研究。本研究将设计合成的两对siRNA序列以及构建成功的pcDNA3.1-GTFⅡF2-FLAG分别转染至食管细胞TE-1和ECA-109后,经 Western blot检测GTFⅡF2蛋白的表达水平,结果表明GTFⅡF2 siRNA2序列明显抑制GTFⅡF2的表达,并且干扰效果优于GTFⅡF2 siRNA1,所以后续一系列实验选用GTFⅡF2 siRNA2进行。Western blot检测结果显示GTFⅡF2 siRNA2在食管癌细胞ECA-109中的knockdown效率达到90%,蛋白表达需要转录因子复合物的共同参与,包括TFⅡA、TFⅡB、TFⅡD、TFⅡE、TFⅡF和TFⅡH[7]。其中GTFⅡF2与RNA聚合酶Ⅱ联系密切[8],功能上与大肠杆菌的RNA聚合酶的sigma70亚基类似,都有识别转录的起始位置,并使RNA聚合酶结合在启动子部位的功能。Knockdown GTFⅡF2无法使转录正常进行。GTFⅡF2 siRNA2在食管癌细胞ECA-109中的knockdown效率明显高于TE-1,说明同一序列在不同细胞中所起的作用也有差异;GTFⅡF2抑制了非特异性转录的起始[9],并且募集聚合酶形成,连同起始复合物到启动子DNA上影响了启动转录的起始过程。过表达FLAG-GTFⅡF2 Western blot结果条带偏高,其中除了有GTFⅡF2内源性表达,FLAG标签对GTFⅡF2的表达可能也有影响。
Western blot检测结果已经证实GTFⅡF2 siRNA2序列明显抑制了GTFⅡF2的表达,鉴于GTFⅡF2对转录过程发挥很重要的作用,设想knockdown GTFⅡF2之后对食管癌细胞的增殖也有影响,所以本实验采用克隆形成实验研究其对细胞增殖的影响。结果表明GTFⅡF2靶向siRNA2能够有效抑制食管癌细胞TE-1、ECA-109的增殖,对ECA-109的抑制率约达70%,而对TE-1抑制率达到50%,其对ECA-109的效果较明显于TE-1。但对GTFⅡF2的过表达进行同样的研究,结果显示对食管癌的增殖并无明显影响,转染空载体与质粒的克隆形成数量比未转染的少,可能是由于质粒转染本身对细胞有影响,但是转染空载体和重组质粒的克隆形成数量相差不大。结果表明虽然GTFⅡF2作为通用转录因子,是转录过程所必需,但并非其能单一影响和调控增殖过程。RNA聚合酶Ⅱ由约10~12个亚基组成[10-11],GTFⅡF2可能结合RNA聚合酶Ⅱ的亚基RPB5来调控转录过程,影响了细胞克隆的增殖。
为了解RNA干扰GTFⅡF2及过表达GTFⅡF2之后对食管癌迁移是否有影响,进行了划痕实验。转染GTFⅡF2 siRNA2后,与阴性对照siRNA组相比,细胞迁移受到明显的抑制;而未转染、阴性对照转染的细胞保持了原有的迁移能力,在一段时间后通过迁移将划痕部分掩盖,GTFⅡF2 siRNA2对ECA-109、TE-1的迁移活性较对照组分别降低了70%和55%,差异有统计学意义;而未转染、转染空载体和重组质粒pcDNA3.1-GTFⅡF2-FLAG并未对细胞迁移产生明显影响。Knockdown GTFⅡF2实验结果提示,在食管癌细胞ECA-109和 TE-1中,细胞增殖以及迁移活性与GTFⅡF2在食管癌细胞中是否表达及表达量高低有关。
[1]Sopta M,Burton Z F,Greenblatt J.Structure and associated DNA-helicase activity of a general transcription initiation factor that binds to RNA polymeraseⅡ[J].Nature,1989,341(6241):410-4.
[2]Bansard C,Lequerré T,Derambure C,et al.Gene profiling predicts rheumatoid arthritis responsiveness to IL-1Ra(anakinra)[J].Rheumatology,2011,50(2):283-92.
[3]Kaplan A,Stockwell B R.Therapeutic approaches to preventing cell death in Huntington disease[J].Prog Neurobiol,2012,99 (3):262-80.
[4]Kitajima S,Chibazakura T,Yonaha M,et al.Regulation of the human general transcription initiation factor TFⅡF by phosphorylation[J].J Biol Chem,1994,269(47):29970-7.
[5]钱 成,王蓓华,徐雪琴,等.肌营养不良蛋白及其衍生物的表达与定位的研究[J].安徽医科大学学报,2015,50(9):1207 -10.
[6]Zhai W,Jeong H,Cui L,et al.In Vitro analysis of huntingtinmediated transcriptional repression reveals multiple transcription factor targets[J].Cell,2005,123(7):1241-53.
[7]Thomas M C,Chiang C M.The general transcription machinery and general cofactors[J].Crit Rev Biochem Mol Biol,2006,41 (3):105-78.
[8]Flores O,Ha I,Reinberg D.Factors involved in specific transcription by mammalian RNA polymeraseⅡ.Purification and subunit composition of transcription factorⅡF[J].J Biol Chem,1990,265(10):5629-34.
[9]Tan S,Garrett K P,Conaway R C,et al.Cryptic DNA-binding domain in the C terminus of RNA polymeraseⅡgeneral transcrip-tion factor RAP30[J].Proc Natl Acad Sci,1994,91(21):9808-12.
[10]Sawadogo M,Sentenac A.RNA polymerase B(II)and general transcription factors[J].Annu Rev Biochem,1990,59:711-54.
[11]Sentenac A.Eukaryotic RNA polymerases[J].CRC Crit Rev Biochem,1985,18(1):31-90.
The effect of general transcription factor GTFⅡF2 expression on the proliferation and migration of esophageal cancer cells
Chen Dandan,Geng Huiwu,Pan Linxin,et al
(Dept of Biology,Anhui Medical University,Hefei 230032)
Objective To investigate the effect of general transcription factor GTFⅡF2 expression on the proliferation and migration of esophageal cancer cells.Methods Synthesized siRNA targeted to GTFⅡF2 gene or negative control siRNA and plasmid pcDNA3.1-GTFⅡF2-FLAG were transfected to esophageal cancer cells respectively by using LipofectamineTM2000.Colony formation assay and wound-healing assay were performed to study the effect of knockdown and overexpression of GTFⅡF2 expression on the proliferation and migration of esophageal cancer cells respectively.Results Knockdown of GTFⅡF2 inhibited the proliferation and migration in TE-1,ECA-109 cells,but overexpression of GTFⅡF2 had no significant effect on cell proliferation and migration.Conclusion GTFⅡF2 gene plays an important role in the proliferation and migration of TE-1,ECA-109 cells.It is useful for further understanding of the mechanism that GTFⅡF2 inhibits the proliferation and migration of TE-1,ECA-109 cells.
GTFⅡF2;gene expression;RNA interference;cell proliferation;cell migration
R 735.1
A
1000-1492(2016)07-0984-06
2016-03-23接收
国家自然科学基金青年基金(编号:81201368)
安徽医科大学生命科学学院生物教研室,合肥 230032
陈丹丹,女,硕士研究生;刘晓颖,女,副教授,硕士生导师,责任作者,E-mail:liuxiaoying@ahmu.edu.cn范礼斌,男,教授,硕士生导师,责任作者,E-mail:lfan@ahmu.edu.cn

