重组TACI-Ig融合蛋白抑制抗CD3抗体诱导T淋巴细胞增殖与活化
杨思民,汪庆童,刘亢亢,汪龙生,吴 莉,魏 伟
◇基础医学研究◇
重组TACI-Ig融合蛋白抑制抗CD3抗体诱导T淋巴细胞增殖与活化
杨思民,汪庆童,刘亢亢,汪龙生,吴莉,魏伟
目的 探讨抗CD3抗体诱导小鼠T淋巴细胞增殖与活化的机制并观察重组人TACI-Ig融合蛋白(rhTACI-Ig)对其的影响。方法 免疫磁珠纯化得到小鼠T淋巴细胞,用抗CD3抗体刺激,同时给予rhTACI-Ig、rhTNFR∶Fc或IgG-Fc。[3H]-TdR参入法检测T细胞增殖能力,流式细胞术检测T细胞亚群比率,Western blot法检测B淋巴细胞刺激因子、BAFF受体(BAFFR)和跨膜激活剂及钙调亲环素配体相互作用分子(TACI)两个受体及IL-2受体(IL-2R)表达水平和NF-κB活性,采用小干扰RNA(siRNA)抑制T细胞BAFFR 或TACI的表达。结果 抗CD3抗体体外可促进T细胞增殖与活化,BAFF、白细胞介素-2(IL-2)、γ-干扰素(IFN-γ)和转化生长因子-β(TGF-β)分泌,BAFFR、TACI、IL-2R表达升高和NF-κB活性增强(P<0.05)。RhTACI-Ig(0.1、1、10、100 μg/ml)体外给药可抑制抗CD3抗体诱导的T淋巴细胞增殖(P<0.05);rhTACI-Ig(1、10、100 μg/ml)可明显降低抗 CD3抗体诱导产生的细胞因子水平(P<0.05,P<0.01),显著抑制CD4+CD69+T细胞、CD4+CD154+T细胞比率,提高CD4+CD62L+T细胞比率(P<0.05,P<0.01),且 rhTACI-Ig (10、100 μg/ml)能降低 T细胞上BAFFR、TACI、IL-2受体的表达,抑制NF-κB活性(P<0.05)。沉默BAFFR或TACI对抗CD3抗体诱导的T细胞增殖有抑制作用(P<0.01)。结论 抗CD3抗体部分通过产生BAFF,激活BAFFR信号而促进T细胞增殖与活化,rhTACI-Ig中和BAFF,抑制BAFF相关受体的表达和NF-κB活性,减少T细胞表达IL-2受体,阻止T细胞过度增殖与活化。
B淋巴细胞刺激因子;重组TACI-Ig融合蛋白;T淋巴细胞;免疫治疗;自身免疫病
网络出版时间:2016-6-6 13:52:31 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160606.1352.002.html
抗CD3抗体可以上调T淋巴细胞白细胞介素2受体(interleukine-2 receptor,IL-2R)表达,诱导细胞增殖与活化[1]。活化的T细胞能分泌IL-1、IL-2、IL-6、IL-10和B淋巴细胞刺激因子(B lymphocyte stimulator,BlyS or BAFF)等多种细胞因子[2]。BAFF及APRIL水平的异常与类风湿关节炎(rheumatoid arthritis,RA)等自身免疫病的发病密切相关[3]。BAFF与APRIL有两个共同受体,即跨膜激活剂及钙调亲环素配体相互作用分子(transmembrane activator or calcium-modulating cyclophylin ligand-interactor,TACI)和 BAFF受体 (receptor for B-cell activating factor,BAFFR)。重组TACI-Ig融合蛋白(rhTACI-Ig)是TACI的胞外部分和人IgG1的Fc段链接而成,能竞争性结合BAFF和APRIL。该实验观察rhTACI-Ig对抗CD3抗体活化的T淋巴细胞及其相关受体和细胞因子的调节作用,并从BAFFR和TACI及其下游信号分子通路的角度,进一步探讨BAFF影响T细胞的机制,为rhTACI-Ig控制T细胞增殖与活化提供实验依据。
1 材料与方法
1.1实验动物 雄性SPF级C57BL/6J小鼠,7~8周龄,(20±2)g,购于上海实验动物研究中心。实验中涉及的小鼠实验方案均经安徽医科大学临床药理研究所动物伦理委员会批准。
1.2药物和试剂 小鼠淋巴细胞分离液购于天津市灏洋生物制品科技有限责任公司;全T细胞分选试剂盒购于德国美天旎生物技术有限公司;DMEM培养基购于美国Gibco公司;氚标记的胸腺嘧啶核苷(3H-TdR)购于中国科学院上海应用物理研究所;T细胞培养上清液IL-2、IL-4、干扰素-γ(interferonγ,IFN-γ)和转化生长因子-β(transforming growth factor-β,TGF-β)水平ELISA试剂盒购于美国R&D公司;兔抗CD3多克隆抗体购于北京博奥森生物技术有限公司;rhTNFR:Fc购于上海中信国健药业有限公司;重组TACI-Ig融合蛋白(批号:20120607)和阴性对照IgG-Fc(批号:20120603)由烟台荣昌生物制药有限公司提供;流式抗体CD69/PE、CD154/ PE、CD62L/PE、CD4/FITC购于美国Biolgend公司;抗BAFFR、TACI、IL-2R一抗购于美国Santa Cruz公司;抗NF-κB p100/p52和抗磷酸化NF-κB p100/ p52(S865)一抗购于英国Abcam公司;辣根酶标记的山羊抗兔IgG及山羊抗鼠IgG购自北京中杉金桥生物技术有限公司;小干扰RNA(small interfering RNA,siRNA)购于上海吉玛制药技术有限公司。
1.3方法
1.3.1小鼠脾脏T淋巴细胞的分离 处死小鼠,无菌剥离脾脏,常规制备小鼠脾脏细胞悬液后用小鼠淋巴细胞分离液纯化,分离得脾脏单个核细胞悬液后进行细胞计数。调节细胞浓度至每40μl含107个细胞。每107个细胞加入10 μl非T细胞的生物素化抗体混合物,轻轻震荡混合经4℃孵育后再按照每107个细胞加入20 μl抗生物素微珠的比例,轻轻震荡混合经4℃孵育后,将细胞悬液在冲洗的PBS流净前加入处于磁场中的分离柱,收集流出液,再用500 μl PBS冲洗3遍后得到未被磁性标记的T淋巴细胞。将得到的T淋巴细胞重新计数铺板培养。
1.3.2分组和给药 将收集到的T淋巴细胞分为正常组、刺激组、rhTACI-Ig浓度组(0.01、0.1、1、10、100 μg/ml)、IgG-Fc(10 μg/ml)阴性对照组和重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(tumour necrosis factor Fc fusion protein,rhTNFR:Fc)(10 μg/ml)阳性对照组。除正常组外,其余各组均用anti-CD3(10 μg/ml)刺激。T淋巴细胞给药培养72 h后分别用于细胞增殖检测、细胞因子水平测定、细胞亚群检测以及受体和信号分子表达水平测定。
1.3.3T淋巴细胞增殖检测 在96孔培养板上,每孔加入100 μl纯化T淋巴细胞悬液(终浓度为1 ×107/ml)及anti-CD3(终浓度为10 μg/ml),同时每个孔加入不同浓度的rhTACI-Ig(终浓度为0.01、0.1、1、10、100 μg/ml)、rhTNFR:Fc(终浓度为10 μg/ml)或IgG-Fc(终浓度为10 μg/ml),每孔的终容积为200 μl,置37℃、5%CO2培养箱培养。在收集细胞前12 h时每孔加入25μl3H-TdR(105Bq/ml)后培养结束,用多头细胞收集器收集细胞于玻璃纤维滤纸上,用液闪仪测其放射性。
1.3.4T淋巴细胞培养上清液中IL-2、IFN-γ、IL-4、TGF-β水平检测 在24孔培养板上,每孔加入500 μl纯化T淋巴细胞悬液(1×107/ml)和anti-CD3(终浓度为10 μg/ml),同时每个孔加入不同浓度的rhTACI-Ig、rhTNFR:Fc或IgG-Fc,每孔的终容积为1 ml。培养72 h后离心(3 000 r/min,10 min),取上清液,采用ELISA法检测IL-2、IFN-γ、IL-4、TGF-β水平。
1.3.5T淋巴细胞亚群比例检测 在50 ml培养瓶中,每瓶分别加入2×107个经纯化T淋巴细胞悬液和抗CD3(终浓度为10 μg/ml),加入后最终的容积为2 ml,加入不同浓度的rhTACI-Ig、rhTNFR:Fc或IgG-Fc,培养72 h后,收集细胞,每管300 μl细胞悬液(1×106/ml),分别加入5 μl适当稀释的CD154-PE/CD4-FITC一抗、CD69-PE/CD4-FITC一抗、CD62L-PE/CD4-FITC一抗,4℃避光孵育30 min后用流式细胞仪检测。
1.3.6T淋巴细胞BAFFR、TACI、IL-2R、磷酸化和总NF-κB p100/p52检测 将6孔板内给药处理后的T淋巴细胞转移至2 ml EP管中,离心(3 000 r/ min,5 min),弃去培养液。每管加入50 μl蛋白裂解液(PMSF 1∶100),充分混匀,冰上静置裂解30 min后,在-80℃和4℃冰箱间反复冻融3次,离心(14 000 r/min,15 min),小心吸取上清液即得总蛋白,用Western blot法检测BAFFR、TACI、IL-2R、磷酸化和总NF-κB p100/p52的表达。将提取的蛋白定量后加入上样缓冲液,进行SDS-PAGE电泳,转移至PVDF膜后,用封闭液封闭2 h,洗脱缓冲液洗3次,4℃冰箱孵育一抗过夜。次日,室温下复温10 min,洗脱缓冲液洗3次,37℃摇床孵育对应的二抗2 h,洗脱缓冲液洗3次,ECL试剂盒显色。用凝胶成像系统扫描结果,以特异性条带的灰度值来反映蛋白表达水平。
1.3.7siRNA转染 将分离的T淋巴细胞按3×106/孔接种在12孔培养板中,1 000 r/min,离心10 min,弃上清液。每管加入100 μl Nucleofector Solution、100 nmol/L siRNA,使用细胞核转染仪进行电转。电转后,立即补充培养液至1.5 ml,培养24 h后加BAFF继续作用24 h。TACI siRNA序列为5′-CAGCGGAGTGGAGAAGTTGAA-3′;BAFFR siRNA序列为5′-TGTGGAAAGGACGAAACACC-3′。
1.4统计学处理 应用SPSS 17.0软件处理和分析数据,结果以表示,两组均数间差异比较用t检验,多组均数间差异的比较采用One Way Anova检验。
2 结果
2.1抗CD3抗体诱导T淋巴细胞BAFF分泌和增殖及hTACI-Ig的作用 抗CD3抗体不同浓度梯度和作用时间实验显示,10 μg/ml抗体刺激T淋巴细胞72 h为体外刺激的亚适浓度和最适时间。抗CD3抗体(10 μg/ml)刺激72 h,T淋巴细胞分泌大量BAFF且增殖功能明显亢进(F=2.869,P= 0.000 4)。rhTACI-Ig(0.1、1、10、100 μg/ml)和rhTNFR∶Fc(10 μg/ml)可明显抑制异常活化的T淋巴细胞增殖反应(F=51.75,P<0.05,P<0.01)。见图1。
2.2抗CD3抗体刺激对T淋巴细胞培养上清液中细胞因子水平的影响以及rhTACI-Ig对其的影响抗CD3抗体刺激可使T淋巴细胞培养上清液中IL-2、IFN-γ和TGF-β水平显著升高(P<0.05,P<0.01),IL-4浓度升高但无显著性。rhTACI-Ig(1、10、100 μg/ml)可明显降低IL-2(F=5.571,P<0.01)和IFN-γ(F=3.876,P<0.01)水平;降低IL-4 (F=7.105,P<0.05)和TGF-β(F=1.663,P<0.05)水平。RhTNFR:Fc可以显著降低抗CD3抗体刺激后升高的 IL-2、IL-4水平(P<0.05),但对IFN-γ和TGF-β无明显作用;IgG-Fc组对上述经抗CD3刺激后升高的细胞因子水平均无明显影响。见图2。

图1 rhTACI-Ig体外对抗CD3抗体诱导的T淋巴细胞增殖能力的影响
2.3rhTACI-Ig对抗CD3抗体刺激的T淋巴细胞亚群比率的影响 抗CD3抗体体外刺激T淋巴细胞,可使CD4+CD69+和CD4+CD154+细胞比率显著升高(P<0.01),同时显著降低CD4+CD62L+细胞比率(P<0.01)。rhTACI-Ig(1、10、100 μg/ml)可显著抑制被升高的CD4+CD69+细胞比率(F= 14.19,P<0.05,P<0.01);rhTACI-Ig(0.1、1、10、100 μg/ml)可明显降低CD4+CD154+细胞比率(F=19.31,P<0.05,P<0.01);rhTACI-Ig(10、100 μg/ml)可显著升高CD4+CD62L+细胞比率(F= 12.69,P<0.05);rhTNFR∶Fc可以明显升高CD4+CD62L+细胞比率(P<0.05),但对CD4+CD69+和CD4+CD154+无影响;IgG-Fc组对上述细胞亚群比率均无影响(图3)。
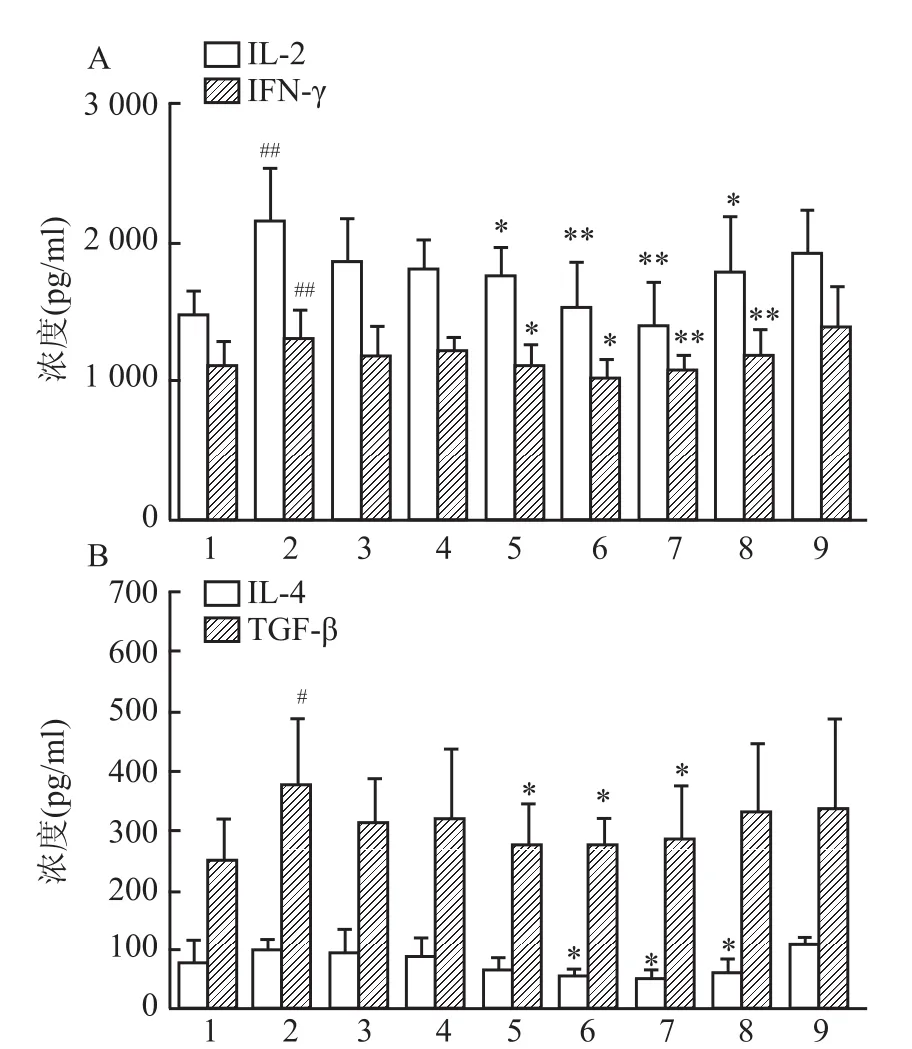
图2 抗CD3抗体刺激对于T淋巴细胞培养上清液中细胞因子水平的影响以及RhTACI-Ig对其的影响
2.4RhTACI-Ig对T淋巴细胞BAFFR、TACI、IL-2R表达和NF-κB p100/p52蛋白表达情况活性的影响 纯化培养T细胞,抗CD3抗体体外刺激可显著升高T淋巴细胞TACI、BAFFR、IL-2R的表达;rhTACI-Ig(1、10 μg/ml)体外给药对异常升高的TACI(F=562.3,P<0.01)、BAFFR(F=1032,P<0.01)、IL-2R(F=9.126,P<0.05)水平有抑制作用,提示rhTACI-Ig抑制BAFF受体信号通路,并阻止T细胞活化。抗CD3抗体可促进T细胞NF-κB p100/p52 865位点丝氨酸磷酸化活化,不改变总NF-κB p100/p52水平;rhTACI-Ig(1、10 μg/ml)阻止了抗CD3抗体诱导的NF-κB p100/p52磷酸化(F= 20.60,P<0.05)。见图4。

图4 RhTACI-Ig对T淋巴细胞BAFFR、TACI、IL-2R表达和NF-κB活性的影响
2.5T淋巴细胞BAFFR或TACI受体对抗CD3抗体诱导细胞增殖的影响 用电转法将BAFFR或 TACI siRNA分别转染入分离纯化的小鼠T淋巴细胞内,转染48 h后用Western blot法检测转染效率,筛选最佳siRNA序列。实验表明BAFFR siRNA的最高沉默率为58.3%(F=64.05),TACI siRNA的最高沉默率为 63.4%(F=41.35)(图 5)。沉默BAFFR后,抗CD3抗体虽然仍能刺激T细胞轻度增殖,但增殖程度显著低于对照组(F=51.49,P<0.01);沉默TACI也对抗CD3抗体诱导的T细胞增殖有抑制作用(F=57.63,P<0.001)(图6),提示抗CD3抗体体外促进T细胞增殖和活化的作用部分通过分泌BAFF,激活BAFFR和TACI受体及下游信号通路来实现。

图5 沉默BAFFR或TACI对抗CD3抗体受体表达水平的影响

图6 沉默BAFFR或TACI对抗CD3抗体诱导T淋巴细胞增殖的影响
3 讨论
免疫调节的异常在自身免疫病的发病机制中起着关键作用,涉及到多种免疫性细胞,其中T淋巴细胞的异常增殖与活化在自身免疫性疾病的发生发展及病理损伤起着重要的作用[4]。CD3分子作为分布于所有T淋巴细胞膜上的重要分化抗原,是T淋巴细胞共有的分子表面标志物。当CD3与T淋巴细胞上的T淋巴细胞受体(TCR)特异性识别结合后,CD3通过TCR-CD3复合体将信号转导到T淋巴细胞胞质内,在诱导T淋巴细胞活化过程中起着关键的作用,从而促进T淋巴细胞的增殖以及各种细胞因子的分泌[5]。因此,抗 CD3抗体能够模拟抗原与TCR结合,向T淋巴细胞传递有效的信号模拟CD3与TCR结合后产生的效应。静息T细胞不表达IL-2R,一旦被活化,T细胞分泌大量IL-2并迅速表达IL-2R[6]。本实验显示,抗CD3抗体促进T淋巴细胞高表达IL-2R,活化NF-κB p100/p52,产生大量BAFF,进一步促进T细胞的增殖活化。抑制BAFF受体BAFFR或TACI表达可减弱抗CD3抗体对T细胞的刺激作用,提示BAFF通路是除TCR信号外,抗CD3抗体活化T细胞的重要通路之一。
目前,在B淋巴细胞中作为BAFF的竞争性拮抗剂rhTACI-Ig对其作用以及相关的作用机制的研究[7]已较深入,但在T淋巴细胞中rhTACI-Ig的影响及相关作用机制尚未清楚。然而在RA、SLE等自身免疫病中,CD4+T淋巴细胞对于炎症免疫反应的诱发和持续起重要作用。CD4+T细胞被自身抗原或细胞因子刺激活化后,分化为不同的功能亚群,如Th1、Th2细胞或调节性T细胞。这些CD4+T细胞通过与其他免疫细胞的相互作用,形成复杂的功能网络,释放Th1(IL-2、IFN-γ)、Th2(IL-4)、Treg(TGF-β)型细胞因子[8]。本实验表明,经抗CD3抗体刺激的T淋巴细胞上清中上述细胞因子均出现了不同程度的升高,而在rhTACI-Ig体外用药时发现其能不同程度地降低其水平。
CD62L表达于初始T淋巴细胞,在相关特异性细胞因子或趋化因子激活淋巴细胞后,可使其细胞表面CD62L表达迅速下调[9]。CD69在T淋巴细胞活化后很短时间即可表达并迅速达到高峰,也是最早表达的分子表面标志,其作为细胞共刺激信号可进一步增强T淋巴细胞的活化或增殖分化[10]。CD154(CD40L)与B淋巴细胞表面的CD40结合,CD154与CD40这对共刺激分子在B淋巴细胞中产生关键的作用,可以活化B淋巴细胞、刺激抗体产生以及免疫球蛋白类型转换等,同时,对于T淋巴细胞活化与增殖及调节其所分泌的细胞因子等过程中也起重要的作用。未活化Th细胞(CD4+CD62L+)、表达活化诱导分子 Th细胞(CD4+/CD69+)和表达CD40L的Th细胞(CD4+/CD154+)比例及其所分泌的细胞因子在RA、SLE等自身免疫疾病的发病机制中起着关键作用,其比例变化可反映机体的免疫功能状态及药物的作用疗效[11]。RhTACIIg可调节T细胞表面活化标志分子的表达。
TACI和BAFFR与肿瘤坏死因子受体相关因子(TNF receptor-associated factor,TRAF)偶联,活化核因子-κB(nuclear factor-κB,NF-κB)p52,降解促凋亡蛋白 Bim,介导细胞活化[12]。RhTACI-Ig作为一种诱骗受体,可作为竞争性拮抗剂结合BAFF和APRIL,阻止它们与其表达在细胞上的相应受体结合,从而阻断其下游信号通路,减少炎性免疫细胞因子的产生[13]。在一些自身免疫病的报道中,使用rhTACI-Ig后病情可以得到一定的缓解,体内的血清中免疫球蛋白和自身抗体水平快速降低,并且能使病人体内表达水平升高的BAFF/APRIL同源三聚体及异源三聚体降低[14-15]。本研究显示,rhTACIIg可以通过中和抗CD3抗体刺激T细胞产生的BAFF,抑制BAFF受体信号和NF-κB活性,减少T细胞表达IL-2R,阻止T细胞增殖,显著抑制Th1型细胞因子产生,明显降低活化Th细胞(CD4+/ CD69+和CD4+/CD154+)比例,升高未活化T细胞(CD4+CD62L+)比例。综上,rhTACI-Ig对治疗T细胞反应依赖的自身免疫病有良好前景。
[1]Hirsch R,Gress R E,Pluznik D H,et al.Effects of in vivo administrationof anti-CD3 monoclonal antibody on T cell function in mice.II.In vivo activation of T cells[J].J Immunol,1989,142 (3):737-43.
[2]Boyman O,Kolios A G,Raeber M E.Modulation of T cell responses by IL-2 and IL-2 complexes[J].Clin Exp Rheumatol,2015,33(4 Suppl 92):54-7.
[3]Wei F,Chang Y,Wei W.The role of BAFF in the progression of rheumatoid arthritis[J].Cytokine,2015,76(2):537-44.
[4]Burmester G R,Feist E,Dörner T.Emerging cell and cytokine targets in rheumatoid arthritis[J].Nat Rev Rheumatol,2014,10 (2):77-88.
[5]Masopust D,Schenkel J M.The integration of T cell migration,differentiation and function[J].Nat Rev Immunol,2013,13 (5):309-20.
[6]Ruiz-Medina B E,Ross J A,Kirken R A.Interleukin-2 receptor β Thr-450 phosphorylation is a positive regulator for receptor complex stability and activation of signaling molecules[J].J Biol Chem,2015,290(34):20972-83.
[7]Wada K,Maeda K,Tajima K,et al.Expression of BAFF-R and TACI in reactive lymphoid tissues and B-cell lymphomas[J]. Histopathology,2009,54(2):221-32.
[8]Chen L,Flies D B.Molecular mechanisms of T cell co-stimulation and co-inhibition[J].Nat Rev Immunol,2013,13(4):227-42.
[9]Ivanova I,Seledtsova G,Mamaev S,et al.Immune responses induced by T-cell vaccination in patients with rheumatoid arthritis [J].Hum Vaccin Immunother,2014,10(5):221-7.
[10]Schoenberger S P.CD69 guides CD4+T cells to the seat of memory[J].Proc Natl Acad Sci U S A,2012,109(22):8358-9.
[11]吴华勋,陈镜宇,汪庆童,等.重组人肿瘤坏死因子受体融合蛋白体外对佐剂性关节炎大鼠淋巴细胞功能的影响[J].安徽医科大学学报,2012,47(11):1324-8.
[12]Stohl W.Therapeutic targeting of the BAFF/APRIL axis in systemic lupus erythematosus[J].Expert Opin Ther Targets,2014,18(4):473-89.
[13]Wang Q T,Ma Y K,Wei W,et al.Effect of rhTACI-Ig fusion protein on antigen-specific T cell responses from keyhole limpet haemocyanin challenged mice[J].Mol Immunol,2011,49(1-2):380-6.
[14]Zhang L,Li P,Wei W,et al.Comparative efficacy of TACI-Ig with TNF-alpha inhibitor and methotrexate in DBA/1 mice with collagen-induced arthritis[J].Eur J Pharmacol,2013,708(1-3):113-23.
[15]Yang Z,Fujii H,Mohan S V.Phosphofructokinase deficiency impairs ATP generation,autophagy,and redox balance in rheumatoid arthritis T cells[J].Nat Rev Rheumatol,2013,210(10):2119 -34.
Inhibitory effect of rhTACI-Ig on anti-CD3 antibody induced T lymphocytes proliferation and activation
Yang Simin,Wang Qingtong,Liu Kangkang,et al
(Institute of Clinical Pharmacology,Anhui Medical University,Key Laboratory of Anti-inflammatory and Immune Medicine of Education Ministry of China,Collaborative Innovation Center of Anti-inflammatory and Immune Medicine,Hefei 230032)
Objective To investigate the molecular mechanism of anti-CD3 antibody induced T lymphocytes proliferation and activation and observe the effect of recombination human TACI-Ig(rhTACI-Ig).Methods T lymphocytes were purified from the spleens of mice by immunomagnetic beads and treated with anti-CD3 antibody with or without different concentrations of rhTACI-Ig,recombinant human tumor necrosis factor-α receptor II:IgG Fc(rhTNFR:Fc)or IgGFc.The proliferation of T lymphocytes was determined by[3H]-TdR incorporation,the percentages of T lymphocytes subsets were tested by flow cytometry.Western blot was applied to evaluate the expression of B cell activating factor receptor(BAFFR),transmembraneactivator or calcium-modulating cyclophylin ligand-interactor(TACI),IL-2 receptor(IL-2R)and the phosphorylation of NF-κB.Small interfering RNAs were used to block BAFFR or TACI expression.Results Anti-CD3 obviously induced the activation of T lymphocytes,upregulated BAFF,interleukin-2(IL-2),interferon-γ(IFN-γ)and transforming growth factor-β(TGF-β)secretion,promoted BAFFR,TACI and IL-2R expression,activated NF-κB(P<0.05).The administration of rhTACI-Ig(0.1,1,10,100 μg/ml)inhibited the proliferation of T lymphocytes induced by anti-CD3 antibody(P<0.05).RhTACIIg(1,10,100 μg/ml)significantly decreased the production of cytokines(P<0.05,P<0.01),markedly downregulated the percentage of CD4+CD69+and CD4+CD154+T lymphocytes,elevated the proportion of CD4+CD62L+T lymphocytes(P<0.05,P<0.01).Meanwhile,rhTACI-Ig(10,100 μg/ml)treatment decreased the level of BAFFR,TACI,IL-2 on T lymphocytes,as well as attenuated the activation of NF-κB(P<0.05).Depletion of BAFFR or TACI markedly blocked anti-CD3 antibody dependent T cell proliferation(P<0.05,P<0.01). Conclusion Anti-CD3 antibody promotes T lymphocytes activation partially through BAFF production and BAFF receptors signaling.RhTACI-Ig neutralizes BAFF,inhibits BAFF signaling and therefore attenuates T lymphocytes activation.
B-cell activating factor;recombination human TACI-Ig;T lymphocytes;immunological therapy;autoimmune diseases
R 593.22;R 392.3;R 392.5;R 967;R 979.5
A
1000-1492(2016)07-0919-07
2016-04-06接收
国家自然科学基金(编号:81173075、81330081、81202541);安徽省自然科学基金(编号:1208085QH146);安徽医科大学青年拔尖人才支持计划(2013);第三批安徽医科大学校级中青年学术技术带头人基金
安徽医科大学临床药理研究所、抗炎免疫药物教育部重点实验室、安徽抗炎免疫药物协同创新中心,合肥 230032
杨思民,男,硕士研究生;魏 伟,男,教授,博士生导师,责任作者,E-mail:wwei@ ahmu.edu.cn;汪庆童,女,副教授,硕士生导师,责任作者,E-mail:hfwqt727@163.com

