β1-整合素促进 Akt/GSK-3β/β-catenin 信号活化并抑制阿霉素诱导的大鼠心肌细胞损伤
李新 刘海涛 陶凌
基础研究
β1-整合素促进 Akt/GSK-3β/β-catenin 信号活化并抑制阿霉素诱导的大鼠心肌细胞损伤
李新 刘海涛 陶凌
目的 研究β1-整合素过表达对阿霉素诱导的大鼠心肌细胞损伤的作用。方法 分离新生SD大鼠心肌细胞,随机分为对照组、空载体组、过表达组、阿霉素组、空载体+阿霉素组、过表达+阿霉素组和LY294002预处理组。利用四唑盐比色法(MTT)检测细胞存活,检测心肌细胞乳酸脱氢酶(LDH)释放率、丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GPx)活性、超氧化物歧化酶(SOD)活性,利用实时定量PCR和Western blot检测细胞中β1-整合素以及Akt磷酸化、GSK-3β、β-catenin、Bcl2、Bax的表达,同时利用流式细胞术检测细胞凋亡。结果 空载体组和过表达组转染效率为(68.8±9.5)%和(71.2±8.9)%。与对照组比较,阿霉素组细胞存活率显著降低(P<0.05),而过表达+阿霉素则提高细胞存活率(P<0.05)。相比于对照组,阿霉素处理促进LDH释放和MDA形成(P<0.05),降低GPx和SOD活性(P<0.05),过表达+阿霉素则可以逆转阿霉素作用。阿霉素抑制心肌细胞Akt磷酸化和β-catenin核转移,β1-整合素过表达则促进Akt磷酸化和β-catenin核转移。阿霉素处理促进细胞凋亡并下调Bcl2表达、上调Bax表达,β1-整合素过表达抑制细胞凋亡并上调Bcl2表达、下调Bax表达。抑制Akt磷酸化显著阻碍β1-整合素的作用。结论 过表达β1-整合素可拮抗阿霉素诱导的细胞毒性,这可能与Akt/GSK-3β/β-catenin信号活化相关。
β1-整合素;阿霉素;心肌细胞;Akt磷酸化;β-catenin
阿霉素是一种抗癌药物,常用于治疗实体瘤和血液恶性疾病[1]。尽管阿霉素在抗肿瘤方面应用广泛,然而由于其能够引发心肌病变和心力衰竭,从而限制了阿霉素在临床上的应用[2]。阿霉素诱发心脏毒性的机制复杂,涉及到多种信号通路异常[3]。如何保护化疗患者免于阿霉素引起心肌功能的损伤已成为当前研究的热点。整合素是由α和β两种Ⅰ型跨膜亚基构成的异二聚体糖蛋白[4]。整合素是重要的信号分子,介导多种信号的跨膜转导,参与细胞的增殖、存活和分化等调控过程[5]。β1-整合素是整合素家族中表达广泛的成员,其功能缺失可导致明显的心脏纤维化和心脏功能异常[6]。本研究通过在心肌细胞中过表达β1-整合素,旨在探索β1-整合素是否能够拮抗阿霉素诱导的心肌细胞毒性,从而可能为预防药物心脏毒性提供措施。
1 材料与方法
1.1 材料 新生SD大鼠由第四军医大学实验动物中心提供[SCXK(军)2015-007];阿霉素购自大连美仑生物技术公司;乳酸脱氢酶(LDH)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GPx)试剂盒、超氧化物歧化酶(SOD)试剂盒购自南京建成生物;一抗β1-整合素抗体、磷酸化Akt抗体、GSK-3β 抗体、β-catenin抗体、Bcl2抗体、Bax抗体、β-actin抗体、Lamin B1抗体购自美国Santa Cruz Biotech公司;辣根过氧化物酶酶标二抗购自美国Abcam公司;Annexin V-FITC细胞凋亡检测试剂盒购自江苏南通碧云天生物;总RNA提取试剂盒、PrimeScriptTMRT Master Mix反转录试剂盒、SYBRRGreen I qPCR试剂盒购自大连宝生物;EpiQuik Nuclear Extraction Kit试剂盒购自美国Epigentek公司。
1.2 方法
1.2.1 细胞分离和培养 将6只出生3 d内的SD大鼠用戊巴比妥钠深麻后处死,分离心脏,剪取心室,用0.25%的胰蛋白酶消化分离心肌细胞。将消化后的细胞悬浮于含20%胎牛血清的DMEM培养基中,贴壁培养去除成纤维细胞。分离培养24 h后,细胞计数,按1×106/孔接种于24孔细胞培养板,用含15%胎牛血清的DMEM培养基继续培养。每隔2 d换液一次,取第4天细胞用作后续实验。
1.2.2 细胞分组处理 将大鼠心肌细胞随机分为7组:对照组、空载体组、过表达组、阿霉素组、空载体+阿霉素组、过表达+阿霉素组和LY29004预处理组。空载体组和过表达组细胞分别利用腺病毒空载体和β1-整合素重组腺病毒转染;阿霉素组细胞利用0.5 μmol/L阿霉素处理24 h;空载体+阿霉素组和过表达+阿霉素组细胞分别转染腺病毒空载体和β1-整合素重组腺病毒24 h后添加0.5 μmol/L阿霉素处理24 h;LY29004预处理组细胞转染β1-整合素重组腺病毒24 h后,先用10 μl 10 mM的LY29004预处理2 h,而后添加阿霉素处理24 h;对照组用等体积的PBS处理相同时长。
1.2.3 重组腺病毒载体构建和体外转染 扩增目的基因β1-整合素,将产物利用内切酶BamHⅠ和SalⅠ双酶切,插入到腺病毒质粒载体pDC315的多克隆位点区,构建 pDC315-β1-integrin。利用Lipofectamine 2000 转染试剂,将 pDC315-β1-integrin与腺病毒包装质粒pBHGloxdelE13cre共转染HEK293细胞。48 h后扩增,反复冻融收集重组腺病毒Adβ1-integrin,测序扩增产物鉴定重组腺病毒。将心肌细胞按1×106/孔接种于六孔板,按感染复数(multiplicity of infection,MOI)=150进行转染。24 h后换液,荧光显微镜下观察转染效率,并利用qRT-PCR和Western blot进行检测。
1.2.4 四唑盐比色法检测心肌细胞存活 将细胞按1×105个/孔接种于96孔培养板,加入15%FBS的H-DMEM培养液进行培养。培养24 h后进行MTT实验检测。按实验分组情况,每孔加入20 μl MTT(5 mg/ml)后培养 4 h。去掉上清,每孔 150 μl加入二甲基亚砜(dimethyl sulfoxide,DMSO),混匀后用酶标仪于490 nm波长下测定吸收值。
1.2.5 检测心肌细胞损伤指标(LDH、MDA、GPx、SOD含量) 将对照组、空载体组、过表达组、阿霉素组、空载体+阿霉素组、过表达+阿霉素组细胞收集至1.5 ml离心管中,分别利用乳酸脱氢酶(LDH)试剂盒、丙二醛(MDA)试剂盒、谷胱甘肽过氧化物酶(GPx)试剂盒、超氧化物歧化酶(SOD)试剂盒测定细胞上清液中LDH、MDA、GPx、SOD酶的含量。
1.2.6 分离心肌细胞细胞核和细胞质蛋白 收集各组心肌细胞,利用EpiQuik Nuclear Extraction Kit试剂盒按说明书提取细胞核蛋白和细胞质蛋白。
1.2.7 流式细胞术检测细胞凋亡 细胞收集至1.5 ml离心管中,细胞计数后调整细胞密度为1×106/L,制成单细胞悬液,加入100 μl结合缓冲液与 FITCAnnexin V(20 μg/ml)10 μl,室温避光放置 30 min,再加入 PI(50 μg/ml)5 μl,室内避光反应 5 min,随后添加 400 μl结合缓冲液,上流式细胞仪检测。
1.2.8 实时定量PCR(qRT-PCR)分析 提取心肌细胞总RNA,并利用PrimeScriptTMRT Master Mix反转录试剂盒合成cDNA第一链。以cDNA第一链为模板扩增目的基因。所用引物:β1-整合素上游引物 5′-GACGAAAGTGCTCTAACA-3′,下游引物5′-CTGAAGGACCACCTCTAC-3′;β-actin 上游引物 5′-GAGGGAAATCGTGCGTGAC-3′,下游引物5′-GGAAGGAAGGCTGGAAGAG-3′。扩增产物经琼脂糖凝胶电泳后染色、拍照。采用ABI 7500型实时荧光定量PCR仪和SYBRRGreen I qPCR试剂盒测定目的基因表达。目的基因和β-actin基因的拷贝数分别根据产生的Ct值从各自的标准曲线获得,取3次重复的平均值,用目的基因的拷贝数除以β-actin的拷贝数作为靶基因的相对表达量。
1.2.9 Western blot分析 收集心肌细胞,RIPA裂解缓冲液裂解细胞,提取心肌细胞总蛋白。在常温下用12%的SDS——聚丙烯酰胺凝胶恒压电泳分离蛋白,半干法将分离后的蛋白转移至PVDF膜上,用含5%脱脂奶粉的TBST室温下水平摇床慢摇封闭1 h。封闭结束后,用抗β1-整合素抗体(1∶500)、抗磷酸化Akt(p-Akt)抗体(1∶600)、抗βcatenin 抗体(1∶600)、抗 GSK-3β 抗体(1∶600)、抗Bcl2抗体(1∶600)、抗 Bax抗体(1:600)在 4 ℃环境中孵育过夜。一抗孵育结束,漂洗,随后用辣根过氧化物酶标记的二抗(1∶10000)室温下孵育1 h。利用ECL显色试剂盒显色,暗室环境负片成像,以βactin(细胞质)、Lamin B1(细胞核)为内参进行定量分析。
1.3 统计学方法 采用SPSS 13.0软件对数据进行统计分析。本研究所有数据均采用±s表示,三组或三组以上间均值比较采用单因素方差分析,并采用LSD法进行两两比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 重组腺病毒载体转染促进心肌细胞中β1-整合素的表达 与对照组比较,空载体组(150 MOI)和过表达组(150 MOI)心肌细胞在转染48 h后,荧光镜下可观察到明显荧光,转染率为(68.8±9.5)%和(71.2±8.9)%(图 1)。同时,与对照组和空载体组比较,过表达组细胞中β1-整合素mRNA和蛋白的相对表达量显著增高,差异具有统计学意义(P<0.05)。见图 2~4。
2.2 β1-整合素过表达提高阿霉素处理的心肌细胞存活率 与对照组比较,空载体组和过表达组心肌细胞存活率未见统计学差异(P>0.05),而阿霉素处理显著降低心肌细胞的体外存活率(P<0.05)。相比于阿霉素组,过表达+阿霉素组心肌细胞存活率显著提高(P<0.05)。空载体+阿霉素组与阿霉素组间细胞存活无明显差异(P>0.05)。见图5。
2.3 β1-整合素过表达抑制阿霉素诱导的心肌细胞损伤 与对照组相比,空载体组和过表达组心肌细胞LDH释放率、MDA含量、GPx活性、SOD活性变化不明显,未见统计学差异(P>0.05);阿霉素组LDH释放率和MDA含量显著增加(P<0.05),而GPx活性和SOD活性显著降低(P<0.05)。与阿霉素组比较,过表达+阿霉素组细胞LDH含量和MDA含量明显降低(P<0.05),GPx活性和SOD活性增高(P<0.05)。空载体+阿霉素组细胞LDH释放量、MDA含量、GPx活性、SOD活性与阿霉素组细胞相比无明显变化(P>0.05)。见表1。
表1 各组心肌细胞上清LDH含量、MDA含量、GPx 和 SOD 活性比较(±s)

表1 各组心肌细胞上清LDH含量、MDA含量、GPx 和 SOD 活性比较(±s)
注:与对照组比较,aP<0.05;与阿霉素组比较,bP<0.05
?
2.4 β1-整合素促进心肌细胞 Akt/GSK-3β/βcatenin信号活化 与对照组和空载体组比较,过表达组细胞Akt磷酸化水平(p-Akt)和细胞核βcatenin表达水平显著提高(P<0.05),而 GSK-3β 和细胞质β-catenin表达水平则明显降低(P<0.05);与对照组比较,阿霉素处理后的心肌细胞中,Akt磷酸化水平和细胞核β-catenin表达水平降低(P<0.05),GSK-3β和细胞质β-catenin表达水平则明显升高(P<0.05)。与阿霉素组相比,过表达+阿霉素组细胞p-Akt和细胞核β-catenin表达明显上调,GSK-3β和细胞质 β-catenin表达下调(P<0.05)。这些蛋白在空载体+阿霉素组细胞中的表达水平与阿霉素组无显著差异(P>0.05)。见图6、7。
2.5 抑制Akt磷酸化促进心肌细胞细胞凋亡 与对照组比较,空载体组和过表达组心肌细胞细胞凋亡比例无显著差别(P>0.05);与对照组比较,阿霉素组心肌细胞细胞凋亡比例显著增高(P<0.05)。与阿霉素组及空载体+阿霉素组比较,过表达+阿霉素组细胞凋亡比例明显降低(P<0.05)。然而与过表达+阿霉素组比较,LY294002预处理组细胞凋亡比例显著升高(P<0.05)。见表 2。
表2 各组心肌细胞细胞凋亡比例(±s)

表2 各组心肌细胞细胞凋亡比例(±s)
注:与对照组比较,aP<0.05;与阿霉素组比较,bP<0.05;与过表达+阿霉素组比较,cP<0.05
?
2.6 抑制Akt磷酸化抑制Bcl2蛋白表达而促进Bax蛋白表达 与对照组比较,空载体组和过表达组心肌细胞中Bcl2蛋白和Bax蛋白表达量无明显变化(P>0.05);相比于对照组,阿霉素组细胞中Bcl2蛋白表达下降,Bax蛋白表达上升,差异具有统计学意义(P<0.05)。与阿霉素组和空载体+阿霉素组相比,过表达+阿霉素组细胞Bcl2蛋白表达上升,Bax蛋白表达降低(P<0.05)。与过表达+阿霉素组比较,LY294002预处理组细胞中Bcl2蛋白表达下降而Bax蛋白表达升高(P<0.05)。见图8、9。
3 讨论
阿霉素导致的严重副作用极大地限制了它在临床上的使用[7]。国内外有多个研究尝试利用中药来减缓阿霉素对动物模型的心脏毒性,然而效果还有待临床验证[8-10]。本研究尝试利用转染重组腺病毒载体的方法,于体外培养的心肌细胞中过表达β1-整合素,观察β1-整合素过表达对阿霉素环境下心肌细胞的影响。阿霉素处理后,心肌细胞存活率显著降低,而过表达β1-整合素则可以提高心肌细胞在阿霉素环境中的存活,说明β1-整合素可能参与拮抗阿霉素诱导的细胞毒性。随后,本研究检测了心肌细胞中LDH释放、MDA含量、GPx活性、SOD活性四项细胞损伤指标,同样证明了β1-整合素在抵抗阿霉素细胞毒性中的作用。因此,本研究接下来探索β1-整合素拮抗阿霉素细胞毒性的作用机制。
Akt蛋白是细胞内重要的信号蛋白分子,它的活化可促进多种细胞的体外存活[11,12]。Yoshida等[13]报道了Akt蛋白的磷酸化介导了CCN1诱导的心肌细胞抗凋亡作用,能够促进心肌细胞在缺血后的存活。本研究因此验证β1-整合素过表达是否可以通过活化Akt蛋白起保护作用。结果发现,β1-整合素显著提高心肌细胞Akt磷酸化水平并拮抗阿霉素下调Akt磷酸化蛋白的作用。Wu等[14]发现,Akt磷酸化可以促进GSK-3β/β-catenin信号活化和β-catenin蛋白核转移,从而发挥对心肌细胞的保护作用。在本研究中,β1-整合素过表达可以下调GSK-3β和细胞质β-catenin,促进β-catenin向细胞核转移。然而,阿霉素处理则诱导相反的作用。这些结果揭示,β1-整合素有可能通过活化Akt/GSK-3β/β-catenin信号来拮抗阿霉素诱导的细胞毒性。在正常环境中,β1-整合素也具有促进Akt磷酸化、β-catenin核转移的作用,但是对细胞存活却无显著影响,可能原因是在正常环境中限制心肌细胞存活的因素并不是Akt磷酸化水平的改变[15]。本研究随后探索了β1-整合素对心肌细胞细胞凋亡的影响。在正常环境下,β1-整合素过表达对心肌细胞细胞凋亡无明显作用。在阿霉素作用下,心肌细胞细胞凋亡率显著增加,而促进β1-整合素的表达可显著降低阿霉素导致的细胞凋亡。然而,当利用LY294002预处理心肌细胞后,β1-整合素拮抗细胞凋亡的作用被显著抑制,由此可推测Akt活性在β1-整合素诱导的拮抗效应中起着关键作用。本研究也分析了心肌细胞中抗凋亡蛋白Bcl2和促凋亡蛋白Bax的表达,结果发现,阿霉素可下调Bcl2的表达而上调Bax的表达,β1-整合素过表达则拮抗阿霉素的作用,上调Bcl2表达而下调Bax的表达。
综合上述本研究发现,过表达β1-整合素可改善阿霉素导致的心肌细胞损伤,这种作用可能与细胞中Akt/GSK-3β/β-catenin信号活化相关。因此,本研究结果可对探索保护化疗患者免于阿霉素药物导致的心肌细胞损伤的途径提供可行性选择。

图1 心肌细胞重组腺病毒转染

图2 qRT-PCR检测各组心肌细胞中β1-整合素mRNA的表达

图3 Western blot检测各组心肌细胞中β1-整合素蛋白表达
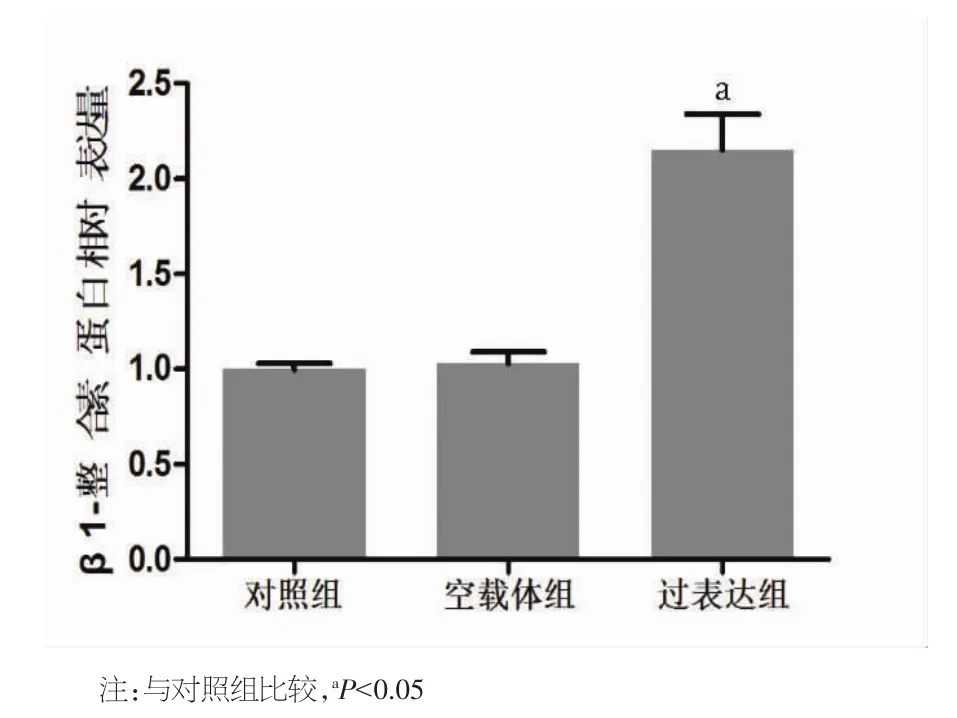
图4 各组心肌细胞中β1-整合素蛋白表达相对定量

图5 四唑盐比色法检测各组心肌细胞存活
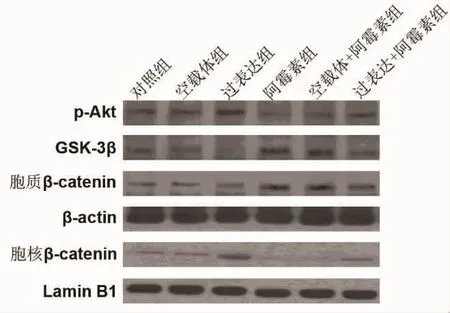
图6 Western blot检测各组心肌细胞p-Akt、GSK-3β、β-catenin蛋白表达

图7 各组心肌细胞p-Akt、GSK-3β、β-catenin表达相对定量

图8 Western blot检测各组心肌细胞Bcl2和Bax蛋白的表达

图9 各组心肌细胞Bcl2和Bax蛋白表达相对定量
[1]Smith LA,Cornelius VR,Plummer CJ,et al.Cardiotoxicity of anthracycline agents for the treatment of cancer:systematic review and meta-analysis of randomised controlled trials.BMC Cancer,2010,10:337.
[2]Ezquer F,Gutierrez J,Ezquer M,et al.Mesenchymal stem cell therapy for doxorubicin cardiomyopathy:hopes and fears.Stem Cell Res Ther,2015,6:116.
[3]Arafa MH,Mohammad NS,Atteia HH,et al.Protective effect of resveratrolagainstdoxorubicin-induced cardiactoxicity and fibrosis in male experimental rats.J Physiol Biochem,2014,70:701-711.
[4]Shen B,Delaney MK,Du X.Inside-out,outside-in,and inside-outside-in:G protein signaling in integrin-mediated cell adhesion,spreading,and retraction.CurrOpin CellBiol,2012,24:600-606.
[5]KennyFN,ConnellyJT.Integrin-mediated adhesion and mechano-sensing in cutaneous wound healing.Cell Tissue Res,2015,360:571-582.
[6]Shai SY,Harpf AE,Babbitt CJ,et al.Cardiac myocyte-specific excision of the beta1 integrin gene results in myocardial fibrosis and cardiac failure.Circ Res,2002,90:458-464.
[7]张懿玮,李元建.阿霉素诱导心肌细胞死亡机制.国际病理科学与临床杂志,2011,31:129-134.
[8]何玲,孙桂波,孙潇,等.木犀草苷对阿霉素诱导乳鼠心肌细胞损伤的保护作用.中国药理学通报,2012,28:1229-1234.
[9]曲震理.丹参酮ⅡA对阿霉素所致体外心肌细胞氧化损伤的保护作用.现代预防医学,2013,40:2520-2523.
[10]Kwatra M,Kumar V,Jangra A,et al.Ameliorative effect of naringin against doxorubicin-induced acute cardiac toxicity in rats.Pharm Biol,2016,54:637-647.
[11]Gallardo Bolanos JM,Balao Da Silva CM,Martin Munoz P,et al.Phosphorylated AKT preserves stallion sperm viability and motility by inhibiting caspases 3 and 7.Reproduction,2014,148:221-235.
[12]叶强,陈良海,刘应才,等.辛伐他汀通过Akt/GSK3β通路抑制心肌梗死后心肌细胞凋亡.中国药理学通报,2011,27:1656-1660.
[13]Yoshida Y,Togi K,Matsumae H,et al.CCN1 protects cardiac myocytes from oxidative stress via beta1 integrin-Akt pathway.Biochem Biophys Res Commun,2007,355:611-618.
[14]Wu QL,Shen T,Shao LL,et al.Ischemic postconditioning mediates cardioprotection via PI3K/GSK-3beta/beta-catenin signaling pathway in ischemic rat myocardium.Shock,2012,38:165-169.
[15]Marunouchi T,Tanonaka K.Cell Death in the Cardiac Myocyte.Biol Pharm Bull,2015,38:1094-1097.
全球健康促进大会首次在中国举行
第九届全球健康促进大会于2016年11月21~24日在中国上海举行。全球健康促进大会是健康促进领域最高级别的会议。本届大会由国家卫生计生委和世界卫生组织共同主办,上海市人民政府承办。来自世界卫生组织各成员国负责健康促进工作的代表,联合国有关机构负责人,部分国家卫生和相关部门部长、健康城市市长,国际健康促进和可持续发展等领域专家学者将参会这一盛会。大会的主题为“可持续发展中的健康促进”。大会会期3天半,与会代表围绕“健康城市”“跨部门行动”“社会动员”“健康素养”等主题进行研讨,旨在运用健康促进的理论与实践实现联合国2030可持续发展目标,为健康促进在21世纪的发展注入新的活力。本届大会发表了《上海宣言》,指导下一阶段全球健康促进工作,推动健康促进的理论和实践,提升健康在联合国2030可持续发展目标中的地位和作用。会议期间举办了“健康城市市长论坛”,呼吁市长在建设健康城市、实现可持续发展目标中发挥关键作用。
今年是“十三五”规划开局之年,也是推进“健康中国”建设的起航之年,又恰逢首届全球健康促进大会召开30周年。在这样一个关键时刻,由中国举办第九届全球健康促进大会,既是开启全球健康促进新征程、全面实施联合国2030年可持续发展目标的重要起点,也是我们向世界展示中国成就、分享中国经验,加快推进健康中国建设的重要契机。大会第三天是“中国国家日”,通过论坛、展览展示、现场考察形式向全世界展示了中国卫生与健康事业发展成就。
β1-integrin promotes Akt/GSK-3β/β-catenin signaling activation and diminishes cardiac myocytes injury induced by doxorubicin
LI Xin*,LIU Hai-tao,TAO Ling.*Department of Cardiovascular Medicine,Xijing Hospital,the Fourth Military Medical University,Xi′an 710032,China
TAO Ling,E-mail:shidasda@163.com
Objective To explore the effect of β1-integrin overexpression on cardiac myocytes injury induced by doxorubicin.Methods Cardiac myocytes were prepared from newborn SD rats and randomly allocated into control,blank,overexpression,doxorubicin treatment,blank+doxorubicin treatment,overexpression+doxorubicin treatment,and LY294002 pretreatment group.Cell survival was determined by MTT assay.LDH release,MDA content,GPx activity,and SOD activity were measured using commercial available kits.qRT-PCR and Western blot were used to analyze the expression of β1-integrin,phosphorylated Akt,GSK-3β,β -catenin,Bcl2,and Bax.Apoptosis of cardiac myocytes was evaluated by flow cytometry.Results Transfection efficacy were(68.8±9.5)%and (71.2±8.9)%for blank group and overexpression group,respectively.Compared with the control,cell survival was markedly decreased in doxorubicin treatment group(P<0.05),while β1-integrin overexpression enhanced cell survival(P<0.05).Furthermore,doxorubicin promoted LDH release and MDA production as well as reduced GPx and SOD activity(P<0.05),while β1-integrin overexpression reversed the effects of doxorubicin treatment(P<0.05).Doxorubicin restrained Akt phosphorylation and nuclear translocation of β-catenin in cardiac myocytes,while β1-integrin overexpression enhanced Akt phosphorylation and nuclear translocation of β-catenin.Doxorubicin prompted apoptosis,downregulated Bcl2 expression,and upregulated Bax expression,which were suppressed by β1-integrin overexpression.However,blockade of Akt phosphorylation impeded the ef-fect of β1-integrin overexpression.Conclusion β1-integrin overexpression could counteract cytotoxicity induced by doxorubicin,which might be attributed to activation of Akt/GSK-3β/β-catenin signaling.
β1-integrin;Doxorubicin;Cardiac myocytes;Phosphorylated Akt;β-catenin
710032 陕西省西安市,第四军医大学西京医院心血管内科(李新、刘海涛、陶凌);铜川市人民医院超声科(李新)
陶凌,E-mail:shidasda@163.com
10.3969/j.issn.1672-5301.2016.12.026
Q95-33;R542.2
A
1672-5301(2016)12-1148-05
2016-04-28)

