生姜提取物对苯并芘染毒大鼠抗氧化酶及Ⅱ相解毒酶活性的影响
李 锋,刘振伟,李庆芝,李大鹏,唐晓珍,王永丽,*
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.莱芜市农业科学研究院,山东莱芜 271100)
生姜提取物对苯并芘染毒大鼠抗氧化酶及Ⅱ相解毒酶活性的影响
李锋1,刘振伟2,李庆芝2,李大鹏1,唐晓珍1,王永丽1,*
(1.山东农业大学食品科学与工程学院,山东泰安 271018;2.莱芜市农业科学研究院,山东莱芜 271100)
探讨生姜提取物对苯并芘染毒大鼠抗氧化酶及II相解毒酶的影响。用不同剂量的生姜提取物(100、200和400 mg/kg(bw)对Wistar大鼠连续灌胃14 d后,一次性腹腔注射20 mg/kg·bw的苯并芘染毒,检测肝脏和肾脏中的抗氧化酶和II相解毒酶的活性。结果表明,三个剂量的生姜提取物灌胃处理对大鼠体重无显著影响(p>0.05),同时对肝、肺和肾的脏体比也无显著影响(p>0.05)。与苯并芘处理组相比,200和400 mg/kg·bw的生姜提取物能明显提高肝脏中谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)的活力,以及肝和肾中醌还原酶(NQO1)和谷胱甘肽硫转移酶(GST)的活力(p<0.05)。以上结果表明,生姜提取物能显著提高大鼠肝脏中抗氧化酶及II相解毒酶的活性。
生姜提取物,苯并芘,抗氧化,解毒酶,大鼠
生姜(ZingiberofficinaleRosc.)是姜科姜属草木植物,在热带及亚热带地区广泛种植[1]。在东亚及东南亚国家,生姜是常用的调味料和传统的中药材[2]。我国生姜种质资源丰富,栽培面积、产量及出产量均居世界首位[3]。生姜中富含姜辣素、姜油树脂等活性成分,具有抗氧化、抗炎抑菌、解毒、止吐止泄等活性,保健和医药价值均较高[4-5]。
研究表明外源性亲电子试剂及致癌物在体内会造成氧化损伤,导致细胞膜、核酸和蛋白质等正常的细胞成分受到损害,并最终导致多种疾病的发生[6-8]。在这些物质的体内代谢过程中,抗氧化酶和II相代谢酶构成了机体重要的防御体系[9]。抗氧化酶主要包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)和过氧化氢酶(CAT)等,它们在清除活性氧自由基等方面发挥重要作用。II相解毒酶(如醌还原酶(NQO1)和谷胱甘肽硫转移酶(GST)等)通过催化内源性极性物质以共价结合的形式与I相反应的活化产物或外来物质结合,从而改变其毒性[10]。通过诱导II相解毒酶,可以有效地实现对外源性致癌物及亲电子试剂的代谢解毒。前期研究表明,多种生姜成分具有很强的抗氧化及II相酶诱导能力。但这些研究大多集中在生姜成分的体外活性研究,如通过DPPH等自由基清除体系评价其体外抗氧化活性[11],通过Hepa1c1c7等细胞模型研究其对醌还原酶的诱导能力[12]等。这些较强的体外作用能否在体内重现尚缺少进一步的证据来支持。而且,已有研究多采用单一的生姜化合物,而在实际饮食中生姜成分多以混合物的形式摄入。因此,本实验以生姜提取物为原料,建立苯并芘大鼠染毒模型,研究了生姜提取物灌胃处理对大鼠抗氧化酶和II相解毒酶活性的影响,以期为生姜功能食品的开发提供科学依据。
1 材料与方法
1.1材料与仪器
新鲜的市售生姜(ZingiberofficinaleRoscoe)购自当地大润发超市;6周龄雄性SPF级Wistar大鼠50只购于中国科学院上海实验动物中心,许可证号:SCXK(沪)2007-2005;磷酸二氢钾、磷酸氢二钠、氢氧化钠上海国药集团化学试剂有限公司,分析纯;还原型辅酶II瑞士Roche公司,分析纯;苯并(α)芘(≥96.0%)百灵威科技有限公司,分析纯;黄素腺嘌呤二核苷酸(FAD)美国Sigma-Aldrich公司,分析纯;超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GPx)试剂盒、过氧化氢酶(CAT)试剂盒、谷胱甘肽硫转移酶(GST)试剂盒南京建成生物工程研究所。
TDL-50B低速台式离心机上海安亭科学仪器厂;Beckman Coulter Avanti J-30I高效离心机美国Beckman Coulter公司;UV-5500紫外可见分光光度计上海元析仪器有限公司;AL104电子天平梅特勒-托利多国际贸易上海有限公司;SpectraMax M2多功能酶标仪美国Molecular Devices公司。
1.2实验方法
1.2.1生姜提取物的制备[13]称取200 g左右样品洗净、去皮、凉干后,切成1~2 mm的薄片,采用无水乙醇按照料液比1∶6(m/v)于50 ℃恒温水浴中提取4 h,过滤,滤液采用真空旋转蒸发浓缩至干,然后溶于100 mL水中,加入等体积的乙酸乙酯,萃取三次,合并乙酸乙酯层,真空旋转蒸发浓缩得到生姜浸膏。经测定,浸膏中总酚含量折算为没食子酸等价物为46.1 mg/g(Folin-Ciocalteu试剂法[14]),姜辣素的质量分数2.76%(香草醛比色法[15])。
1.2.2实验动物及分组饲养室温度控制在(22±1) ℃,每天保持12 h光暗交替。动物适应培养一周后,将体重相近的大鼠随机分成五组:空白组、苯并芘致毒组(BαP组)、低剂量生姜提取物处理组(B+LG组)、中剂量生姜提取物处理组(B+MG组)和高剂量生姜提取物处理组(B+HG组)。每只大鼠单笼饲养,自由采食和饮水。生姜提取物溶于蒸馏水中,每日上午9点分别灌胃0.2 mL的生理盐水(空白组和BαP组)、100 mg/kg·bw生姜样品(B+LG组)、200 mg/kg·bw生姜样品(B+MG组)、400 mg/kg·bw生姜样品(B+HG组),连续灌胃14 d。末次灌胃1 h后,苯并芘致毒组及生姜提取物处理组大鼠均腹腔注射20 mg/kg·bw的苯并芘(溶解到玉米油中),对照组注射同等体积的玉米油,然后禁食12 h,称取体重;处死动物,摘取肝和肾脏。按如下公式,计算脏体比:

1.2.3抗氧化酶活性的测定取一定量的肝脏组织,按照重量体积比1∶9加入生理盐水,于组织匀浆器中制成10%的匀浆液。取部分匀浆液,于3000 r/min离心10 min,取上清液,按照试剂盒方法测定肝脏中GPx、CAT和SOD酶活性[11]。
1.2.4脏器中II相解毒酶活性的测定取一定量的肝脏和肾脏置于冰冷的Tris-KCl缓冲液(pH7.6)中,在冰浴中制成10%的匀浆液。于4 ℃下20000×g离心20 min,取上清液,继续100000×g离心60 min,取上清液,用于测定醌还原酶(NQO1)和谷胱甘肽硫转移酶(GST)活性。
1.2.5统计学分析实验数据采用平均值±标准差表示,用统计学软件SAS 8.0进行单因素方差分析(ANOVA),p<0.05时表示均值间差异显著,p<0.01时表示均值间差异极显著。
2 结果与分析
2.1生姜提取物对大鼠体重及脏体比的影响
如图1所示,实验开始前各组大鼠体重无显著差异。经连续14 d灌胃后,空白组、BαP处理组及三个剂量的生姜提取物灌胃组之间,动物的体重增加没有显著性差异(p>0.05)。表明在12 h之内,20 mg/kg·bw的BαP腹腔注射处理不会显著影响大鼠的体重。据报道,BαP腹腔注射的半数致死剂量约为500 mg/kg·bw,而本实验中BαP的使用剂量为20 mg/kg·bw,远低于其半数致死剂量。经过对各组动物的肝脏和肾脏的脏体比分析,各处理组之间肝、肾器官的脏体比也不存在显著性差异(p>0.05)。
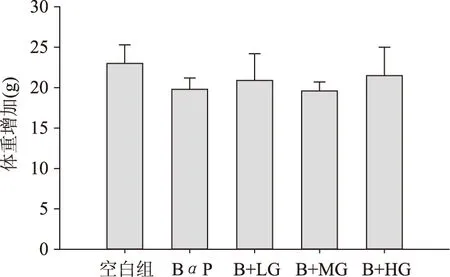
图1 生姜提取物处理组中大鼠的体重增加值Fig.1 Body weight gains of rats treated with different doses of ginger extracts
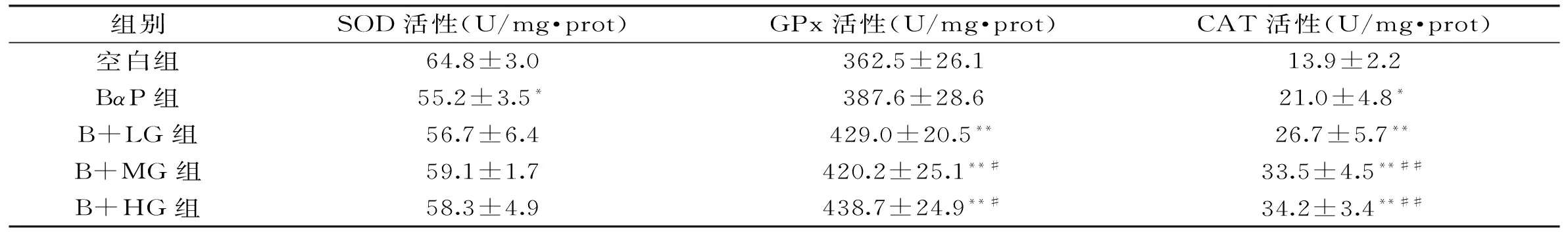
表1 生姜提取物对苯并芘染毒大鼠肝脏抗氧化酶活力的影响
注:与空白组相比,*p<0.05,**p<0.01;与BαP组相比,#p<0.05,##p<0.01。图2、图3同。
2.2生姜提取物对大鼠抗氧化酶活力的影响
如表1所示,空白组中大鼠肝脏SOD的活力为(64.8±3.0) U/mg·prot,BαP处理导致动物肝脏SOD的活力显著下降(p<0.05),为(55.2±3.5) U/mg·prot。在生姜提取物灌胃处理组中,肝脏SOD的活力分别为(56.7± 6.4) U/mg·prot(100 mg/kg·bw),(59.1± 1.7) U/mg·prot(200 mg/kg·bw)和(58.3± 4.9) U/mg·prot(400 mg/kg·bw),但与BαP处理组相比无显著性差异(p>0.05)。
BαP组大鼠肝脏GPx酶活力为(387.6±28.6) U/mg·prot,与空白组相比(362.5±26.1) U/mg·prot无显著差异(p>0.05)。经过连续14 d不同剂量的生姜提取物灌胃处理后,与空白组相比,生姜提取物处理组中肝脏GPx活力均极显著升高(p<0.01);同时,与BαP组相比,200和400 mg/kg·bw的生姜提取物处理组中GPx活力显著增加(p<0.05),100 mg/kg·bw的生姜提取物灌胃组无显著变化(p>0.05)。对于CAT活性,BαP处理导致肝脏中CAT的活力由空白组中的(13.9±2.2) U/mg·prot显著升高至(21.0±4.8) U/mg·prot(p<0.05)。生姜提取物灌胃处理后,肝脏中CAT酶的活力进一步升高,与空白组相比差异极显著(p<0.01)。与BαP组相比,100、200和400 mg/kg·bw生姜提取物处理组的活力分别提高了27%、60%和63%,其中200和400 mg/kg·bw剂量组与BαP组差异极显著(p<0.01)。这些结果表明,200和400 mg/kg·bw生姜提取物处理能在一定程度上提高动物肝脏的GPx和CAT活力,缓解BαP造成的氧化应激状态。
2.3生姜提取物对大鼠脏器中II相解毒酶活力的影响
如图2所示,与空白组相比,BαP处理显著提高了动物肝脏和肾脏中NQO1酶的活力(p<0.05)。与BαP组相比,不同剂量的生姜提取物灌胃处理对肝脏及肾脏中NQO1酶活力的影响显著。在肝脏中,低、中、高剂量生姜提取物灌胃处理均可显著高NQO1酶的活力,经过14 d连续处理后,高剂量组酶活力最高,比BαP单独处理组提高了94%。在肾脏中,所有处理组的NQO1酶活力均显著高于空白组(p<0.05);与BαP组相比,中高剂量生姜提取物处理组肾脏中NQO1酶活力分别显著提高了29%和50%(p<0.05)。以上结果表明,生姜提取物可显著提高大鼠肝脏和肾脏中NQO1酶活力。
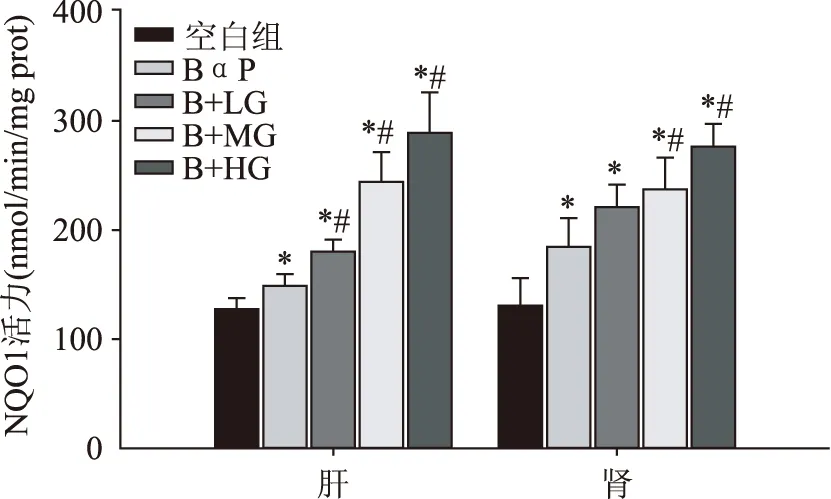
图2 生姜提取物对大鼠脏器中NQO1活力的影响Fig.2 Effects of ginger extracts on quinonereductase activity in organs of rats
生姜提取物处理对大鼠脏器中GST酶活力的影响见图3。与对照组相比,BαP刺激导致肝脏及肾脏中GST酶的活力显著升高(p<0.05)。与BαP组相比,中高剂量的生姜提取物连续灌胃14 d,大鼠肝脏和肾脏中GST酶的活力显著上升(p<0.05),但低剂量生姜提取物处理组与BαP组相比无显著性差异(p>0.05)。这些结果表明,中高剂量的生姜提取物对肝脏和肾脏中GST酶的活力具有显著的提升作用(p<0.05)。
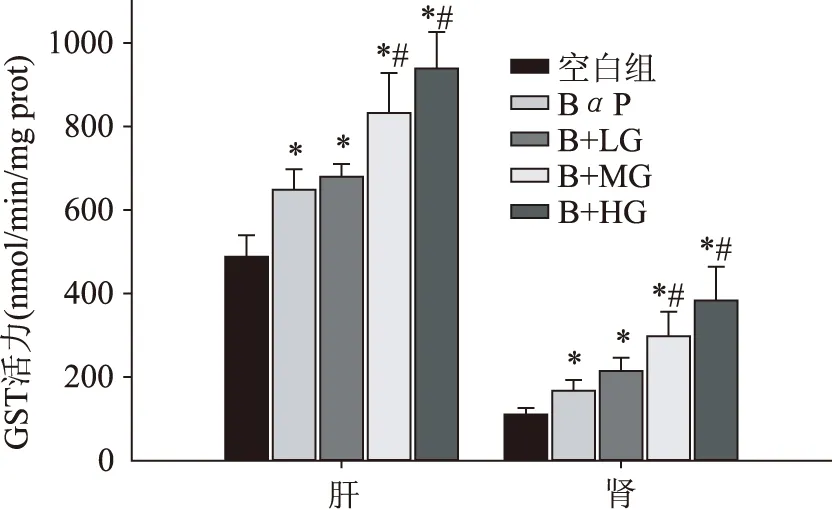
图3 生姜提取物对大鼠脏器中谷胱甘肽硫转移酶活力的影响Fig.3 Effects of ginger extracts on glutathione-S transferase activity in organs of rats
3 讨论

由于肝脏是BαP进行生物转化的重要器官,也是其毒性作用主要的靶器官[17],因此,我们首先研究了生姜提取物对苯并芘染毒大鼠肝脏内抗氧化酶活力的影响。结果表明,用200和400 mg/kg·bw的生姜提取物连续灌胃14 d,能够显著改善BαP氧化损伤造成的肝脏GPx和CAT酶活力的下降。我们的研究结果与Kota等[18]的报道相一致,他们发现在饮食中添加5%的姜粉组与不添加的对照组相比,可以使大鼠肝脏中GPx的活性提高30%,SOD活性提高141%,CAT的活性提高94%。El-Sharaky等[19]也发现100 mg/kg·bw的生姜提取物能有效改善溴苯导致的大鼠肝脏中GPx和SOD酶活性的下降。Ahmed等[20]也发现用含1%生姜的饲料喂养大鼠,可以显著抑制马拉硫磷引起的大鼠抗氧化酶活性的下降,并且显著提升大鼠血液中谷胱甘肽的含量,其作用效果与100 mg/kg·bw的抗坏血酸类似。这些结果表明,在不同的外源性毒物导致的机体氧化应激模型中,生姜提取物均表现出提高机体抗氧化酶活力的作用。
外源性毒物在体内的生物转化主要包括I相反应和II相反应。I相反应往往会激活某些不具活性的致癌物前体,而II相反应在II相解毒酶的催化下,可通结合反应等使高活性的致癌物失活,起到真正解毒作用。因此,诱导II相解毒酶的表达,可以有效促进II相反应,保护机体免受毒性物质和活性氧的侵害。其中,NQO1和GST酶是体内主要的代表性II相解毒酶,NQO1可催化多种醌类及其衍生物发生失去两个电子的还原反应,从而保护细胞免受其代谢过程中产生的反应活性氧及亲电子物质的损伤[21]。GST酶催化GSH与多种致癌剂的亲电中心结合,形成硫醚连接的谷胱甘肽结合物,改变其极性从而利于其排出体外[22]。很多研究证实,具有癌症化学预防作用的植物化学物质大多具有较强的II相解毒酶诱导活性[23]。在本研究中我们发现,与BαP处理组相比,中高剂量的生姜提取物处理组具有显著提升大鼠肝脏和肾脏中的NQO1和GST酶活力的能力。本文的研究结果与Nirmala[24]等人的报道一致。目前,有关生姜提取物体内诱导II相解毒酶作用的研究报道相对较少。但是体外细胞模型研究证实很多生姜成分具有较强的II相解毒酶诱导能力,如6-脱氢姜烯酚和1-脱氢-6-姜二酮等能显著诱导鼠肝癌Hepa1c1c7细胞中NQO1的活性[12]。本研究发现生姜提取物具有较强的体内诱导II相解毒酶的能力,可能与这些成分的共同作用有关。
4 结论
用100、200和400 mg/kg·bw的生姜提取物对Wistar大鼠连续灌胃14 d,各处理组间动物体重没有显著性差异,肝、肺和肾的脏体比也无显著差异(p>0.05)。与BαP处理组相比,200和400 mg/kg·bw的生姜提取物能明显提高肝脏中抗氧化酶GPx和CAT的活力(p<0.05),但对SOD酶影响不显著;200和400 mg/kg·bw的生姜提取物对肝和肾中主要的II相解毒酶NQO1和GST的活力也具有显著的提升作用(p<0.05)。以上结果表明,生姜提取物通过提高大鼠肝脏中主要抗氧化酶及II相解毒酶的活性,能够提高机体的抗氧化能力和对苯并芘的代谢解毒作用。这些发现对于揭示生姜这一药食兼用植物的保健作用提供了参考,同时也可为开发高附加值的生姜功能食品及新型药品提供一定的实验依据。
[1]陈燕,倪元颖,蔡同一. 生姜提取物的综合利用与深加工研究[J]. 食品工业科技,2000,21(4):76-78.
[2]El-Abhar HS,Hammad LN,Gawad HS. Modulating effect of ginger extract on rats with ulcerative colitis[J]. Journal of Ethnopharmacology,2008,118(3):367-372.
[3]李秀,徐坤,巩彪. 生姜种质遗传多样性和亲缘关系的SRAP分析[J]. 中国农业科学,2014,47(4):718-726.
[4]Baliga MS,Haniadka R,Pereira MM,et al. Update on the chemopreventive effects of ginger and its phytochemicals[J]. Critical Reviews in Food Science and Nutrition,2011,51(6):499-523.
[5]Terry R,Posadzki P,Watson LK,et al. The use of ginger(Zingiber officinale)for the treatment of pain:a systematic review of clinical trials[J]. Pain Medicine,2011,12(12):1808-1818.
[6]刘文博,谭晓斌,贾晓斌,等. 基于Nrf2通路的中药化学预防肿瘤的研究思路[J]. 中草药,2011,42(7):1429-1434.
[7]Hayashi G,Cortopassi G. Oxidative stress in inherited mitochondrial diseases[J]. Free Radical Biology and Medicine,2015,88(A):10-17.
[8]Kowluru RA,Mishra M. Oxidative stress,mitochondrial damage and diabetic retinopathy[J]. Biochimica et Biophysica Acta(BBA)-Molecular Basis of Disease,2015,1852(11):2474-2483.
[9]张圣方,赵龙玉,王雪,等. 泰山蛹虫草多糖对免疫抑制小鼠血清蛋白含量和体内抗氧化能力的影响[J]. 食品工业科技,2015,36(11):332-335.
[10]Lee MS,Lee B,Park KE,et al. Dieckol enhances the expression of antioxidant and detoxifying enzymes by the activation of Nrf2-MAPK signalling pathway in HepG2 cells[J]. Food Chemistry,2015,174(1):538-546.
[11]Kim KC,Kang KA,Zhang R,et al. Up-regulation of Nrf2-mediated heme oxygenase-1 expression by eckol,a phlorotannin compound,through activation of Erk and PI3K/Akt[J]. The International Journal of Biochemistry & Cell Biology,2010,42(2):297-305.
[12]Li F,Wang YL,Parkin KL,et al. Isolation of quinone reductase(QR)inducing agents from ginger rhizome and theirinvitroanti-inflammatory activity[J]. Food Research International,2011,44(6):1597-1603.
[13]Li F,Nitteranon V,Tang XZ,et al.Invitroantioxidant and anti-inflammatory activities of 1-dehydro-[6]-gingerdione,6-shogaol,6-dehydroshogaol and hexahydrocurcumin[J]. Food Chemistry,2012,135(2):332-337.
[14]Singleton VL,Orthofer R,Lamuela-Raventós RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of folin-ciocalteu reagent,in Methods in Enzymology[M].
1999,Academic Press,152-178.
[15]张明昶,李健,蒙继昭. 紫外分光光度法测定姜中姜辣素类化合物的含量[J]. 贵州医药,2003,27(3):283-284.
[16]Terry EN,Ganna PH,Molokie R,et al. Changes in the activity of the GPx-1 anti-oxidant selenoenzyme in mononuclear cells following imatinib treatment[J]. Leukemia Research,2011,35(6):31-833.
[17]史巧巧,席俊,陆启玉. 食品中苯并芘的研究进展[J]. 食品工业科技,2014,35(5):379-381.
[18]Kota N,Krishna P,Polasa K. Alterations in antioxidant status of rats following intake of ginger through diet[J]. Food Chemistry,2008,106(3):991-996.
[19]El-Sharaky AS,Newairy AA,Kamel MA,et al. Protective effect of ginger extract against bromobenzene-induced hepatotoxicity in male rats[J]. Food and Chemical Toxicology,2009,47(7):1584-1590.
[20]Ahmed RS,Seth V,Pasha ST. Influence of dietary ginger(Zingiber officinales Rosc)on oxidative stress induced by malathion in rats[J]. Food and Chemical Toxicology,2000,38(5):443-450.
[21]Ross D,Kepa JK,Winski SL,et al. NAD(P)H:quinone oxidoreductase 1(NQO1):chemoprotection,bioactivation,gene regulation and genetic polymorphisms[J]. Chemico-Biological Interactions,2000,129(1-2):77-97.
[22]Yang CS. Dietary factors may modify cancer risk by altering xenobiotic metabolism and many other mechanisms[J]. Journal of Nitrition,2006,136(10):2685S-2686S.
[23]Russo GL. Ins and outs of dietary phytochemicals in cancer chemoprevention[J]. Biochemical Pharmacology,2007,74(4):533-544.
[24]Nirmala K,Prasanna Krishna T,Polasa K. Modulation of xenobiotic metabolism in ginger(Zingiber Officinale Roscoe)fed rats[J]. International Journal of Nutrition and Metabolism,2010,2(3):56-62.
Effects of ginger extract on activities of antioxidant enzymes and phase II detoxifying enzymes in benzo(α)pyrene-treated rats
LI Feng1,LIU Zhen-wei2,LI Qing-zhi2,LI Da-peng1,TANG Xiao-zhen1,WANG Yong-li1,*
(1.College of Food Science and Engineering,Shandong Agricultural University,Taian 271018,China;2.Laiwu Academy of Agricultural Science,Laiwu 271100,China)
The aim of this study was to investigate the effects of ginger extract on activities of antioxidant enzymes and phase II enzymes in benzo(α)pyrene(BαP)-treated rats. Wistar rats were fed by gavage with different doses of ginger extract 100,200 and 400 mg/kg·bw for 14 days. After 14 day of feeding,20 mg/kg·bw of BαP was intraperitoneally injected to the rats. Afterwards,the animals were sacrificed and their livers and kidneys were collected for analysis of antioxidant enzymes and phase II enzymes. Results showed that three doses of ginger extract did not significantly affect body weight of the rats(p>0.05),as well as the organs to body weight ratios(p>0.05). Compared with the BαP group,both 200 and 400 mg/kg·bw of ginger extract significantly elevated the activities of glutathione peroxidase(GPx)and catalase(CAT)in liver,as well as the activities of quinone reductase(NQO1)and glutathione S-transferase(GST)in liver and kidney(p<0.05). These results suggested that ginger extract could improve the activities of antioxidant enzymes and phase II enzymes in rats.
ginger extract;benzo(α)pyrene;antioxidant enzymes;detoxifying enzymes;rats
2015-10-26
李锋(1983-),男,博士,讲师,研究方向:食品营养化学,E-mail:lifeng0605@163.com。
王永丽(1982-),女,博士,讲师,研究方向:食品安全与质量控制,E-mail:lily8941@163.com。
国家自然科学基金项目(31201417);中国博士后科学基金(2013M540561)。
TS201.4
A
1002-0306(2016)12-0350-05
10.13386/j.issn1002-0306.2016.12.058

