大鲵活性肽酶法制备工艺优化及抗氧化性分析
张佳婵,王昌涛,3,*,李 萌,赵 丹
(1.北京工商大学理学院,北京 100048;2.植物资源研究开发北京市重点实验室,北京 100048;3.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048)
大鲵活性肽酶法制备工艺优化及抗氧化性分析
张佳婵1,2,王昌涛1,2,3,*,李萌1,2,赵丹1,2
(1.北京工商大学理学院,北京 100048;2.植物资源研究开发北京市重点实验室,北京 100048;3.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048)
研究了碱性蛋白酶水解制备大鲵活性肽的工艺条件以及大鲵活性肽的理化性质。以水解度为指标,通过Box-Behnken实验设计方法,确定最佳工艺条件为:酶解温度50 ℃,酶解时间1.5 h,酶添加量70 U/g,pH8.91,液料比2∶1(mL/g),蛋白酶解液的水解度值为DH=19.61%±0.12%。所得大鲵活性肽的蛋白质含量为52.40%±1.28%。HPLC分析可知该大鲵活性肽的分子量多分布在1000.00 u以内。在30 mg/mL,大鲵活性肽对羟自由基和超氧阴离子自由基的清除率分别为81.83%、56.27%。
大鲵,活性肽,酶解,水解度,抗氧化作用
大鲵(Andriasdavidianus)俗称娃娃鱼,属两栖类(Amphibia)有尾目(Caudata)隐鳃鲵科(Cryptobrachidae),主要分布于长江中上游、珠江中上游及汉水上游地区[1],属国家二类保护动物[2]。2004年颁布的《野生动物保护法》一方面严厉打击了破坏大鲵资源以及捕杀、贩卖等一系列非法犯罪行为,另一方面也鼓励驯养繁殖和合法合理经营。目前,仅湖南省就有30多家大鲵驯养繁殖企业,年繁殖能力已达4万到5万尾[3]。国务院野生动物保护办公室批准极小数的养殖专业户利用人工养殖子二代以下的无繁殖能力的个体、伤残体进行科研、加工和利用,这使得从大鲵体内提取营养成分为人类服务成为可能。
目前对大鲵的研究主要集中在其资源状况[4]、生物学习性[5-6]、繁殖[7]、病害[8]以及功能基因[9-10]方面,有关大鲵营养价值和食用价值的研究也有部分报道[11-15]。对大鲵资源的深加工方面主要为宰杀后提取皮、肉、骨,利用方法较为简单且附加值低[16]。本文以大鲵肉为原料,先后利用二次酶解技术,对大鲵肉进行脱脂和水解,并对第二次酶解技术进行了条件优化,同时对制备的大鲵活性肽进行主要成分分析和分子量分布测定,最后对抗氧化性进行了研究,为其在保健食品中的应用奠定基础。
1 材料与方法
1.1材料与仪器
大鲵浙江永强养殖公司提供;脂肪酶(1.0×105U/mL)、碱性蛋白酶(7.4×104U/mL)Novozymes(北京)酶制剂公司;牛血清蛋白、维生素B12、氧化型谷胱甘肽(纯度均大于99%)北京迪朗生化科技有限公司;其他试剂均为分析纯,购于国药集团化学试剂有限公司。
ZN-048型小型粉碎机上海安亭科学仪器厂;TB-214电子天平北京赛多利斯仪器系统有限公司;PHS-3C pH计上海雷磁仪器厂;UVmini-1240紫外分光光度计日本岛津;高速冷冻离心机日本立牌SCR20BC型;LGJ-10冷冻干燥机上海医用分析仪器厂;Buchi全自动凯氏定氮仪瑞士Buchi公司;Waters 2695高效液相色谱仪美国Waters公司。
1.2实验方法
1.2.1制备大鲵活性肽的工艺流程大鲵肉→清洗→绞碎→按液料比3∶1(mL/g)加水匀浆→pH4,40 ℃脂肪酶酶解2 h脱脂→沸水浴灭酶15 min→一定条件下蛋白酶酶解→沸水浴灭酶15 min→5000 r/min离心20 min→过滤→酶解液→冷冻干燥得淡黄色粉末。
1.2.2酶法制备大鲵活性肽的单因素实验
1.2.2.1酶添加量的单因素实验以水解度(DH)为指标,固定反应条件pH8,液料比为3∶1(mL/g),酶解时间为3 h,酶解温度45 ℃,酶添加量分别为35、70、140、210、280 U/g,考察酶添加量对大鲵活性肽制备的影响。
1.2.2.2酶解温度的单因素实验以水解度(DH)为指标,固定酶添加量为140 U/g,pH8,液料比为3∶1(mL/g),酶解时间为3 h,酶解温度分别为25、35、45、55和65 ℃,考察温度对大鲵活性肽制备的影响。
1.2.2.3pH的单因素实验以水解度(DH)为指标,固定酶添加量为140 U/g,液料比为3∶1(mL/g),温度45 ℃,酶解3 h,pH分别为7、8、9、10、11,考察pH对大鲵活性肽制备的影响。
1.2.2.4液料比的单因素实验以水解度(DH)为指标,固定酶添加量为140 U/g,pH8,45 ℃,酶解时间为3 h,液料比分别为1∶1、2∶1、3∶1、4∶1、5∶1(mL/g),考察液料比对大鲵活性肽制备的影响。
1.2.2.5酶解时间的单因素实验以水解度(DH)为指标,固定酶添加量为140 U/g,液料比为3∶1(mL/g),pH为8,酶解温度为45 ℃,酶解时间分别为1、2、3、4、5 h,考察酶解时间对大鲵活性肽制备的影响。
1.2.3响应面法优化酶法制备大鲵活性肽的工艺条件利用甲醛滴定法测定所得酶解液的水解度(DH)[17]。
在单因素实验的基础上,选择对水解度影响较大的pH、温度、酶解时间和酶添加量4个因素为考察对象进行Box-Behnken设计,优化大鲵活性肽的最佳酶解工艺,因素水平见表1。
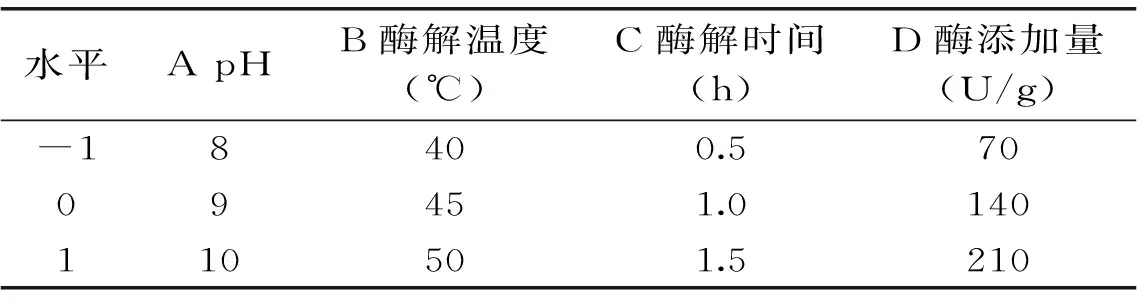
表1 Box-Behnken设计因素水平表
1.2.4理化性质的测定含水量的测定采用常压干燥法,具体参照GB/T5009.3-2010;灰分的测定采用干法灰化法,参照GB/T5009.4-2010;脂肪含量的测定采用索氏提取法,参照GB/T5009.6-2003;蛋白质含量的测定采用凯氏定氮法,参照GB/T5009.5-2010。
1.2.5大鲵活性肽分子量的测定用HPLC检测大鲵活性肽的相对分子质量分布。
色谱条件:色谱柱TsK gel 2000 SWXL 300 mm×7.8 mm,流动相为乙腈∶水∶三氟乙酸为30∶70∶0.1(v/v/v),检测波长为280 nm,流速为1.00 mL/min,柱温30 ℃。
样品制备:以流动相为溶剂配制浓度为5.00 mg/mL的样品,再用微孔膜(0.45 μm)过滤后进样。
标准样品的制备:将牛血清蛋白(Mr 67000)、维生素B12(Mr 1335)、氧化型谷胱甘肽(Mr 614)配成混标,每种物质含量均为5.00 mg/mL。
1.2.6大鲵多肽冻干粉的制备采用最优工艺条件制备大鲵多肽,对所得大鲵蛋白水解液进行冷冻干燥,条件为-80.00 ℃,0.03 mBar,48.00 h。
1.2.7体外抗氧化活性实验分别采用NBT法和脱氧核糖法测定大鲵多肽的超氧阴离子自由基和羟自由基的清除能力[18-19]。
2 结果与分析
2.1碱性蛋白酶制备大鲵活性肽的单因素实验
2.1.1酶添加量的确定图1为不同酶添加量对大鲵蛋白水解度的影响。由图1可知,在35~140 U/g范围内,随着酶添加量的增加,大鲵蛋白的水解度增高。在140~280 U/g范围内,水解度不再随着酶添加量的增大而增大,这可能是由于底物已全部与酶形成酶-底物复合物,没有多余的底物与酶接触。因此,综合考虑,酶的最适添加量为140 U/g。
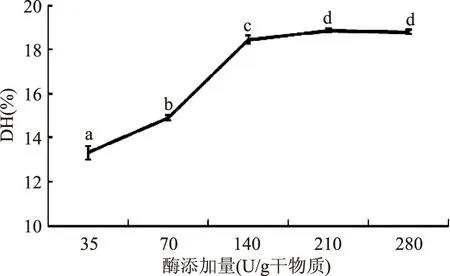
图1 酶添加量对大鲵蛋白水解度的影响Fig.1 Effects of enzyme amounts on the degree of hydrolysis of giant salamander protein hydrolysates注:不同字母表示差异显著(p<0.05);图2~图5同。
2.1.2酶解温度对DH的影响不同酶解温度对大鲵蛋白水解度的影响见图2。由图2可知,温度为45~55 ℃范围内的水解度最大,低于45 ℃时,随着酶解温度的升高水解度增加。超过55 ℃后,水解度缓慢下降,其可能原因是温度过高使酶的蛋白质结构发生改变,导致活力降低[20]。
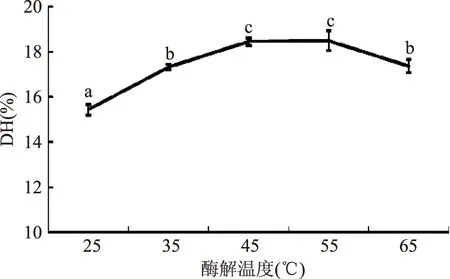
图2 酶解温度对大鲵蛋白水解度的影响Fig.2 Effects of reaction temperature on the degree of hydrolysis of giant salamander protein hydrolysates
2.1.3pH对DH的影响体系pH影响着酶和底物分子解离集团的解离状态,适当的pH下酶与底物分子可以结合并促使反应进行。由图3可知 pH为9~10时水解度最大,约为17.50%。pH低于9或高于10时,水解度均有所降低,可见pH=9为碱性蛋白酶催化得到大鲵活性肽的较适pH范围。
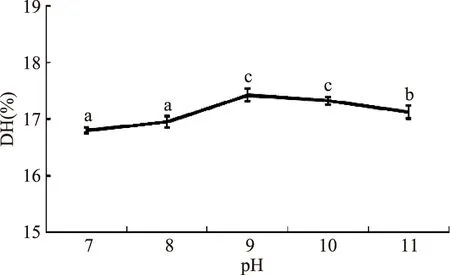
图3 pH对大鲵蛋白水解度的影响Fig.3 Effects of pH on the degree of hydrolysis of giant salamander protein hydrolysates
2.1.4液料比对DH的影响图4为不同液料比(mL/g)对大鲵蛋白水解度的影响。图4可知,液料比在2∶1、3∶1、4∶1时均保持较高的DH,且水平之间无显著性差异。所以选取液料比为2∶1,作为后续响应面实验条件。
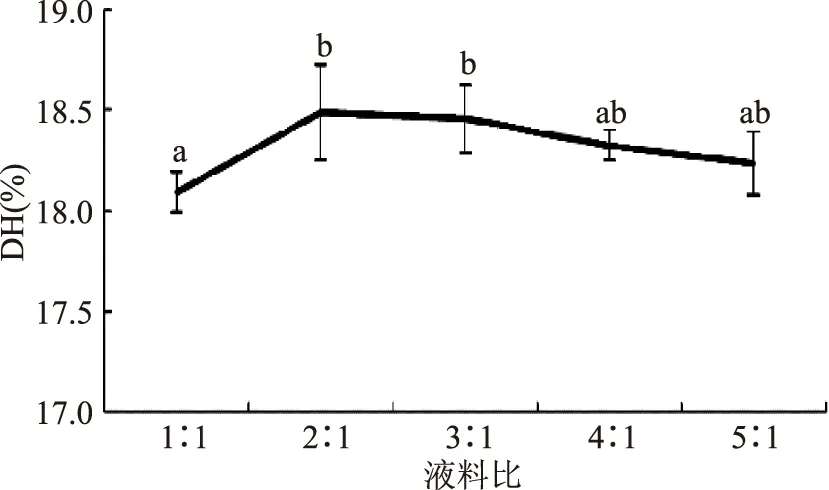
图4 液料比对大鲵蛋白水解度的影响Fig.4 Effects of the ratio of liquor to material on the degree of hydrolysis of giant salamander protein hydrolysates
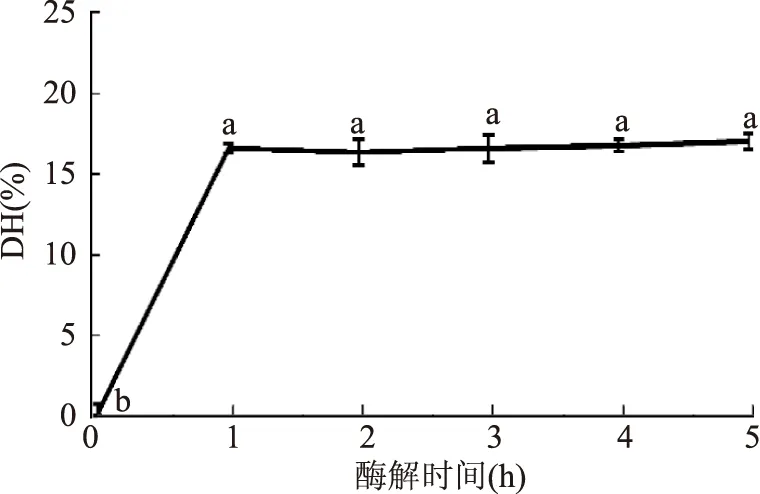
图5 酶解时间对大鲵蛋白水解度的影响Fig.5 Effects of reaction time on the degree of hydrolysis of giant salamander protein hydrolysates
2.1.5酶解时间对DH的影响本实验研究了不同酶解时间处理下大鲵肉糜在碱性蛋白酶作用下的水解度。由图5可知,在酶解初期的1 h内,蛋白质水解度急剧升高,而在1~5 h内变化较为缓慢。
2.2响应面法优化碱性蛋白酶酶解制备大鲵活性肽的工艺条件
采用响应面优化设计(Response Surface Methodology,RSM),对大鲵活性肽的酶法制备条件进行优化与统计分析。利用统计软件Design-Expert 8.0进行数据拟合和分析,考察pH、温度、液料比和酶解时间4个单因素的交互关系,寻求水解度可能达到的极大值,实验设计和结果见表2。
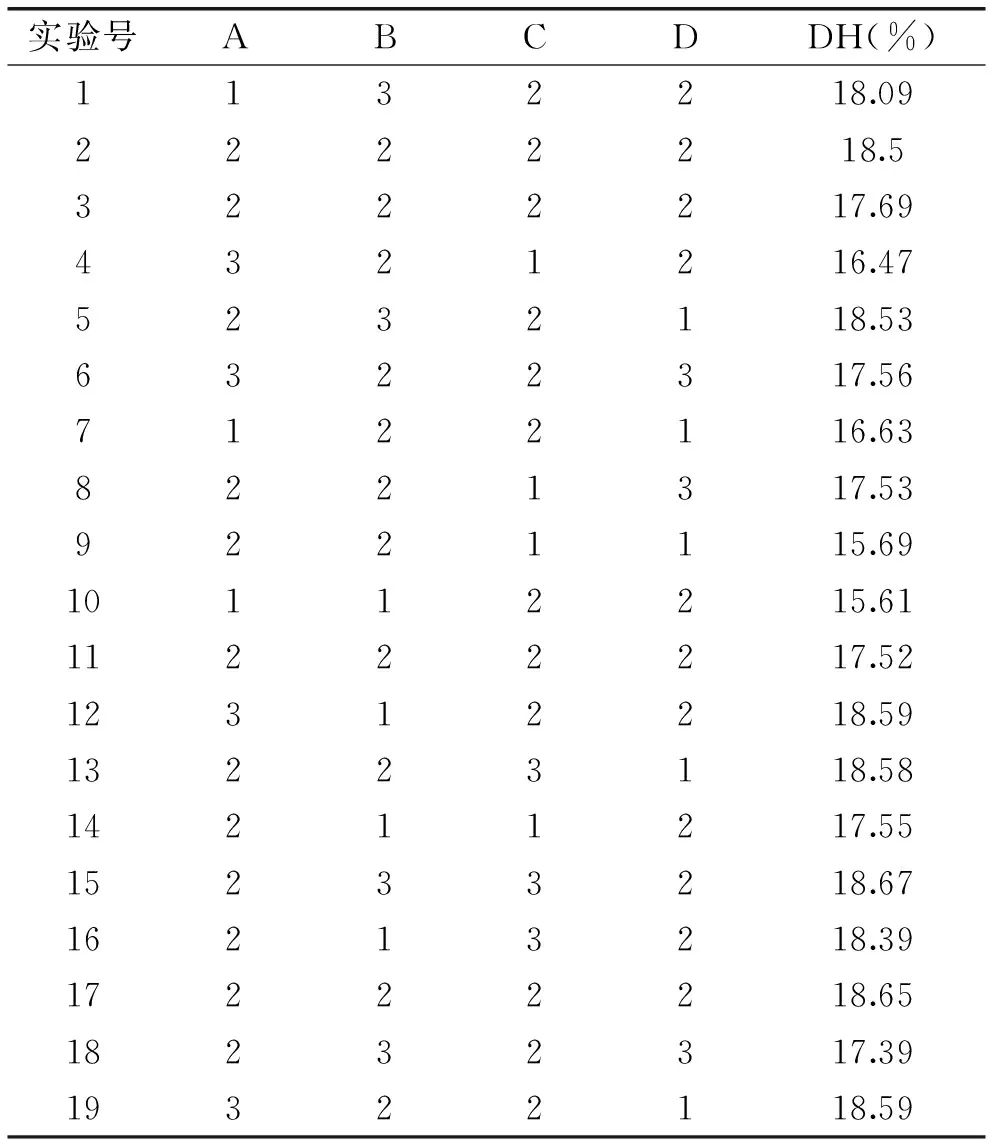
表2 Box-Behnken设计与实验结果
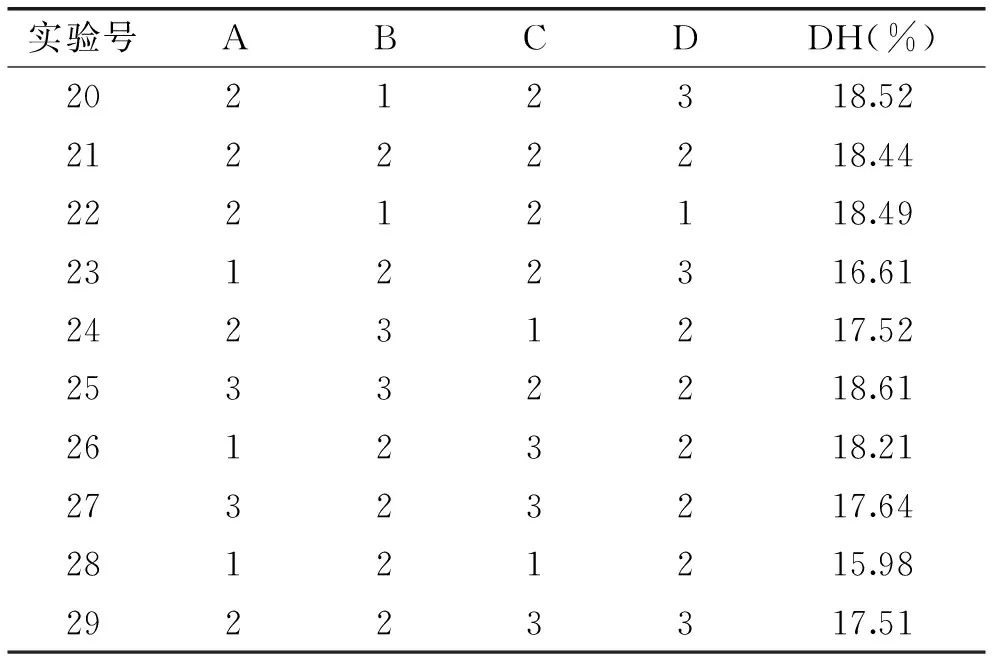
续表
通过二次模拟回归系数计算,得到以水解度表示的二次回归拟合方程:
DH=18.16+0.53A+0.14B+0.69C-0.12D-0.61AB-0.26AC-0.25AD+0.078BC-0.29BD-0.73CD-0.63A2+0.29B2-0.49C2-0.25D2
对表2中实验结果进行统计分析,方差分析结果见表3。该模型p值=0.0132(p<0.05视为模型显著),表明该模型高度显著,可用来进行响应值预测。
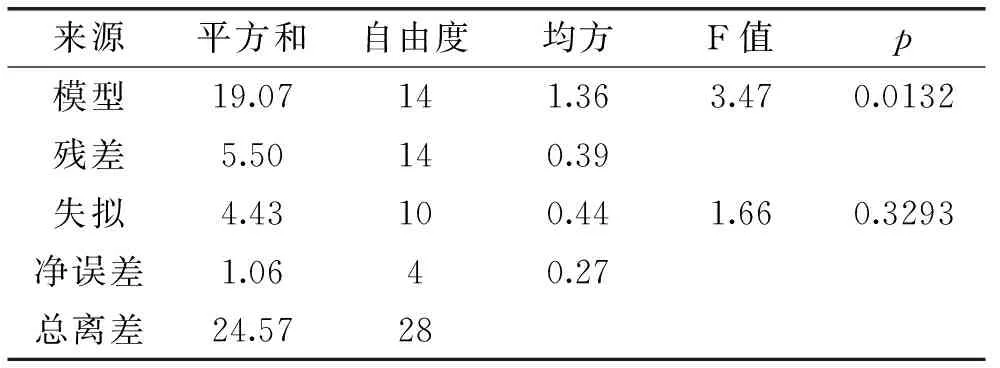
表3 Box-Behnken设计模型方差分析
对于某一特定因素,F值越大,p值越小说明该因素越重要。由表4可知:A(pH)、C(酶解时间)CD、A2对酶法制备大鲵活性肽的影响显著(p<0.05),B(酶解温度)、D(酶添加量)、AB、AC、AD、BC以及BD的交互作用影响不显著。
相互作用的响应面分析见图6,酶解时间、酶添加量的交互作用显著,其他因素的交互作用影响不显著。根据拟合方程,可以得到最佳酶解工艺条件为:酶解温度50 ℃,酶解时间1.5 h,酶添加量70 U/g,pH8.91,蛋白酶解液的水解度值为19.76%。
为了检验模型预测的准确性,在最佳制备条件下进行了3次实验,其DH为 19.61%±0.12%,可见该模型能较好地预测实际合成情况。
2.3大鲵活性肽的理化性质研究
对原料大鲵肉和大鲵活性肽的成分进行比较分析,结果见表5。从表5可以看出,酶解处理得到的大鲵活性肽蛋白质含量高达52.40%±1.28%,脂肪含量最低,为0.14%±0.08%。灰分含量较高,达到10.01%±0.42%,这与含水量的降低有很大关系,也与酶解过程中因pH的调节导致生成盐类有关。灰分的高含量限制了其在食品中的应用,有待于进一步的研究。
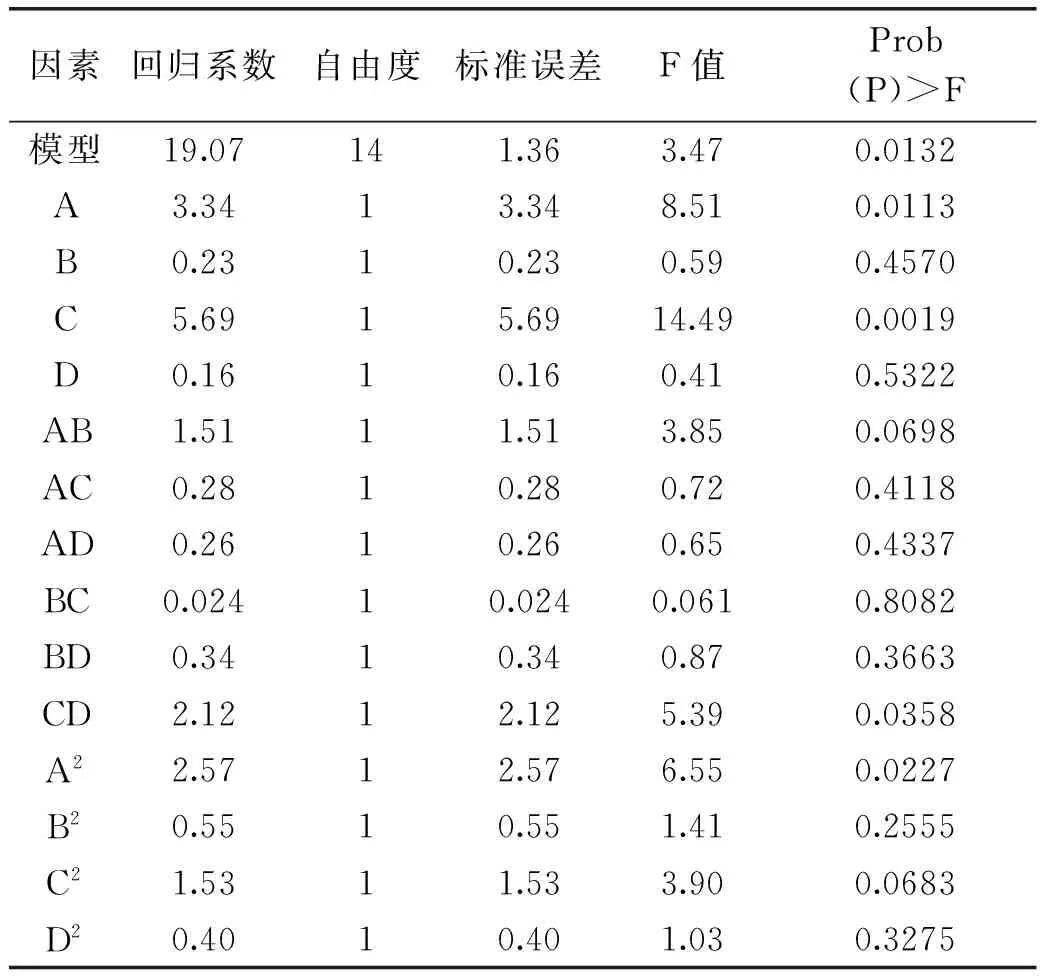
表4 二次模型回归系数的显著性检验
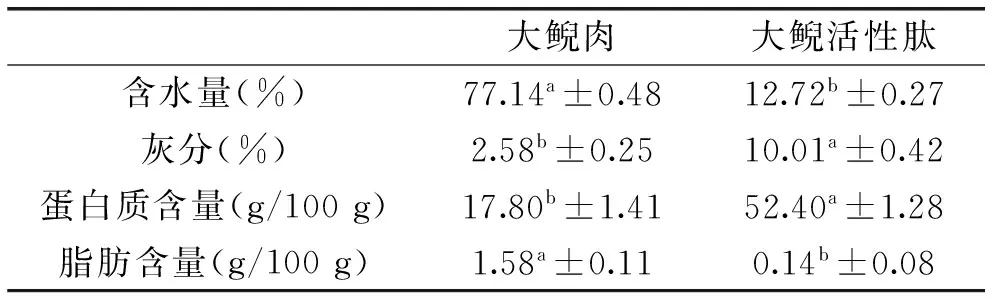
表5 常规成分分析
注:不同小写字母表示大鲵肉和大鲵活性肽两者在同一指标下有显著差异(p<0.05)。
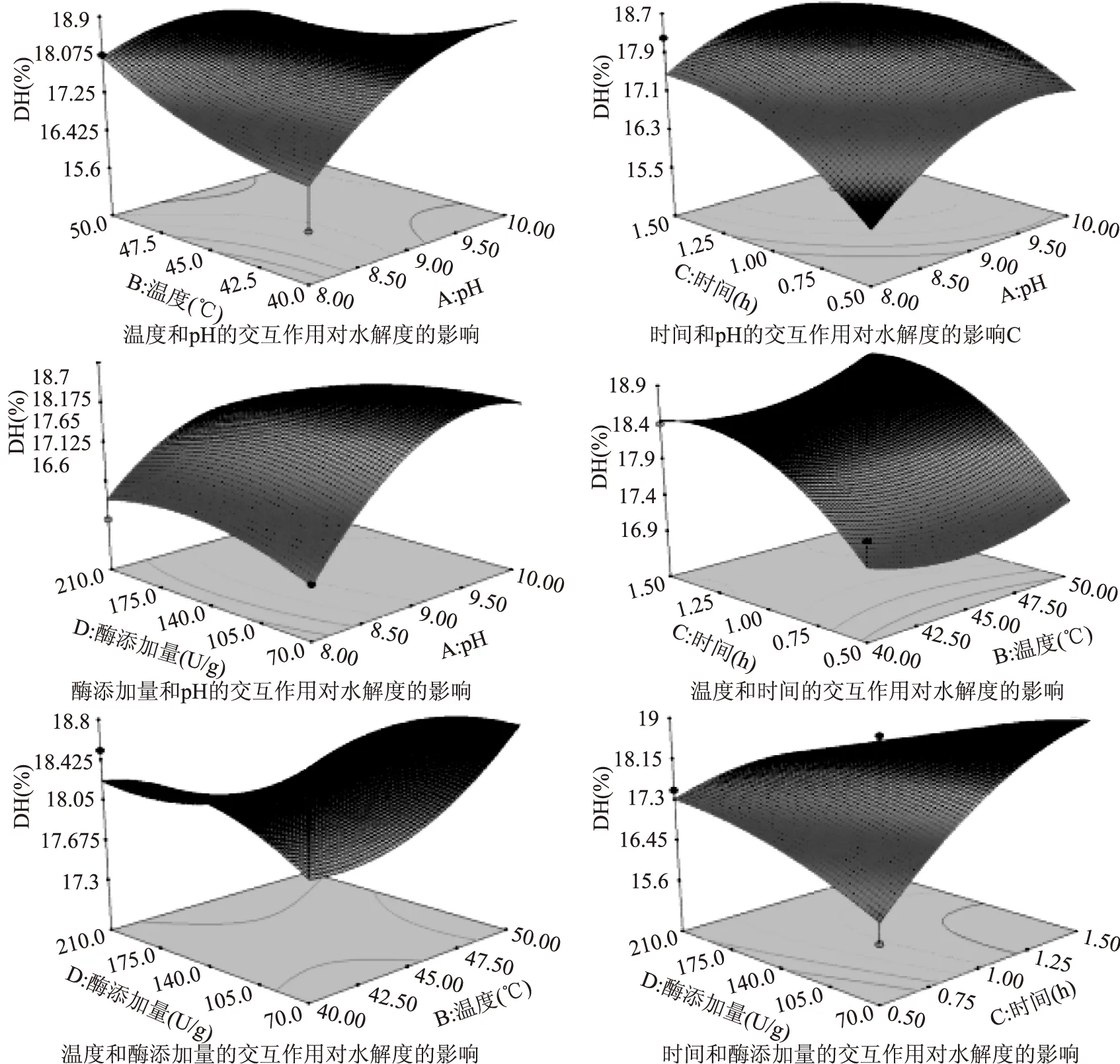
图6 不同自变量交互作用对大鲵蛋白水解度影响的响应面图Fig. 6 Response surface for the interaction effects of independent variables on the degree of hydrolysis of giant salamander protein hydrolysates
2.4大鲵活性肽的分子量分布
选用三种标准样品,分别为牛血清白蛋白、维生素B12和氧化型谷胱甘肽。对这三种标准样品(5 mg/mL)进行HPLC分析。根据凝胶柱渗透层析原理,分子量大的物质先被洗脱下来,具体分子量、分子量对数和洗脱时间详见表6。
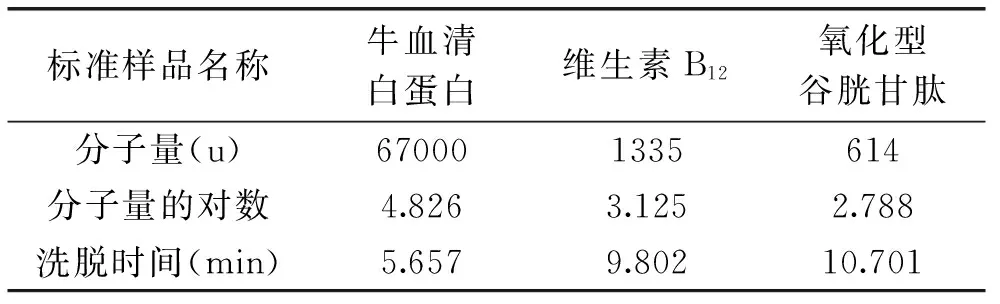
表6 三种标准样品的分子量与洗脱时间的关系表
制作三种标准样品的相对分子质量对数与标准样品经HPLC的洗脱时间的关系曲线。采用最小二乘法,求出回归直线方程为:
y=-0.4136x+7.1985(R2=0.9997)
其中,x代表洗脱时间,y代表分子量对数。
由图7可以看出,大鲵活性肽样品主要出现三个组分峰,洗脱时间分别为10.955、10.172、9.401 min,根据标准曲线计算出各峰组分的分子量分别为444.32、928.51、2042.90 u,根据峰面积计算该三种物质分别占44.68%、29.50%、17.58%,三者共占91.76%(表7)。

表7 大鲵活性肽的分子量分布情况表
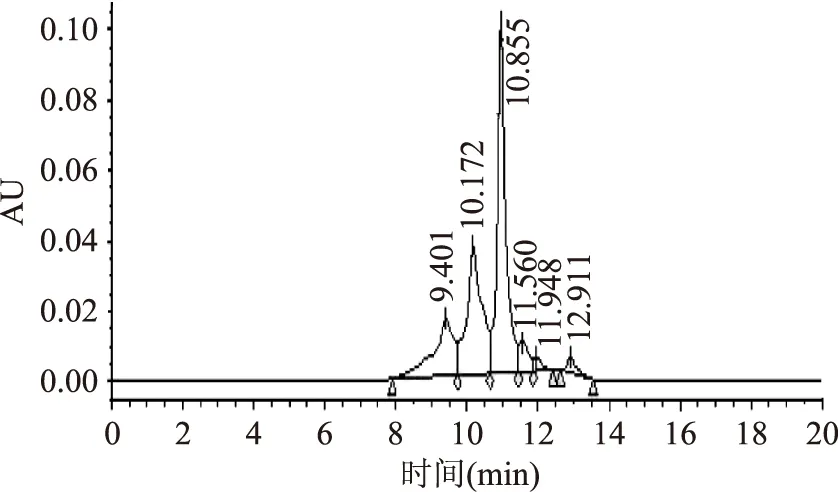
图7 大鲵活性肽的HPLC图谱Fig.7 HPLC spectrpgam of giant salamander peptide
2.5大鲵活性肽对羟自由基和超氧阴离子自由基的清除作用
由图8可知,大鲵活性肽对两种自由基均具有不同程度的清除作用。随着添加浓度的增加,大鲵活性肽对两种自由基的清除作用也随之增强。浓度为15 mg/mL时,大鲵活性肽对超氧阴离子自由基清除率为32.29%;浓度为30 mg/mL 时,大鲵活性肽对羟自由基的清除率已达到81.83%,超氧阴离子自由基的清除率达到了56.27%。以上结果表明,大鲵活性肽具有较好的抗氧化作用。
3 结论
以大鲵肉为研究对象,利用脂肪酶对大鲵肉初
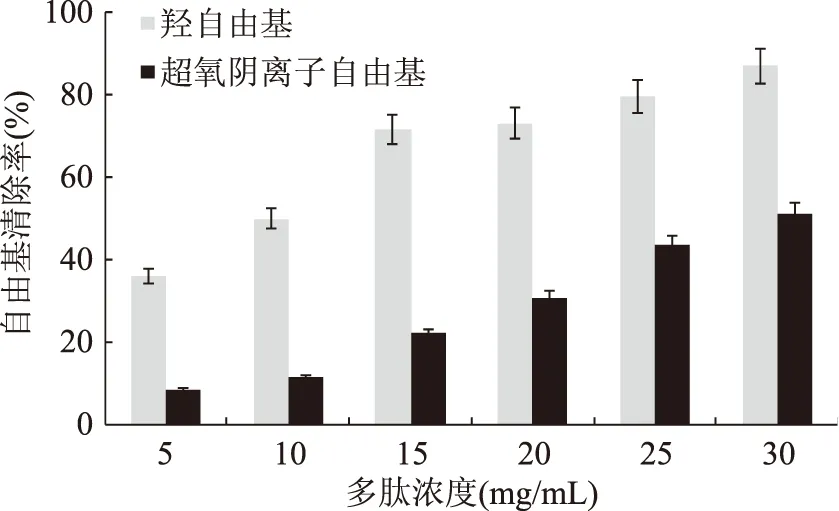
图8 大鲵活性肽浓度对自由基的清除率作用Fig.8 Concentration of giant salamander peptide on free radical scavenging capability
步进行脱脂处理,然后利用蛋白酶酶解大鲵肉制备大鲵活性肽,通过响应面优化设计,得到了蛋白酶酶解最优工艺条件为:酶解温度50 ℃、酶解时间1.5 h、酶添加量70 U/g、pH8.91。在此最优条件下,DH=19.61%±0.12%。本实验同时对所得大鲵活性肽进行了常规成分分析,得出大鲵活性肽的蛋白质含量达到52.40%±1.28%,其中大鲵活性肽分子量有44.68%分布在444.32 u,29.50%分布在928.51 u,分子量多分布在1000 u以内;该活性肽对羟自由基和超氧阴离子自由基均具有不同程度的清除作用。有文献记载小分子量多肽更有利于人体吸收和抗氧化活性的增强[21-22],这表明大鲵活性肽作为保健食品具有潜在的优势。
[1]王晶琦,李丕鹏,陆宇燕,等.桓仁林蛙与东北林蛙蝌蚪的形态特征及比较[J].四川动物,2006,25(2):349-353.
[2]牟洪民,李媛,姚俊杰,等.大鲵生物学研究的新进展[J].水产科学,2011,30(8):513-516.
[3]罗庆华,刘英,张立云.张家界市大鲵资源保护、增殖现状与对策[J].安徽农业科学,2009,35(19):9023-9025,9052.
[4]宋鸣涛. 秦岭太白山北坡两栖爬行动物[J]. 动物学杂志,1986(5):9-12.
[5]Chan S T H,Sandor T,Lofts B. A histological,histochemical,and biochemical study of the adrenal tissue of the Chinese giant salamander(AndriasdavidianusBlanchard)[J]. General and Comparative Endocrinology,1975,25(4):509-516.
[6]Lan SC,Li D F,Jiang J C. Call and skin glands secretion
induced by stimulation of midbrain in urodele(Andriasdavidianus)[J]. Brain Research,1990,528(1):159-161.
[7]杨楚彬,罗凯坤,周海燕,等.大鲵输卵管的基本组织结构及其发育变化[J].湖南师范大学自然科学学报,2003,26(1):64-68.
[8]王高学,白占涛,张向前,等.大鲵赤皮病病原分离鉴定及防治实验[J].西北农林科技大学学报(自然科学版),1999,27(4):71-74.
[9]Rafael Z,Edward M,Michael V,et al.Complete nucleotide sequence of the mitochondrial genome of a salamander,Mertensiella luschani[J]. Gene,2003,317(23):17-27.
[10]Yang YP,Meng ZM,Liu Y,et al. Growth hormone and prolactin in Andrias davidianus:cDNA cloning ,tissue distribution and phylogenetic analysis[J]. General and Comparative Endocrinology,2010,165(2):177-180.
[11]王军,于月英,李林强 ,等.中国大鲵油脂肪酸成分及流变性分析[J].食品科学,2009,30(24):405-408.
[12]李林强,昝林森.中国大鲵肌内脂肪酸组成及其抗氧化研究[J].食品工业科技,2010,31(1):364-366.
[13]黄世英,郭文韬,杨志伟,等.人工养殖大鲵肉营养成分分析[J].时珍国医国药,2009,20(5):1-2.
[14]刘绍,孙麟,阳爱生,等.饲养中国大鲵氨基酸组成分析[J]. 氨基酸和生物资源,2007,29(4):53-55.
[15]刘绍,阳爱生,彭国平,等.饲养中国大鲵软骨与肌肉中几种重要矿物质的ICP-AES法测定与分析[J].食品工业科技,2007,28(8):225-226.
[16]李伟,于新莹,佟长青,等.大鲵黏液酶解产物的制备及其抗疲劳作用研究[J].食品工业科技,2011,32(6):146-148,151.
[17]王朝旭,赵丹,王小雪.酶法水解骨蛋白最佳条件的研究[J].食品科学,2001,22(2):48-49.
[18]赵艳红,李建科,李国秀.天然抗氧化物体外活性评价方法的优选与优化[J].食品科学,2008,29(6):64-69.
[19]刘文颖,徐亚光,任玮.三文鱼皮胶原肽体外抗氧化活性研究[J].食品科技,2010,35(12):86-89.
[20]周光朝,刘良忠,万菡,等.高水解度草鱼鱼鳞胶原蛋白肽的研究[J].粮食科技与经济,2011,36(2):52-56.
[21]张宁,康跻耀,高建萍,等.胶原蛋白肽分子量对吸收过程的影响研究[J].生物学杂志,2013,30(2):10-13.
[22]郑捷,李素,胡爱军,等.不同分子量真鲷鱼骨多肽抗氧化活性的研究[J].食品工业科技,2014,35(2):108-111.
Optimal enzymatic preparation conditions and antioxidative activity of giant salamander bioactive peptide
ZHANG Jia-chan1,2,WANG Chang-tao1,2,3,*,LI Meng1,2,ZHAO Dan1,2
(1.School of Science,Beijing Technology and Business University,Beijing 100048,China;2.Beijing Key Laboratory of Plant Resources Research and Development,Beijing 100048,China;3.Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Technology and Business University,Beijing 100048,China)
In this paper,enzymatic preparation conditions of giant salamander bioactive peptide and its physicochemical properties were studied. Based on the degree of hydrolysis,the preparation method was optimized by response surface methodology. The optimal temperature,the reaction time,the ratio of liquor to material,enzyme amounts,and pH were 50 ℃,1.5 h,2∶1(mL/g),70 U/g ,and pH8.91,respectively,the highest degree of hydrolysis was obtained,up to 19.61%±0.12%. Protein content of the bioactive peptide was 52.40%±1.28% and the molecule weight of the most bioactive peptide was below 1000 u. At the concentration of 30 mg/mL,the scavenging rates of giant salamander bioactive peptide against hydroxyl radical and superoxide anion were 81.83% and 56.27%,respectively.
giant salamander;bioactive peptide;enzymolysis;degree of hydrolysis;antioxidative activity
2015-11-09
张佳婵(1987-),女,硕士,实验师,研究方向:食品生物技术,E-mail:xiaochan8787@163.com。
王昌涛(1975-),男,博士,教授,研究方向:生物化工,E-mail:wangct@th.btbu.edu.cn。
质检公益性行业科研专项(201310132);质检公益性行业科研专项(201410019)。
TS254.1
A
1002-0306(2016)12-0217-06
10.13386/j.issn1002-0306.2016.12.033

