重组大肠杆菌产谷氨酰胺转氨酶的发酵条件优化
舒 畅,罗水忠,2,蔡 静,2,姜绍通,2,郑 志,2,*
(1.合肥工业大学生食品科学与工程学院,安徽合肥 230009;2.安徽省农产品精深加工重点实验室,安徽合肥 230009)
重组大肠杆菌产谷氨酰胺转氨酶的发酵条件优化
舒畅1,罗水忠1,2,蔡静1,2,姜绍通1,2,郑志1,2,*
(1.合肥工业大学生食品科学与工程学院,安徽合肥 230009;2.安徽省农产品精深加工重点实验室,安徽合肥 230009)
以谷氨酰胺转氨酶生产菌株重组大肠杆菌BL21(DE3)/mtg为研究对象,对工程菌的发酵产酶条件进行了优化。首先通过单因素实验法,对培养基碳、氮源种类及浓度、培养温度、初始pH、装液量、接种量、诱导时机、诱导浓度、诱导温度及诱导时间进行了优化;随后采用Plackett-Burman设计从中筛选出3个关键影响因子:初始pH、培养温度及诱导温度;最后通过Box-Benhnken设计建立上述3个因子对谷氨酰胺转氨酶比酶活的响应面模型。结果表明,最佳发酵条件为:葡萄糖5 g/L,酵母粉28 g/L,蛋白胨14 g/L,培养温度34 ℃,初始pH7.0,装液量50 mL(250 mL三角瓶),接种量5%,诱导时机4 h,IPTG浓度0.6 mmol/L,诱导温度25 ℃,诱导时间14 h。在该条件下,优化后的谷氨酰胺转氨酶比酶活达1.507 U/mg,为未优化前的1.56倍。
谷氨酰胺转氨酶,重组大肠杆菌,发酵优化,响应面法
谷氨酰胺转氨酶(Transglutaminase,EC 2.3.2.13,TGase)是一种催化酰基转移反应的酶,它以谷氨酰胺残基γ-羧酰胺基为酰基供体,催化蛋白质分子内、分子间的交联,蛋白质和氨基酸之间的连接及蛋白质分子内谷氨酰胺基的水解,从而极大地改变蛋白质的功能性质[1],在肉制品、水产品和乳制品[2]等领域都有广泛的应用前景,被誉为“21世纪超级粘合剂”。
TGase最初从动[3]、植物组织[4]中提取,但工艺复杂、产量低、分离成本高,不利于大规模工业化应用。自1989年Ando等[5]从茂源链霉菌(Streptomycesmobaraensis)中分离得到微生物来源的TGase(MTGase,MTG),至今已有大量链霉菌属[6]和芽孢杆菌属[7]等菌种的发酵产酶研究。相比其他来源的TGase,MTG具有非Ca2+依赖性、催化效率高、底物特异性低、温度稳定性高[8]等特点,且其生产周期短,易分离纯化,成本优势明显[9],故倍受研究者青睐。为提高MTG产率,国内外围绕优势菌种选育、发酵工艺优化及基因工程菌构建等方面展开了大量工作。目前,MTG已在大肠杆菌(Escherichiacoli)[10]、谷氨酸棒杆菌[11]、酵母[12]、枯草芽孢杆菌[13]和链霉菌等[14]宿主中成功表达,但普遍存在酶活低、产量少等问题。
本课题组在前期研究中将S.mobaraensis来源的TGase基因在大肠杆菌BL21(DE3)中成功表达。为探讨以发酵法产MTG的可能性,本研究对重组大肠杆菌BL21(DE3)/mtg的发酵产酶过程进行了优化,为后续研究中试及工业化生产提供参考。
1 材料与方法
1.1材料与仪器
含S.mobaraensisTGase基因的重组大肠杆菌BL21(DE3)/mtg由合肥工业大学食品科学与工程学院谷物科学与食品发酵研究室构建与保藏;CBZ-Gln-Gly、L-谷氨酸-γ-单羟肟酸均购自美国Sigma公司;还原性谷胱甘肽、Tris、牛血清蛋白均购自北京索莱宝科技有限公司;胰蛋白胨、酵母粉均购自英国Oxoid公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG)均购自生工生物工程(上海)股份有限公司;其他试剂均为国产分析纯。
LDZX-50KBS型立式灭菌器上海申安医疗器械有限公司;ZHJH-C1112B型超净工作台、ZWY-240型全温型多振幅轨道摇床上海智城分析仪器制造有限公司;DHP-9012B型电热恒温培养箱上海一恒科学仪器有限公司;SP-722E型可见分光光度计上海光谱仪器有限公司;HH-4型数显恒温水浴锅江苏省金坛市友联仪器研究所;CR22GII型高速冷冻离心机日本Hitachi公司;PH-108型笔式酸度计杭州陆恒生物科技有限公司;JY99-IIIBN型超声波连续流细胞粉碎机宁波新芝生物科技股份有限公司。
1.2实验方法
1.2.1培养基的配制种子培养基:LB/Kan培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,卡那霉素0.1,pH7.0。发酵培养基:TB/Kan培养基(g/L):蛋白胨12,酵母粉24,K2HPO412.54,KH2PO42.31,甘油5,卡那霉素0.1,pH7.0。
1.2.2培养方法种子培养:自-80 ℃保藏的甘油管中取适量菌液涂布LB平板,37 ℃过夜培养后挑取单菌落接种于50 mL种子培养基(250 mL三角瓶),37 ℃、200 r/min过夜培养。发酵培养及诱导产酶:将培养好的种子液以5%的接种量接种到50 mL发酵培养基(250 mL三角瓶)中,37 ℃、200 r/min培养至菌液OD600为0.8时加入终浓度0.6 mmol/L的IPTG,26 ℃、200 r/min诱导16 h。
1.2.3单因素实验以细胞密度值(OD600)及MTG比酶活为考察指标,依次以碳源种类(甘油、葡萄糖、麦芽糖、乳糖、蔗糖、可溶性淀粉)、碳源浓度(2、4、5、6、8、10 g/L)、氮源种类(蛋白胨和酵母粉(1∶2)、氯化铵、硝酸钠、硫酸铵、尿素)、氮源浓度(1、2、4、5、6、8 g/L)、接种量(1%、3%、5%、7%、9%)、装液量(15、25、50、75、100 mL)(250 mL三角瓶)、培养温度(26、30、34、37、41 ℃)、初始pH(6.0、6.5、7.0、7.5、8.0)、IPTG浓度(0.2、0.4、0.6、0.8、1.0 mmol/L)、诱导时机(IPTG添加时间:2、3、4、5、6、7 h)、诱导时间(13、14、15、16、17、18、19 h)及诱导温度(22、26、30、34、37、41 ℃)为影响因素进行单因素实验。初始实验条件为:甘油5 g/L、蛋白胨12 g/L、酵母粉24 g/L、接种量5%、装液量50 mL、培养温度37 ℃、初始pH7.0、IPTG浓度0.6 mmol/L,诱导时机4 h、诱导时间16 h、诱导温度26 ℃。除考察因素外,每次实验的其他因素条件均以前一实验所得最优条件置换。
1.2.4Plackett-Burman(PB)设计优化在单因素实验基础上进行PB设计,各因素选取2个水平,高水平约取低水平的1.25倍,响应值为MTG比酶活。PB实验因素水平见表1。
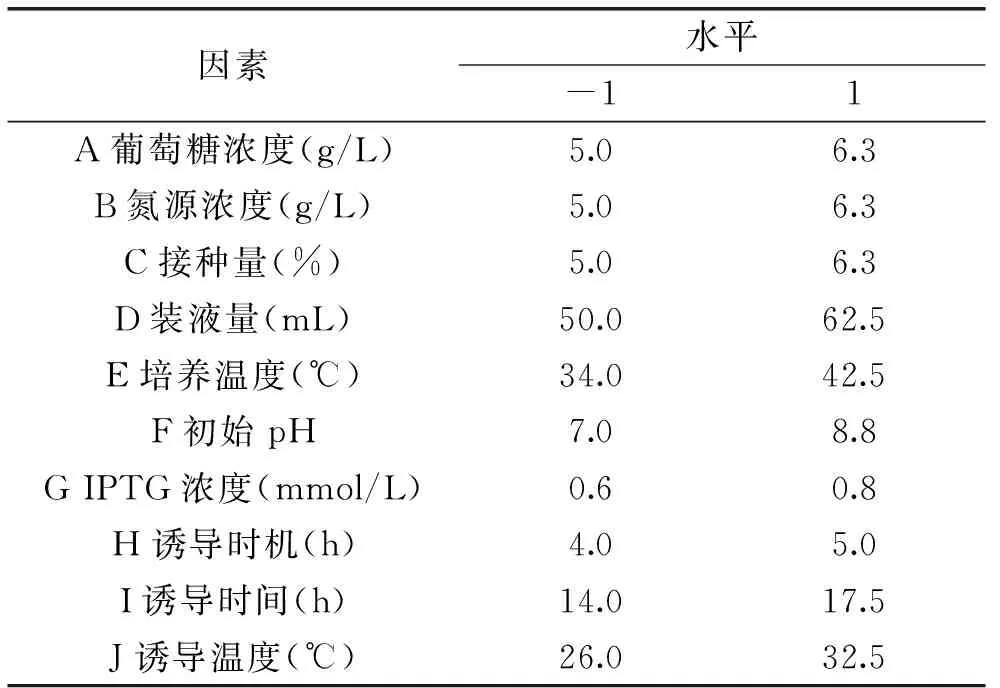
表1 Plackett-Burman(PB)实验因素水平设计
1.2.5Box-Benhnken(BB)实验设计以PB实验筛选出的三个显著因素(培养温度、初始pH、诱导温度)为实验因素,以MTG比酶活为响应值,各因素选取3个水平,设计三因素三水平共17个实验点的响应面实验。BB实验因素水平设计见表2。
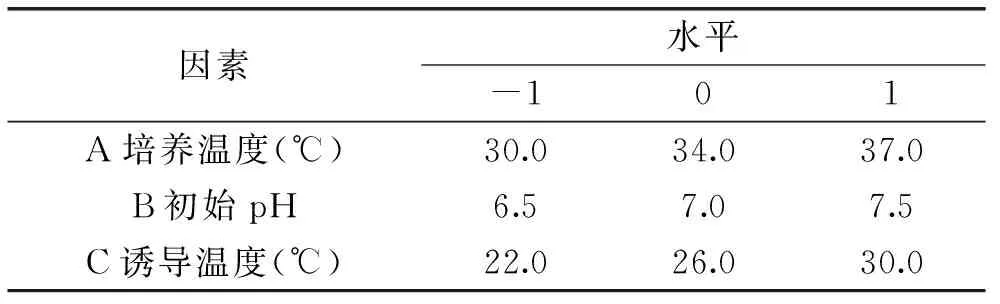
表2 Box-Benhnken(BB)实验因素水平设计
1.2.6分析方法
1.2.6.1细胞密度值的测定发酵液经适度稀释后,以无菌培养液为对照,于波长600 nm处所测吸光值乘以稀释倍数即为菌体浓度(OD600)。
1.2.6.2MTG比酶活的测定发酵液4 ℃、7000 r/min离心10 min,收集菌体于冰上超声破碎10 min,4 ℃、16000 r/min离心15 min,收集上清即为粗酶液。按Grossowicz比色法[15]测定酶活:以CBZ-Gln-Gly为底物,L-谷氨酸-γ-单羟肟酸作标准曲线。酶单位活力(U)定义为:37 ℃时每分钟催化底物生成 1 μmol L-谷氨酸-γ-单羟肟酸的酶量。比酶活(U/mg)定义为:每毫克蛋白具有的酶活力。蛋白含量测定参考Bradford法[16]。
1.3数据处理
每组实验均重复三次,实验结果以平均值±标准差形式表示。应用Microsoft Office Excel 2013和Design-Expert 8.0.6软件进行数据分析,Origin 8.5软件作图。
2 结果与分析
2.1单因素实验
2.1.1碳源种类及浓度对重组菌生长和产酶的影响碳源为微生物生长代谢提供物质基础和能量来源。按含碳质量分数相等的原则,分别以葡萄糖、麦芽糖、乳糖、蔗糖和可溶性淀粉来代替TB培养基中的甘油(5 g/L)为碳源进行单因素实验。由图1可知,碳源为可溶性淀粉时菌体浓度最高,但MTG比酶活较低;葡萄糖为碳源时MTG比酶活最高,且菌体浓度仅次于淀粉。故选择葡萄糖为最优碳源,进而考察其浓度对菌体生长和产酶的影响。由图2可知,随着葡萄糖浓度的增加,菌体浓度和MTG比酶活均先增加后减少,当葡萄糖浓度为5 g/L时,两者均达最高值,分别为(4.49±0.46)和(1.13±0.08)U/mg。黄亚杰等[17]也有类似报道。
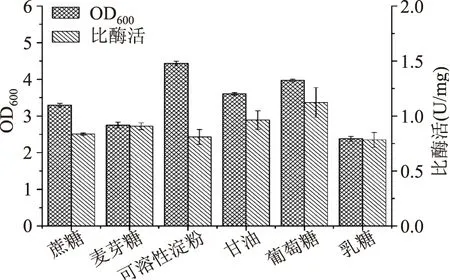
图1 不同碳源对菌体生长和产酶的影响Fig.1 Effect of different carbon sources on cell growth and MTG production
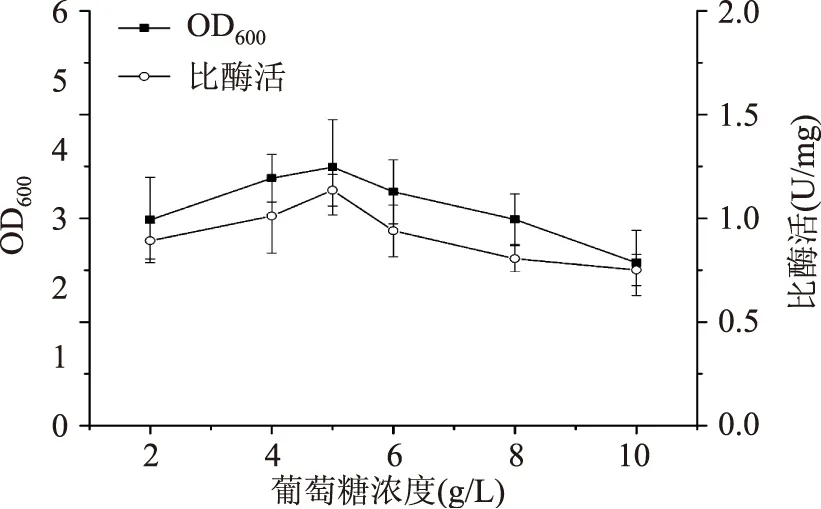
图2 葡萄糖浓度对菌体生长和产酶的影响Fig.2 Effect of glucose concentrations on cell growth and MTG production
2.1.2氮源种类及浓度对重组菌生长和产酶的影响氮源主要用于菌体细胞物质和含氮代谢物的合成。按含氮质量分数相等的原则,分别以氯化铵、硝酸钠、硫酸铵和尿素来代替TB培养基中的复合氮源(总含氮量为4.2 g/L)进行单因素实验。由图3可知,氮源种类对重组菌生长和产酶有较大影响,复合氮源明显优于其他氮源。据Harrison等[18]研究显示,酵母粉对重组酶释放至大肠杆菌周质空间有明显促进作用。故保持蛋白胨和酵母粉复配比不变,进而考察复合氮源总含氮量对重组菌生长和产酶的影响。由图4可知,随氮源浓度的增加,菌体浓度也增加,而MTG比酶活呈先增后减趋势。当复配氮源总含氮量为5 g/L(蛋白胨为14 g/L,酵母粉为28 g/L)时,MTG比酶活达最大值,为(1.17±0.09)U/mg。
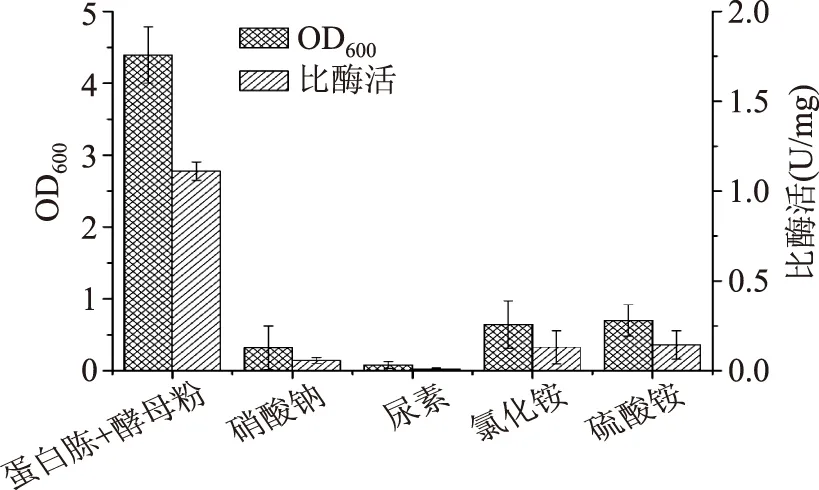
图3 不同氮源对菌体生长和产酶的影响Fig.3 Effect of different nitrogen sources on cell growth and MTG production

图4 氮源浓度对菌体生长和产酶的影响Fig.4 Effect of nitrogen concentrations on cell growth and MTG production
2.1.3接种量对重组菌生长和产酶的影响接种量对发酵周期及溶氧量都有直接影响[17]。由图5可知,当接种量为5%时,菌体浓度和MTG比酶活均最大。故选择5%为最佳接种量。
2.1.4装液量对重组菌生长和产酶的影响装液量影响菌株通气状况,适度的溶解氧是微生物代谢及产物合成的关键。由图6可知,随装液量的增加,菌体浓度和MTG的比酶活均上升,在50 mL时达到最大值,随后均降低。故选择50 mL为最佳装液量。
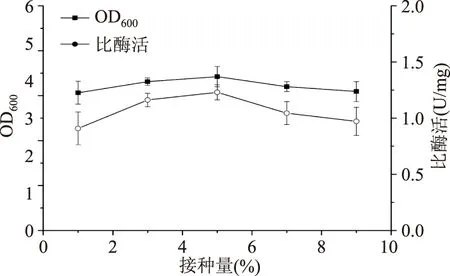
图5 接种量对菌体生长和产酶的影响Fig.5 Effect of inoculum sizes on cell growth and MTG production
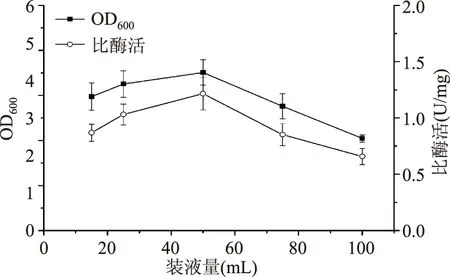
图6 装液量对菌体生长和产酶的影响Fig.6 Effect of medium volumes on cell growth and MTG production
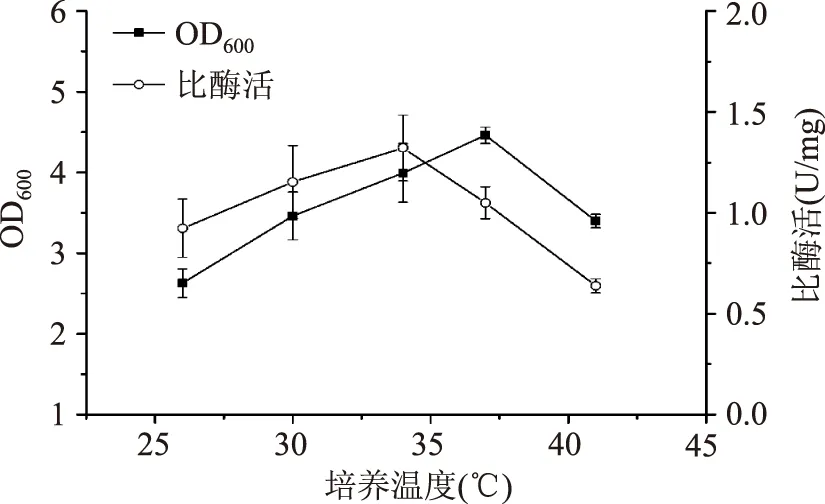
图7 培养温度对菌体生长和产酶的影响Fig.7 Effect of temperatures on cell growth and MTG production
2.1.5培养温度对重组菌生长和产酶的影响较高温度时细菌生长速率高,但易积累代谢副产物,抑制其生长和产物表达[19]。由图7可知,37 ℃时菌体浓度最高,但34 ℃时MTG比酶活最高(1.32±0.16)U/mg,为前者的1.3倍。故选择34 ℃为最佳培养温度。
2.1.6初始pH对重组菌生长和产酶的影响由图8可知,pH对菌体生长和产酶有较大影响。随其增加,菌体浓度和MTG比酶活均先上升后下降,pH为7.0时,两者都为最大值。故选择pH7.0为最佳初始pH。
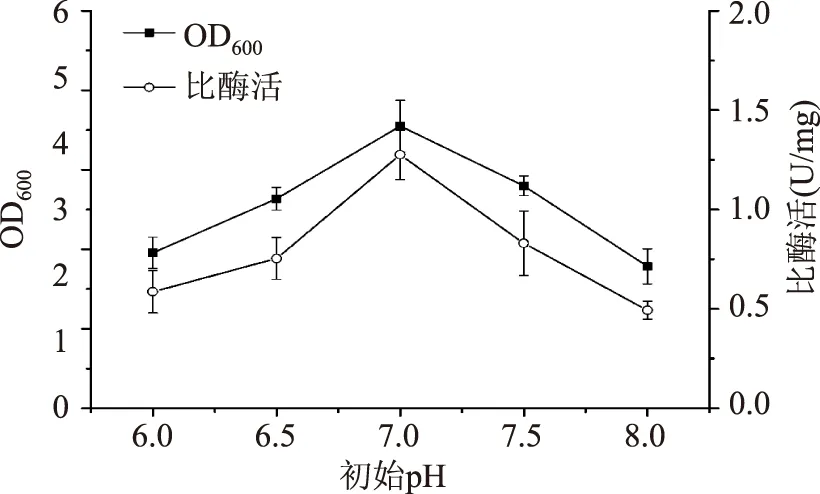
图8 初始pH对菌体生长和产酶的影响Fig.8 Effect of initial pH on cell growth and MTG production
2.1.7IPTG浓度对重组菌生长和产酶的影响由图9可知,IPTG浓度为0.6 mmol/L时,MTG比酶活最高,为(1.32±0.14)U/mg。故选择0.6 mmol/L为最佳IPTG浓度。

图9 IPTG浓度对菌体生长和产酶的影响Fig.9 Effect of IPTG concentrations on cell growth and MTG production
2.1.8诱导时机(IPTG添加时间)对重组菌生长和产酶的影响由图10可知,在对数中期4 h添加IPTG,MTG比酶活最高,这与之前类似研究报道[20]一致。故选择4 h为最佳诱导时机。
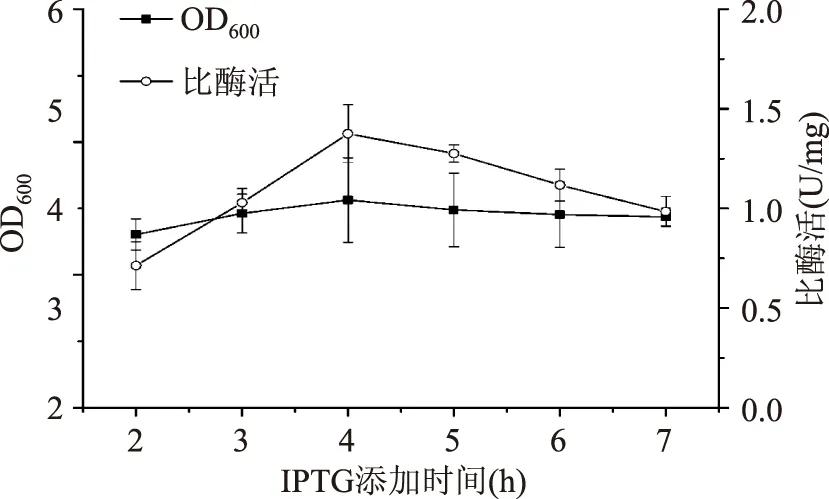
图10 IPTG添加时间对菌体生长和产酶的影响Fig.10 Effect of the adding time of IPTG on cell growth and MTG production
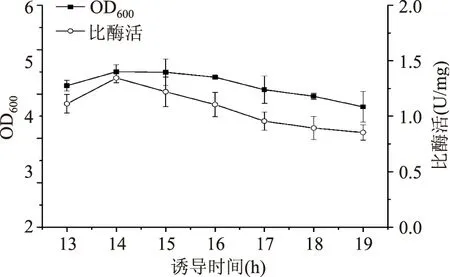
图11 诱导时间对菌体生长和产酶的影响Fig.11 Effect of induction time on cell growth and MTG production
2.1.9诱导时间对重组菌生长和产酶的影响由图11可知,14 h时菌体浓度和MTG比酶活均为最高值,此后随时间增加而降低。故选择14 h为最佳诱导时间。

表3 PB实验设计及结果
2.1.10诱导温度对重组菌生长和产酶的影响由图12可知,22~37 ℃内菌体浓度随诱导温度增加而增加,但低温有利于重组大肠杆菌产物的表达[19],26 ℃时MTG的比酶活最高,故选择26 ℃为最佳诱导温度。

图12 诱导温度对菌体生长和产酶的影响Fig.12 Effect of induction temperatures on cell growth and MTG production
2.2PB实验
PB设计及实验结果见表3,方差分析见表4。模型p<0.05(0.0463),显著可用。由表4可知,MTG比酶活的显著影响因素依次为初始pH、培养温度、诱导温度,其他因素对MTG比酶活影响较小。因此选择以上三个因素进行响应面优化。

表4 PB设计方差分析
注:*表示差异显著(p<0.05);**表示差异极显著(p<0.01),表6同。
2.3BB实验
2.3.1BB设计及结果分析响应面实验设计及结果见表5,利用Design-Expert软件对表5数据进行回归拟合所得方程为:
Y=1.5+0.013A+0.035B-0.093C+0.075AB-0.028AC+0.019BC-0.21A2-0.54B2-0.18C2。
回归方程相关系数R2为0.993,说明方程拟合较好,可用来分析各因素和MTG比酶活间的关系。由表6可知,回归模型极显著(p<0.0001),失拟项不显著(p>0.05),模型可用。对MTG比酶活影响最显著的因素为诱导温度(C),其次为初始pH(B)和培养温度(A)。除培养温度、初始pH与诱导温度交互项(BC)为显著因素外,各因素及其交互作用(B、C、AB、AC、A2、B2、C2)都为极显著性因素。
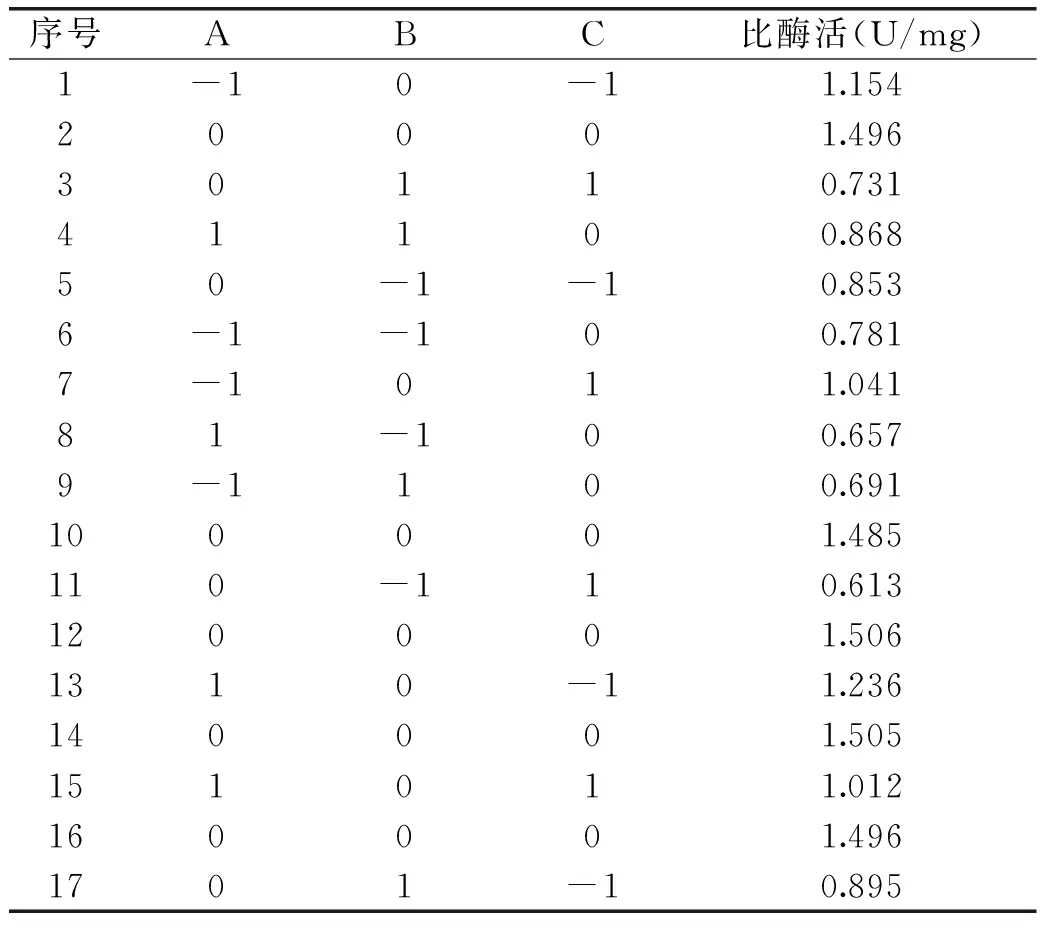
表5 BB实验设计及结果
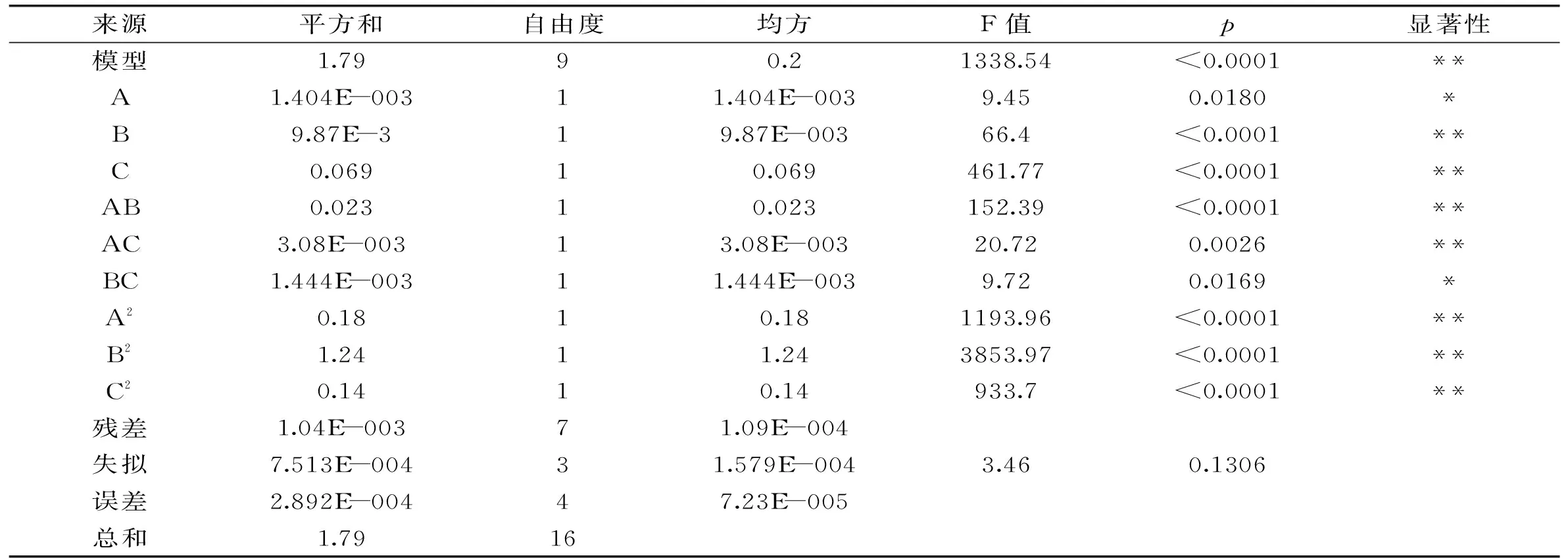
表6 BB设计方差分析
2.3.2各因素间的交互作用初始pH与培养温度、初始pH与诱导温度、培养温度与诱导温度的交互作用对MTG比酶活影响的响应面图见图13。由图可知,响应面陡峭,各因素间交互作用明显。经软件分析计算得当培养温度为33.68 ℃、初始pH为7.02、诱导温度为24.98 ℃时,MTG比酶活的预测值最大,为1.511 U/mg。
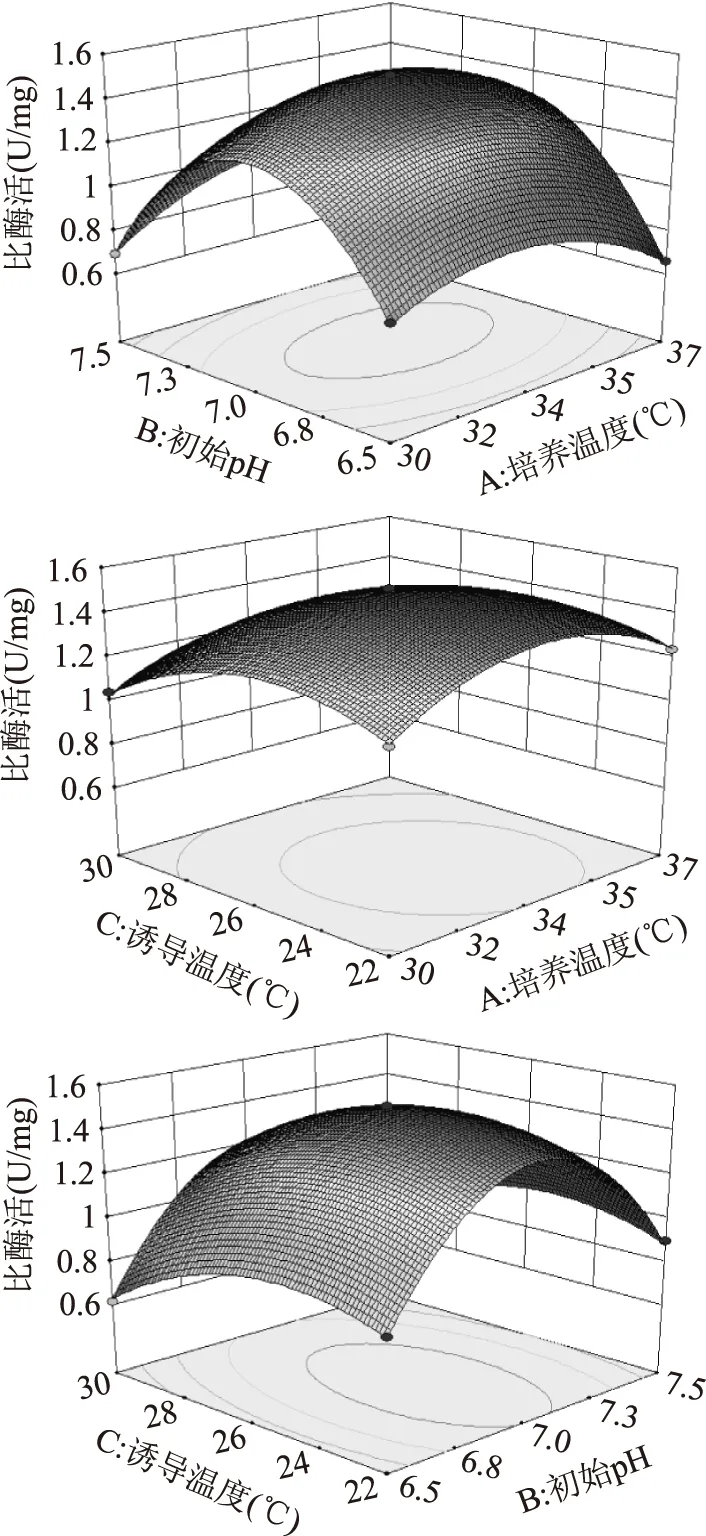
图13 各因素交互作用对MTG比酶活的交互影响Fig.13 Response surface plots of variable parameters on the specific activity of MTG
2.3.3验证实验考虑实际操作的局限性,将上述预测最优条件修正为:培养温度34 ℃、初始pH7.0、诱导温度25 ℃。该条件下所产MTG比酶活为(1.507±0.03)U/mg,与理论值接近,且在95%预测区间[1.44,1.59]内,说明通过响应面分析得到的条件较为可靠,具有一定的实践指导意义。
3 结论
通过单因素实验、Plackett-Burnman设计及Box-Benhnken设计,对重组大肠杆菌产MTG的发酵条件进行了优化。结果表明,最佳发酵条件为:葡萄糖5 g/L,酵母粉28 g/L,蛋白胨14 g/L,接种量5%,装液量50 mL(250 mL三角瓶),初始pH7.0,培养温度34 ℃,诱导时机4 h,IPTG浓度0.6 mmol/L,诱导温度25 ℃,诱导时间14 h。优化后的MTG比酶活为1.507 U/mg,为未优化前的1.56倍。
[1]Yokoyama K,Nio N,Kikuchi Y. Properties and applications of microbial transglutaminase[J]. Appl Microbiol Biotechnol,2004,64(4):447-454.
[2]Gaspar AL,de Góes-Favoni SP. Action of microbial transglutaminase(MTGase)in the modification of food proteins[J]. Food Chem,2015,171:315-322.
[3]Folk JE,Chung SI. Molecular and catalytic properties of transglutaminases[J]. Adv Enzymol Relat Areas Mol Biol,1973,38:109-191.
[4]Serafini-Fracassini D,Del Duca S,Beninati S. Plant transglutaminases[J]. Phytochemistry,1995,40(2):355-365.
[5]Ando H,Adachi M,Umeda K,et al. Purification and characteristics of a novel transglutaminase derived from microorganisms[J]. Agricultural and Biological Chemistry,1989,53(10):2613-2617.
[6]Cui L,Du G,Zhang D,et al. Purification and characterization of transglutaminase from a newly isolatedStreptomyceshygroscopicus[J]. Food Chemistry,2007,105(2):612-618.
[7]de Barros Soares LH,Assmann F,Záchia Ayub MA. Purification and properties of a transglutaminase produced by aBacilluscirculansstrain isolated from the Amazon environment[J]. Biotechnol Appl Biochem,2003,37(3):295-299.
[8]刘松,张东旭,堵国成,等. 微生物谷氨酰胺转胺酶的表达及分子改造研究进展[J]. 生物工程学报,2011,27(12):1681-1689.
[9]李洪波,张兰威,崔艳华,等. 微生物源谷氨酰胺转氨酶基因工程菌株的研究进展[J]. 食品工业科技,2013,34(17):389-394.
[10]Takehana S,Washizu K,Ando K,et al. Chemical synthesis of the gene for microbial transglutaminase fromStreptoverticilliumand its expression inEscherichiacoli[J]. Biosci Biotechnol Biochem,1994,58(1):88-92.
[11]Liu YH,Lin S,Liu K,et al. High-level expression of theStreptomycesmobaraenseCICC 11018 transglutaminase inCorynebacteriumglutamicumATCC 13032[J]. Applied Biochemistry and Microbiology,2014,50(5):456-462.
[12]Yurimoto H,Yamane M,Kikuchi Y,et al. The pro-peptide ofStreptomycesmobaraensistransglutaminase functions in cis and in trans to mediate efficient secretion of active enzyme from methylotrophic yeasts[J]. Biosci Biotechnol Biochem,2004,68(10):2058-2069.
[13]罗宁,杨慧林,沈徐凯,等. 转谷氨酰胺酶酶原在枯草芽孢杆菌WB800中的表达[J]. 现代食品科技,2011,27(7):734-737.
[14]Bae SJ,Kim HS,Hwang YI,et al. Cloning of transglutaminase gene fromStreptomycesplatensisYK-2 and its high expression in Streptomyces strains[J]. Journal of the Korean Society for Applied Biological Chemistry,2012,55(3):417-422.
[15]Crossowicz N,Wainfan E,Borek E. The enzymatic formation of hydroxamic acids from glutamine and asparagines[J]. J Biol Chem,1950,187(1):111-125.
[16]Bradford MM. A Rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[17]黄亚杰,王子辉,赵彦伟,等. 重组大肠杆菌产谷氨酰胺转氨酶培养基及发酵条件优化[J]. 中国酿造,2013,31(4):21-24.
[18]Harrison JS,Keshavarz-Moore E,Dunnill P,et al. Factors affecting the fermentative production of a lysozyme-binding antibody fragment inEscherichiacoli[J]. Biotechnol Bioeng,1997,53(6):611-622.
[19]叶姣,陈长华,夏杰,等. 温度对重组大肠杆菌生长及外源蛋白表达的影响[J]. 华东理工大学学报,2002,28(4):364-367.
[20]赵金星,张梁,顾正华,等. 重组大肠杆菌表达铜绿假单胞菌溶血性磷脂酶C[J]. 微生物学报,2013,53(3):259-268.
Optimization of the fermentation conditions for transglutaminase by recombinantEscherichiacoli
SHU Chang1,LUO Shui-zhong1,2,CAI Jing1,2,JIANG Shao-tong1,2,ZHENG Zhi1,2,*
(1.School of Food Science and Engineering,Hefei 230009,China;2.Key Laboratory for Agricultural Products Processing of Anhui Province,Hefei 230009,China)
The paper investigated the improvement of the production of microbial transglutaminase(MTGase,MTG)by recombinantEscherichiacoliBL21(DE3)/mtg in 250 mL shake flasks. Using single factor experiment,the types and the concentrations of carbon sources and nitrogen sources of the media,the inoculum sizes,the medium volumes,the culture temperature,the initial pH,the inducer concentration,the adding time of inducer,the induction temperature and the induction time were optimized,respectively. Among the above factors,3 key factors,the culture temperature,the initial pH and the induction temperature,were selected by Plackett-Burman design. And a response surface model of the 3 factors and the specific activity of MTG were constructed by Box-Benhnken design. The optimal conditions were as follows,the media contained 5 g/L of glucose,28 g/L of yeast extract and 14 g/L of tryptone,and the bacteria were cultured in 50 mL(250 mL triangle bottle),pH7.0 optimized media at 34 ℃ for 4 h with 5%(v/v)inocula and were induced by 0.6 mmol/L IPTG at 25 ℃ for 14 h. Under the optimal conditions,the maximum specific activity of MTG was 1.507 U/mg,which was 1.56 times larger than the MTG produced in initial conditions.
transglutaminase;recombinantEscherichiacoli;fermentation optimization;response surface method
2016-01-04
舒畅(1992-),女,硕士研究生,研究方向:发酵工程,E-mail:allison_shu@163.com。
郑志(1971-),男,博士,教授,研究方向:谷物科学,E-mail:zhengzhi@hfut.edu.cn。
国家高技术研究发展计划(863计划)(2013AA102201)。
TS201.1
A
1002-0306(2016)12-0183-07
10.13386/j.issn1002-0306.2016.12.027

