人工培养冬虫夏草胞外多糖的分离纯化及组成分析
曾丽萍,张志红,吴素蕊,樊 建,赵天瑞,*
(1.昆明理工大学云南省食品安全研究院,云南昆明 650500;2.中华全国供销合作总社昆明食用菌研究所,云南昆明 650223)
人工培养冬虫夏草胞外多糖的分离纯化及组成分析
曾丽萍1,张志红1,吴素蕊2,樊建1,赵天瑞1,*
(1.昆明理工大学云南省食品安全研究院,云南昆明 650500;2.中华全国供销合作总社昆明食用菌研究所,云南昆明 650223)
将冬虫夏草菌丝体培养液以醇沉法提取多糖,通过DEAE-52纤维素层析柱和SephadexG-100凝胶层析柱分级纯化后得到两种单一的中性多糖组分EPS-1w和EPS-2w。应用紫外分光光度、SephadexG-100凝胶柱层析法和比旋度法鉴定多糖的纯度,凝胶过滤法、理化实验和高效液相色谱研究其相对分子质量、理化性质及组成。结果表明:EPS-1w和EPS-2w为均一组分且易溶于水、稀酸、碱,其平均分子量分别约为4.65×104u和3.48×104u,均主要是由D-甘露糖、D-葡萄糖、D-半乳糖组成,其物质的量比分别为23.7∶6.2∶8.5和35∶3.6∶3.1。
冬虫夏草,多糖,分离纯化,理化性质,组成分析
冬虫夏草[Cordycepssinensis(Berk.)Sacc.]是我国传统的名贵中药材之一,与人参、鹿茸被并称为“中药三宝”,具有补肾益气、止咳化痰、抗疲劳、滋补强壮等功效[1]。冬虫夏草是虫草真菌寄生于蝙蝠蛾科昆虫幼虫上的子座及幼虫尸体上形成的复合体,主要分布于青海、西藏、云南以及甘肃等海拔3000~5100 m的高寒草甸的泥土中[2]。由于受生长条件的限制较大,其资源日渐匮乏,价格也日益增高,如何有效地利用及合理地开发该药材的活性成分成为研究学者们关注的课题。
目前,对于冬虫夏草的活性成分研究主要集中在腺苷、虫草素、虫草多糖和虫草蛋白等方面,其中,多糖作为冬虫夏草中一种重要的活性化合物,是具有一定开发潜力的天然药物化学成分[3]。据报道真菌多糖的药理活性与其结构、相对分子量等有关,一般分子量大于1.6×104u的大分子组分才具有较强的生物活性[4]。针对于冬虫夏草资源的稀缺,人们对其深层发酵的活性成分进行了研究,且大量药理、药化及临床应用表明:人工虫草菌丝体和发酵液与天然冬虫夏草具有相似的化学成分、药理作用和临床疗效[5]。本研究以添加一定量的吲哚乙酸(IAA)的冬虫夏草发酵液为原料提取其胞外多糖[6],通过DEAE-52纤维素层析和SephadexG-100凝胶层析的分级纯化得到EPS-1w和EPS-2w两个中性多糖组分,并结合紫外-可见光谱分析、凝胶过滤、高效液相色谱等方法对其理化性质和单糖的组成进行了探讨,为进一步探究冬虫夏草胞外多糖的开发和利用提供理论基础和技术支持。
1 材料与方法
1.1材料与仪器
冬虫夏草菌由昆明食用菌研究所提供;DEAE-52填料北京索莱宝科技有限公司;SephadexG-100填料北京鼎国昌盛生物技术有限责任公司;D-半乳糖、L-鼠李糖、D-甘露糖、D-阿拉伯糖、D-葡萄糖、D-木糖、D-岩藻糖上海源叶生物科技有限公司;PMP剂(1-苯基-3-甲基-5吡唑啉酮)北京化学试剂公司;其余试剂均为分析纯。
DEAE-52纤维素层析柱(2.6 cm×60 cm)、SephadexG-100层析柱(1.6 cm×80 cm)上海沪西仪器厂;BSZ-100A型自动部分收集器上海青浦沪西仪器厂;ZD-F12型真空冷冻干燥机南京载智自动化设备有限公司;N-1100型旋转蒸发仪上海爱朗仪器有限公司;LXJ-ⅡB型大容量离心机上海安亭科学仪器厂;1260高效液相色谱分析仪美国安捷伦科技有限公司。
1.2实验方法
1.2.1冬虫夏草多糖的分离纯化将培养得到的冬虫夏草菌丝体发酵液离心(5000 r/min,10 min)取上清液,减压浓缩至原体积1/4,并加入3倍体积的乙醇溶液(95%),醇沉(4 ℃,24 h),离心(5000 r/min,10 min)取沉淀,用乙醇溶液(75%)反复洗涤2~3次,离心取沉淀,再用适量超纯水溶解后冻干备用,即得发酵液粗多糖[7]。具体路线见图1。

图1 冬虫夏草多糖分离纯化的步骤Fig.1 Process for the separation and purification of Cordyceps sinensis polysaccharides
1.2.2冬虫夏草菌丝体发酵液中多糖的分离纯化
1.2.2.1DEAE-52纤维素层析柱纯化取50 mg已脱除蛋白[8]的胞外多糖溶于5 mL超纯水中,以4000 r/min离心10 min后将多糖溶液过0.45 μm微孔滤膜,再用滴管将过滤后的多糖溶液沿壁缓慢地加入平衡好的DEAE纤维素-52色谱柱中。分别用超纯水、0.3、0.5 mol/L的NaCl溶液进行洗脱,以1.0 mL/min流速,每管收集8 min。用苯酚-硫酸法[9]在490 nm波长下跟踪检测,直至检测不到糖组分的流出,收集合并主峰的洗脱液,绘制洗脱曲线。将超纯水洗脱部分浓缩后透析,冷冻干燥,备用。
1.2.2.2SephadexG-100色谱柱进一步纯化将DEAE-52纤维素柱层析分级得到的胞外多糖25 mg溶于5 mL超纯水中,后用滴管将多糖溶液沿壁缓慢地加入平衡好的SephadexG-100色谱柱中,用蒸馏水以流速1.0 mL/min,每管10 min自动收集洗脱组分。用苯酚-硫酸法在490 nm波长下跟踪检测,直至检测不到糖组分的流出,收集合并主峰的洗脱液,绘制洗脱曲线。收集相应组分冻干。
1.2.3纯度鉴定将经过DEAE-52纤维素层析柱和SephadexG-100凝胶层析柱两次逐步纯化后得到多糖组分,结合紫外分光光度法、SephadexG-100凝胶柱层析法和比旋度法检测多糖组分纯度。
1.2.4分子质量的测定[10]取5 mg蓝色葡聚糖溶于适量体积的0.1 mol/L NaCl溶液中,过SephadexG-100层析柱,以0.1 mol/L NaCl溶液,洗脱速度0.2 mL/min进行洗脱,用苯酚-硫酸法测糖含量,得外水体积V0。采用同样条件,用已知分子量的T系列葡聚糖(T10、T40、T70、T100、T500)各5 mg过柱子,分别得到相应的洗脱体积Ve,并根据柱直径(1.6 cm)和凝胶柱床高度(68 cm),计算柱床体积Vt,以Kav[其中,Kav=(Ve-V0)/(Vt-V0)]为横坐标,lgM为纵坐标绘制标准曲线。
1.2.5冬虫夏草多糖纯品理化指标的测定将纯化过的多糖通过一系列的实验对其溶解性[11-12](水、丙酮、甲醇、稀酸、稀碱、乙醚、二甲基亚砜、氯仿)、碘-碘化钾反应[13]、菲林试剂反应[14]、三氯化铁反应[15]、双缩脲反应[16]性质进行研究。
1.2.6HPLC分析单糖的组成[17]称取10 mg各种单糖标品,将其溶于5 mL纯净水中。将单糖溶液,0.5 mol/L的PMP溶液,0.3 mol/L的NaOH溶液各吸取1 mL混匀,70 ℃衍生反应30 min,冷却后加入1 mL 0.3 mol/L的HCl溶液中和。加入氯仿和水各3 mL,混合摇匀,待分层后弃去氯仿层,反复萃取3次至上层水相无色为止。再将水相过0.45 μm有机滤膜,用于HPLC分析。
取多糖10 mg于安瓿瓶中,再加入1 mL 2 mol/L的三氟乙酸溶液,用酒精喷灯封管后,于110 ℃水解4 h,取出后冷却,用0.3 mol/L的NaOH溶液调至中性,定容至10 mL,5000 r/min离心10 min,分别取上清液,0.5 mol/L的PMP溶液,0.3 mol/L的NaOH溶液各1 mL混匀,于70 ℃衍生30 min,冷却后加入1 mL 0.3 mol/L的HCl溶液中和。加入氯仿和水各3 mL,混合摇匀,待分层后弃去氯仿层,反复萃取3次至上层水相无色为止。再将水相过0.45 μm有机滤膜,用于HPLC分析。
1.3数据统计
实验数据的处理统计使用Oringin8.5软件。
2 结果与分析
2.1冬虫夏草多糖的分离纯化
2.1.1DEAE-52纤维素柱层析以超纯水、0.1、0.3、0.5 mol/L的NaCl溶液进行梯度洗脱后,分别得到3个峰,收集2个较大峰,经浓缩、透析、冻干后得白色絮状多糖。由图2可知,通过DEAE-52纤维素柱的分级纯化,先后可洗脱出3种多糖组分,分别命名为EPS-w,EPS-1s,EPS-2s。由于DEAE-52为阴离子交换柱,因此,用超纯水洗脱时,中性多糖会随超纯水首先被洗脱下来,而酸性多糖将会被吸附于介质上,需使用具有更强电荷性质的NaCl溶液才能将其洗脱下来。由此可知,EPS-w为中性多糖,EPS-1s和EPS-2s为酸性多糖。据报道[18]中性多糖活性高于酸性多糖的活性,且EPS-w为冬虫夏草胞外多糖的主要组分之一,所以选EPS-w做后续的进一步研究。
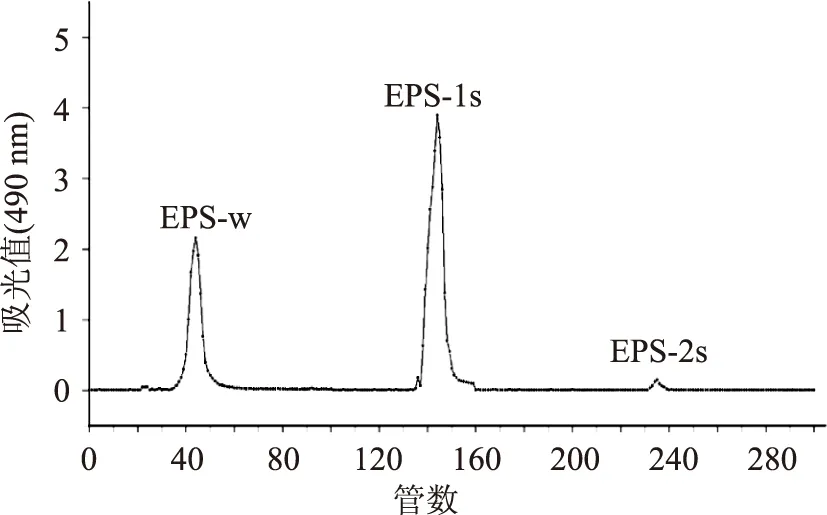
图2 冬虫夏草发酵液胞外多糖DEAE-52纤维素柱层析洗脱曲线Fig.2 The elution profile of exopolysaccharidesfrom cultured Cordyceps sinensis on DEAE-52
2.1.2SephadexG-100凝胶柱层析通过SephadexG-100凝胶柱层析对EPS-w进一步纯化。由图3可知,通过SephadexG-100凝胶柱对EPS-w进行纯化后,先后可洗脱出2种多糖组分,分别命名为EPS-1w(管号19~40),EPS-2w(管号58~75),说明EPS-w并不是单一组分,再通过纯度鉴定EPS-1w与EPS-2w是否为单一组分。

图3 EPS-w的SephadexG-100凝胶柱层析洗脱曲线Fig.3 The elution profile of EPS-w on SephadexG-100 column chromatography
2.2EPS-1w与EPS-2w的纯度鉴定
2.2.1紫外-可见光谱分析分别称取适量的EPS-1w与EPS-2w,并配制成2 mg/mL的水溶液,用超纯水调零,在190~700 nm波长范围内进行紫外扫描,由图4可知,EPS-1w和EPS-2w在280 nm和260 nm处没有吸收峰,说明EPS-1w和EPS-2w溶液中均不含蛋白质和核酸类物质;在620 nm处没有吸收峰,说明不含色素类物质。

图4 EPS-1w和EPS-2w的紫外-可见光扫描图Fig.4 UV spectrum of EPS-1w and EPS-2w
2.2.2SephadexG-100凝胶柱层析法分别称取EPS-1w和EPS-2w各25 mg,溶于5 mL超纯水中,注入SephadexG-100凝胶柱中,用超纯水进行洗脱,采用苯酚-硫酸法跟踪检测,绘制洗脱曲线如图5所示。

图5 SephadexG-100柱层析纯度检验图Fig.5 SephadexG-100 column chromatography注:A、B分别表示EPS-1w和EPS-2w。
由图5(A)、(B)可知,EPS-1w和EPS-2w均为单一对称峰,表明EPS-1w和EPS-2w在分子量组成上也是均一的。
2.2.3比旋度法在相同条件下,用自动数显旋光仪分别对EPS-1w和EPS-2w分级沉淀物水溶液的旋光度进行测定,结果如表1所示。

表1 EPS-w和EPS-2w分级沉淀物的比旋光度
比旋度是均一分子量多糖的特征指数之一,其值具有唯一性[19]。因此,不同浓度乙醇沉淀出的多糖组分,如果具有相同的比旋度,那么就证明该多糖组分为均一组分。由表1可知,EPS-1w和EPS-2w在25%、50%和80%浓度乙醇的比旋光度基本相同,表明EPS-1w和EPS-2w为相对均一的多糖组分,且比旋光度为分别为+28.6 °和+35.7 °。
综上所述,经紫外光谱、凝胶层析法和比旋光度等方法分析表明纯化后的冬虫夏草胞外多糖组分EPS-1w和EPS-2w为相对均一多糖。
2.3EPS-1w和EPS-2w分子质量测定分析
T系列葡聚糖的标准曲线如图6所示,根据EPS-1w和EPS-2w各自的洗脱体积Ve(分别为132.1、133.9 mL)代入回归方程:y=-1.278x+5.6305(R2=0.9709)得二者的平均分子量分别约为4.65×104u和3.48×104u。这与闫景坤[20]测得的冬虫夏草胞外多糖EPS-1A的平均分子质量4×104u(由高效凝胶渗透色谱法测得)和龚敏[21]测得的冬虫夏草胞外多糖CS-81002的平均分子量4.3×104u(由凝胶过滤法测得)相接近,但与于春秀[22]测得的冬虫夏草胞外多糖EPS-1a的平均分子量4.16×105u(由凝胶过滤法测得)具有较大差别,这可能是由于冬虫夏草多糖的提取、纯化方法等因素的影响。

图6 分子量标准曲线Fig.6 The standard curve of mormal molecular weight
2.4理化性质分析
通过理化实验分析可知,多糖EPS-1w和EPS-2w均为白色絮状固体,无异味,易溶于水、稀酸、碱,不溶于氯仿、甲醇、二甲基亚砜、乙醚和丙酮等有机试剂,热稳定性良好;碘化反应不显蓝色,表明此多糖为非淀粉类;与斐林试剂和三氯化铁反应均为阴性,表明不含有单糖和多酚类物质;考马斯亮蓝反应和260 nm吸收反应均为阴性,表明可能不含有糖醛酸、蛋白质和核酸类物质。
2.5单糖组成
将EPS-1w和EPS-2w用TFA水解成单糖,通过PMP进行衍生,得到的衍生物用HPLC进行分析,结果分别如图7、8、9所示。

图7 单糖标准品的HPLC图Fig.7 The HPLC profile of monosaccharide standards注:1,D-甘露糖;2,L-鼠李糖;3,D-葡萄糖;4,D-半乳糖;5,D-木糖;6,D-阿拉伯糖;7,D-岩藻糖;图8、图9同。
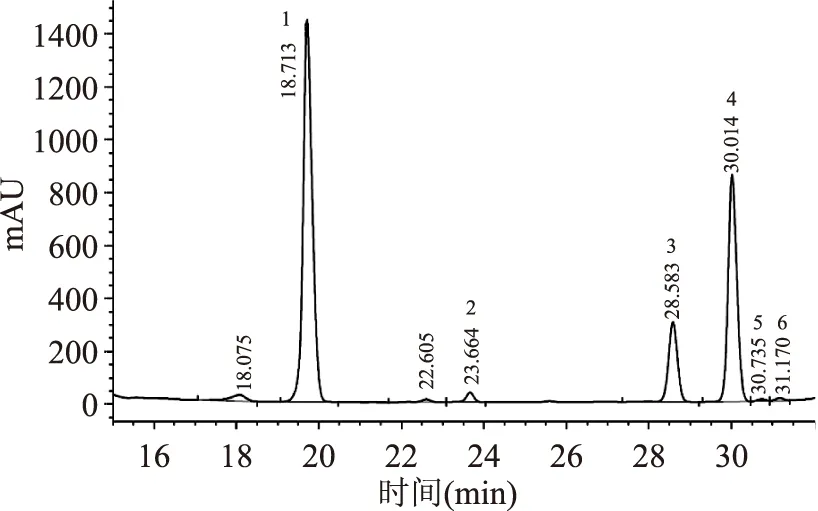
图8 EPS-1w的高效液相色谱图Fig.8 The HPLC profile of EPS-1w

图9 EPS-2w的高效液相色谱图Fig.9 The HPLC profile of EPS-2w
经HPLC结果表明,EPS-1w和EPS-2w均主要由D-甘露糖、D-葡萄糖以及D-半乳糖组成,并含有少量的L-鼠李糖、D-木糖以及D-阿拉伯糖;根据各单糖衍生物的峰面积可计算出二者的D-甘露糖:D-葡萄糖:D-半乳糖分子摩尔比分别为23.7∶6.2∶8.5和35∶3.6∶3.1,EPS-2w较EPS-1w具有更高含量的D-甘露糖。由以上的实验结果可知,EPS-1w与EPS-2w的主要单糖组分,且葡萄糖的含量相对较低,这与于春秀[22]、李晓明[23]及龚敏[21]等人研究结果较为接近;但闫景坤[20]分析有所差异,其结果分析葡萄糖占比例较大。
3 结论
3.1通过DEAE-52离子交换和ScphadexG-l00凝胶过滤将醇沉法提取的冬虫夏草发酵液中的多糖进行分级纯化,得到两种中性多糖组分EPS-2w、EPS-1w。经紫外光谱扫描、SephadexG-100凝胶柱层析法和比旋度法结合分析可知EPS-1w和EPS-2w都是均一多糖。
3.2通过对EPS-1w和EPS-2w的理化性质分析,均为白色絮状固体,无异味,且都易溶于水、稀酸、碱,不溶于氯仿、甲醇、二甲基亚砜、乙醚和丙酮等有机试剂,表明不含蛋白质、淀粉、核酸、酚类以及还原糖,具有真菌多糖的典型性质。
3.3经分析EPS-1w和EPS-2w的分子量分别为4.65×104u和3.48×104u;二者的单糖组分相同,主要由D-甘露糖、D-葡萄糖以及D-半乳糖组成,并含有少量的L-鼠李糖、D-木糖以及D-阿拉伯糖;但二者的单糖分子摩尔比分别为D-甘露糖∶D-葡萄糖∶D-半乳糖=23.7∶6.2∶8.5和35∶3.6∶3.1。
[1]黄奕诚,陈雪香,贺丽苹,等. 蛹虫草多糖的纯化及其分子量的测定[J]. 现代食品科技,2012,28(8):1054-1057.
[2]许峰,吴玲芳,林善,等. 发酵冬虫夏草菌丝体中虫草多糖含量的检测及结构鉴定[J]. 基因组学与应用生物学,2014,33(6):1294-1302.
[3]朱蕴兰,陈宏伟,张城. 富硒蛹虫草胞内多糖对自由基的清除作用[J]. 农业工程,2011,1(3):53-57.
[4]Das S K,Masuda M,Sakurai A,et al. Medicinal uses of the mushroom Cordyceps militaris:Current state and prospects[J]. Fitoterapia,2010,81(8):961-968.
[5]吴彩琴,陈野,郝迎. 冬虫夏草液体发酵生产多糖和菌丝体的研究[J]. 食品科学,2009,30(5):171-174.
[6]张志红,吴素蕊,邰丽梅,等. 吲哚乙酸对冬虫夏草生物量、胞外多糖产量及其抗氧化性能的影响[J]. 食品工业科技,2015,36(12):181-184.
[7]朱朝阳,刘高强,旷思敏,等. 冬虫夏草真菌产胞外多糖发酵条件的优化[J]. 食品科技,2013(5):18-21.
[8]Staub A M. Removal of protein-Sevage method[J]. Methods in Carbohydrate Chemistry,1976,5:5-6.
[9]张居作,许巧玲,徐君飞. 苦瓜多糖含量的苯酚硫酸法检测研究[J]. 食品研究与开发,2015,36(5):82-85.
[10]颜军,易勇,邬晓勇,等. 黄芪多糖的相对分子量测定及单糖组成分析[J]. 食品科技,2012,37(12):278-283.
[11]Chen R,Xue M,Chen W,et al. Evaluation of the physicochemical properties and antioxidant activities of polysaccharides from Semen Euryales[J]. Journal of Chinese Pharmaceutical Sciences,2014,23(8):578-587.
[12]赵海宁. 大黄多糖的分级纯化及结构研究[D]. 上海:华东理工大学,2011.
[13]刘芳,陈贵堂,胡秋辉,等. 金针菇锌多糖分离纯化及其结构特征[J]. 食品科学,2014,35(5):1-7.
[14]王卫国,吴强,胡宝坤,等. 几种测定灰树花多糖中蛋白质含量方法的比较研究[J]. 中国食用菌,2003,22(1):27-30.
[15]王昂,王丽丽,仪宏,等. 茚三酮比色法测定谷氨酸含量的研究[J]. 中国调味品,2005,8(8):50-52.
[16]Yang W,Pei F,Shi Y,et al. Purification,characterization and anti-proliferation activity of polysaccharides from Flammulina velutipes[J]. Carbohydrate Polymers,2012,88(2):474-480.
[17]戴军,朱松,汤坚,等. PMP柱前衍生高效液相色谱法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报,2007,26(2):206-210.
[18]焦中高. 红枣多糖的分子修饰与生物活性研究[D].杨凌:西北农林科技大学,2012.
[19]Valachovic P,Pechovu A,Mason TJ. Towards the industrial production of medicinal tincture by ultrasound assisted extraction[J]. Ultrason Sonochem,2001,8(2):111-117.
[20]闫景坤. 抗氧化新型冬虫夏草多糖的制备、结构与溶液特征研究[D]. 广州:华南理工大学,2010.
[21]龚敏,朱勤,王彤,等. 冬虫夏草多糖的分子结构与免疫活性[J]. 生物化学杂志,1990,6(6):486-492.
[22]于春秀. 一种虫草胞外多糖的研究[D]. 合肥:安徽农业大学,2002.
[23]李晓明,戴乳琴,朱勤. 冬虫夏草菌发酵液多糖的组分分析[J]. 中国中药杂志,1989,14(2):31-33.
Isolation,purification and composition analysis of extracellular polysaccharide from culturedCordycepssinensis
ZENG Li-ping1,ZHANG Zhi-hong1,WU Su-rui2,FAN Jian1,ZHAO Tian-rui1,*
(1.Yunnan Institute of Food Safety,Kunming University of Science and Technology,Kunming 650500,China; 2.Kunming Edible Fungi Institute of All China Federation of Supply of Marketing Cooperative,Kunming 650223,China)
In the research,the polysaccharide fromCordycepssinensis’ mycelium culture had been extracted by alcohol sinking method. After been fractionated and purified with DEAE-52 cellulose column chromatography and SephadexG-100 gel column chromatograph,two neutral polysaccharides were obtained which named EPS-1w and EPS-2w. UV-spectrophotometry,SephadexG-100 gel column chromatograph method and specific optical rotation method were used to identify the purity of these two polysaccharides. And the gel filtration method and physical and chemical experiments as well as high performance liquid chromatography had been used for analyzing the polysaccharides’ relative molecular mass,physical and chemical characters and compositions. The results showed that both of EPS-1w and EPS-2w were homogeneous components,and they could be dissolved in the water,dilute acid and alkali. Their average relative molecular mass was about 4.65×104u and 3.48×104u. The EPS-1w and EPS-2w were composed by D-mannose,D-glucose,D-galactose,and the amount of substance were 23.7∶6.2∶8.5 and 35:3.6:31.
Cordycepssinensis;polysaccharide;purification;physicochemical property;composition analysis
2015-09-10
曾丽萍(1990-),女,硕士研究生,研究方向:食品科学与工程,E-mail:825767453@qq.com。
赵天瑞(1964-),男,副教授,研究方向:食品科学与工程,E-mail:food363@163.com。
国家科技支撑科技课题(2013BAD16B01)。
TS201.2
A
1002-0306(2016)10-0127-05
10.13386/j.issn1002-0306.2016.10.016

