星形细胞瘤组织中PCNA、HMGB1的表达观察
韦迪岱,陈晋,郑文明
(三亚市人民医院,海南三亚 572000)
星形细胞瘤组织中PCNA、HMGB1的表达观察
韦迪岱,陈晋,郑文明
(三亚市人民医院,海南三亚 572000)
目的观察星形细胞瘤组织中增殖细胞核抗原(PCNA)和高迁移率族蛋白B1(HMGB1)的表达变化。方法采用免疫组化SP法检测70例份星形细胞瘤组织(肿瘤组)和20例份癌旁正常组织(癌旁组)PCNA、HMGB1,分析两指标间及其与星形细胞瘤临床病理参数的关系。结果肿瘤组及癌旁组PCNA阳性表达率分别为90.0%、45.0%,HMGB1阳性表达率分别为72.9%、0,两组比较,P均<0.05。PCNA、HMGB1表达均与星形细胞瘤病理分级有关(P均<0.05)。星形细胞瘤组织中PCNA与HMGB1表达呈正相关(r=6.82,P<0.05)。PCNA阳性、阴性表达者生存期分别为(21.27±7.15)、(33.47±4.61)个月,HMGB1阳性、阴性表达者生存期分别为(20.58±6.33)、(35.18±4.55)个月,两者比较,P均<0.05。结论星形细胞瘤组织中PCNA、HMGB1的表达升高,并与星形细胞瘤病理分级有关,阳性表达者预后差。
星形细胞瘤;高迁移率族蛋白B1;增殖细胞核抗原
星形细胞瘤是中枢神经系统常见肿瘤之一,根据其恶性程度可分为星形细胞瘤(WHOⅡ级)、间变型星形细胞瘤(WHO Ⅲ级)和胶质母细胞瘤(WHO Ⅳ级)。大量实验表明,星形细胞瘤的病理过程与肿瘤的增殖、侵袭性相关[1]。增殖细胞核抗原(PCNA)是一种核蛋白,与细胞的增殖状态密切相关,可作为反映肿瘤细胞增殖程度与判断预后的指标[2]。高迁移率族蛋白B1(HMGB1)是一种细胞因子,研究认为其参与了部分肿瘤的增殖、生长、浸润与转移。本研究观察了星形细胞瘤组织中PCNA、HMGB1的表达变化,并探讨其意义。
1 资料与方法
1.1临床资料收集2010年5月~2014年6月三亚市人民医院收治的颅内原发星形细胞瘤患者70例,男46例,女24例;年龄29~74(48.6±13.2)岁,其中≤40岁31例,>40岁39例;肿瘤直径≤4 cm 24例,>4 cm 46例;按WHO 2007中枢神经系统肿瘤分类标准[3],Ⅰ、Ⅱ级23例,Ⅲ级26例,Ⅳ级21例。所有患者均经病理证实且术前均未行放化疗。手术留取原发星形细胞瘤组织70例份(肿瘤组),另取20例份癌旁正常组织作为对照(癌旁组)。
1.2PCNA、HMGB1检测方法采用免疫组化SP法。收集石蜡包埋的组织标本,常规切片(厚4~5 μm)、脱蜡,蒸馏水漂洗3遍,加入5%BSA,4 ℃条件下放置30 min,分别加入一抗4 ℃条件下过夜,次日冲洗后加入二抗,DBA显色,苏木素复染,脱水、透明、封片后镜检。PBS代替一抗作为阴性对照,已知抗体阳性标本作为阳性对照。结果判定标准:HMGB1阳性染色为细胞质内出现棕色细小颗粒,PCNA阳性染色为细胞核内出现棕黄色乃至棕褐色颗粒。每一张星形细胞瘤切片选取连续的10个高倍视野(400×),每个视野计数200个细胞,分别统计其中的所有阳性细胞,计算阳性率。
1.3统计学方法采用SPSS19.0统计软件。计数资料比较采用χ2检验,相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1两组PCNA、HMGB1表达比较肿瘤组及癌旁组PCNA阳性表达率分别为90.0%(63/70)、45.0%(9/20),HMGB1阳性表达率分别为72.9%(51/70)、0,两组比较,P均<0.05。
2.2PCNA、HMGB1表达与星形细胞瘤临床病理参数的关系结果见表1。由表1可知,PCNA、HMGB1表达均与星形细胞瘤病理分级有关(P均<0.05)。
2.3星形细胞瘤组织中PCNA与HMGB1表达的相关性星形细胞瘤组织中PCNA与HMGB1表达呈正相关关系(r=6.82,P<0.05)。
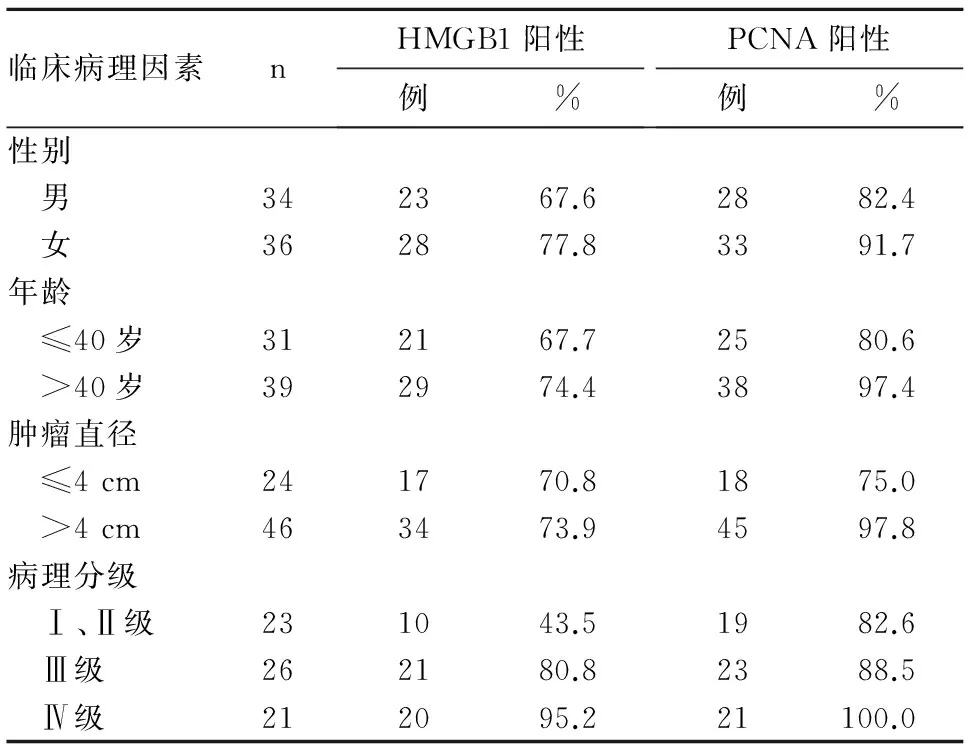
表1 PCNA、HMGB1表达与星形细胞瘤临床病理参数的关系
2.4PCNA、HMGB1表达与星形细胞瘤患者预后的关系所有患者随访2 a以上。PCNA阳性、阴性表达者生存期分别为(21.27±7.15)、(33.47±4.61)个月,HMGB1阳性、阴性表达者生存期分别为(20.58±6.33)、(35.18±4.55)个月,两者比较,P均<0.05。
3 讨论
星形细胞瘤是常见的恶性脑肿瘤之一,恶性程度及病死率高。星形细胞瘤的典型特征为肿瘤侵袭性及转移,目前认为一些细胞调节因子及生物活性介质在其中发挥至关重要的作用。大量临床试验表明,高表达侵袭性生物因子的患者预后较差。因此,寻找一个星形细胞瘤新的基因治疗靶点尤为重要。
PCNA是一种S期细胞核内大量表达的核蛋白之一,在DNA的合成调控中发挥至关重要的作用[4]。细胞无限增殖被认为是肿瘤发生机制之一,肿瘤细胞的增殖活性与肿瘤的浸润、转移和预后密切相关[5]。有研究[6,7]表明,正常胃黏膜组织PCNA不表达,而胃癌组织中PCNA呈高表达,分化程度越低,含量越高。本研究显示,肿瘤组PCNA阳性表达率高于癌旁组,PCNA表达与星形细胞瘤病理分级有关,PCNA阳性表达者生存期短于阴性表达者。
HMGB1是一种细胞因子,研究[8]认为其参与了肿瘤的增殖、生长、浸润与转移。近年大量研究[9~12]证实,HMGB1与胃癌、结直肠癌、胰腺癌的侵袭及淋巴、血液转移相关。HMGB1在多种肿瘤和未成熟细胞中表达丰富,趋化作用可被其诱导产生,参与肿瘤细胞转移。本研究显示,肿瘤组HMGB1阳性表达率高于癌旁组,HMGB1表达与星形细胞瘤病理分级有关,HMGB1阳性表达者生存期短于阴性表达者。我们推测,可能与HMGB1通过Ras、MAPK途径,促使MAPKs磷酸化,进而激活NF-κB,而NF-κB是一种重要的核转录因子,存在于真核细胞中,其与基因上启动子区的固定核苷酸序列结合启动基因转录,从而完成细胞增殖与分化、肿瘤形成与转移等一系列重要生物学功能[13]。
综上,星形细胞瘤组织中PCNA、HMGB1的表达升高,并与星形细胞瘤病理分级有关,阳性表达患者预后差。
[1] 李婷梁,颖莉,余力.脑胶质瘤组织中血管生成拟态的表达及临床意义[J].中华神经医学杂志,2014,13(9):929-933.
[2] 陆晓峰,陈刚.胃癌组织中PCNA、COX-2、p53及EGFR的表达及其与预后的关系[J].山东医药,2012,52(41):39-41.
[3] Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007,114(2):97-109.
[4] 赵鲁笳,邢广莹,王美华,等.进展期胃癌P53蛋白和PCNA/cyclin的表达[J].大连医科大学学报,2011,33(3):220.
[5] 魏昕,杨举伦.Ki-67和PCNA表达与乳腺癌及乳腺癌化疗敏感性的关系[J].中国免疫学杂志,2014,11(30):1549-1551.
[6] 宋国智,李利敏.人脑胶质瘤中PCNA的表达及临床意义[J].脑与神经疾病,2012,20(2):133-136.
[7] Kayaselcuk F, Zorludemir S, Gumurduhu D, et al. PCNA and Ki 67in centralnervous system tumors: correlation with the histologicaltype and grade[J]. J Neurooncol, 2002,57(5):115-121.
[8] 刘辉,姚咏明,丁丽华,等.活化T细胞核因子2可介导高迁移率族蛋白B1促进白细胞介素-2转录表达[J].中华实验外科杂志,2010,27(7):1425-1428.
[9] 苏卫民,毕明宏.HMGB1/MMP9在非小细胞肺癌中的表达及临床意义[J].临床肺科杂志,2012,17(8):1463-1465.
[10] 张世栋,徐美林.HMGB1和NF-KBp65在非小细胞肺癌组织中的表达及意义[J].山东医药,2011,51(8):17-19.
[11] 高宝全,李延青,李文捷,等.胰腺癌HMGBI表达及其与血行转移的关系研究[J].中华胰腺病杂志,2008,8(5):308-311.
[12] 贺小燕,王海琳,陈晓红,等.HMGB1在卵巢癌中的表达及临床意义[J].现代生物医学进展,2011,11(4):695-697.
[13] 黄立锋,李金凤,姚咏明,等.黄芪甲苷对体外高迁移率族蛋白B1介导小鼠调节性T细胞免疫功能的影响[J].国际中医中药杂志,2014,36(10):889-893.
10.3969/j.issn.1002-266X.2016.15.017
R739.41
B
1002-266X(2016)15-0050-02
2015-09-06)

