399株医院真菌感染的分布特点及耐药性分析
徐新民 李 敏 李瑞红 张 燕 陆 瑶 王慧珠
(首都医科大学附属北京地坛医院检验科,北京 100015)
· 检验医学与临床 ·
399株医院真菌感染的分布特点及耐药性分析
徐新民李敏李瑞红张燕陆瑶王慧珠*
(首都医科大学附属北京地坛医院检验科,北京 100015)
目的了解本院临床常见真菌的种类及常用抗真菌药物的耐药情况,为临床合理使用抗真菌药物提供依据。方法对2014年1月至2015年12月临床采集的标本进行真菌分离培养,采用科玛嘉念珠菌显色培养基及API 20C AUX酵母菌鉴定试剂盒进行真菌鉴定,ATB Fungus 3药敏试剂盒进行药敏试验,统计分析菌种的构成及其对5种抗真菌药物的敏感率。结果共收集培养得到399株真菌,标本类型以尿液为主,念珠菌中以白色假丝酵母菌为主,共188株,占47.1%;丝状真菌中以烟曲霉菌为主,共25株,占6.3%。白色念珠菌对抗真菌药物的敏感性较好,大部分在95%以上,但光滑念珠菌对唑类药物敏感性相对较低,对氟康唑的敏感性只有65.1%。曲霉菌对两性霉素B、伊曲康唑和伏立康唑均有着较高的敏感性。结论医院真菌感染以白色念珠菌为主,两性霉素B和5-氟胞嘧啶对其有较高的抗菌活性;光滑念珠菌对唑类药物有较高的耐药性,临床应根据药敏结果合理使用抗真菌药物。
医院真菌;药物敏感试验;菌群分布
近几年,医院内真菌感染的发病率逐年增高[1],尤其针对免疫力低下患者。随着大量广谱抗菌药物以及免疫抑制剂的使用,条件致病性真菌感染已成为医院感染的重要因素[2]。现对首都医科大学附属北京地坛医院近两年真菌感染的分布特点以及药敏结果进行分析,为临床早期诊断及合理用药提供科学依据。
1 材料与方法
1.1标本来源
2014年1月至2015年12月住院及门诊患者送检的痰、尿液、咽拭子、血液、脑脊液、胆汁、胸腹水、肺泡灌洗液及各种分泌物等不同类型标本中分离出的399株酵母样真菌及丝状真菌。
1.2仪器和试剂
法国生物梅里埃公司的血琼脂平板、沙保罗琼脂培养基、API 20 C AUX酵母菌鉴定试剂盒、ATB Fungus 3药敏试剂条和E-Test试剂条。科玛嘉显色培养基和棉兰染色液为自制。
1.3分离和鉴定
将临床送检标本严格按照《全国临床检验操作规程》[3]进行,培养后挑取可疑菌落进行革兰染色,镜检见到酵母样真菌孢子后,挑取单个菌落接种于科玛嘉显色培养基,通过呈现出的不同颜色确定菌种类型。对于显色不明显的菌种用API 20 C AUX酵母菌鉴定试剂条进一步鉴定。丝状真菌的鉴定主要根据菌体形态特征,主要包括菌落形态和镜下形态。
1.4药敏试验
将分离出的酵母样真菌制备成2.0麦氏单位的菌悬液,取其20 μL加入到ATB F2培养液中,混匀后取135 μL加入 ATB Fungus 3药敏试剂条中每个凹状的药敏孔中,置于35 ℃温箱中,24 h或48 h判读结果,判读标准按照说明书进行。丝状真菌采用E-Test药敏试纸条法。所有药敏结果根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) M27-A3和ATB Fungus 3建立的折点判读,将受试菌分为敏感、中介或者耐药。
1.5质量控制
质控菌株为白色念珠菌 ATCC 64500,由国家卫生和计划生育委员会临床检验中心提供。
2 结果
2.1真菌在临床科室的分布及构成比
真菌检出率占前5位的临床科室分别为重症监护室(intensive care unit, ICU) (107株,26.82%)、感染一科(87株,21.80%)、呼吸科(37株,9.27%)、感染二科(24株,6.02%)和内五科(18株,4.51%)。
2.2真菌菌株的标本来源及构成
标本类型以尿液和痰液为主,共检出399株真菌,包括酵母样真菌371株(92.3%)和丝状真菌28株(7.0%),其中白色念珠菌检出最多,共188株,占47.1%。各菌株的标本来源及构成详见表1。
2.3药敏试验结果
对399株真菌中主要的5种真菌进行药敏分析,结果显示,白色念珠菌对抗真菌药物的敏感性大部分在95%以上,光滑念珠菌对唑类药物敏感性相对较低,尤其对氟康唑,敏感性只有65.1%, 对5-氟胞嘧啶和两性霉素B敏感性较好,分别为94.1%和98.2%。5-氟胞嘧啶对新型隐球菌和热带念珠菌的敏感性均为100%。曲霉菌对两性霉素B、伊曲康唑和伏立康唑的敏感性约为90%,详见表2。

表1 399株真菌感染的标本来源及真菌构成
CSF: cerebrospinal fluid; BALF: bronchoalveolar lavage fluid.
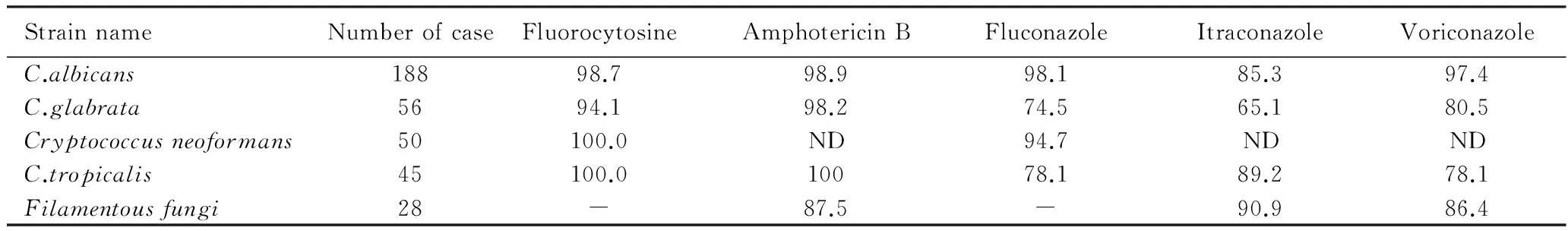
表2 主要真菌对5种抗真菌药物的敏感率
ND:no definition.
3 讨论
真菌广泛存在于人体皮肤黏膜、呼吸道、肠道等处,属于条件致病菌,当机体免疫力下降或者抗生素过度使用导致菌群失调时就会致病。研究[4-5]显示呼吸道真菌感染在各种深部真菌感染中居于首位,并且以酵母样真菌为主。
本院真菌送检科室最多的是ICU、感染科和呼吸科,占57%左右。另外,399株真菌中以念珠菌(371株,93.0%)为主,最主要的是白色念珠菌(188株,47.1%),与国内研究[4-6]基本一致,其次为光滑念珠菌(56株,15.0%)和新型隐球菌(50株,12.5%),新型隐球菌检出率高于其他医院[5],这可能与本院艾滋病患者较多有关。从病原菌的来源来看,以尿液最多,共149株,占37.3%,其次为痰液和脑脊液。值得注意的是,除了脑脊液标本中以新型隐球菌为主外,其他所有标本类型中,均以白色念珠菌为主。这可能与该菌对宿主细胞黏附性较强有关,并且白色念珠菌广泛分布于自然界,通常不致病,但当机体免疫力下降或长期使用广谱抗菌药物、激素、免疫抑制剂、化学药物治疗等时,易引起白色念珠菌的继发感染。光滑念珠菌为人体的一种腐生菌,可致泌尿生殖道感染,本研究从尿液中分离的也最多[7]。有报道[8]显示其会引起心脏、肺的深部感染,偶可致败血症、骨髓炎,是新生儿的条件致病菌。但近年来光滑念珠菌的耐药性有递增的趋势,Pfaller等[9]曾对念珠菌进行了全球最大规模的药敏实验,结果显示,光滑念珠菌对不同的抗真菌药物均存在不同程度的广泛耐药情况,对氟康唑耐药最为严重,总体来看,光滑念珠菌对药物的耐药性与年龄呈负相关。新型隐球菌通常经呼吸道侵入体内,再经血液传播至中枢神经系统,也经常侵犯肺、皮肤、骨骼等,机体免疫力低下者,如实体器官移植者、艾滋病患者都存在高风险的隐球菌感染[10-11],并且有着较高的感染病死率。除了酵母样真菌外, 笔者还分离出了28株丝状真菌,包括烟曲霉菌25株(6.3%), 黄曲霉菌2株(0.51%)和黑曲菌1株(0.25%)。
本研究的药敏结果显示,除了光滑念珠菌对唑类药物敏感性相对较低外,大部分念珠菌对抗真菌药物敏感性较好,均在90%以上。由于试剂盒中两性霉素B、伊曲康唑和伏立康唑对新型隐球菌无判读标准,因此,笔者也未统计这3种药物对新型隐球菌的敏感性。笔者采用E-TEST的方法对丝状真菌(主要是曲霉菌)进行药敏试验,结果显示,曲霉菌对两性霉素B、伊曲康唑和伏立康唑的敏感性约为90%。两性霉素B是治疗深部真菌感染的首选药物, 但因其不良反应大而受到限制[12]。5-氟胞嘧啶和唑类药物不良反应轻, 对多种深部真菌感染有明显抑制作用, 但5-氟胞嘧啶很少单独用药, 一般与两性霉素B 联合应用。对于抗真菌治疗药物的选择,还应该考虑感染部位,同样的抗真菌药物在不同的感染部位可能有效的抗菌浓度也不同,如氟康唑在尿液穿透率大约90%,而在眼组织穿透率只有大约28%~75%[13-14],因此,应根据患者的生理、病理、免疫等状态合理用药。
总之,真菌感染已成为院内感染的重要因素[15],虽然药物敏感现状仍算良好,但为得到及时有效的治疗和避免资源的浪费,仍应重视真菌病原学检查及药物敏感性的监测,以指导临床合理使用抗真菌药物。
[1]李文波, 刘丽华, 张玉娟,等. 2010-2012年医院感染真菌的临床分布及耐药性分析[J]. 国际检验医学杂志, 2013, 9(34):2409-2412.
[2]Ramana K V, Kandi S, Venkata B P, et al. Invasive fungal infections: a comprehensive review[J].Am J Infect Dis, 2013, 1(4):64-69.
[3]叶应妩, 王毓三,申子瑜,等. 全国临床检验操作规程[M].3版.南京:东南大学出版社,744-745.
[4]栗 芳, 王清涛, 杜小玲,等.医院内深部真菌感染的临床分布和药敏结果[J]. 中华医院感染学杂志, 2006,16(4):445-447.
[5]梁培松,王结珍,孙各琴,等. 446株临床分离真菌的分布及药物敏感性分析[J].国际检验医学杂志, 2014, 3(1): 108-110.
[6]崔羽立,赵俊英. 40 例泌尿生殖道念珠菌病患者的菌种及药敏分析[J].首都医科大学学报,2006,27(2): 266-269.
[7]罗湘蓉,郑朋玉,袁军,等. 泌尿道结石患者尿道感染病原菌分布及耐药性分析[J]. 中国医科大学学报, 2015,44(11):1031-1034.
[8]Spiliopoulou A, Vamvakopoulou S, Bartzavali C, et al. Eleven-year retrospective survey of candidaemia in a university hospital in southwestern Greece[J]. Clin Microbiol Infect, 2010, 16(9):1378-1381.
[9]Pfaller M A, Castanheira M, Messer S A, et al. Variation in candida spp. distribution and antifungal resistance rates among bloodstream infection isolates by patient age: report from the SENTRY Antimicrobial Surveillance Program (2008-2009)[J]. Diagn Microbiol Infect Dis, 2010, 68(3):278-283.
[10]Kothiwala S K, Prajapat M, Kuldeep C M,et al. Cryptococcalpanniculitis in a renal transplant recipient: case report and review of literature [J]. J Dermatol Case Rep, 2015, 9(3):76-80.
[11]Badali H, Alian S, Fakhim H, et al. Cryptococcal meningitis due to Cryptococcus neoformans genotype AFLP1/VNI in Iran: a review of the literature [J]. Mycoses, 2015, 58(12): 689-693.
[12]杨虹, 张爽, 张晓辉, 等.抗生素滥用的原因及合理化使用建议[J]. 解放军医药杂志,2013, 25(5): 68-71.
[13]Dodds Ashley E S. Treatment options for invasive fungal infections [J].Pharmacotherapy, 2006, 26(6 Pt 2):55S-60S.
[14]丁秀荣,苏建荣.氟康唑对近平滑念珠菌生物膜的影响[J]. 首都医科大学学报, 2014,35(4):433-437.
[15]段宝生. 医院感染的研究现状[J]. 中国煤炭工业医学杂志, 2013,16(2):329-333.
编辑陈瑞芳
Fungal pathogens distribution and drug resistance of 399 stains fungi isolated in a hospital
Xu Xinmin, Li Min, Li Ruihong, Zhang Yan, Lu Yao, Wang Huizhu*
(DepartmentofClinicalLaboratory,BeijingDitanHospital,CapitalMedicalUniversity,Beijing100015,China)
ObjectiveTo understand common fungal species and antifungal drug resistance in our hospital and to provide important evidences for rational use of antifungal agents in clinical practice. MethodsWe performed fungal culture for clinically collected specimens from January 2014 to December 2015, and used CHROMagar Candida chromogenic medium and API 20C AUX yeast identification kit to identify fungal species. ATB Fungus 3 susceptibility kits were used to test drug susceptibility. At last, we counted the composition of fungal species and sensitive rates of 5 kinds of antifungal drugs. ResultsWe obtained a total of 399 strains of fungi. Urine was the main sample of clinical specimen and Candida albicans were the main strain (188 strains, accounting for 47.1%) in Candida. In filamentous fungi, Aspergillus fumigatus were the main strain (25 stains, accounting for 6.3%). The sensitivity of Candida albicans to antifungal drugs was more than 95%, but the sensitivity of Candida glabrata to azole was relatively low and only 65.1% for fluconazole. Aspergillus had a high sensitivity to amphotericin B, itraconazole and voriconazole. ConclusionCandida albicans was the main hospital fungal infection and amphotericin B and 5-flucytosine had high antifungal activity against this fungus. Candida glabrata had a higher resistance to azoles and clinically reasonable use of antifungal drugs according to the results of drug susceptibility is very important.
hospital fungi; drug susceptibility test; pathogens distribution
北京市优秀人才培养资助(2014000021469G235)。This study was supported by Beijing Municipal Foundation for the Excellent Talents(2014000021469G235).
10.3969/j.issn.1006-7795.2016.04.017]
R 379
2016-04-30)
*Corresponding author, E-mail:whz660527@sina.com
网络出版时间:2016-07-2021∶12网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160714.2112.016.html

