应用CNAS CL-36标准评估HBV DNA定量检测试剂的抗干扰能力
方 芳 陈柯霖 陈 燕 黄泽玉 吕 虹 刘淑静 周 金 张国军 康熙雄
(首都医科大学附属北京天坛医院检验科,北京 100050)
· 检验医学与临床 ·
应用CNAS CL-36标准评估HBV DNA定量检测试剂的抗干扰能力
方芳陈柯霖陈燕黄泽玉吕虹刘淑静周金张国军康熙雄*
(首都医科大学附属北京天坛医院检验科,北京 100050)
目的评估乙型肝炎病毒(hepatitis B virus,HBV)脱氧核糖核酸(deoxyribonucleic acid,DNA)定量检测试剂的抗干扰能力。方法选择临界值、低值、中值和高值HBV DNA阳性血清样本,采用实时荧光定量PCR(quantitative real-time polymerase chain reaction, q-RT-PCR)技术检测1.63~17.25 g/L的血红蛋白(hemoglobin, Hb)或26.55~497.50 μmol/L的总胆红素(total bilirubin, TBIL)对HBV DNA阳性样本检测结果的干扰,依据中国合格评定国家认可委员会(China National Accreditation Service for Conformity Assessment,CNAS)CL-36中的评价标准:偏差大于等于±7.5%时,判断检测结果受到干扰。结果当Hb浓度为7.75~17.25 g/L时,各样本均受到干扰;当Hb≤3.50 g/L时,各样本均未受到干扰。当TBIL浓度为274.60~399.15 μmol/L时,仅HBV DNA=2.24×108IU/mL的样本检测未受到干扰;当TBIL=153.55 μmol/L时,仅HBV DNA=4.62×102IU/mL的样本检测受到干扰;当TBIL=26.55 μmol/L时,各样本均未受到干扰。结论该HBV DNA定量检测试剂具有一定的抗干扰能力:Hb≤3.50 g/L、TBIL≤26.55 μmol/L对检测结果没有影响。
乙型肝炎病毒;聚合酶链反应;血红蛋白;总胆红素;干扰
乙型肝炎病毒脱氧核糖核酸(hepatitis B virus deoxyribonucleic acid, HBV DNA)的定量检测可反映病毒复制水平,主要用于慢性HBV感染的诊断、治疗适应证的选择及抗病毒疗效的判断[1-3]。临床实验
室主要采用实时荧光定量PCR(quantitative real-time polymerase chain reaction, q-RT-PCR)检测HBV DNA,HBV DNA检测的准确性将直接影响医生对患者的诊断和治疗。检验标本的状态对检测结果准确性可产生严重影响,ISO15189质量管理体系也明确指出必须对检测干扰因素进行评估[4],因此笔者对在临床实际工作中常见的溶血、黄疸对q-RT-PCR定量检测HBV DNA的干扰作用进行检测,并依据《医学实验室质量和能力认可准则在分子诊断领域的应用说明(CNAS CL-36)》[4]的评估标准对实验结果进行了评价。
1 材料与方法
1.1研究对象
1)HBV DNA阳性样本:选择无溶血、无高胆红素血症、无高脂血症,丙氨酸氨基转移酶(alanine aminotransferase, ALT)及门冬氨酸氨基转移酶(aspartate aminotransferase,AST)等肝功能生化检测项目均正常的HBV DNA阳性血清样本4例,浓度分别为:1号,4.01×108IU/mL;2号,6.44×105IU/mL;3号,3.33×103IU/mL;4号,9.65×102IU/mL,均来源于本院门诊乙型肝炎病毒携带者。
2)阴性混合血清、EDTA抗凝全血样本来源于无乙型肝炎病史且HBV DNA阴性、无高胆红素血症、无高脂血症、无溶血的正常体检者。
3)溶血样本:提取EDTA抗凝全血样本中的红细胞,经0.9%(质量分数)氯化钠注射液反复洗涤6次,在-20 ℃冻融后溶血,与阴性血清混合,依据EP7-A[5],分别制备5个浓度的血红蛋白(hemoglobin,Hb)样本池:38.25 g/L(高值样本池)、28.25 g/L(75%样本池)、17.50 g/L(中值样本池)、7.75 g/L(25%样本池)和3.25 g/L(低值样本池)。
4)高胆红素血清样本:用注射用水将纯品胆红素(武汉市长立生物技术有限公司提供)完全溶解后,与阴性血清混合,依据EP7-A[5],分别制备5个浓度的总胆红素(total bilirubin, TBIL)样本池:1 017.50 μmol/L(高值样本池)、788.60 μmol/L(75%样本池)、519.10 μmol/L(中值样本池)、291.80 μmol/L(25%样本池)和45.40 μmol/L(低值样本池)。
1.2方法
1)从每个HBV DNA阳性的血清样本中各取出200 μL分别放入11支0.5 mL离心管中,然后在这11支离心管中分别加入5种不同浓度的溶血样本、5种不同浓度的高TBIL样本以及阴性血清200 μL(1∶1稀释),制备成含有5种不同浓度的Hb干扰样本、5种不同浓度的TBIL干扰样本以及对照样本。
2)按照试剂说明书分两批分别检测受到Hb干扰的样本和对照样本及受到TBIL干扰的样本和对照样本中的HBV DNA病毒载量,每个样本重复3次,结果取均值。
3)分别检测上述干扰样本中的Hb浓度和TBIL浓度,每个样本重复4次,结果取均值。
1.3仪器设备及试剂
1)HBV DNA的检测:采用瑞士Roche Lightcycler 480 Ⅱ检测,试剂购自湖南圣湘生物技术有限公司。
2)Hb的检测:采用日本Sysmex 800i血细胞计数仪及其配套试剂。
3)TBIL的检测:采用日本Hitachi labospect 008 全自动生化分析仪及日本和光(WAKO)的TBIL检测试剂。
4)质量控制:PCR质控品:试剂盒自带高值质控品(1.26×105~1.26×106)IU/mL及本实验室自制的低值质控品(4.25×103~1.01×104)IU/mL。Hb质控品:Sysmex e-CHECK(XS)。TBIL质控品:BIO-RAD Lyphochek Assayed Chemistry Control。上述质控结果均在控,实验有效。
1.4统计学方法

2 结果
2.1两种干扰样本中Hb及TBIL浓度
干扰样本中的Hb浓度最低为1.63 g/L,最高为(17.25±1.50)g/L;干扰样本中的TBIL浓度最低为(26.55±0.17) μmol/L,最高为(497.50±5.50)μmol/L,详见表1。
2.2 不同浓度的Hb对不同浓度的HBV DNA样本检测造成的干扰
各HBV DNA阳性样本经阴性血清1∶1稀释后作为对照样本的浓度分别为:1号,1.74×108IU/mL;2号,3.39×105IU/mL;3号,1.67×103IU/mL;4号,4.97×102IU/mL。与对照相比,以偏差低于±7.5%为实验可接受范围,当Hb浓度≥7.75 g/L时,各样本均受到干扰;当Hb浓度≤3.50 g/L时,各样本均未受到干扰,详见表2。Hb的浓度越高,对扩增的影响越大,扩增荧光强度越低,扩增效率越低,CT值越高(图1)。
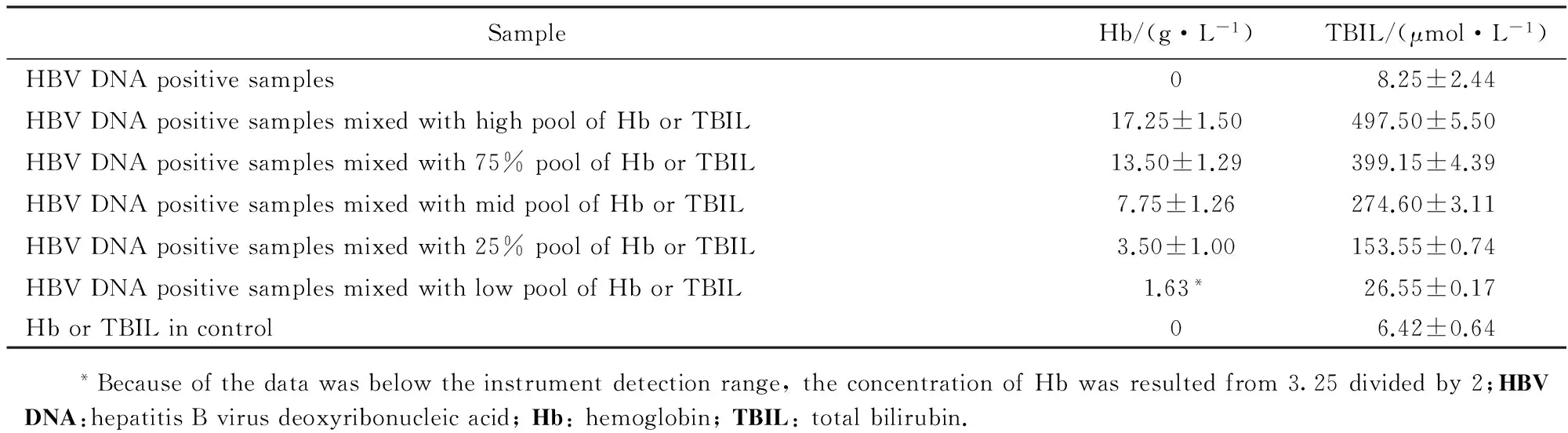
表1 Hb干扰样本和TBIL干扰样本中的Hb浓度和TBIL浓度

表2 不同浓度的Hb对不同浓度的HBV DNA样本检测造成的干扰
*Logarithm of HBV DNA concentration; Hb: hemoglobin; HBV DNA: hepatitis B virus deoxyribonucleic acid.
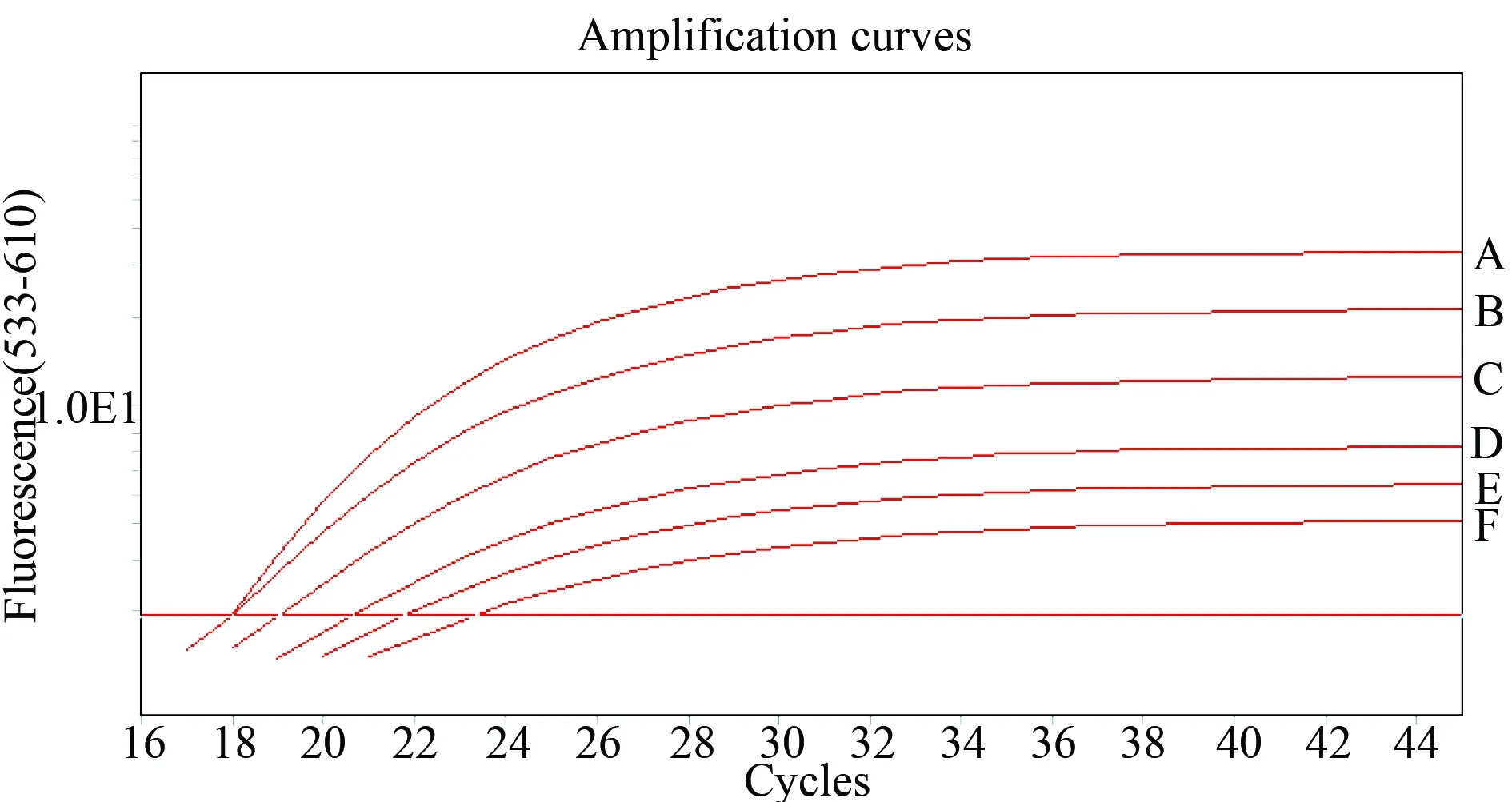
图1 不同浓度的Hb对HBV DNA 浓度为
A: control; B: Hb=1.63 g/L; C: Hb=3.50 g/L; D: Hb=7.75 g/L; E: Hb=13.50 g/L; F:Hb=17.25 g/L;Hb: hemoglobin; HBV DNA: hepatitis B virus deoxyribonucleic acid.
2.3 不同浓度的TBIL对不同浓度的HBV DNA样本检测造成的干扰
各HBV DNA阳性样本经阴性血清1∶1稀释后作为对照样本的浓度分别为:1号,2.24×108IU/mL;2号,2.88×105IU/mL;3号,1.67×103IU/mL;4号,4.62×102IU/mL。与对照相比,以偏差低于±7.5%为实验可接受范围,当TBIL≥497.50 μmol/L时,各样本均受到干扰;当TBIL浓度为274.60~399.15 μmol/L时,仅HBV DNA=2.24×108IU/mL的样本检测未受到干扰;当TBIL=153.55 μmol/L时,除HBV DNA=4.62×102IU/mL的样本检测受到干扰外,其余样本均未受到干扰;当TBIL≤26.55 μmol/L时,各样本检测均未受到干扰,详见表3。TBIL的浓度越高,对扩增的影响越大,扩增荧光强度越低,扩增效率越低,CT值越高(图2)。

表3 不同浓度的TBIL对不同浓度的HBV DNA样本检测造成的干扰
*Logarithm of HBV DNA concentration; TBIL: total bilirubin; HBV DNA:hepatitis B virus deoxyribonucleic acid.

图2 不同浓度的TBIL对HBV DNA 浓度为2.24×108 IU/mL的检测样本的影响
A: control; B: TBIL=26.55 μmol/L; C: TBIL=153.55 μmol/L; D: TBIL=274.60 μmol/L; E: TBIL=399.15 μmol/L; F: TBIL=497.50 μmol/L; TBIL:total bilirubin; HBV DNA: hepatitis B virus deoxyribonucleic acid.
3 讨论
q-RT-PCR技术检测HBV DNA的病毒载量,灵敏度高、特异度好,能够有效避免环境污染和样本的交叉污染,在临床得到广泛应用,但是其定量的准确性易受到样本中干扰物质的影响。因此笔者依据CNAS CL-36的要求,对该试剂的抗干扰能力进行评价。
在评价q-RT-PCR检测HBV DNA的干扰因素的影响程度时,笔者未查到统一的判断标准。在CNAS CL-36中推荐的关于对耗材抑制物的验收判断标准:可用新、旧批号耗材检测同一批数个样品,其中阳性样本应包括:临界值、低值、中值和高值样品,定量检测结果的偏倚小于±7.5%且阴性和临界值样品符合预期,即判断耗材的抑制物符合实验要求[4]。笔者将样本中的血红蛋白、总胆红素对样本检测结果的干扰作用在一定程度上视为是对定量PCR实验的抑制因素,因此引用偏差小于±7.5%的标准作为判断本实验抗干扰能力的标准,并分别使用临界值、低值、中值和高值的HBV DNA阳性的样本进行检测。这一判断方法较以往文献中使用的通过比较样本的扩增效率[8]、配对比较干扰与非干扰样本的检测结果[9]等方法简便易行,工作量小。
血红蛋白是红细胞内的主要PCR抑制物,它含有铁元素,其抑制机制可能与这些蛋白释放铁离子至PCR混合物中有关。研究铁的抑制效应[10]时发现,铁干扰DNA 的合成,而胆红素是血红蛋白的衍生物,也是PCR的抑制剂。有研究[10]表明,亚铁血红素可抑制DNA聚合酶活性。氯化高铁血红素通过直接作用于DNA聚合酶,成为一个与靶DNA竞争的抑制剂和核苷酸的非竞争性抑制剂。此外,该研究[10]表明,1%血液可完全抑制Taq酶活性,而与Mg离子浓度无关。而本研究使用的DNA聚合酶即为Taq酶,因此检测结果明显受到溶血的影响。
本研究结果显示,对于同一个HBV DNA阳性样本,血红蛋白浓度、总胆红素浓度越高,对PCR的干扰作用越大;在同一干扰浓度下,HBV DNA浓度越低,越容易受到干扰物质的影响。若DNA浓度高(2.24×108IU/mL),即使高浓度的TBIL(399.15 μmol/L)也不会对结果构成明显的影响(偏差为 -6.83%)。如果干扰物质为Hb,即使是高浓度的HBV DNA样本(1.74×108IU/mL)也仅在浓度为Hb≤3.5 g/L时不会对结果造成明显的影响。但是对于HBV DNA浓度本身就低的样本(4.62×102IU/mL),即使样本中的TBIL浓度较低(153.55 μmol/L),检测结果也会出现明显的偏差(-9.92%)。这些提示笔者在临床工作中必须重视样本中干扰物质对检测结果的影响,尽量避免干扰物质对检测干扰,例如将溶血样本退回临床,重新抽取合格的样本检测。对不能避免的干扰,如无法重新抽血或患者黄疸的情况下,在判断检测结果是否会受到干扰物质的影响时,应主要考虑3个因素:干扰物质的浓度、干扰物质的种类、样本中含有待测核酸的浓度,必要时通过抗干扰手段进行干预,例如以阴性血清稀释待测样本以降低干扰物质浓度从而避免假阴性结果,但同时还必须注意避免因样本本身含有DNA量过低,而导致稀释后检测结果的假阴性。
本研究表明:该HBV DNA定量检测试剂具有一定的抗干扰能力:血红蛋白≤3.50 g/L、总胆红素≤26.55 μmol/L对检测结果没有影响。应用CNAS CL-36的判断标准来评价q-RT-PCR实验中的干扰因素影响的方法简便易行。
[1]中华医学会肝病学会分会,中华医学会感染病学分会. 慢性乙型肝炎防治指南(2015更新版)[J]. 中华肝脏病杂志, 2015, 23(12): 888-904.
[2]欧晓娟,王晓明,贾继东,等. 慢性乙型肝炎肝穿病理与血清HBV DNA及肝功能的关系[J]. 首都医科大学学报,2006,27(4):435-437.
[3]单晶,丁惠国. 乙型肝炎病毒基因型与血清型的关系及临床意义[J]. 首都医科大学学报,2004,25(4):557-559.
[4]中国合格评定国家认可委员会. CNAS CL-36医学实验室质量和能力认可准则在分子诊断领域的应用说明[EB/OL].(2015-11-11)[2016-04-01]. https://www.cnas.org.cn/rkgf/sysrk/rkyyzz/2015/12/873732.shtml.
[5]Powers D, Boyd J, Glick M, et al.EP7-A Interference Testing in Clinical Chemistry; Approved Guideline[S]. Wayne:NCCLS, 2002:9-22.
[6]廖萍,周文杰,张霞,等. SYSMEX CS-5100全自动血凝仪的抗干扰性能研究[J]. 血栓与止血, 2015, 21(1): 5-9.
[7]张伟坚,刘光明,梁凤琼. 普利生C2000-A全自动血凝仪的性能验证[J]. 南昌大学学报:医学版,2014, 54(6):16-20.
[8]余南,陈小坚,甘明,等.脂血标本的核酸定量检测效果评价[J].热带医学杂志,2007,7(5):429-432.
[9]雷泽洪,黄胜起,陈振翅. 血红蛋白和肝素对FQ-PCR检测HBV DNA结果的影响[J].中国热带医学,2008,8(7):1235-1236.
[10]李金明. 实时荧光PCR技术[M]. 北京:人民军医出版社,2014:72.
编辑陈瑞芳
Evaluation of anti-interference capability of HBV DNA quantitative reagents according to CNAS CL-36 criterion
Fang Fang, Chen Kelin, Chen Yan, Huang Zeyu, Lyu Hong, Liu Shujing, Zhou Jin, Zhang Guojun, Kang Xixiong*
(DepartmentofClinicalLaboratory,BeijingTiantanHospital,CapitalMedicalUniversity,Beijing100050,China)
ObjectiveTo evaluate the anti-interference capability of hepatitis B virus (HBV) deoxyribonucleic acid (DNA) quantitative reagents. MethodsHBV DNA positive serum samples with critical concentrations, low, medium and high were collected. The analysis of interference was performed in four HBV DNA positive samples with hemoglobin (Hb) ranging from 1.63 to 17.25 g/L or total bilirubin (TBIL) ranging from 26.55 to 497.50 μmol/L by quantitative real-time polymerase chain reaction (q-RT-PCR). According to criterion of China National Accreditation Service for Conformity Assessment (CNAS) CL-36, if the bias is higher than and equal to ±7.5%, there will be interference with the detection of HBV DNA. ResultsAll of the HBV DNA positive sample were subjected to interference with Hb ranging from 7.75 to 17.25g/L, and were not subjected to interference with Hb less than or equal to 3.50 g/L. For TBIL ranging from 274.60 to 399.15 μmol/L, the sample with HBV DNA viral load 2.24×108IU/mL was the only one without interference. For TBIL=153.55μmol/L,only the sample with HBV DNA viral load 4.62×102IU/mL was subjected to interference. None of the HBV DNA positive sample were subjected to interference with TBIL less than or equal to 26.55μmol/L. ConclusionThe HBV DNA quantitative reagent has certain anti-interference capability: there was no interference effect on HBV DNA results when Hb is less than or equal to 3.50 g/L and TBIL is less than or equal to 26.55 μmol/L.
hepatitis B virus;PCR;hemoglobin;total bilirubin;interference
北京市卫生系统高层次人才培养计划基金(2013-3-052)。This study was supported by the High Level Technical Talent Development of Beijing Health System(2013-3-052)
10.3969/j.issn.1006-7795.2016.04.016]
R 446
2016-04-30)
*Corresponding author, E-mail:kangxx@vip.sina.com
网络出版时间:2016-07-2020∶48网络出版地址:http://www.cnki.net/kcms/detail/11.3662.r.20160714.2048.002.html

