不同因子对酿酒酵母降解桑椹花青素的影响研究
赖剑峰,杨荣玲,陈智毅,刘学铭
(广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州510610)
不同因子对酿酒酵母降解桑椹花青素的影响研究
赖剑峰,杨荣玲,陈智毅,刘学铭
(广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东广州510610)
通过改变发酵培养基碳源或氮源浓度,添加不同无机离子或不同浓度外源乙醇,以及调节pH值,比较发酵后主要花青素的含量变化。结果表明,凡是有利于酿酒酵母生长和酒精发酵的因素都促进酿酒酵母对桑椹花青素的降解,其中对降解矢车菊素-3-葡萄糖苷的影响更加明显。
酿酒酵母; 花青素; 桑椹; 酒精发酵; 降解
桑椹为桑科落叶乔木桑树Morus L.的成熟果穗,含有丰富的糖类、有机酸、维生素、矿物质等营养成分,还含有花青素、儿茶素、绿原酸等生物活性物质,具有调节免疫、促进造血细胞生长、抗诱变、降血糖、降血脂、护肝等药理作用,在医药和食品工业中有广泛的应用[1-2]。鲜桑椹含有丰富的汁液,桑椹果汁含有丰富的糖类、有机酸及花青素和白藜芦醇等多种成分,是发酵生产桑椹红酒的良好原料。利用桑椹汁发酵生产的桑椹酒含有与红葡萄酒类似的成分,已经成为我国一个新的果酒品种,市场不断扩大[3]。我们在研究中发现,桑椹花青素在桑椹汁酒精发酵过程中显著减少,发酵7 d总花青素含量下降58%,两种主要的单体花青素下降的趋势不同[4]。
花青素是桑椹中一类主要的功能性成分,也是桑椹果酒呈现颜色的基础,主要的单体花青素是矢车菊素-3-葡萄糖苷(C-3-G)和矢车菊素-3-芸香糖苷(C-3-R)[5-6]。桑椹汁发酵生产果酒主要是通过酵母的生长和发酵作用而实现的,说明酵母的生理生化特性是桑椹花青素发生降解的主要原因。如何在桑椹酒生产中保持高含量的活性成分,是酿酒工作者十分关心的问题。大量研究发现,酵母的种类会影响花青素等酚类物质的降解[7,11],但对影响同一酵母的不同因素的作用研究甚少。除花青素外,桑椹果汁中还含有许多非花青素酚类物质[2]及一些其他固形物,这些化合物的存在,对研究酵母与花青素的相互作用增加了复杂性。本研究通过添加外源碳源、氮源和无机盐配制一个成分简单而明确的模拟酒精发酵培养基,添加经过大孔树脂纯化后的富含花青素桑椹提取物来研究不同因素对酿酒酵母降解桑椹花青素的影响。
1 材料与方法
1.1材料、试剂及仪器
1.1.1供试材料
富含花青素桑椹提取物:新鲜桑椹果汁经大孔树脂分离纯化、真空浓缩和冷冻干燥制成,实验室自制。
葡萄酒用高活性干酵母:安琪酵母股份有限公司。
矢车菊素-3-葡萄糖苷(C-3-G)和矢车菊素-3-芸香糖苷(C-3-R)对照品:购自法国Extrasynthese公司。
食用蔗糖、酵母膏、KH2PO4、MgSO4·7H2O、NaOH、浓盐酸、无水乙醇、Fe2(SO4)3·7H2O、CaCl2·2H2O、ZnSO4、MnSO4·H2O、CuSO4·5H2O均为国产分析纯。
1.1.2仪器设备
酒精计;LC 1260型高效液相色谱仪(G1311 1260 quat Pump VL,G1314F 1260 VWD):美国Aglient公司。
1.2实验方法
1.2.1碳源浓度对酿酒酵母降解桑椹花青素的影响
在由KH2PO4(4.5 g/L)、MgSO4·7H2O(1.2 g/L)、酵母膏(5.6 g/L)和富含花青素桑椹提取物(7.0 g/L)组成的培养基中,分别添加50 g/L、100 g/L、150 g/L、200 g/L、250 g/L和300 g/L的蔗糖,10%接种量,26℃发酵7 d后分别测定酒精和主要单体花青素的含量。
1.2.2氮源浓度对酿酒酵母降解桑椹花青素的影响
固定蔗糖的浓度为250 g/L,无机盐和富含花青素桑椹提取物含量不变,分别添加6.5 g/L、13.0 g/L、19.5 g/L 和26.0 g/L的酵母膏,同1.2.1条件接种和发酵,7 d后分别测定酒精和主要单体花青素的含量。
1.2.3无机盐对酿酒酵母降解桑椹花青素的影响
在由蔗糖(250 g/L)、酵母膏(6.5 g/L)、富含花青素桑椹提取物(7 g/L)、KH2PO4(4.5 g/L)和MgSO4·7H2O(1.2 g/L)组成的培养基中,分别加入Fe2(SO4)3·7H2O(3.4 g/L)、CaCl2·2H2O(3 g/L)、ZnSO4(3 g/L)、MnSO4·H2O(3 g/L)、CuSO4·5H2O(3 g/L),同1.2.1条件接种和发酵,7 d后分别测定酒精和主要单体花青素的含量。
1.2.4pH值对酿酒酵母降解桑椹花青素的影响
由蔗糖(250 g/L)、酵母膏(6.5 g/L)、富含花青素桑椹提取物(7 g/L)、KH2PO4(4.5 g/L)和MgSO4·7H2O(1.2 g/L)组成的人工发酵培养基,用3 mol/L NaOH和3 mol/L HCl配制pH值分别为3.0、3.5、4.0、4.5、5.0和5.5的人工酒精发酵培养,同1.2.1条件接种和发酵,7 d后测定酒精和主要单体花青素的含量。
1.2.5外源乙醇浓度对酿酒酵母降解桑椹花青素的影响
在由蔗糖(250 g/L)、酵母膏(6.5 g/L)、富含花青素桑椹提取物(7 g/L)、KH2PO4(4.5 g/L)和MgSO4·7H2O(1.2 g/L)组成的人工发酵培养基中,加入无水乙醇,使得发酵液初始乙醇含量分别为0、1%vol、2%vol、3%vol、4%vol和5%vol,同1.2.1条件接种和发酵,7 d后测定酒精和主要单体花青素的含量。
1.3分析方法
pH值:使用pH计测定。
乙醇含量测定:以蒸馏法去除样品中不挥发物质,用酒精计法测得乙醇体积的百分数值,按温度校正,求得20℃时乙醇的体积分数。
单体花青素含量测定:采用HPLC法检测。流动相A:10%甲酸;流动相B:甲醇。分析条件:Agilent 1200高效液相色谱仪;SB-C18分析型色谱柱(4.6×250 mm,5 Micron);检测波长520 nm和280 nm;进样量20µL;流速为0.8 mL/min。0~20 min用A流动相由95%梯度洗脱至40%,样品保留时间为20 min。
2 结果与分析
2.1碳源浓度对酿酒酵母降解桑椹花青素的影响
碳源浓度对酿酒酵母酒精发酵和降解桑椹花青素的影响见图1。

图1 不同碳源浓度对发酵液中酒精和单体花青素含量的影响
从图1A可以看出,碳源浓度对发酵后酒精含量有显著影响,在一定范围内酒精含量与添加的碳源浓度正相关,说明酿酒酵母可以在该人工发酵培养基正常进行生长和酒精发酵。从图1B可以看出,碳源浓度对发酵后桑椹主要单体花青素含量有很大影响,其中尤其对C-3-G含量的影响更为显著。随着碳源浓度的增加,C-3-G的含量下降显著,当含糖量在5%时,发酵7 d后C-3-G的含量下降到13.0 mg/L,当含糖量增加到25%后,C-3-G的含量下降到6.2 mg/L。相对来讲,在整个发酵过程中,C-3-R的含量随着碳源浓度的增加降低较少,含糖量从5%增加到25%,其含量从18.2 mg/L下降到16.4 mg/L,下降幅度仅为8.6%。有研究表明,酿酒酵母在生长和酒精发酵过程中会释放丙酮酸、乙醛等次级代谢产物到培养基中,并与花青素反应生成一些大分子衍生物[12-13]。酵母的一些生物活性酶对花青素降解起重要作用[14]。由于C-3-G的结构比C-3-R简单,极性更大,更容易受到攻击[15]。但这种伴随酵母利用碳源和氮源生长和发酵同时降解花青素的现象与微生物降解有机污染物的共代谢机制[16]十分相似,但目前尚未看到有关微生物利用共代谢机制降解花青素的文献报道,值得进一步研究。
2.2氮源浓度对酿酒酵母降解桑椹花青素的影响
氮源作为发酵中重要的培养基成分之一,其对发酵液中花青素含量的影响见图2。
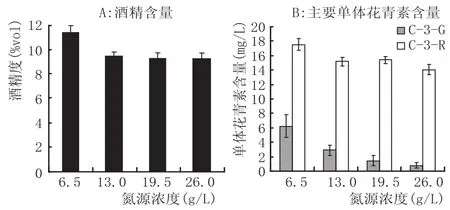
图2 不同氮源浓度对发酵液中酒精和花青素含量的影响
从图2A可以看出,氮源浓度对发酵后的酒精含量有一定影响,氮源含量增加,酒精含量下降,这主要是因为酵母利用营养物质过度生长,导致能够用于酒精转化的碳源减少。从图2B可以看出,氮源含量对发酵液中桑椹主要单体花青素含量也有显著影响。C-3-G的含量随着氮源浓度的增加而降低,当氮源浓度为6.5 g/L时,其含量为6.5 mg/L,但氮源浓度增加到26 g/L时,其含量仅为0.8 mg/L,与初始含量相比,降幅达到95.7%。同样,C-3-R的含量随着氮源浓度的增加也呈递减的趋势,当氮源浓度为6.5 g/L时,其含量为17.5 mg/L,但氮源浓度增加到26 g/L时,其含量下降到14.0 mg/L。正如前述,氮源的添加有利于酵母的生长,从而使酵母酶系更加活跃,进一步降解花青素。而C-3-G结构比C-3-R简单,因此更容易受到外源酶等因素的攻击。
2.3无机盐对酿酒酵母降解桑椹花青素的影响
本文主要研究了添加外源Fe3+、Mn2+、Ca2+、Zn2+和Cu2+对酿酒酵母酒精发酵和降解桑椹花青素的影响,其结果见图3。

图3 不同无机盐对发酵液中酒精和花青素含量的影响
从图3A可看出,当培养基中添加Fe3+、Mn2+、Ca2+和Zn2+时,发酵结束后,酒精度分别为11.3%vol、11.1%vol、10.8%vol和10.6%vol,各组差别无显著性。然而当添加同等浓度的Cu2+后,培养结束后没有乙醇生成。这是因为Cu2+具有抗菌作用,酵母生长和发酵均被抑制,发酵没有正常进行,因此在反应结束后检测不到乙醇的存在。从图3B可知,培养基中添加Fe3+、Mn2+、Ca2+和Zn2+时对酵母生长的影响较小,酵母对花青素的降解幅度较大,发酵结束后C-3-G的含量分别为2.5 mg/L、3.4 mg/L、3.5 mg/L 和3.9 mg/L,是初始含量的13.7%、19.2%、20.5%和21.3%。而在添加Cu2+的培养基中,7 d后C-3-G的含量仍达初始含量的98%,几乎没有降解。同样,C-3-R的含量呈现相似的变化趋势。Balik[17]发现Fe3+对花青素有破坏作用,而Zn2+则具有保护作用。我们也发现,培养基中添加硫酸锌时,C-3-G的含量要比添加硫酸铁时要高。由于Cu2+具有抗微生物作用,因此,添加Cu2+的发酵液中的酵母没有生长发酵,桑椹花青素也没有发生降解。
2.4pH值对酿酒酵母降解桑椹花青素的影响
pH值对酿酒酵母酒精发酵和降解桑椹花青素的影响见图4。

图4 不同pH值对发酵液中酒精和花青素含量的影响
从图4A可以看出,发酵液pH值对酿酒酵母进行酒精发酵有较大影响,pH值低于4.0时酒精发酵受到抑制,过高的pH值也影响酒精发酵,pH4.5时酒精发酵比较完全。从图4B可以看出,发酵液保留的桑椹主要花青素与酒精发酵的趋势恰好相反,尤以C-3-G的含量更为明显。当pH3.0时发酵液中C-3-G的含量最高,为14.9 mg/L,当pH4.5时,发酵液中C-3-G含量最低,为5.6 mg/L,只有初始含量的30.4%。C-3-R的含量受到的影响较小,当pH4.5时发酵液中C-3-R的含量最低,为初始含量的84.9%,当pH3.0时,C-3-R含量最高为19.3 mg/L,是初始含量的94.2%。这主要是由于当培养基pH值较低时,酵母的生长受到一定的影响,从而影响了其对花青素的降解。从pH值同时影响酵母生长发酵和桑椹花青素降解的关系看,酵母降解花青素机制更符合微生物共代谢特点。
2.5外源乙醇对酿酒酵母降解桑椹花青素的影响
添加外源乙醇对酿酒酵母酒精发酵和降解桑椹花青素的影响见图5。
从图5A可以看出,在不添加外源乙醇的正常发酵中发酵液酒精度为11.3%vol,随着乙醇添加量的增加,发酵结束后的酒精度呈逐渐递增的趋势。当发酵液中乙醇的添加量为5%vol时,发酵液酒精度达到13.2%vol。由此可见,发酵液中酒精度随着乙醇添加量的增加而升高,但添加过高浓度的乙醇,发酵产生的乙醇较理论值要低,主要是发酵液乙醇达到一定浓度时抑制了酵母的生物活性,不再进行酒精发酵。
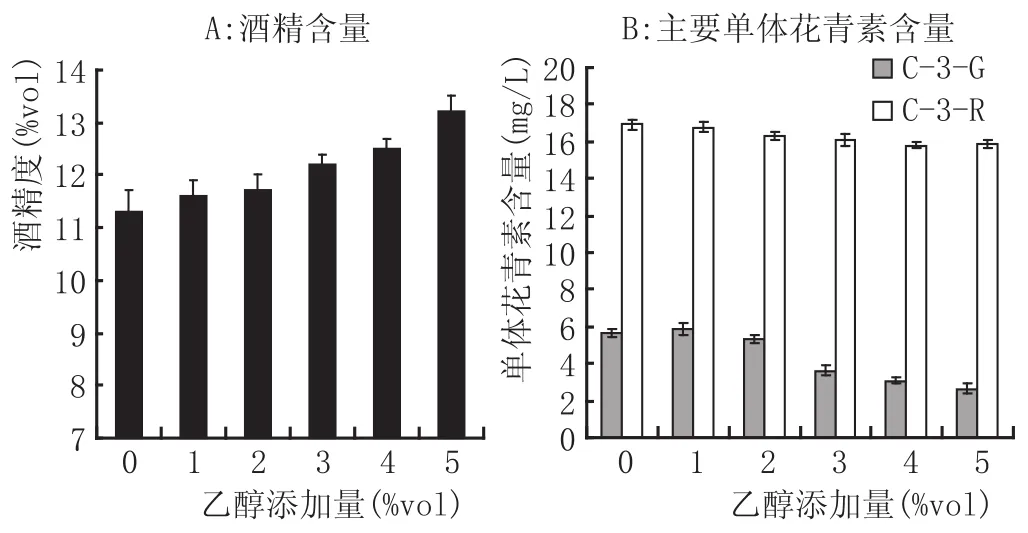
图5 不同乙醇添加量对发酵液中酒精和花青素含量的影响
从图5B可以看出,培养基中添加一定浓度的乙醇后,酵母对C-3-G含量的影响比较显著。随着发酵液中初始乙醇浓度的升高,C-3-G的含量基本呈下降趋势。当乙醇含量为1%vol时,发酵液中C-3-G的含量最高为5.8 mg/L,为初始含量的31.4%,而当乙醇含量为5%vol时,发酵液中C-3-G含量最低为2.6 mg/L,是初始含量的14.3%。但添加不同浓度的乙醇对发酵液中C-3-R的含量影响较小。初始培养基不添加乙醇时,C-3-R含量最高为16.9 mg/L,当乙醇含量增加到4%vol时,发酵液C-3-R的含量最低为15.8 mg/L,为初始含量的77.1%,下降幅度较小。乙醇作为酵母的代谢产物之一,如果浓度过高会抑制酵母的代谢,理论上应该对花青素起到保护作用,但本实验发现乙醇的添加促进了酵母对花青素的转化,具体机制有待探索。
3 结论
添加碳源和氮源以及发酵液合适的pH值等有利于酿酒酵母生长发酵的因素,有利于酿酒酵母降解桑椹花青素。添加外源Fe3+、Mn2+、Ca2+和Zn2+对酿酒酵母降解桑椹花青素的影响较小,添加较大量Cu2+完全抑制酿酒酵母的生长、发酵和对桑椹花青素的降解。添加一定量的外源乙醇尽管对酿酒酵母的发酵无显著影响,但促进其降解桑椹花青素。凡是发生桑椹花青素降解的情况,都是结构较简单的C-3-G降解为主。
[1] 刘学铭,肖更生,陈卫东.桑椹的研究与开发进展[J].中草药,2001,32(6):569-571.
[2] 李妍,刘学铭,刘吉平,等.不同果桑品种桑椹成熟过程中非花青素酚类物质的含量变化[J].蚕业科学,2008,34(4):711-717.
[3] 吴继军,肖更生,刘学铭,等.桑椹酒的研制与规模化生产[J].食品与发酵工业,2002,28(6):76-77.
[4] 刘学铭,吴继军,廖森泰,等.桑椹汁乙醇发酵过程中主要成分和功能成分的动态变化[J].食品与发酵工业,2006,32(12):138-141.
[5] Liu X M,Xiao G S,Chen W D,et al.Quantification and purification of mulberry anthocyanins with macroporous resins [J].Journal of Biomedicine and Biotechnology,2004,5:326-331.
[6] Du Q,Zheng J,Xu Y.Composition of anthocyanins in mulberry and their antioxidant activity[J].Journal of Food Composition andAnalysis,2008,21:390-395.
[7] 史红梅,孙玉霞,蒋锡龙,等.酵母对桑椹酒中酚类物质的影响研究[J].山东农业大学学报:自然科学版,2013,44(4):516-520.
[8] 李双石,苏宁,吴志明,等.不同酿酒酵母发酵对红葡萄酒中花色苷组成的影响[J].食品与发酵工业,2012,38(11):101-104.
[9] Hayasaka Y,Birse M,Eglinton J,et al.The effect of Saccharomyces cerevisiae and Saccharomyces bayanus yeast on colour properties and pigment profiles of a Cabernet Sauvignon red wine[J].Australian Journal of Grape and Wine Research,2007,13:176-185.
[10]MorataA,Loira I,Heras J M,et al.Yeast influence on the formation of stable pigments in red winemaking[J].Food Chemistry,2016,197:686-691.
[11]Sun S Y,Jiang W G,Zhao Y P.Evaluation of different Saccharomyces cerevisiae strains on the profile of volatile compounds and polyphenols in cherry wines[J].Food Chemistry,2011,127:547-555.
[12]MorataA,Gómez-Cordovés M C,Colomo B,et al.Pyruvic acid and acetaldehyde production by different strains of Saccharomyces cerevisiae:relationship with VitisinAand B formation in red wines[J].Journal ofAgricultural and Food Chemistry,2003,51(25):7402-7409.
[13]MorataA,Benito S,Loira I,et al.Formation of pyranoanthocyanins by Schizosaccharomyces pombe during the fermentation of red must[J].International Journal of Food Microbiology,2012,159:47-53.
[14]Manzanares P,Rojas V,Genovés S,et al.Apreliminary search for anthocyanin-β-D-glucosidase activity in non-Saccharomyces wine yeasts[J].International Journal of Food Science and Technology,2000,35:95-103.
[15]Medina K,Boido E,Dellacassa E,et al.Yeast interactions with anthocyanins during red wine fermentation[J].American Journal of Enology and Viticulture,2005,56(2):104-109.
[16]Tobajas M,Monsalvo V M,MohedanoAF,et al. Enhancement of cometabolic biodegradation of 4-chlorophenol induced with phenol and glucose as carbon sources by Comamonas testosterone[J].Journal of Environmental Management,2012,95:S116-S121.
[17]Balik J.Dynamics of changes in total anthocyanins during the fermentative maceration of grapes[J].Horticulture Science,2006,33(3):103-107.
Effects of Different Factors on Degradation of Mulberry Anthocyanins by Saccharomyces cerevisiae
LAI Jianfeng,YANG Rongling,CHEN Zhiyi and LIU Xueming
(Key Lab of Functional Foods of Ministry ofAgriculture,Guangdong Key Lab ofAgricultural Products Processing,Sericulture& Agri-Food Research Institute,GuangdongAcademy ofAgricultural Sciences,Guangzhou,Guangdong 510610,China)
In order to explore the effects of different factors on the degradation of mulberry anthocyanins by Saccharomyces cerevisiae,the content of two main mulberry anthocyanins(C-3-G and C-3-R)in simulated alcohol fermentation media rich in anthocyanins were investigated by changing carbon source,nitrogen source,minerals,exogenous alcohol concentrations and pH.The results showed that,those factors in favor of the growth and alcohol fermentation of Saccharomyces cerevisiae could improve the degradation of mulberry anthocyanins,especially C-3-G.
Saccharomyces cerevisiae;anthocyanin;mulberry;alcohol fermentation;degradation
TS262.7;TS261.1;TS261.4
A
1001-9286(2016)08-0036-04
10.13746/j.njkj.2016125
广东省对外合作项目(2013B050800018);广州市科技计划项目(2014J2200068)。
2016-04-12
赖剑峰(1987-),男,硕士研究生。
刘学铭(1967-),男,博士,研究员,主要从事农产品加工研究,E-mail:xuemingliu@21cn.com。
优先数字出版时间:2016-06-03;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160603.1620.008.html。

