重复经颅磁刺激对抑郁模型大鼠行为学及海马区糖皮质激素受体表达的影响☆
任慧聪谷世娜赵琳李文强张朝辉
重复经颅磁刺激对抑郁模型大鼠行为学及海马区糖皮质激素受体表达的影响☆
任慧聪*谷世娜*赵琳*李文强*张朝辉*
目的观察重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)对慢性应激抑郁模型大鼠的抗抑郁作用及对海马区糖皮质激素受体(glucocorticoid receptor,GR)表达的影响,探讨rTMS抗抑郁作用的可能机制。方法75只健康成年雄性大鼠随机分为造模组(60只)和空白对照组(15只),造模组采用孤养联合慢性温和不可预见应激(chronic unpredictability stimulus,CUMS)方法制备抑郁大鼠模型,为期3周,筛选造模成功的大鼠45只随机分为rTMS组、伪rTMS组和抑郁对照组,每组15只,rTMS组和伪rTMS组分别接受10 Hz 的rTMS刺激和伪刺激干预3周,抑郁对照组和空白对照组不给予干预。分别于造模前、造模后、rTMS干预后进行体重测量、蔗糖水消耗实验和强迫游泳实验评估,rTMS干预后检测大鼠海马区GR蛋白和海马GR mRNA表达水平。结果造模后,rTMS组、伪rTMS组和抑郁对照组大鼠蔗糖水消耗量较空白对照组下降,强迫游泳不动时间增加(P<0.01)。rTMS干预后,rTMS组体重增长率、蔗糖水消耗量与伪rTMS组和抑郁对照组相比均较高(P<0.01),强迫游泳不动时间较短(P<0.01)。伪rTMS组及抑郁对照组海马区GR蛋白及其mRNA表达水平与rTMS组和空白对照组相比均较低(P<0.05)。结论 rTMS能够改善CUMS抑郁模型大鼠的抑郁样行为,可能与上调海马区GR表达有关。
抑郁症 重复经颅磁刺激 大鼠 糖皮质激素受体
【Abstract】Objective To explore the effect of repetitive transcranial magnetic stimulation(rTMS)on behaviors and hippocampal glucocorticoid receptor(GR)protein expression in chronic stress depression model rats and the possible antidepressant mechanism of rTMS.Method Seventy-five male Sprague-Dawley rats were randomly divided into the blank control group(n=15)and the stress-induced group(n=60).Singly housing and chronic unpredictable mild stress (CUMS)were used to induce the depression model in stress-induced group.Forty-five CUMS rats were selected and ran⁃domly divided into rTMS group(receiving 10 Hz rTMS intervention for 3 weeks),sham group(receiving pseudo rTMS treatments for 3 weeks)and depression group(with no further treatment).Body weight measurements and performance in the sucrose consumption and forced swimming test(FST)were evaluated before modeling,after modeling and after inter⁃vention.The GR protein and GR mRNA expression level in the hippocampus were examined after intervention.Results Compared with control group,the body weight growth rate and the sugar water preference were significantly lower in stress-induced group(P<0.01),and the immobility time of FST was significantly longer(P<0.01).After the 3-week rTMSintervention,the body weight growth rate and the sugar water preference in rTMS group,which were insignificantly differ⁃ent from control group(P>0.05),were higher than those in sham group and depression group(P<0.01).The immobility times of FST in rTMS group and control group were shorter than sham group and depression group(P<0.01).Compared with rTMS group and control group,GR and GR mRNA expression levels in the hippocampus were significantly reduced in sham group and depression group(P<0.01).Conclusion rTMS can improve depression behavior of CUMS rats,which may be associated with upregulation of GR expression in the hippocampus.
【Key Words】Depression Repetitive transcranial magnetic stimulation Rats Glucocorticoid receptor
近年来,大量研究表明抑郁症患者大脑诸多区域糖皮质激素受体(glucocorticoid receptor,GR)表达有所减少[1],在与情绪、认知及应激调节等均有重要关系的海马组织中,角回3(cornu ammonis 3,CA3)区、齿状回(fascia dentate,DG)区等均呈现GR表达减少[2-3]。动物研究表明抗抑郁剂能上调GR表达水平,经长期抗抑郁治疗后,GR mRNA浓度及GR的糖皮质激素结合活性均升高[4]。作为一种无创、安全的物理治疗手段,重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS)在抑郁症的治疗中已广泛应用。其抗抑郁作用可能与诸多神经生物学改变有关[5-6],那么rTMS是否能通过上调海马区GR蛋白表达水平,改善大脑功能以达到抗抑郁效果呢?本研究通过孤养联合慢性温和不可预见应激(chronic unpredictability stim⁃ulus,CUMS)建立大鼠抑郁模型,观察rTMS刺激对大鼠抑郁样行为的改善作用,并观察海马区GR及其mRNA表达情况。
1 材料与方法
1.1实验动物与建模 75只同批次健康成年雄性Sprague-Dawley(SD)大鼠,体重220~270 g,河南省实验动物中心提供(合格证号:No.41003100001498)。适应实验室环境1周,动物饲养房间温度24~26℃,12 h/12 h明暗循环照明。大鼠随机分为造模组(60只)和空白对照组(15只)。造模组单笼饲养,参照Willner[7]的CUMS方法制备抑郁模型,即禁食24 h、禁水24 h、昼夜颠倒24 h、冰水游泳5 min、束缚2 h、夹尾2 min、电击足底(每次10 s,间歇5 s,共10次)共7种刺激,每日1种随机安排,同种刺激不连续出现以使动物不能预料刺激的发生,共21 d。空白对照组正常饲养,4只/笼。
1.2分组与处理 经行为学评估从造模组中筛选造模成功的大鼠45只,随机分为rTMS组、伪rTMS组和抑郁对照组,每组15只。
rTMS组大鼠造模结束后即给予3周rTMS刺激,rTMS采用CCY-Ⅰ型磁刺激仪及环形动物线圈,线圈直径约70 mm,刺激时固定大鼠头部,线圈平面与大鼠大脑半球相切,刺激频率为10 Hz,刺激量100%MT,每天20串,每串50个脉冲,每2串刺激之间间歇15 s,共1000次脉冲[8],连续5 d为1个疗程,每2个疗程间隔2 d,共3个疗程的干预[9]。伪rTMS组置于相同的环境,线圈不通电,即不给予电流脉冲,只有同样次数的声音刺激。抑郁对照组不给予干预。治疗期间“空白对照组”对照组正常喂养,其余各组继续给予孤养联合CUMS以避免抑郁模型自行退化。
1.3行为学评估
1.3.1体重测量 于造模前、造模后以及完成rTMS干预后分别对各组大鼠进行体重测量,计算体重增长率[体重增长率=(此次体重-前次体重)/前次体重×100%],评估大鼠体重变化趋势。
1.3.2蔗糖水消耗实验 分别于造模前、造模后及rTMS干预后次日清晨(8:00),各组大鼠行24 h禁食水,然后测定大鼠1 h内每100 g体质量1%蔗糖水消耗量。蔗糖水消耗量(mL/100g)=蔗糖水饮用量(mL)/体重(g)×100。
1.3.3强迫游泳测试 强迫游泳实验在造模后及rTMS干预后进行(9:30~11:30),把大鼠放在40 cm水深(温度24~26℃)的透明玻璃容器(高25 cm,直径14 cm)中被迫游泳。每次测试6 min,记录后4 min大鼠的不动时间。每只大鼠单独进行测试,每组大鼠分别平行逐一进行,以确保各组间无测试时间偏倚。由2名研究者同时观察,取其记录结果的平均值。
1.4检测GR表达水平 每组随机选取9只大鼠,将大鼠麻醉后用4%多聚甲醛溶液灌注内固定后,断头取出全脑,4%多聚甲醛溶液外固定后进行脑组织脱水、包埋及切片制作(由于灌注取脑时伪rTMS组和对照组各有1只大鼠灌注失败,每组最终保留8只检测GR)。采用免疫组织化学法检测海马区GR蛋白,使用即链霉亲和素(strept avi⁃din-biotin complex,SABC)免疫组化染色试剂盒(SA2002⁃兔IgG),按说明书操作,以DAB显色,PBS缓冲液代替一抗作为阴性对照。采用Leica Application Suite图像采集系统采集海马CA3区及DG区GR阳性蛋白染色图片,采用Image-Pro Plus 6.0图像分析软件测定每张图片中GR阳性染色的平均光密度值,以反映GR表达水平。
1.5检测GR mRNA表达水平 将各组剩余的6只大鼠进行腹腔麻醉后迅速离断头部,参照大鼠脑解剖图谱,冰块上分离取出海马组织,置于冷冻管后迅速放于液氮中,然后转移至-70℃低温冰箱,保存备用。采用逆转录PCR(reverse transcription PCR,RT-PCR)法检测海马GR mRNA及内参基因GAPDH水平。反应体系为cDNA模板液2µL、上游引物(10 μmol/L)1µL、下游引物(10 μmol/L)1µL、4×d NTP mix(10μmol/L)0.5µL、Taq DNA聚合酶0.2µL、Taq DNA缓冲液2.5µL、去离子双蒸水17.8µL。GR上游引物5’-ACTGCCCAGCATGCCG CTAT-3’,下游引物5’-TGCAATCACTTGACGCCC ACCT-3’,片段长度302 bp。GAPDH上游引物5’-GGGCTCTCTGCTCCTCCCTCT-3’,下游引物5’-CCGTTGAACTTGCCGTGGGT-3’,片段长度244 bp。扩增条件为95℃预变性2 min,95℃变性20 s,62℃退火20 s,72℃延伸60 s,共30个循环,最后72℃延伸2 min,15℃终止反应。扩增完成后将PCR反应产物即行电泳,并于UVI凝胶成像系统照像,GAS7001B凝胶图像分析软件测定光密度,用以表示PCR产量。目的基因GR mRNA的相对表达量为目的基因的PCR产量经内参基因GAPDH的PCR产量校正后比值(相对表达量=目的基因产物光密度/内参基因产物光密度)。
1.6统计学方法采用SPSS 20.0进行统计分析。大鼠体重增长率、蔗糖水消耗量和强迫游泳不动时间的分析采用重复测量资料方差分析,简单效应分析采用单因素方差分析进行各时点上4组间比较,rTMS干预后各组大鼠海马GR和GR mRNA表达水平的比较采用单因素方差分析,组间两两比较采用LSD法。检验水准α为0.05,双侧检验。
2 结果
2.1造模前后及rTMS干预后行为学评估结果 重复测量方差分析示,大鼠造模后和干预后体重增长率的分组与时间交互作用具有统计学意义(F= 4.13,P=0.02);造模前、造模后和干预后大鼠蔗糖水消耗量的分组与时间交互作用有统计学意义(F= 22.35,P<0.01);造模前、造模后和干预后强迫游泳不动时间的分组与时间交互作用具有统计学意义(F=150.51,P<0.01)。
进一步分析,造模前,各组大鼠体重、蔗糖水消耗量及强迫游泳不动时间比较差异均无统计学意义(P>0.05)。造模后,4组大鼠的体重增长率差异有统计学意义(F=8.58,P<0.01),蔗糖水消耗量(F=35.69,P<0.01)和强迫游泳不动时间(F= 70.06,P<0.01)差异亦均有统计学意义,其中rTMS组、伪rTMS组、抑郁对照组分别与空白对照组相比,体重增长率较低(P<0.01),蔗糖水消耗量减少(P<0.01),强迫游泳不动时间延长(P<0.01),而3组间比较差异均无统计学意义(P>0.05),提示造模成功。见表1。
rTMS干预后,4组大鼠的体重增长率差异有统计学意义(F=13.93,P<0.01),其中rTMS组与空白对照组差异无统计学意义(P=0.23),伪rTMS组和抑郁对照组间无统计学差异(P=0.88),但均比rTMS组和空白对照组低(P<0.01)。rTMS干预后,4组大鼠蔗糖水消耗量(F=43.68,P<0.01)和强迫游泳不动时间(F=180.44,P<0.01)差异有统计学意义,rTMS组相比伪rTMS组、抑郁对照组蔗糖水消耗量增高(P<0.01),强迫游泳不动时间减少(P<0.01),rTMS组与 对照组间亦有统计学差异(P<0.01),伪rTMS组与抑郁对照组间各项行为学指标差异均无统计学意义(P>0.05),而该2组与 对照组的差异有统计学意义(P<0.01)。见表1。
2.2海马CA3区、DG区GR蛋白表达水平 rTMS干预后,各组大鼠间海马CA3区(F=170.83,P<0.01)和DG区(F=274.93,P<0.01)GR蛋白表达水平差异有统计学意义。rTMS组大鼠海马CA3区和DG区GR蛋白表达水平与伪rTMS组、抑郁对照组相比均较高(P<0.01),与空白对照组无统计学差异(P>0.05);伪rTMS组、抑郁对照组则均较空白对照组低(P<0.01),而伪rTMS组与抑郁对照组相比差异无统计学意义(P>0.05)。见表2及图1。
2.3海马GR mRNA表达水平 rTMS干预后,各组大鼠海马GR mRNA表达量差异有统计学意义(F= 99.06,P<0.01)。rTMS组海马GR mRNA表达量与伪rTMS组、抑郁对照组相比较高(P<0.01),与空白对照组比较无统计学差异(P=0.06);伪rTMS组和抑郁对照组海马GR mRNA表达量均较空白对照组低(P<0.01),而伪rTMS组与抑郁对照组间差异无统计学意义(P=0.28)。见表3。
表1 造模前、造模后及干预后大鼠行为学评估结果(±s)

表1 造模前、造模后及干预后大鼠行为学评估结果(±s)
1)与空白对照组比较,经LSD-t检验,P<0.01;2)与伪rTMS组比较,经LSD-t检验,P<0.01;3)与抑郁对照组比较,经LSD-t检验,P<0.01
组别n 造模前体重蔗糖水消耗量(mL/100g)rTMS组伪rTMS组抑郁对照组空白对照组15 15 15 15 242.00±16.34 249.00±17.44 244.33±26.11 246.67±25.19体重增长率造模后22.56%±7.47%1)22.99%±6.67%1)23.59%±5.82%1)37.49%±5.89%干预后35.42%±6.94%2)3)19.76%±9.77%1)20.36%±12.65%1)40.18%±12.83%造模前2.73±0.41 2.59±0.52 2.76±0.67 2.69±0.77造模后1.67±0.651)1.60±0.511)1.74±0.291)3.45±0.75干预后4.41±0.911)2)3)2.45±0.481)2.02±0.681)3.61±0.33组别 强迫游泳不动时间(s)rTMS组伪rTMS组抑郁对照组空白对照组造模前60.00±13.09 58.33±8.59 56.67±10.47 61.67±12.05造模后179.33±23.061)183.67±19.501)167.00±34.681)71.00±17.85干预后87.67±12.521)2)3)175.33±20.311)177.33±18.691)64.67±14.94
表2 干预后大鼠海马CA3区、DG区GR蛋白表达水平(±s)
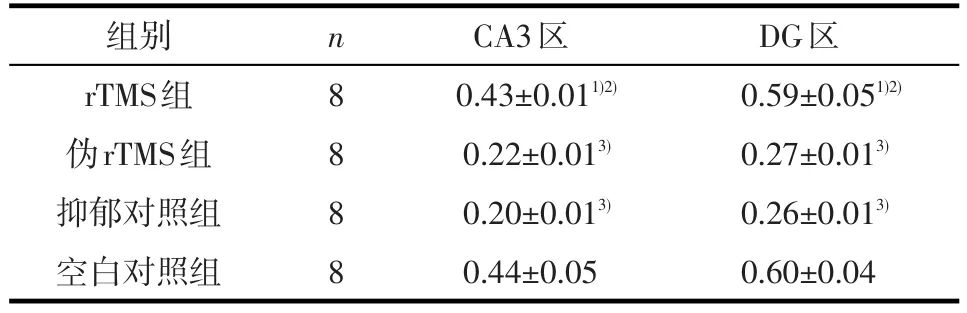
表2 干预后大鼠海马CA3区、DG区GR蛋白表达水平(±s)
1)与伪rTMS组比较,经LSD-t检验,P<0.01;2)与抑郁对照组比较,经LSD-t检验,P<0.01;3)与空白对照组比较,经LSD-t检验,P<0.01
组别rTMS组伪rTMS组抑郁对照组空白对照组n8 8 8 8 CA3区0.43±0.011)2)0.22±0.013)0.20±0.013)0.44±0.05 DG区0.59±0.051)2)0.27±0.013)0.26±0.013)0.60±0.04
表3 各组大鼠海马GR mRNA相对表达量(±s)

表3 各组大鼠海马GR mRNA相对表达量(±s)
1)与伪rTMS组比较,经LSD-t检验,P<0.01;2)与抑郁对照组比较,经LSD-t检验,P<0.01;3)与空白对照组比较,经LSD-t检验,P<0.01
GR mRNA相对表达量0.40±0.031)2)0.21±0.023)0.19±0.023)0.44±0.04组别rTMS组伪rTMS组抑郁对照组空白对照组n6 6 6 6
3 讨论
孤养联合CUMS是制备抑郁动物模型的经典方法,21 d的CUMS制模后,利用体重变化评估、蔗糖水消耗实验和强迫游泳实验评估抑郁模型制备是否成功[10-11]。本研究表明,慢性应激后,造模组大鼠体重增长率、蔗糖水消耗量明显减少,强迫游泳不动时间延长,说明抑郁模型大鼠制备成功。而rTMS干预后,rTMS组大鼠体重增长率、蔗糖水消耗量明显高于抑郁对照组,强迫游泳不动时间低于抑郁对照组;伪rTMS组各项结果较抑郁对照组未见明显差异。这提示rTMS具有抗抑郁作用。SACHDEV等[12]使用1~25 Hz rTMS对抑郁模型大鼠进行干预,结果显示高频及低频rTMS均可使大鼠强迫游泳不动时间显著缩短。本研究采用10 Hz的rTMS进行研究,结果与之相符。
GR是抑郁症发生、发展及转归中的重要角色。GR调控的转录激活能够导致包括钙结合蛋白、突触小体相关蛋白(synatosome-associated pro⁃tein,SNAPs)等对细胞内信号转导、代谢、神经结构、突触可塑性和记忆等具有关键功能的蛋白基因发生转录[13]。另一方面,GR能迅速控制谷氨酸的释放,调节突触传递可塑性[14]。GR还能通过调节TrkB及cAMP依赖的信号通路来调节神经营养因子(brain-derived neurotrophic factor,BDNF)相关信号传导[15]。GR另一重要作用是对下丘脑-垂体-肾上腺(hypothalamus pituitary adrenal,HPA)系统进行负反馈抑制调节[16]。既往研究表明抑郁动物模型海马区GR的表达量降低[17]。与文献结果相一致,本研究也表明,慢性应激导致抑郁模型大鼠海马区GR阳性蛋白减少,GR mRNA表达水平降低。
诸多研究表明rTMS能够调节大脑神经环路,改变脑内神经递质及内分泌水平等,从而发挥情绪调节作用[18]。本研究结果显示,给予21 d的rTMS干预后,大鼠海马区GR蛋白表达水平比抑郁对照组增多,GR mRNA表达量明显上调。该结果与HEYDENDAEL等[4]所观察到的三环类抗抑郁剂丙咪嗪能够提高抑郁大鼠前额叶、室旁核等脑区GR表达量的结果相一致。结合大鼠行为学表现及GR生物学功能,推测海马区GR含量减少与慢性应激所致的大鼠抑郁样表现密切相关[19],而rTMS可能通过上调海马区GR表达量来改善抑郁症状。
本研究从GR的生物学功能及其在抑郁症中生物学改变着手,观察rTMS改善慢性应激抑郁模型大鼠抑郁行为的同时,大鼠海马区GR表达情况的变化,推测rTMS抗抑郁作用可能与GR水平有关。本研究的不足之处是仅从GR表达数量方面探讨rTMS对GR的影响,未能探究GR受体结合能力等功能性改变,GR表达调节涉及到相关的第二信使途径及cAMP-PKA途径等,本研究未能在更深层面了解其是通过何种途径来改变GR的表达,期待在以后的实验中进行更加深入的研究。

图1 4组大鼠海马区GR蛋白免疫组化图(10×20倍)A:rTMS组CA3区;B:伪rTMS组CA3区;C:抑郁对照组CA3区;D:空白对照组CA3区;E:rTMS组DG区;F:伪rTMS组DG区;G:抑郁对照组DG区;H:空白对照组DG区
[1]MORAITIS AG,BLOCK T,NGUYEN D,et al.The role of glu⁃cocorticoid receptors in metabolic syndrome and psychiatric ill⁃ness[J].J Steroid Biochem Mol Biol,[2016-03-18].http://dx. doi.org/10.1016/j.jsbmb.2016.03.023.
[2]LIN YT,LIU TY,YANG CY,et al.Chronic activation of NPF⁃FR2 stimulates the stress-related depressive behaviors through HPA axis modulation[J].Psychoneuroendocrinology,2016,71:73-85.
[3]CHIBA S,NUMAKAWA T,NINOMIYA M.Chronic restraint stress causes anxiety and depression-like behaviors,downregu⁃lates glucocorticoidreceptor expression,and attenuates glutamate release induced by brain-derived neurotrophic factor inthe pre⁃frontal cortex[J].Prog Neuropsychopharmacol Biol Psychiatry,2012,39(1):112-119.
[4]HEYDENDAEL W,JACOBSON L.Differential effects of imip⁃ramine and phenelzine on corticosteroid receptor gene expres⁃sion in mousebrain:potential relevance to antidepressant re⁃sponse[J].Brain Res,2008,1238:93-107.
[5]GAO F,WANG S,GUO Y,et al.Protective effects of repetitive transcranial magnetic stimulation in a rat model of transient ce⁃rebral ischaemia:a microPET study[J].Eur J Nucl Med Mol Im⁃aging,2010,37(5):954-961.
[6]NODA Y,SILVERATEIN WK,BARR MS,et al.Neurobiologi⁃cal mechanisms of repetitive transcranial magnetic stimulation of the dorsolateral prefrontal cortex in depression:a systematic review[J].Psychol Med,2015,45(16):3411-3432.
[7]WILLNER P.Animal models as simulations of depression[J]. Trends Pharmacol Sci,1991,12(4):131-136.
[8]LEFAUCHEUR JP,ANDRÉ-OBADIA N,ANTAL A,et al.Evi⁃dence-based guidelines on the therapeutic use of repetitive tran⁃scranial magnetic stimulation(rTMS)[J].Clinical Neurophysiolo⁃gy Official Journal of the International Federation of Clinical Neurophysiology,2014,125(11):2150-2206.
[9]白冰.rTMS对抑郁模型大鼠学习记忆及海马突触可塑性的影响[D].新乡医学院,2014.
[10]王琼,罗晓敏,邵枫,等.两种慢性应激诱导的抑郁模型大鼠前额叶认知功能的比较研究[J].中国神经精神疾病杂志,2012,38(8):449-453.
[11]余早勤,张程亮,向道春,等.不同抗抑郁药在小鼠体内的时辰药理学研究[J].中国神经精神疾病杂志,2014,40 (12):705-709.
[12]SACHDEV PS,MCBRIDE R,LOO C,et al.Effects of different frequencies of transcranial magnetic stimulation(TMS)on the forced swim test model of depression in rats[J].Biol Psychiatry, 2002,51(6):474-479.
[13]FINSTERWALD C,ALBERINI CM.Stress and glucocorticoid receptor-dependent mechanism in long-term memory:from adaptive responses to psychopathologies[J].Neurobiol Learn Mem,2014,112:17-29.
[14]POPOLI M,YAN Z,MCEWEN BS,et al.The stressed synapse:the impact of stress and glucocorticoids on glutamate transmis⁃sion[J].Nat Rev Neurosci,2012,13(1):22-37.
[15]JI Y,PANG PT,FENG L,et al.Cyclic AMP controls BDNF-in⁃duced TrkB phosphorylation and dendritic spine formation in mature hippocampal neurons[J].Nat Neurosci,2005,8(2):164-172.
[16]PARIANTE CM,MILLER AH.Glucocorticoid receptors in ma⁃jor depression:relevance to pathophysiology and treatment[J]. Biol Psychiatry,2001,49(5):391-404.
[17]CHIBA S,NUMAKAWA T,NINOMIYA M.Chronic restraint stress causes anxiety-and depression-like behaviors,downregu⁃lates glucocorticoid receptor expression,and attenuates gluta⁃mate release induced by brain-derived neurotrophic factor in the prefrontal cortex[J].Prog Neuropsychopharmacol Biol Psy⁃chiatry,2012,39(1):112-119.
[18]廖力维,王继军.重复经颅磁刺激治疗精神障碍作用机制[J].中国神经精神疾病杂志,2013,39(9):573-576.
[19]WU X,WU J,XIA S,et al.Icaritin opposes the development of social aversion after defeat stress via increases of GR mRNA and BDNF mRNA in mice[J].Behav Brain Res,2013,256:602-608.
(责任编辑:肖雅妮)
The effect of repetitive transcranial magnetic stimulation on behaviors and hippocampal GR protein ex⁃pression in depression model rats.
REN Huicong,GU Shina,ZHAO Lin,LI Wenqiang,ZHANG Zhaohui.
The second af⁃filiated hospital of Xinxiang Medical University,Xinxiang 453002,China.Tel:0373-3388112.
R749.4
A
10.3969/j.issn.1002-0152.2016.07.008
☆河南省高等学校重点科研项目(编号:16A320044);新乡市科技攻关计划项目(编号:ZG15019)
*新乡医学院第二附属医院(新乡 453002)
(E-mail:zzhui816@126.com)
2016-01-20)

