降钙素原监测与血液病合并感染患者的临床相关性分析
郑佳佳,孙爱宁,张彤彤,陈苏宁,常伟荣,张险峰,吴德沛
降钙素原监测与血液病合并感染患者的临床相关性分析
郑佳佳,孙爱宁,张彤彤,陈苏宁,常伟荣,张险峰,吴德沛
目的 探讨降钙素原(PCT)定量检测及监测其动态变化在血液病化疗及移植相关感染患者中的临床应用价值。方法 收集并回顾性分析苏州大学附属第一医院血液科497例血清PCT阳性(>0.5μg/L)的血液病患者的临床资料,比较PCT水平在感染性休克、血流感染及不同菌种之间的差异。应用受试者工作特征曲线(ROC曲线)进行评价,明确PCT在血流感染中的诊断价值。检测患者第一次发热时、使用抗菌药物治疗后第3、7、14、21、28天血清PCT水平,比较感染控制组和感染迁延组及感染恶化组间PCT的变化规律以及PCT变化在预测感染控制中的作用。结果 497例PCT阳性患者中421例(84.7 %,421/497)为实验室或临床确诊感染,其中发热24 h内PCT即阳性的有296例(70.3 %,296/421);发生感染性休克(14.0 %,59/421)和未发生感染性休克(86.0 %,362/421)患者PCT中位值分别为6.29μg/L 和1.16μg/L,两者PCT值差异有统计学意义(P<0.01);421例感染患者中有408例同时行血培养检查,其中血培养阳性167例(40.9 %,167/408),血培养阴性240例(58.8 %,240/408),1例曲霉污染,两组PCT中位值分别为2.47μg/L、1.15μg/ L,差异有统计学意义(P<0.01)。167例血培养阳性患者中,革兰阴性菌感染(64.7 %,108/167)和革兰阳性菌感染(22.2 %,37/167)患者PCT中位值分别为4.32μg/L和1.39μg/L,差异具有统计学意义 (P<0.01)。PCT诊断血流感染的曲线下面积(AUC)是0.670,PCT取2.05μg/L为截点时诊断性能最高,其灵敏度、特异度分别为54.3 %,70.0 %。289例动态监测抗感染治疗后的PCT水平患者中感染控制组192例,感染迁延组71例,感染恶化组26例,3组在抗感染治疗后前3 d的PCT水平无差异,但3d后 PCT水平差异显著。结论 PCT可作为感染尤其血培养阴性感染发热患者较优的快速辅助实验室诊断指标之一,其动态变化对判断感染控制情况及抗菌药物使用均具有重要的指导意义。
降钙素原; 血液病; 血培养; 感染
血液病患者大多由于大剂量化疗、免疫抑制剂、激素等药物的应用使患者粒细胞缺乏,机体抵抗力、抗感染能力下降,同时外周静脉置管的应用使患者粒细胞缺乏期感染发生率可高达53 %~80 %,是最常见致命性并发症[1],因此,对其感染的早期诊断和治疗对预后至关重要。但目前反映感染的敏感标志物很少,如白细胞计数、C反应蛋白等传统反映炎性反应指标,对恶性血液病伴感染的诊断没有明显的特异性[2]。血液细菌学培养阳性是诊断血流感染的唯一金标准,但血培养阳性率仅为10%~20%,且病原菌分离、培养时间长,不能达到早期、快速诊断疾病的要求。降钙素原(PCT)是降钙素的前体,自 1993 年被发现以来,已证实在多种疾病合并感染时升高,并且是粒细胞缺乏早期合并严重细菌感染的一个敏感且特异的指标。我们收集苏州大学附属第一医院血液科住院治疗的血液病患者,回顾性分析PCT 在恶性血液病伴感染患者中的临床价值。
1 材料与方法
1.1一般资料
收集并回顾性分析2012年 5月-2015 年4月在本院血液科住院治疗的血液病化疗或移植期PCT阳性患者的临床资料,对年龄,性别,基础疾病,PCT动态监测结果,病原菌培养结果,影像资料,医院感染日期、时间、部位,抗菌药物使用和病情转归,患者感染的病原菌分布,感染部位,感染率,是否发生感染性休克等相关因素进行统计。将感染患者在抗菌药物干预治疗后病情转归分为感染控制组(痊愈+显效),感染迁延组,感染恶化组,分析其与PCT的关系。
1.2感染的诊断标准
感染性发热标准定义[3]:单次体温>38.5 ℃或38 ℃持续6 h以上且除外其他原因如药物、输血、输液及移植物抗宿主病(GVHD)等所致的发热,即诊断为感染性发热。感染性发热包括:①病原学确诊的感染(MDI),发热且血培养阳性(外周血或中央静脉导管)伴或不伴脓毒症或其他临床感染的症状;②临床确诊的感染(CDI),具备细菌感染的临床表现且有细菌感染的症状、体征,影像学检查发现感染灶,抗菌药物治疗有效,但血培养阴性,包括上呼吸道感染、肺部感染、尿路感染、皮肤软组织感染、消化道感染等;③未明原因发热(FUO),体温>38 ℃至少1 h或12 h内发热2次无明显原因,未查及感染灶,病原学及影像学检查无阳性发现。粒细胞缺乏的标准为中性粒细胞(ANC)<0.5×109/ L。感染性休克参照 2001 年美国胸科医师学会、危重病医学会共识会议制定的诊断标准(ACCP/ SCCM 2001)。
1.3临床疗效评估
根据卫生部颁布的《抗菌药物临床研究指导原则》,将抗菌药物临床疗效分为痊愈、显效、进步、无效4级。痊愈:治疗后症状、体征、实验室检查结果及病原学检查结果均恢复正常;显效:治疗后病情好转,但上述4项中有1项未完全恢复正常;进步:用药后病情好转,但不够明显;无效:用药72h后病情无明显进步或加重。
1.4方法
1.4.1PCT检测 患者均抽取静脉血 2mL,采血清为标本,采用电化学发光法,试剂盒由德国柏林 BRAHAMS Diagnostica公司提供,采用罗氏全自动荧光免疫分析仪,≥0.5μg/L为阳性阈值。首次测定在抗感染治疗前,并动态监测抗感染治疗后PCT变化。
1.4.2其他检查方法 所有患者当体温高于 38.5℃时,在全病程中均作3 次血培养。血培养方法:抽取肘正中静脉血 5 mL,采用法国生物酶里埃公司BACT/ALERT 培养基、BACT/ALERT-3D 型血培养仪。有呼吸系统症状或体征的患者并行胸部 64 排 CT 检查。
1.5统计学分析
采用 SPSS 21.0 统计软件进行数据分析。PCT数据均先进行正态分析,如数据为非正态性分布,数据表述方式为中位数,数据间比较采用非参数检验。应用受试者工作特征曲线(ROC曲线)-曲线下面积(AUC)图分析PCT诊断血流感染的临床价值。以 P <0.05 为差异有统计学意义。
2 结果
2.1患者的一般临床及感染特征
497例血液病患者在化疗或移植期间监测血清PCT水平首次>0.5 μg/L,其中有421(84.7 %,421/497)例发生感染。男性242例,女性179例;年龄8~72 岁,中位年龄 36.5 岁。行造血干细胞移植193例,化疗228例;急性髓细胞白血病152例、急性淋巴细胞白血病98例、恶性淋巴瘤58例、骨髓增生异常综合征26例、重型再生障碍性贫血27例、多发性骨髓瘤患者19例、慢性粒细胞白血病11例、慢性粒单核细胞白血病6例、其他恶性血液病24例。408例行血培养检查中167例阳性。有253例感染主要表现在口腔黏膜、上呼吸道、肺、肛周、泌尿道、肠道及皮肤软组织等,往往伴不同部位的合并感染;其中肺部感染74例、肠道消化道黏膜炎40例、肛周感染10例、皮肤软组织感染7例、泌尿道感染6例、上呼吸道感染5例、口腔黏膜炎4例、不同部位合并感染64例、粒细胞缺乏期不明原因感染43例。 PCT中位值在年龄结构、性别比例、疾病类别、感染部位等方面差异均无统计学意义。
2.2PCT与感染性休克的关系
血液病合并感染患者中发生感染性休克59例(14.0 %),未发生感染性休克362例(86.0 %),感染性休克者血清 PCT 水平总体高于未发生者,两者比较差异有统计学意义(P<0.01),见表1。
2.3PCT和血培养的关系
血液病合并感染421例患者中有408例同时行PCT及血培养检查,其中血培养阳性167例(40.9 %),病原菌分布见表2;血培养阴性240例(58.8 %,),曲霉污染1例;血培养阳性者血清PCT 水平总体高于血培养阴性者,两者比较差异有统计学意义(P<0.01),见表1。
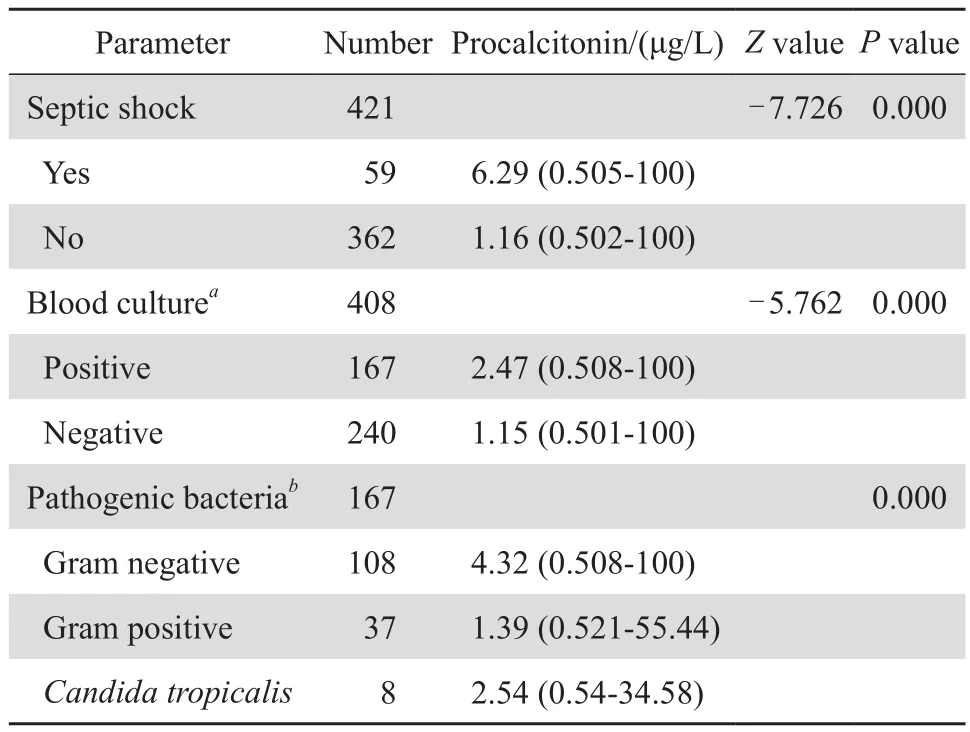
表1 血液病合并感染患者血清PCT与感染性休克、血流感染、菌种的相关性Table 1 Correlation between procalcitonin concentration and septic shock,sepsis,and bacterial species in hematologic patients
2.4PCT与革兰阳性菌、革兰阴性菌的关系
167例血培养阳性患者中革兰阴性菌感染108例(64.7 %),革兰阳性菌感染37例(22.2 %),混合细菌感染14例(8.4 %),真菌感染8例。见表 2。革兰阴性菌感染者较革兰阳性菌感染者PCT明显升高,差异有统计学意义(P<0.01),见表 1。
2.5PCT预测血流感染的价值
预测价值采用ROC曲线分析PCT预测血流感染的价值。血清PCT水平对血培养阳性的ROC曲线曲线下面积(AUC)为0.670,PCT取2.05 μg/ L为截点时预测性能最高,其灵敏度、特异度分别为54.3 %,70 .0%,见图1 。

表2 血流感染的病原菌分布Table 2 Bacterial species of the isolates from blood culture
2.6血清 PCT动态变化与临床转归
421例感染患者中有289例动态监测抗感染治疗前后的PCT水平,其中有192例患者在经有效抗菌药物治疗后感染控制,71例患者感染迁延,26例患者感染恶化(16例因感染加重死亡,其中6例因严重GVHD死亡),各组间PCT水平变化及差异见表3,图2。

图1 PCT水平诊断血流感染ROC曲线Figure 1 The receiver operating characteristic curve of procalcitonin for diagnosis of sepsis
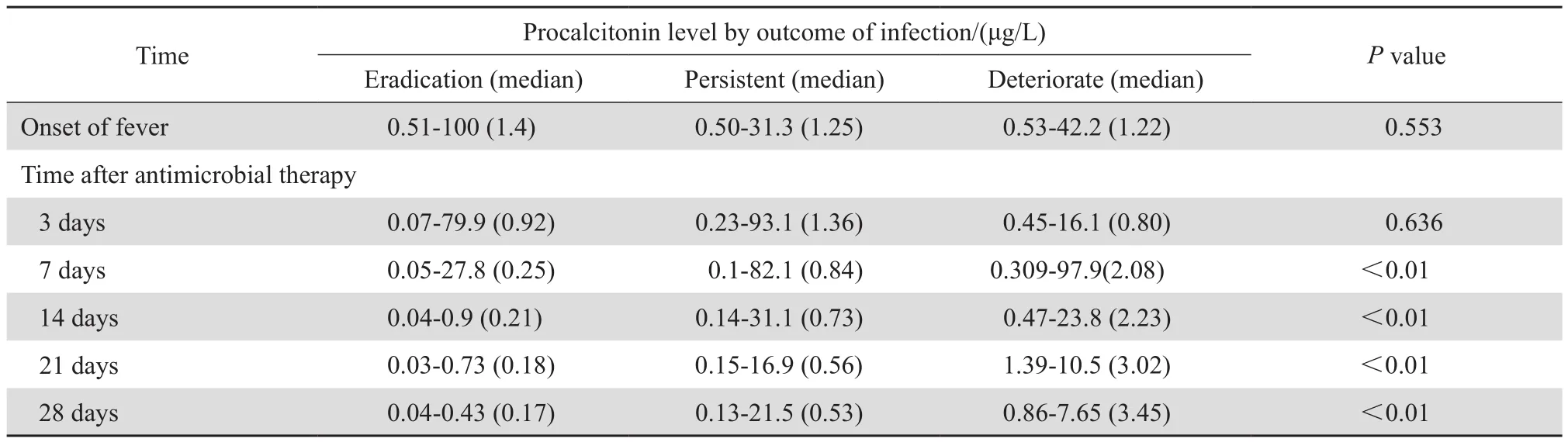
表3 不同转归患者PCT水平比较Table 3 Procalcitonin level in the patients with different outcomes

图2 不同转归患者PCT动态变化Figure 2 The dynamic change of procalcitonin level in terms of different patient outcomes
3 讨论
感染是恶性血液病患者发生临床急危重症的高危因素之一,造血干细胞移植患者合并严重的感染又可诱发GVHD,两者相互影响,进一步增加患者的病死率[4],因此,对其感染的早期诊断、及时治疗对预后至关重要。已证实PCT能在粒细胞缺乏期合并感染的患者中显著升高[5],而且它的升高受激素及免疫抑制剂影响较小,健康人的血清 PCT 水平极低(0.1~0.5 μg/L),在感染发生后2~3 h开始升高,并且与感染的程度成正相关,严重的细菌感染时可升高达 10~100 μg/ L[6];它是早期预测感染的可靠指标[7]。本研究中的血液病患者化疗或移植期常规监测PCT,有84.7 % PCT阳性患者有明确感染,并且多数感染患者在首次发热时 PCT即增高,且发生感染性休克患者的PCT水平较未发生者明显增高(P<0.01);HATZISTILIANOU等[7]、袁正泉等[8]研究发现,血培养阳性患者血清PCT水平较阴性者明显升高,且二者差异有统计学意义,这与我们的结果一致。多项研究表明革兰阴性菌感染者的PCT值显著增高[9-10],本研究血液病伴血流感染患者中革兰阴性菌感染者较革兰阳性菌感染者亦有显著差异,这可能与内毒素是PCT的重要刺激因子有关,在167例血培养阳性感染患者中仅有8例(4.8 %)真菌感染。国外几项研究报道PCT预测血流感染的截点值为1~2 μg/L,灵敏度、特异度分别为44 %~88 %、61 %~88 %[5]。 最 近 由WACKER 等[11]在一项研究中系统性回顾了3 244例血流感染患者,发现PCT预测血流感染的灵敏度、特异度分别为77 %和79 %,ROC曲线下AUC为0.8。本研究结果显示,血清PCT水平对血培养阳性的ROC曲线AUC为0.670,PCT取2.05 μg/L为截点时诊断性能最高,其灵敏度、特异度分别为54.3 % 和70 .0%,与既往文献相符。PCT升高作为感染的预测指标补充了血培养阴性病例的感染确诊依据。PCT的持续降低反映了退热、临床症状的改善、抗感染治疗有效的临床过程,并且不受感染细菌种类及感染类型的影响[12]。我们的数据显示,感染患者经有效抗感染治疗后PCT 水平在第3天即出现明显下降,而随着感染的加重PCT水平逐渐增高,说明动态监测PCT 水平变化趋势对评价恶性血液病患者合并感染的严重程度、判断预后甚至指导治疗具有更为重要的意义。
本研究中15.3 %(76/497)患者PCT阳性,但并未发现明显感染病灶,整个病程也未出现发热,仅有部分患者出现轻微的消化道黏膜炎性反应,这主要是因为PCT水平受系统性炎性反应综合征、创伤、神经内分泌、肿瘤等多种因素的影响,它们可导致PCT水平升高而出现假阳性[13]。
综上所述,监测PCT及其动态变化可作为感染诊断、判断病程和预后的指标,所以对症状不典型、病情变化快的中性粒细胞缺乏患者,感染早期采用快速半定量方法监测血清 PCT 水平,不但对感染的严重程度及抗感染治疗的疗效做出判断,还能帮助临床预测革兰阳性菌与革兰阴性菌感染,尤其是血培养阴性感染发热患者较优的快速辅助诊断方法,从而指导临床更合理的经验性使用抗菌药物。
[1]CROKAERT F. Febrile neutropenia in children[J]. Int J Antimicrob Agent,2000,16(2):173-176.
[2]PETROLA V,TOIKKA P,IRJALA K,et al. Discrepancy between total white blood cell count and serum C-reactive protein levels in febrile children[J]. Scand J Infect Dis,2007,39(6-7):560-565.
[3]HUGHES WT,ARMSTRONG D,BODEY GP,et a1. 1997 guidelines for the use of antimicrobial agents in neutropenic patients with unexplained fever. Infectious Diseases Society of America[J].Clin Infect Dis,1997,25(3):551-573.
[4]夏凌辉,邹萍,胡俊斌,等.造血干细胞移植后并发感染121例的临床分析[J].中华器官移植杂志,2006,27(11):685-688.
[5]SAKR Y,SPONHOLZ C,TUCHE F,et al. The role of procalcitonin in febrile neutropenic patients:review of the literature[J]. Infection,2008,36(5):396-407.
[6]AZEVEDO JR,TORRES OJ,CZECZKO NG,et al. Procalcitonin as a prognostic biomarker of severe sepsis and septic shock[J]. Rev Col Bras Cir ,2012 ,39(6):456-461.
[7]HATZISTILIANOU M,REKLITI A,ATHANASSIADOU F,et al. Procalcitonin as an early marker of bacterial infection in neutropenic febrile children with acute lymphoblastic leukemia[J]. Inflamm Res,2010 ,59(5):339-347.
[8]袁正泉,陈中湘,刘培香.血清降钙素原(PCT)测定对败血症早期诊断的临床意义[J].实用预防医学杂志,2011,18 (12):2394-2395.
[9]BRODSKA H,MALICKOVA K,ADAMKOVA V,et al. Significantly higher procalcitonin levels could differentiate gramnegative sepsis from Gram-positive and fungal sepsis[J]. Clin Exp Med,2013 ,13(3):165-170.
[10]Guo SY,Zhou Y,Hu QF,et al. Procalcitonin is a marker of gram-negative bacteremia in patients with sepsis[J]. Am J Med Sci,2015,349(6):499-504.
[11]WACKER C,PRKNO A,BRUNKHORST FM,et al. Procalcitonin as a diagnostic marker for sepsis:a systematic review and meta-analysis[J]. Lancet Infect Dis,2013,13(5):426-435.
[12]HATZISTILIANOU M,REKLEITY A,ATHANASSIADOUF,et al. Serial procalcitonin responses in infection of children with secondary immunodeficiency[J]. Clin Invest Med,2007,30(2):E75-E85.
[13]BECKER KL,SNIDER R,NYLON ES.Procaleitonin in sepsis and systemic inflammation:a harmful biomarker and a therapeutic target[J].Br J Pharmacol,2010,159(2):253-264.
Clinical significance of procalcitonin monitoring in the hematological patients complicated with infection
ZHENG Jiajia,SUN Aining,ZHANG Tongtong,CHEN Suning,CHANG Weirong,ZHANG Xianfeng,WU Depei. (Jiangsu Institute of Hematology,The First Affiliated Hospital of Soochow University,Collaborative Innovation Center of Hematology,Suzhou Institute of Blood and Marrow Transplantation,Key Laboratory of Thrombosis and Hemostasis of Ministry of Health,Suzhou 215006,China)
Objective To evaluate the clinical value of procalcitonin (PCT) measurement and its dynamic monitoring in the hematological patients complicated with infection while undergoing chemotherapy or transplant. Methods The clinical data were collected and analyzed retrospectively in 497 hematological patients with serum PCT above 0.5 μg/L. The procalcitonin level was compared between the patients with septic shock and those without,between the patients with positive blood culture and those with negative blood culture,and between the patients with gram-positive bloodstream infection and those with gram-negative bloodstream infection.Receiver operating characteristic curve was used to evaluate the diagnostic value of procalcitonin in predicting sepsis. PCT values were collected at the onset of fever and 3,7,14,21,and 28 days after antimicrobial therapy. The dynamic change of PCT after operation was compared between the patients whose infection was successfully controlled and those without adequate control. Results Of the 497 hematological patients with serum PCT value>0.5 μg/L,421 (84.7 %,421/497) were diagnosed with infection based on clinical symptoms and microbiological testing. PCT value increased (>0.5 μg/L) within 24 hours after fever onset in 296 (70.3 %,296/421) patients. The median and range of procalcitonin level (6.29,0.505-100,μg/L) were significantly higher in 59 (14.0 %,59/421) patients with septic shock than in those (86.0 %,362/421) without (1.16,0.502-100,μg/L,Z = -7.726,P<0.01). Of the 408 patients receiving blood culture,the median and range of procalcitonin level was significantly higher in the 167 patients (2.47,0.508-100,μg/L) with positive blood culture than in the 240 patients with negative blood culture (1.15,0.501-100,μg/L,Z = -5.762,P<0.01). Additionally,the median and range of procalcitonin level was significantly higher in the 108 (64.7 %,108/167) patients with gram-negative sepsis (4.32,0.508-100,μg/L) than in the 37 (22.2 %,37/167) patients with gram-positive sepsis (1.39,0.521-55.44,μg/L,Z = -2.024,P<0.01). The area under the curve for PCT was 0.670,whereas a cut-off value of 2.05 μg/L provided the best sensitivity (54.3 %) and specificity (70.0 %),respectively. PCT monitoring in the 289 patients with known outcome of infection showed no significant difference in terms of dynamic PCT change between the patients with deteriorate (n = 26) and persistent (n = 71)infection and those (n = 192) whose infection was successfully eradicated within 72 hours (P>0.05). However,the PCT after 72 hours was significantly different between the three groups (all P<0.01). Conclusion Procalcitonin monitoring could be used as a rapid and supplementary diagnostic marker of infection,especially in blood culture-negative infected patients. The dynamic change of PCT can reflect the status of infection and outcome of antimicrobial therapy.
procalcitonin; hematopathy; blood culture; infection
R552
A
1009-7708(2016)04-0419-05
10.16718/j.1009-7708.2016.04.008
江苏省卫生公益性行业科研专项(201202017);国家高技术研究发展计划(863 计划)(2012AA02A505);江苏省科教兴卫工程-临床医学中心(ZX201102);江苏省自然科学基金(BK20131168);苏州市自然基金(20113201110010)。
苏州大学附属第一医院血液内科,江苏省血液研究所,卫生部血栓与止血重点实验室,血液学协同创新中心,江苏 苏州 215006。
郑佳佳(1991—),女,硕士研究生,主要从事恶性血液病与造血干细胞移植研究。
孙爱宁,E-mail:sunaining@suda.edu.cn。
2015-07-13
2015-09-23

