日香桂根的化学成分研究(III)
张 旭,秦玉琴, 张春艳, 李羽晗, 石继祥, 王 欣, 陆世惠, 黄 静
(四川大学 华西药学院,四川 成都 610041)
·研究简报·
日香桂根的化学成分研究(III)
(四川大学 华西药学院,四川 成都610041)
利用柱层析法(硅胶,C18)从日香桂根的乙酸乙酯提取物中分离出8个单体化合物[女贞苷(1),连翘苷(2),(+)-羟基松脂醇-1-O-β-D-葡萄糖(3),(+)-环橄榄树脂素(4), 2α,3β-二羟基乌苏-12-烯-28酸(5),对羟基苯乙醇(6),(-)-橄榄脂素(7)和橄榄树脂素-4-O-β-D-葡萄糖苷(8)],其结构经1H NMR和13C NMR确证。5为首次在木犀科植物中发现,4为首次在木犀属植物中发现,2, 3, 7和8为首次在日香桂植物中发现。
木犀科; 木犀属; 日香桂; 柱层析法; 化学成分
桂花系木犀科木犀属植物,其果实、枝干、花、根或根皮均有药用价值。其中,桂花根载于具有治疗胃痛、牙痛、风湿麻木、筋骨疼痛等功效[1]。
日香桂是新发现的属于银桂品系的稳定野生变异品种。本课题组曾对日香桂干花的成分进行了系统的化学成分研究[2-3],并且首次开展了对日香桂根的化学成分研究[4-5]。
本文在课题组前期研究的基础上,进一步报道了日香桂根化学成分的研究结果。利用柱层析法(硅胶,C18)从日香桂根的乙酸乙酯提取物中分离出8个单体化合物[女贞苷(1),连翘苷(2),(+)-羟基松脂醇-1-O-β-D-葡萄糖(3),(+)-环橄榄树脂素(4), 2α,3β-二羟基乌苏-12-烯-28酸(5),对羟基苯乙醇(6),(-)-橄榄脂素(7)和橄榄树脂素-4-O-β-D-葡萄糖苷(8), Chart 1],其结构经1H NMR和13C NMR确证。5为首次在木犀科植物中发现,4为首次在木犀属植物中发现,2, 3, 7和8为首次在日香桂植物中发现。
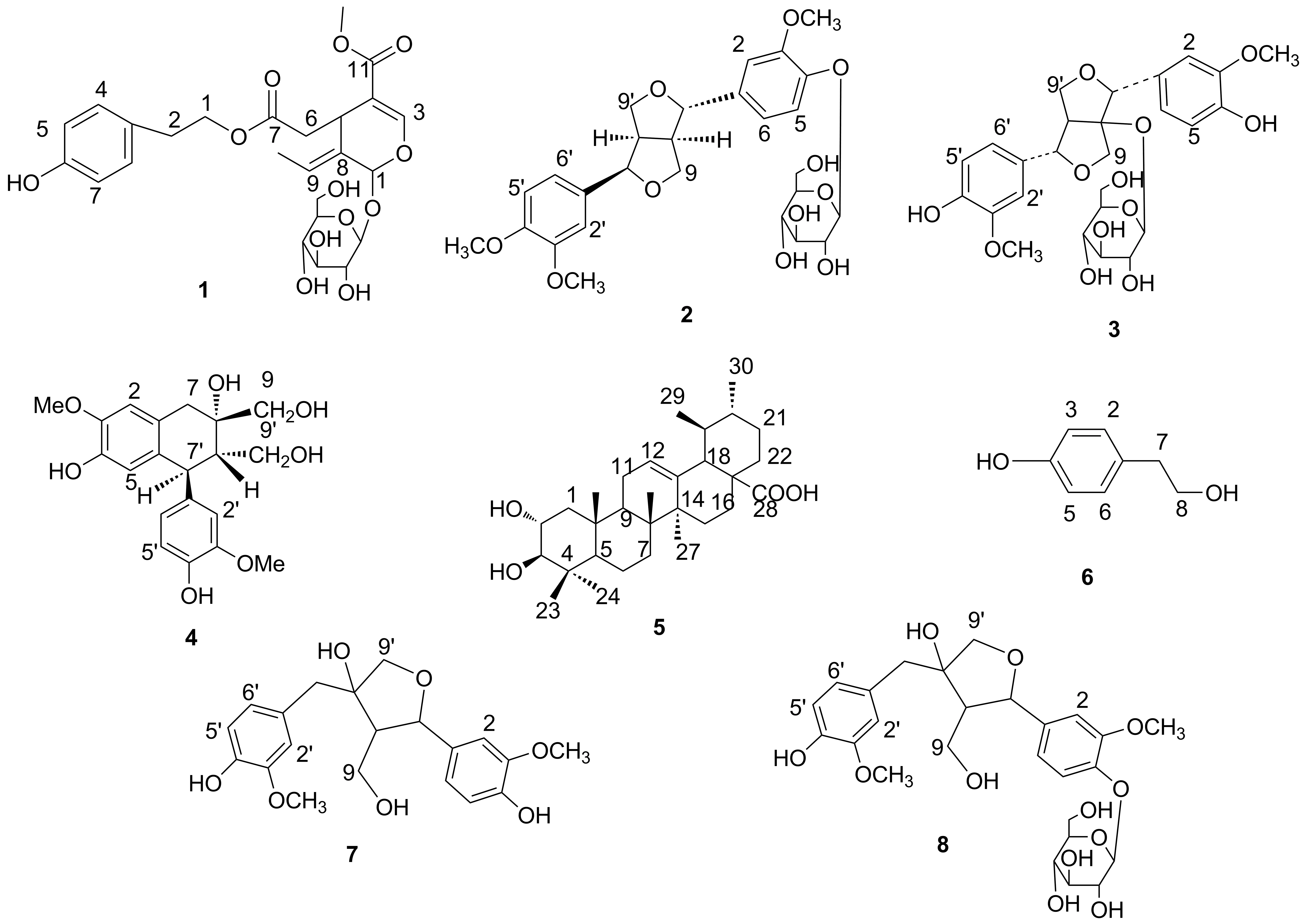
Chart 1
1 实验部分
1.1仪器与试剂
ACE 200型和Varian INO-VA400/54型核磁共振仪(DMSO-d6为溶剂,TMS为内标);RP-C18反相柱;Sephadex LH-20凝胶柱。
日香桂根,2012年9月采自成都市温江区,由黄静教授鉴定为日香桂Osmanthusfragrans‘Rixianggui’的根;其余所用试剂均为分析纯。
1.2提取与分离
桂花根粗粉4.1 kg用70%乙醇浸泡后回流提取两次(每次1.5 h)。过滤,合并提取液,减压浓缩得流浸膏。流浸膏用95%乙醇热溶解后,过滤,滤液减压浓缩至无醇味,残留物加水溶解得水溶液;水溶液依次用石油醚和乙酸乙酯萃取,浓缩得石油醚浸膏,乙酸乙酯浸膏和水浸膏。乙酸乙酯浸膏经硅胶柱层析[梯度洗脱剂:V(二氯甲烷) ∶V(甲醇)=1 ∶0~0 ∶1]分离得7个流份(Ⅰ~Ⅶ)。(分离得7段,由于第一段极性较小所以只有后6段继续进行了硅胶柱分离) Ⅱ~Ⅶ依次经硅胶柱层析[梯度洗脱剂:V(乙酸乙酯) ∶V(甲醇)=1 ∶0~1 ∶1]分离,C18反相柱层析和制备薄层色谱纯化得1~8。
2 结构鉴定
1(甲醇): 白色粉末;1H NMRδ: 苷元单元[5.87(s, 1H, 1-H), 7.51(s, 1H, 3-H), 4.04(m, 1H, 5-H), 2.40(dd,J=14.4 Hz, 9.2 Hz, 1H, 6a-H), 2.62(dd,J=14.4 Hz, 4.0 Hz, 1H, 6b-H), 5.95(q,J=6.8 Hz, 1H, 8-H), 1.61(d,J=6.8 Hz, 3H, 10-H), 3.65(s, 3H, OMe)]; 葡萄糖单元[4.65(d,J=7.6 Hz, 1H, Glc-1-H)]; 苯乙基单元[4.13(t,J=6.8 Hz, 2H, 1-H), 2.74(t,J=6.8 Hz, 2H, 2-H), 7.02(d,J=8.0 Hz, 2H, 4,8-H), 6.67(d,J=8.0 Hz, 2H, 5,7-H)];13C NMRδ: 苷元单元[93.3(C1), 153.9(C3), 108.0(C4), 30.5(C5), 39.9(C6), 171.1(C7), 123.5(C8), 129.4(C9), 13.3(C10), 166.6(C11), 51.7(OCH3)]; 葡萄糖单元[99.3(C1), 73.6(C2), 76.8(C3), 70.3(C4), 77.7(C5), 61.5(C6)]; 苯乙基单元[65.5(C1), 33.8(C2), 128.2(C3), 130.2(C4), 115.5(C5), 156.1(C6), 115.5(C7), 130.2(C8)]。以上数据与文献[6]值基本一致, 故鉴定1为女贞苷。
2(甲醇-二氯甲烷): 针状结晶;1H NMRδ: 7.05~6.86(m, 6H, ArH), 3.76(s, 3H, OCH3), 3.75(s, 3H, OCH3), 3.74(s, 3H, OCH3);13C NMRδ: 显示27个碳信号, 其中12个芳碳信号[135.7(C1), 110.8(C2), 149.3(C3), 146.3(C4), 115.6(C5), 118.6(C6), 131.6(C1′), 109.8(C2′), 148.9(C3′), 148.0(C4′), 111.9(C5′), 117.9(C6′)]; 葡萄糖信号[100.5(C1″), 73.6(C2″), 77.3(C3″), 70.1(C4″), 77.5(C5″), 61.6(C6″)];另有6个脂肪碳信号[87.1(C7), 54.5(C8), 70.7(C9), 81.7(C7′), 49.7(C8′), 69.4(C9′)];此外还有三个甲氧基信号55.8(OCH3)。以上数据与文献[7]报道的数据基本一致, 故鉴定2为连翘苷。
3(甲醇): 无色粉末;1H NMRδ: 7.04~6.66(m, 6H, ArH), 3.77(s, 3H, OCH3), 3.74(s, 3H, OCH3);13C NMRδ: 127.5(C1), 113.9(C2), 146.9(C3), 146.3(C4), 114.4(C5), 121.6(C6), 131.8(C1′), 110.1(C2′), 114.4(C3′), 146.2(C4′), 115.5(C5′), 118.7(C6′); 87.8(C7), 97.8(C8), 72.6(C9), 85.3(C7′), 58.9(C8′), 70.1(C9′);葡萄糖信号[ 98.8(C1″), 73.4(C2″), 77.4(C3″), 70.0(C4″), 77.4(C5″), 61.1(C6″)];2个甲氧基信号55.8(OCH3)。以上数据与文献[8]报道的数据基本一致, 故鉴定3为(+)羟基松脂醇-1-O-β-D-葡萄糖苷。
4(甲醇-二氯甲烷): 针状结晶;1H NMRδ: 6.72~6.52(m, 5H, ArH), 2.44(d,J=17.2 Hz, 1H, 7-Ha), 3.09(d,J=17.2 Hz, 1H, 7-Hb), 1.89(d,J=11.7 Hz, 1H, 8′-H), 3.86(d,J=11.7 Hz, 1H, 7′-H);13C NMRδ: 39.0(C7), 69.4(C8), 68.2(C9), 45.8(C8ˊ), 59.3(C9′), 43.3(C7′), 116.4(C5), 144.1(C6), 145.9(C7), 112.5(C8), 125.4(C9), 112.1(C10), 137.2(C1′), 113.6(C2′), 147.6(C3′), 144.9(C4′), 115.6(C5′), 122.1(C6′), 55.9(OCH3), 55.7(OCH3)。以上数据与文献[9]报道的数据基本一致, 故鉴定4为(+)-环橄榄树脂素。
5(甲醇-二氯甲烷): 白色粉末;1H NMRδ: 0.70(s, 3H, 25-H), 0.74(s, 3H, 24-H), 0.915(s, 6H, 23,29-H);13C NMRδ: 47.2(C1), 67.3(C2), 82.4(C3), 39.1(C4), 54.9(C5), 18.2(C6), 32.8(C7), 40.0(C8), 47.3(C9), 37.8(C10), 23.1(C11), 124.7(C12), 138.4(C13), 41.9(C14), 27.7(C15), 23.5(C16), 47.0(C17), 52.5(C18), 38.7(C19), 39.1(C20), 30.4(C21) 36.5(C22), 29.0(C23), 16.6(C24), 17.1(C25), 17.2(C26), 24.0(C27), 178.5(C28), 17.4(C29), 21.3(C30)。以上数据与文献[10]报道的数据基本一致, 故鉴定5为2α, 3β-二羟基乌苏-12-烯-28-酸。
6(丙酮): 无色固体;1H NMRδ: 7.00(d,J=8.0 Hz, 2H, 2,6-H), 6.67(d,J=8.0 Hz, 2H, 3,5-H), 3.53(dd,J=7.2 Hz, 4.8 Hz, 2H, 8-H), 2.61(t,J=7.2 Hz, 2H, 7-H);13C NMRδ: 155.7(C4), 130.0(C2, 6), 129.7(C1), 115.2(C3, 5), 62.9(C8), 38.5(C7)。参考文献[11]数据, 将6鉴定为对羟基苯乙醇。
7(丙酮): 淡黄色粒状结晶;1H NMRδ: 7.05~6.67(6H, ArH), 4.61(d,J=7.2 Hz, 1H, 7-H), 3.63(d,J=8.8 Hz, 1H, 9′-Ha), 3.45(d,J=8.8 Hz, 1H, 9′-Hb), 2.86(d,J=14.0 Hz, 1H, 7′-Ha), 2.76(d,J=14.0 Hz, 1H, 7′-Hb), 3.75(s, 3H, OCH3), 3.74(s, 3H, OCH3);13CNMRδ: 显示12个芳碳信号[147.7(C3), 47.3(C3′), 146.0(C4), 145.0(C4′), 34.8(C1), 129.6(C1′), 122.9(C6′), 119.6(C6), 115.3(C5), 115.2(C5′), 115.0(C2′), 111.3(C2)]; 6个脂肪碳信号[83.8(C7), 61.0(C8), 59.4(C9), 39.5(C7′), 81.0(C8′), 76.6(C9′)];此外还有2个甲氧基碳信号55.9(OCH3)。参考文献[12]数据, 将7鉴定为(-)-橄榄脂素。
8 (甲醇): 白色粉末;1H NMRδ: 7.03(s, 1H, 2-H), 6.92(s, 1H, 2′-H), 6.96(d,J=8.4 Hz, 1H, 5′-H), 6.55(d,J=8.4 Hz, 1H, 6′-H), 6.78(d,J=7.8 Hz, 1H, 6-H), 6.69(d,J=7.8 Hz, 1H, 5-H), 4.59(d,J=7.2 Hz, 1H, 7-H), 2.14(m, 1H, 8-H), 3.55(m, 1H, 9-Ha), 3.45(m, 1H, 9-Hb), 2.89(d,J=13.8 Hz, 1H, 7′-Ha), 2.80 (d,J=13.8 Hz, 1H, 7′-Hb), 3.62(d,J=9.6 Hz, 1H, 9′-Ha), 3.82(d,J=9.6 Hz, 1H, 9′-Hb), 4.85(d,J=7.2 Hz, 1H, 1′-H);13C NMRδ: 显示12个芳碳信号[148.5(C3), 147.6(C3′), 145.9(C4), 145.3(C4′), 134.7(C1), 132.5(C1′), 122.6(C6′), 119.5(C6), 115.2(C5), 115.1(C5′), 115.0(C2′), 111.3(C2) ]; 6个脂肪碳信号[83.6(C7), 61.1(C8), 59.3(C9), 39.6(C7′), 80.8(C8′), 76.5(C9′)]; 2个甲氧基碳信号[56.0(OCH3), 55.9(OCH3)] 和葡萄糖碳信号[100.5(C1″), 73.6(C2″), 77.3(C3″), 70.0(C4″), 77.2(C5″), 61.0(C6″)]。参考文献[13]数据, 将鉴定8为橄榄树脂素-4-O-β-D-葡萄糖苷。
[1]江苏新医学院. 中药大辞典[M].上海:科学技术出版社,1986.
[2]唐敏,谭小燕,钟雪梅,等. 日香桂花的化学成分研究[J].华西药学杂志,2009,24(1):10-13.
[3]席贞,唐敏,王文静,等. 日香桂花的化学成分研究(Ⅱ)[J].华西药学杂志,2011,26(3):216-220.
[4]刘淼,杨晓燕,彭晓姣,等. 日香桂根的化学成分研究[J].合成化学,2013,21(3):306-308.
[5]黄冕,刘淼,许浩然,等. 日香桂根的化学成分研究(II)[J].合成化学,2013,21(6):689-691.
[6]Zhen D H, Hui D, Hong X X,etal. Secoiridoid constituens from the fruits ofLigustrumlucidum[J].Phytochemistry,2001,56(4):327-330.
[7]Maiada M A, Rahman, Paul M,etal. Lignans ofForsythiaintermeia[J].Phytochemistry,1990,29(6):1971-1980.
[8]孔德云,蒋毅,姚英,等. 伸梗獐芽菜的苷类成分[J].中草药,1995,26(1):7-10.
[9]Sugiyama M, Nagayama E, Kikuchi M,etal. Ligan and phenylpropanoid glycosides fromOsmanthusasiaticus[J].Phytochemistry,1993,33(5):1215-1219.
[10]张前军,杨晓生,朱海燕,等. 连钱草化学成分研究[J].天然产物研究与开发,2006,18(1):55-57.
[11]苑艳光,王录全,吴立军. 刺五加茎的化学成分[J].沈阳药科大学学报,2002,19(5):325-327.
[12]Lee D G, Lee S M, Bang M H,etal. Lignans from theflowers ofOsmanthusfragransvar.aurantiacusand theirinhibition effect on NO production[J].Arch Pharm Res,2011,34(12):2029-2035.
[13]左月明,张忠立,曾金祥,等. 缬草的化学成分研究[J].中草药,2012,43(7):1293-1295.
Studies on the Chemical Components of the Roots ofOsmanthusfragrans‘Rixianggui’(III)
ZHANG Xu,QIN Yu-qin,ZHANG Chun-yan,LI Yu-han,SHI Ji-xiang,WANG Xin,LU Shi-hui,HUANG Jing*
(West China School of Pharmacy, Sichuan University, Chengdu 610041, China)
The chemical components of the roots ofOsmanthusfragrans‘Rixianggui’ were investigated by the chromatography methods(silica gel, C18). Eight compounds[ligustroside (1), phillyrin(2), (+)-hydroxyinoresinol-1-O-β-D-glucoside(3), (+)-cyclo-olivil(4), 2,3-dihydroxyurs-12-en-28-oic acid(5),p-hydroxyphenylethanol(6), (-)-olivil(7) and (-)-olivil-4-O-β-D-glucopyranoside(8)] were isolated from the EA extract of the roots of the title plant. The structures were confirmed by1H NMR and13C NMR. 5 was isolated from the family Oleaceae, 4 from genusOsmanthusand 2, 3, 7, 8 from this plant for the first time.
Oleaceae;Osmanthusfragrans; Rixianggui; chromatography method; chemical constituent
2016-06-12
张旭(1990-),女,汉族,湖南浏阳人,主要从事药物化学的研究。 E-mail: 357526172@qq.com
通信联系人: 黄静,教授,博士生导师, E-mail: huangj_pharm@scu.edu.cn
R284.2
A
10.15952/j.cnki.cjsc.1005-1511.2016.08.16152

