阿魏酸印迹聚合物微球的合成及特异吸附性能
罗孟君(益阳医学高等专科学校,湖南益阳413000)
阿魏酸印迹聚合物微球的合成及特异吸附性能
罗孟君
(益阳医学高等专科学校,湖南益阳413000)
拟制备阿魏酸分子印迹聚合物微球,考察聚合物的特异吸附性能。以阿魏酸为模板分子,丙烯酰胺(AM)为功能单体,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,2,2′-偶氮二异丁腈(AIBN)为引发剂,采用沉淀聚合法合成分子印迹微球,采用静态吸附及扫描电镜(SEM)方法对微球进行表征。制得的印迹聚合物微球的形貌和吸附性能较好,对阿魏酸与肉桂酸的选择性分离因子α为1.97。分子印迹聚合物微球对阿魏酸分子有特异性吸附和识别能力。
沉淀聚合法;分子印迹聚合物;阿魏酸
分子印迹技术(molecular imprinting technology,MIT)是将印迹分子与单体、交联剂在溶液中进行聚合得到高分子聚合物,然后通过物理或化学的方法除去聚合物中的印迹分子,得到在空间和结合位点上与印迹分子完全匹配的聚合物的技术[1-4]。分子印迹聚合物(molecularly imprinted polymer,MIP)具有特异性识别性能,有“塑料抗体”的称号,它具有高选择性、经济性、重复使用周期长、化学性能稳定、环境适应能力强等优点,近年来广泛应用于色谱分离、生物酶模拟、分离材料、人工受体、仿生传感器检测和临床药物分析等领域[5-8]。
阿魏酸(ferulic acid,FA)是一种功能性酚酸[9],在阿魏、当归、升麻、川芎等常用中药植物中与细胞壁多糖和木质素交联构成细胞壁的一部分而广泛存在。它具有很强的抗氧化和抗炎活性,可用于心血管疾病的治疗[10-11]。作为一种广泛存在且具有强大机体保护作用的活性分子,阿魏酸在医药、食品、化妆品等领域的用途越来越广泛。近年来,国内外学者对阿魏酸的来源、在生物体内的合成机制及化学合成方法进行了大量的研究探索[12-14],希望找到一种稳定、高效、经济的获取阿魏酸的途径。
本论文报道以阿魏酸为模板分子,丙烯酰胺(AM)为功能单体,乙二醇二甲基丙烯酸酯(EGDMA)为交联剂,2,2'-偶氮二异丁腈(AIBN)为引发剂,乙腈为致孔剂,采用沉淀聚合法合成了对阿魏酸分子有特异性吸附、识别性能的MIP微球,通过平衡吸附实验和Scatchard分析,对该分子印迹聚合物的结合作用和选择性能进行了研究。
1 材料与方法
1.1试剂和仪器
阿魏酸标准品,美国Sigma公司产品;肉桂酸标准品,美国Sigma公司产品;甲基丙烯酸(纯度99%),美国Sigma公司产品;丙烯酰胺(纯度99%),美国Sigma公司产品;乙二醇二甲基丙烯酸酯(纯度98%),科密欧公司产品;偶氮二异丁腈(化学纯),上海阿拉丁试剂有限公司产品;乙腈(色谱纯),科密欧公司产品。
HH-4型恒温水浴锅,巩义市予华仪器有限责任公司制造;UV-2450型紫外分光光度计,日本岛津公司制造;SEM Hitachi S-4300型扫描电子显微镜,日本日立公司制造;AX-200型电子天平,日本Shimadzu Philippines公司制造;ASAP2020型比表面和孔径分布测定仪,美国Micromeritics Instruments公司制造。
1.2分子印迹聚合物微球的制备
1.2.1功能单体的考察室温下,以乙腈作为溶剂配制一定浓度的阿魏酸溶液,分别与甲基丙烯酸、丙烯酰胺溶液混合,形成复合物。利用紫外分光光度计,分别对甲基丙烯酸、丙烯酰胺与模板分子形成的配合物吸收值进行测定,选出最佳功能单体。
1.2.2功能单体用量的考察为筛选出制备阿魏酸分子印记微球工艺中模板分子与功能单体的最佳配比组合,分别按照模板分子与功能单体的物质的量配比为1∶0、1∶2、1∶4、1∶6的不同组合进行检测,将移取后的两种物质共同溶于一定体积的乙腈中,定容后分别对各溶液进行紫外光谱扫描,根据吸收峰的比较结果选定最佳配比值。
1.2.3阿魏酸分子印迹聚合物微球的制备准确称取0.1 mmol阿魏酸溶于一定量20 mL乙腈中,加入0.4 mmol功能单体AM,于室温下振荡30 min,置于冰箱中过夜,使阿魏酸与AM充分作用,然后加入2 mmol交联剂EGDMA及10 mg引发剂AIBN,混合均匀后,通氮气10 min除氧,密封,将混合液置于恒温水浴箱,60℃热聚合24 h。聚合产物离心获得沉淀,用甲醇与乙酸的混合溶液(体积比8∶2)洗掉模板分子与未参与聚合的反应物,直至洗净,再用甲醇洗去过量的乙酸,于烘箱中45℃真空干燥,所得聚合物为MIP。同时按同样方法不加阿魏酸制备空白聚合物(NIP)。
1.3吸附性能测定
1.3.1分析方法
1)标准溶液的配制:准确称取8 mg阿魏酸放入小烧杯中,加入少许乙腈,待完全溶解后移入500 mL容量瓶中定容。摇匀后得到质量浓度为16 mg/L的阿魏酸储备液。根据储备液分别配制质量浓度为2.0、4.0、6.0、8.0、10.0 mg/L的阿魏酸溶液。肉桂酸的标准溶液依上述步骤同样配制。
2)最大吸收波长的确定:将质量浓度为4 mg/L的阿魏酸和肉桂酸溶液分别进行紫外全波长扫描,得光谱图,据此选择测定所用波长对。测定阿魏酸的波长对为:λ1=271 nm作为测量波长,λ2=255 nm作为参比波长;肉桂酸的波长对为:λ3=292 nm作为测量波长,λ4=325 nm作为参比波长。
3)标准曲线的测定:用阿魏酸标准溶液系列在波长λ1和λ2处分别测定,可得吸光度差值ΔA1与质量浓度C1(mg/L)间的线性关系;用肉桂酸标准溶液系列在波长λ3和λ4处分别测定,可得吸光度差值ΔA2与质量浓度C2(mg/L)间的线性关系。
1.3.2聚合物吸附性能的测定将100.0 mg阿魏酸MIP微球放入40 mL的磨口锥形瓶中,分别加入不同浓度的阿魏酸乙腈溶液,室温振荡吸附24 h,离心分离后取上层清液,用方法1.3.1测定阿魏酸浓度,平行实验3次,根据吸附前后浓度变化计算聚合物的吸附量Q(μmol/g);绘制出吸附量Q与不同浓度关系的静态等温吸附曲线。同时考察NIP微
球的吸附性能。
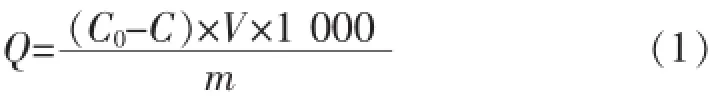
式(1)中:C0为吸附前溶液中阿魏酸的浓度(mmol/ L);C为吸附后溶液中阿魏酸的浓度(mmol/L);m为称取的分子印迹聚合物的质量(mg);V为阿魏酸溶液的体积(mL)。
1.3.3吸附动力学测定分别称取100 mg的MIP 和NIP微球至50 mL的磨口锥形瓶中,分别加入25 mL浓度为2.5 mmol/L的阿魏酸乙腈溶液,然后将其放入恒温振荡器中室温振荡。每隔20 min取20 μL溶液进行色谱分析,测定溶液中阿魏酸浓度,从而分析其吸附动力学性质。
1.3.4MIP微球的选择性考察为了观察MIP微球的选择性识别性能,选用阿魏酸的结构类似物肉桂酸作为竞争底物,在浓度为2.5 mmol/L的乙腈溶液中进行平衡吸附实验,测定达到平衡时溶液中的目标分子浓度,并计算出阿魏酸与肉桂酸的分离因子(α)及分离系数(KD),

式(2)中:cp(mmol/L)表示聚合物结合底物的浓度,cs(mmol/L)表示溶液中底物的平衡浓度。α为2种不同底物的分离系数之比。
1.4聚合物形貌表征分析
利用Hitachi S-4300 SEM扫描电子显微镜对聚合物微球的表面结构和粒径进行分析;利用ASAP2020型比表面和孔径分布测定仪对MIP与NIP的比表面积及孔径参数进行测定。
2 结果与讨论
2.1阿魏酸分子印迹聚合物的制备
2.1.1功能单体的选择分子印迹聚合物的特异吸附性能体现在其对印迹分子的选择性识别能力。通过在相同溶剂与用量条件下,针对两种常用的功能单体与模板分子通过氢键作用形成的配合物在相关波长范围吸光度值的减小情况,对两种功能单体进行比较,筛选出效果最优的功能单体。功能单体的选择通常是通过紫外吸收曲线来测定的,因为模板分子与功能单体进行自组装时主要通过氢键进行作用,氢键的形成对分子轨道的能量有影响,它使基态向激发态跃迁产生能级差,由此使不同组合的复合物在色谱峰上的位置发生变化,氢键作用越强,产生的差异越大,这能更好地说明模板分子与功能单体的结合能力,如图1所示。
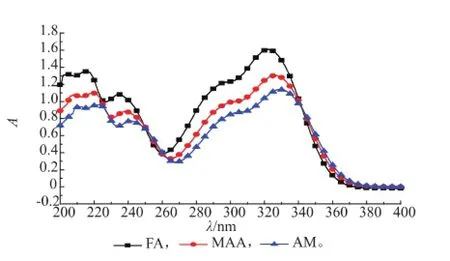
图1 阿魏酸与功能单体之间的作用Fig.1 Interaction between FA and functional monomers
2.1.2模板分子与功能单体用量比率的选择通过紫外吸收曲线测定功能单体与模板分子的比率,按阿魏酸与AM物质的量比分别为1∶0、1∶2、1∶4、1∶6的量进行称取,均溶于25 mL乙腈中作用,紫外光谱分析见图2。
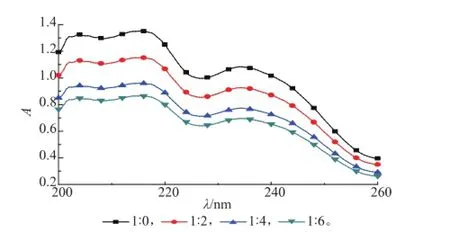
图2 不同比率的阿魏酸与丙烯酰胺吸收光谱Fig.2 Absorption spectra of FA with different proportion of AM in acetonitrile
从图2可以看出,随着模板分子与功能单体比率的增加,吸光度值逐渐减低。FA与AM物质的量比率由1∶2到1∶4时紫外吸收值的变化趋势相对较大,说明此时FA与AM结合位点较多;当物质的量比率由1∶4到1∶6时,紫外吸收值降低得不多,为避免AM过量而发生自身缔合,本实验选择FA与AM的物质的量比率为1∶4。
2.2MIP与NIP对阿魏酸吸附性能的考察
2.2.1标准曲线按照1.3.1方法,分别对阿魏酸与肉桂酸进行紫外检测,根据吸光度差值与质量浓度的关系,分别得到阿魏酸与肉桂酸的标准曲线(图3、图4)。

图3 阿魏酸标准曲线Fig.3 Standard curve of FA
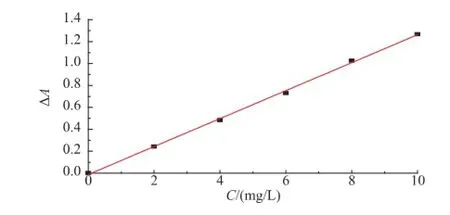
图4 肉桂酸标准曲线Fig.4 Standard curve of CA
其中阿魏酸回归方程为
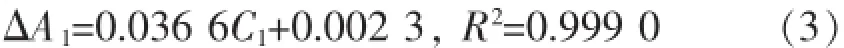
肉桂酸回归方程为
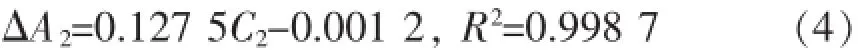
2.2.2吸附量的考察分别考察了MIP与NIP对不同浓度阿魏酸溶液的吸附性能,绘制出了相应的等温吸附曲线,吸附详情见图5。可知,在0.2~5.0 mmol/L范围内,吸附量与溶液浓度成正相关性。同时,印迹聚合物的吸附量明显大于非印迹聚合物,这是由于印迹聚合物中有预定的孔穴,内部官能团能与模板分子作用,而非印迹聚合物中则没有这种孔穴,其对阿魏酸的吸附为非特异性吸附。
父亲用这些钱,做了一顶纱帐,挂在床上,挡住了蚊虫的进攻。这是我们家第一顶蚊帐。做好后的第一晚,父亲让我和弟弟睡在里面,说我是功臣。嘻嘻!
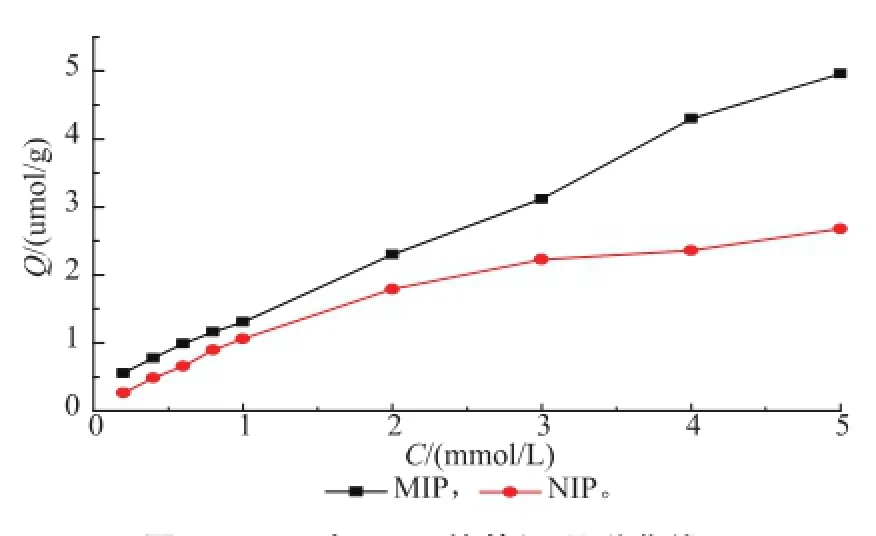
图5 MIP与NIP的等温吸附曲线Fig.5 Adsorption isotherm of FA MIP and NMIP
2.2.3Scatchard分析以Scatchard模型对聚合物的结核性能进行评价:

式(5)中:Kd为结合位点的平衡离解常数,Qmax为结合位点的最大表观结合量(μmol/g),Cmat为吸附达到平衡后阿魏酸的平衡浓度(mmol/L),Q为聚合物对阿魏酸的吸附量(μmol/g)。
以Q/Cmat对Q作图,由图6可见,对于MIP来说,Q/Cmat对Q不是线性关系,说明MIP对阿魏酸的结合位点是不等价的,但其Scatchard曲线可以分为线性关系良好的两段,由此推测MIP有两类不同的吸附。而NIP的Scatchard曲线是线性关系,说明只存在一种类型的吸附。通过对图6中MIP的两段直线的截距和斜率计算得到:Kd1=0.518 mmol/L,Kd2= 13.137 mmol/L,结合位点最大表征结合量Qmax1= 1.918 μmol/g,Qmax2=17.905 μmol/g;通过对NIP的Scatchard曲线截距和斜率计算得到:Kd3= 3.175 mmol/L,结合位点最大表征结合量Qmax3= 4.44 μmol/g。由此可知,印迹聚合物具有很大的特异性吸附,而空白聚合物则没有特异性吸附。
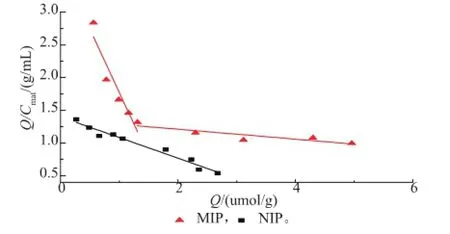
图6 scatchard曲线Fig.6 Scatchard plotanalysis of the binding affinity
2.2.4MIP与NIP微球的吸附动力学对MIP与NIP微球进行吸附动力学测定,结果如图7所示。
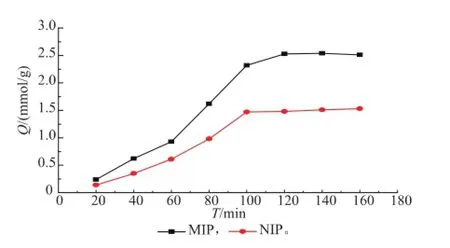
图7 吸附动力学曲线Fig.7 Kinetics of adsorption of MIP and NIP
由图7可知,随着时间增长,MIP对阿魏酸的吸附量逐渐增大,当吸附时间达到100 min,吸附接近饱和。NIP对阿魏酸吸附量不大,随着时间增长,也呈增大的趋势。
2.3MIP微球对底物的吸附选择性考察
以与阿魏酸结构类似的N-甲基-阿魏酸作为竞争底物,在浓度5.0 mmol/L的乙腈溶液中进行平衡吸附实验。实验结果如表1所示。
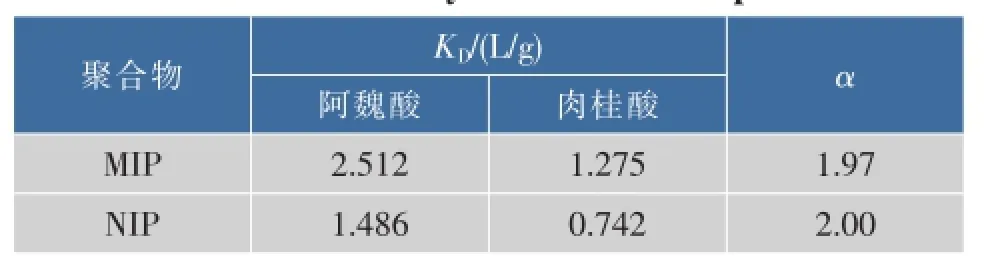
表1 聚合物微球的选择性Table 1 Selectivity of MIP Micro-Spheres
由表1可知,与NIP微球相比,MIP微球对阿魏酸具有较好的选择性。
2.4MIP与NIP扫描电镜分析
用扫描电子显微镜(SEM)分别观测两种微球的形貌,其中MIP微球粒径约2 μm,NIP微球粒径约3 μm。由图8可看出,实验中制备的MIP与NIP形态均一,除NIP粒径较MIP大外,彼此间无明显差异,这可能是制备过程中由于印记分子阿魏酸的存在,使得聚合物的空间排列发生了改变。


图8 MIP与NIP的扫描电镜图Fig.8 SEM photographs of MIP and NIP
2.5MIP与NIP的比表面积与孔径特征
表2列出了MIP与NIP颗粒的氮气吸附实验结果,可见MIP与NIP颗粒的比表面积与孔径参数。
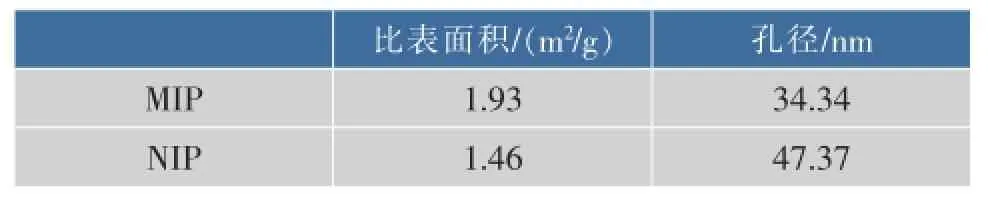
表2 MIP与NIP的部分结构参数Table 2 Structure parameters of MIP and NIP
3 结语
采用沉淀聚合法制备了阿魏酸分子印迹聚合物微球,并对其制备方法进行了初步优化。吸附性能考察实验说明,印记聚合物对阿魏酸分子能选择性吸附,MIP吸附性能较NIP强。吸附选择性实验结果表明,相对于与阿魏酸结构相似的肉桂酸,实验中所制备的MIP微球对阿魏酸有较强的选择结合特性,MIP与NIP对阿魏酸的最大表观结合量分别为17.905 μmol/g与3.175 mmol/L。该方法简单易行,聚合物微球颗粒在2μm左右,为天然产物中阿魏酸的分离提纯提供了一种新的有效途径。
[1]Mosbach K.Molecular imprinting[J].Trends in Biochemical Sciences,1994,19(1):9-14.
[2]Andersson L I.Molecular imprinting:developments and applications in the analytical chemistry field[J].Journal of Chromatography B:Biomedical Sciences and Applications,2000,745(1):3-13.
[3]Bures P,Huang Y,Oral E,et al.Surface modifications and molecular imprinting of polymers in medical and pharmaceutical applications[J].Journal of Controlled Release,2001,72(1):25-33.
[4]Piletsky S A,Alcock S,Turner A P.Molecular imprinting:at the edge of the third millennium[J].TRENDS in Biotechnology,2001,19(1):9-12.
[5]Zhang W,Chen Z.Preparation of micropipette tip-based molecularly imprinted monolith for selective micro-solid phase extraction of berberine in plasma and urine samples[J].Talanta,2013,103:103-109.
[6]Ebrahimzadeh H,Dehghani Z,Asgharinezhad A A,et al.Determination of haloperidol in biological samples using molecular imprinted polymer nanoparticles followed by HPLC-DAD detection[J].International Journal of Pharmaceutics,2013,453 (2):601-609.
[7]Ulbricht M.Membrane separations using molecularly imprinted polymers[J].Journal of Chromatography B,2004,804(1):113-125.
[8]Sergeyeva T A,Slinchenko O A,Gorbach L A,et al.Catalytic molecularly imprinted polymer membranes:Development of the biomimetic sensor for phenols detection[J].Analytica Chimica Acta,2010,659(1):274-279.
[9]Ou S,Kwok K C.Ferulic acid:Pharmaceutical functions,preparation and applications in foods[J].Journal of the Science of Food and Agriculture,2004,84(11):1261-1269.
[10]Adam A,Crespy V,Levrat-Verny M A,et al.The bioavailability of ferulic acid is governed primarily by the food matrix rather than its metabolism in intestine and liver in rats[J].The Journal of Nutrition,2002,132(7):1962-1968.
[11]Suzuki A,Kagawa D,Fujii A,et al.Short-and long-term effects of ferulic acid on blood pressure in spontaneously hypertensive rats[J].American Journal of Hypertension,2002,15(4):351-357.
[12]Mancuso C,Santangelo R.Ferulic acid:Pharmacological and toxicological aspects[J].Food and Chemical Toxicology,2014,65:185-195.
[13]Xiong Y K,Zhu G H,Zhang J Q,et al.Purification of ferulic acid,senkyunolide I and senkyunolide H from the volatile oil of rhizoma chuanxiong using High-Speed countercurrent chromatography and preparative liquid chromatography[J].Advanced Materials Research,2014,1033:259-264.
[14]Zhao S,Yao S,Ou S,et al.Preparation of ferulic acid from corn bran:Its improved extraction and purification by membrane separation[J].Food and Bioproducts Processing,2014,92(3):309-313.
Preparation of Molecularly Imprinted Polymer Microspheres and Their Recognition Properties for Ferulic Acid
LUO Mengjun
(Yiyang Medical College,Yiyang 413000,China)
The ferulic acid molecular imprinted polymer(MIP)microspheres were synthesized and the recognition properties of MIP for ferulic acid were studied.Ferulic acid and ethyleneglycol dimethacrylate(EGDMA)were used as the template and cross-linker to synthesize the Ferulic acid MIP microspheres,respectively.The microspheres were inerratic microspheres,which characterized by static adsorption and scanning electron microscopy(SEM).The MIP microspheres showed that the high adsorption capacity and the partition cinnamic acid of the microspheres adsorbing ferulic acid was 1.97.Ferulic acid MIP microspheres had the bilirubin specific adsorption and identification ability to the ferulic acid molecules.
precipitation polymerization,molecular imprinted polymer,ferulic acid
TQ 050.43
A
1673—1689(2016)03—0290—06
2014-11-27
国家自然科学基金项目(21275049);湖南省教育厅科研项目(14C1126)。
罗孟君(1977—),女,湖南益阳人,理学硕士,副教授,主要从事天然植物功能成分提取与应用研究。
E-mail:luomengjun78@sina.com

