艾灸及艾烟对ApoE-/-小鼠血脂、肝脏病理形态及肝脏CD36、ABCA1表达的影响
崔莹雪,赵百孝,刘钧天,黄玉海
艾灸及艾烟对ApoE-/-小鼠血脂、肝脏病理形态及肝脏CD36、ABCA1表达的影响
崔莹雪1,赵百孝2,刘钧天2,黄玉海2
(1.首都医科大学附属北京中医医院,北京 100010;2.北京中医药大学针灸推拿学院,北京 100029)
目的 观察艾灸及艾烟干预对动脉粥样硬化模型血脂、肝脏病理改变和肝细胞内胆固醇代谢相关分子的影响,分析艾灸和艾烟对胆固醇代谢的调节作用,探讨艾灸及艾烟的作用机制。方法 将51只8周龄ApoE-/-小鼠随机分为模型组、艾烟组、艾灸组,每组17只,20只C57BL/6小鼠作为空白对照。正常组、模型组小鼠常规抓取和固定;艾烟组小鼠暴露于10 mg/m3~15 mg/m3艾烟环境;艾灸组小鼠艾灸关元穴。所有干预每日20 min,每星期6次,连续干预12星期。全自动生化分析仪检测总胆固醇);HE染色观察肝脏病理形态;免疫组化法检测肝脏CD36、ABCA1的表达。结果 模型组小鼠血清TG、LDL-C含量显著高于正常组(=0.003,=0.001),HDL-C含量显著低于正常组(=0.007),TC含量与正常组无显著差异(>0.05);艾灸组小鼠血清TG、LDL-C含量显著低于模型组(=0.03,=0.001),HDL-C、TC含量与模型组无显著差异(=0.11,=0.11);艾烟组小鼠血清TG、LDL-C含量显著低于模型组(=0.01,=0.008),HDL-C含量与模型组无显著差异(>0.05);艾灸组与艾烟组各项血脂指标均无显著性差异(>0.05)。模型组小鼠肝细胞索、肝窦排列紊乱,肝细胞肿胀变性明显。艾烟组、艾灸组小鼠肝细胞肿胀程度明显减轻,炎细胞浸润程度较模型组减轻。模型组CD36表达显著高于正常组(=0.004),ABCA1表达显著低于正常组(<0.001);艾灸组CD36表达与模型组无显著性差异(=0.09),ABCA1表达显著高于模型组(=0.03);艾烟组CD36表达显著低于模型组(=0.02),ABCA1表达显著高于模型组(=0.002);艾灸组与艾烟组CD36、ABCA1表达均无显著差异(>0.05)。结论 早期艾灸关元穴可以一定程度调整动脉粥样硬化模型ApoE-/-小鼠血脂代谢紊乱的状态,减缓肝脏病变发生,减少肝脏内胆固醇的蓄积,这可能是艾灸疗法预防动脉粥样硬化的作用机制之一。艾烟作为艾灸生成物,是艾灸发挥治疗作用的有效因素。
艾条灸;艾烟;ApoE-/-小鼠;胆固醇
心脑血管疾病是人类目前发病率最高的疾病之一,具有极高的致死率和致残率。动脉粥样硬化(atherosclerosis,AS)是心血管疾病的主要病理基础,其病变的发生发展是一个复杂的过程,胆固醇代谢紊乱是导致AS的主要发病机制。肝脏是脂质代谢的重要器官,在脂类的消化、吸收、合成、分解与运输中都发挥重要作用。体内脂质过多会增加肝脏负荷,脂类物质在肝细胞内蓄积,引起肝脏代谢障碍,肝脏功能受损会进一步导致脂质代谢紊乱,加重形成动脉粥样硬化性病变。
中医学认为动脉粥样硬化由痰浊血瘀互结,脉络痹阻不通引起[1-3],属于中医艾灸疗法的适应证范围[4-6]。根据中医学理论,艾灸有温通百脉、宣通气血的功能。大量的临床和实验研究发现,艾灸疗法具有降低血脂、改善动脉粥样硬化的作用[7-9]。艾烟是艾灸过程中的产物,其中含有多种活性成分,具有抗炎、抗氧化等作用。研究发现,艾烟可以良性调整机体胆固醇代谢[10-11]。
本实验选用AS动物模型ApoE-/-小鼠(载脂蛋白E基因敲除)作为观察对象,并对其分别进行艾灸关元穴和艾烟暴露两种干预。通过观察ApoE-/-小鼠血脂、肝脏的病理形态,以及肝细胞内CD36和ABCA1(肝细胞内参与胆固醇代谢的重要分子)的表达,分析艾灸和艾烟对胆固醇代谢的调节作用,探讨艾灸及艾烟的作用机制。
1 材料与方法
1.1 实验动物
本实验选用8周龄ApoE-/-小鼠作为AS模型,同龄相同遗传背景非转基因小鼠C57BL/6作为空白对照。小鼠购自于北京大学医学部实验动物科学部。ApoE-/-小鼠采用高脂饲料(北京维通利华实验动物有限公司提供,含15%猪油、2%胆固醇、0.05%胆酸)喂养,C57BL/6采用常规饲料喂养。所有小鼠均可自由进食饮水,饲养环境温度为(22±2)℃,湿度为50%~60%。采用人工控制室内照明,保持12 h光照(8:00- 20:00)和黑暗(20:00-次日8:00)交替循环。
1.2 主要仪器与试剂
细艾条(0.5 cm×20 cm),购自河南南阳汉医艾绒有限公司;小鼠固定器(150 mm×65 mm×50 mm),可固定小鼠头、尾、四肢部位,且底板处设有小孔,可暴露腹部,购自上海华岩仪器设备有限公司;带孔玻璃缸,自制,80 cm×80 cm×60 cm,顶层玻璃正中设有直径为5 mm圆孔;光散射式数字粉尘测试仪,购自北京宾达绿创科技有限公司;罗氏MODULAR P800全自动生化分析仪;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)试剂盒购自北京北化康泰临床试剂有限公司;ABCA1(ab18180)及CD36(ab325031)一抗均购自ABCAM公司。
1.3 动物分组及处理
51只8周龄ApoE-/-小鼠随机分为模型组、艾烟组、艾灸组,每组17只,20只C57BL/6小鼠作为空白对照组(正常组)。小鼠适应性喂养1星期后,进行实验干预,干预方法如下。
正常组采用固定器固定小鼠头、尾、四肢部位,不进行其他干预;模型组采用固定器固定小鼠头、尾、四肢部位,不进行其他干预;艾烟组将小鼠放入固定器后放入玻璃缸,玻璃缸内臵有调试好的粉尘测试仪。点燃艾条,从玻璃缸上方圆孔中将燃烧的一端插入,令艾烟充满玻璃缸。用粉尘测试仪测试其浓度,根据课题组前期测定临床艾灸诊室的平均浓度[12],以及既往实验报道的艾烟有效浓度[13],本实验中艾烟浓度的设定在10~15 mg/m3,当艾烟浓度达到预期浓度范围时将艾条取出,迅速封闭圆孔。此后每隔3 min记录一次浓度数值,使数值保持在10~15 mg/m3之间。若数值高于15 mg/m3,可将上方玻璃盖稍微移动,令艾烟散去部分后迅速将盖子移回;若数值低于10 mg/m3,再将点燃的艾条由圆孔插入以补充艾烟。
艾灸组采用固定器固定小鼠头、尾、四肢部位后架起。固定器底板处设有小孔,可暴露腹部关元穴,点燃艾条放于小鼠腹部下方,使灸火透过固定器底部小孔传至小鼠关元穴。同时在施灸过程中对实验操作间的艾烟浓度进行监测,艾烟浓度保持在10~15 mg/m3之间。
所有干预均为每日20 min,每星期6次,连续干预12星期,在第12星期末处死小鼠。
1.4 取材及检测
末次干预后,禁食不禁水12 h。小鼠麻醉后,用眼球摘除法从眼眶静脉丛采集血液标本约1.5~2 mL,置于离心管中,静置1 h后,离心15 min(4℃,1500 r/min)。离心后将血清保存于﹣20℃冰箱中备用。采用罗氏(MODULAR P800)全自动生化分析仪检测总胆固醇(TC)、甘油三酯(TG)和高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
迅速解剖腹部,取下肝脏,生理盐水冲洗,放入4%中性多聚甲醛固定24 h,制作石蜡切片,并进行HE染色和免疫组化反应。免疫组化二步法具体步骤,将切片脱蜡至水;采用枸橼酸缓冲液放入高压锅水煮进行抗原修复;双氧水封闭;滴加一抗(抗体稀释度均为1:100),0.01 mol的PBS代替一抗做阴性对照,4℃冰箱过夜;滴加二抗(即用型)30 min;室温DAB显色,显微镜下观察,观察目标出现阳性后,蒸馏水洗终止反应;苏木素复染,盐酸乙醇分化,氨水返蓝;脱水透明及中性树胶封片。
染色完毕后,在Olympus BX51光学显微镜下观察,采用Anymicro DSSTM图像采集系统读片并拍照。每组随机选取10只小鼠,将每只小鼠切片高倍镜下拍摄三个视野,将采集的图像应用Image-pro Plus5.1图像分析系统进行分析。所得数据作免疫组织化学染色阳性信号累积光密度(IOD),以IOD值作为组织表达的定量标准。累积光密度(IOD)=平均光密度(AOD)×阳性面积(A)。
1.5 统计学方法
采用SPSS13.0统计软件对实验结果进行统计分析。各组数据均符合方差分析条件,采用单因素方差分析(-),继以检验法进行组间比较,结果以均数±标准差表示。所有检验均为双侧检验,若<0.05认为差异有统计学意义。
2 结果
2.1 艾灸及艾烟对ApoE-/-小鼠血脂的影响
各组小鼠均有个别死亡现象,对各组存活小鼠血脂水平比较结果显示(见表1),模型组小鼠血清TG、LDL-C含量显著高于正常组(=0.003,=0.001), HDL-C含量显著低于正常组(=0.007),TC含量与正常组无显著差异(>0.05);艾灸组小鼠血清TG、LDL-C含量显著低于模型组(=0.03,=0.001),HDL-C、TC含量与模型组无显著差异(=0.11,=0.11);艾烟组小鼠血清TG、LDL含量显著低于模型组(=0.01,=0.008), HDL含量与模型组无显著差异(>0.05);艾灸组与艾烟组各项血脂指标均无显著性差异(>0.05)。
表1 各组小鼠血清TC、TG、LDL-C、HDL-C含量比较 (±,mmol/L)
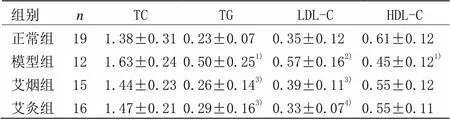
组别nTCTGLDL-CHDL-C 正常组191.38±0.310.23±0.070.35±0.120.61±0.12 模型组121.63±0.240.50±0.251)0.57±0.162)0.45±0.121) 艾烟组151.44±0.230.26±0.143)0.39±0.113)0.55±0.12 艾灸组161.47±0.210.29±0.163)0.33±0.074)0.55±0.11
注:与正常组比较1)<0.05,2)<0.001;与模型组比较3)<0.05,4)<0.001
2.2 艾灸及艾烟对ApoE-/-小鼠肝脏病理形态的影响
正常组小鼠肝细胞索、肝窦、中央静脉、汇管区均细胞形态如常,排列有序;未见细胞变性、肿胀,汇管区未见胆管增生、炎细胞浸润。模型组小鼠肝细胞索、肝窦排列紊乱,肝细胞肿胀变性明显,肝窦受压变窄,中央静脉迂曲扩张充血,汇管区血管扩张明显,炎细胞浸润。艾烟组小鼠肝细胞索排列较规则,肝细胞轻度肿胀,汇管区血管充血,炎细胞浸润。艾灸组小鼠肝细胞索排列较规则,肝细胞肿胀程度明显减轻,汇管区血管充血,少量炎细胞浸润(见图1)。
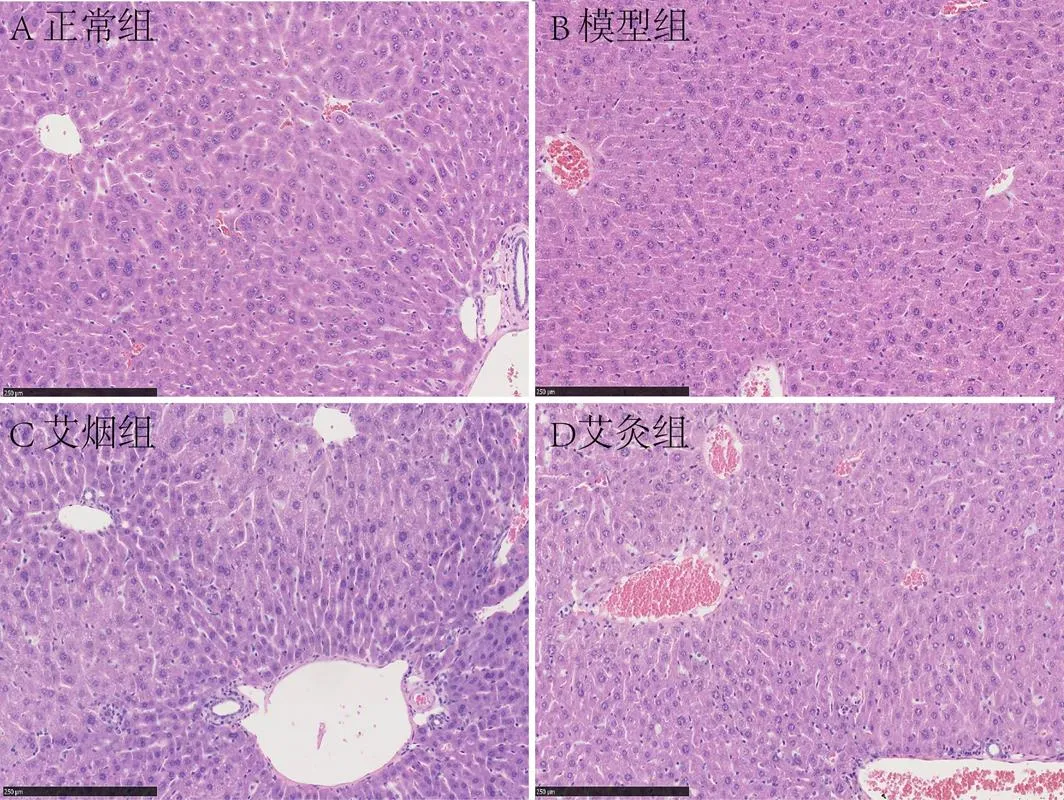
图1 各组小鼠肝脏病理形态(×20)
2.3 艾灸及艾烟对各组ApoE-/-小鼠肝脏CD36、ABCA1表达的影响
与正常组小鼠比较,模型组小鼠肝脏CD36表达显著高于正常组(=0.004),ABCA1表达显著低于正常组(<0.001)。与模型组小鼠比较,艾灸组小鼠肝脏CD36表达与模型组无显著性差异(=0.09),ABCA1表达显著高于模型组(=0.03)。艾烟组小鼠肝脏CD36表达显著低于模型组(=0.02),ABCA1表达显著高于模型组(=0.002);艾灸组与艾烟组CD36、ABCA1表达均无显著差异(=0.32,=0.15)。详见表2,图2-3。
表2 各组小鼠肝脏CD36、ABCA1累积光密度值(IOD)比较 (±)
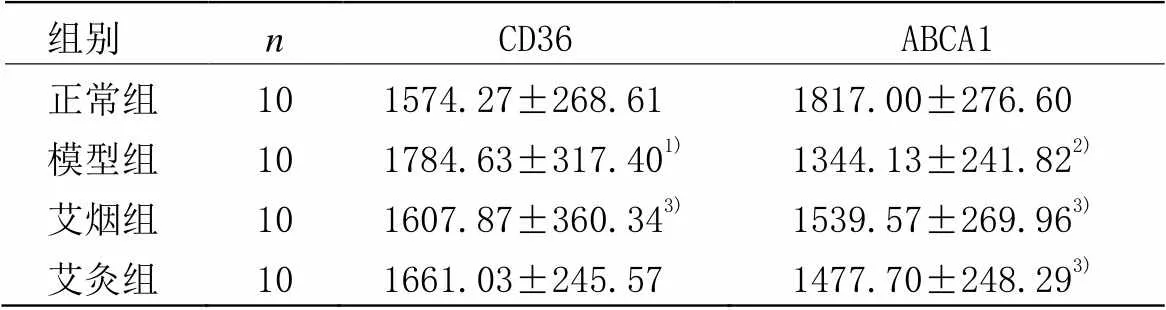
组别nCD36ABCA1 正常组101574.27±268.611817.00±276.60 模型组101784.63±317.401)1344.13±241.822) 艾烟组101607.87±360.343)1539.57±269.963) 艾灸组101661.03±245.571477.70±248.293)
注:与正常组比较1)<0.05,2)<0.001;与模型组比较3)<0.05
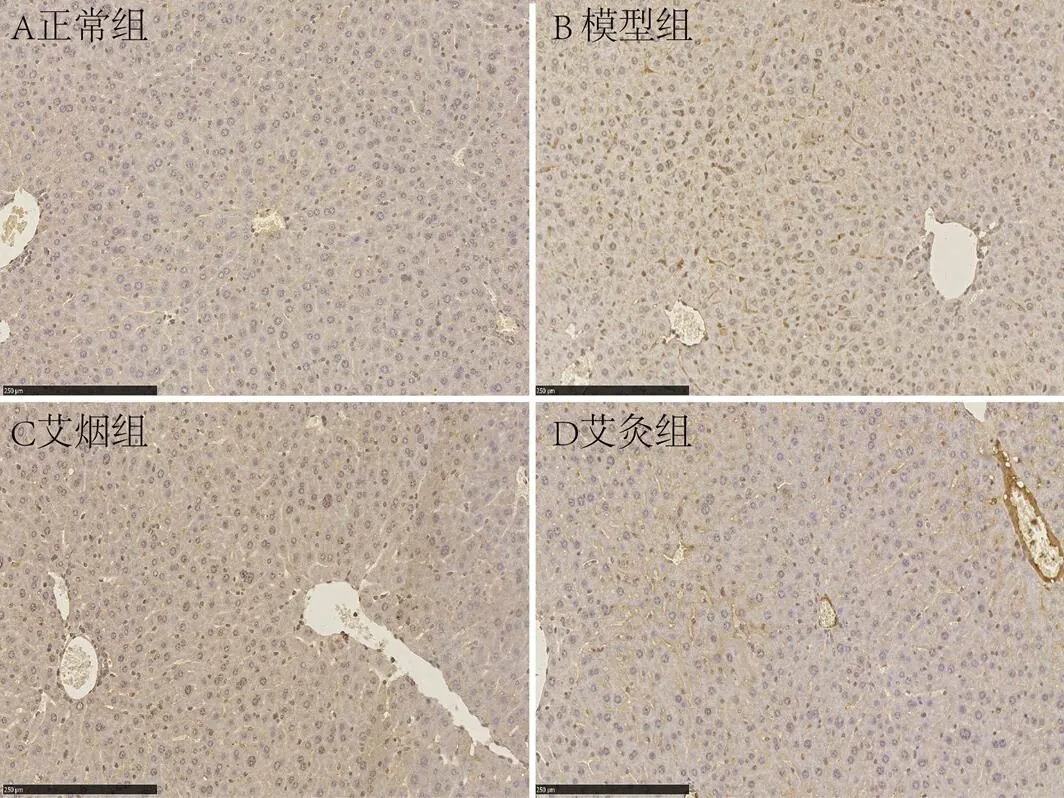
图2 各组小鼠肝脏CD36表达比较(×20)
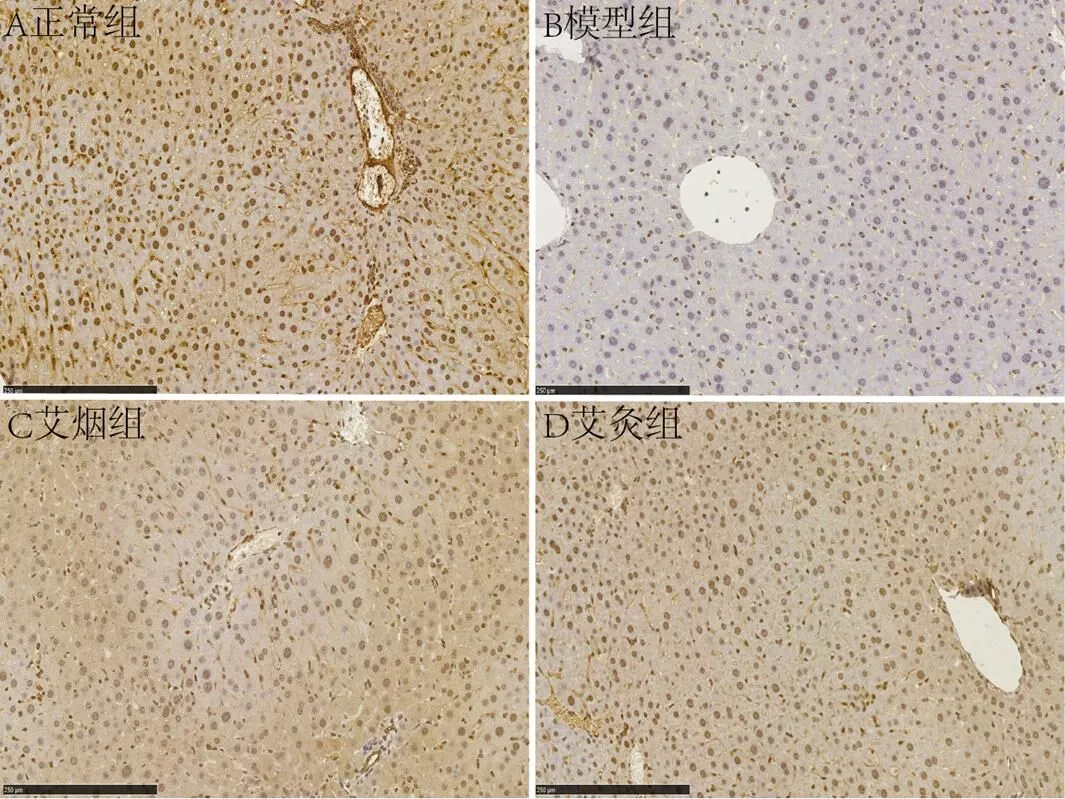
图3 各组小鼠肝脏ABCA1表达比较(×20)
4 讨论
肝脏是脂质代谢的重要器官,饮食摄取的脂质,经由肝脏合成极低密度胆固醇(VLDL)和甘油三酯,并转运入血,进一步水解供机体利用,同时体内过多的胆固醇,可以在高密度脂蛋白(HDL)的运载下重新回到肝脏(此过程称为胆固醇的逆向运转),在肝脏水解,并以胆汁的形式排泄。血液中过高的胆固醇水平,不仅会引发动脉粥样硬化病变,同时会对肝脏组织造成巨大的负担。体内过多的脂质可引起肝脏细胞脂质过度摄入及合成,同时对脂质的运转能力下降,脂类物质在肝细胞内蓄积,引起肝脏代谢障碍,造成肝脏组织病理损伤,肝脏的实质细胞受累成为脂肪负荷细胞,成为脂肪肝。并可引发一系列脂质代谢紊乱,加重动脉粥样硬化病变。可以说,动脉粥样硬化和肝脏功能障碍密切相关。有实验研究表明,高脂饮食可以导致家兔在主动脉和肝脏都出现病理改变。并随着高脂饮食的时间延长,病变逐渐加重[14]。本实验发现,ApoE-/-小鼠在给予高脂饮食12星期的情况下,出现肝细胞索、肝窦排列紊乱,肝细胞明显肿胀变性,汇管区血管扩张,炎性细胞浸润等现象,可以证明小鼠存在病变趋势。相较于模型组,早期进行艾灸或艾烟干预的ApoE-/-小鼠,肝细胞的肿胀变性及炎性细胞浸润等现象较未治疗的小鼠减轻,说明艾灸治疗或艾烟暴露存在保护肝细胞、防止肝细胞变性的作用趋势。但本实验各组小鼠肝脏均未出现明显的脂肪变性、坏死的情况出现,对肝脏的病理形态的影响有待于更长时间的实验观察。
B族清道夫受体CD36广泛表达于多种细胞类型,介导细胞对胆固醇的摄取。在巨噬细胞中,CD36可介导巨噬细胞对氧化低密度脂蛋白的摄取,参与巨噬细胞泡沫化。肝细胞表面的CD36可负责肝脏对脂肪酸的摄取,CD36在肝细胞的基础表达较低,但在高脂饮食的刺激下其表达可显著增加[15]。CD36的过表达可增加组织对脂肪酸和胆固醇摄入、储存和利用。Koonen DP等[15]研究发现,高脂喂养可使小鼠肝CD36蛋白表达增加2.6倍,肝脏甘油三酯存储上升1.7倍。有研究显示,高脂饮食引起肝脏CD36的表达增加是脂肪肝病变的重要潜在病理机制[15-16]。临床观察也发现,肝脏CD36基因表达与脂肪肝患者的肝脂肪含量呈正相关[17]。在本实验中发现,ApoE-/-小鼠肝脏CD36的表达较正常小鼠明显升高,而经艾烟干预的ApoE-/-小鼠肝脏CD36明显降低,提示艾烟可以防止肝细胞对脂质的过度摄取,减轻肝脏脂肪性病变。艾灸治疗组的ApoE-/-小鼠,肝脏CD36的表达有降低趋势,但是效果不像艾烟干预一样明显。对于艾烟效果优于艾灸治疗的现象,还有待于进一步的研究进行深入探讨。
ABCA1属于ATP结合盒(ABC)转运蛋白A类亚族,主要在细胞质膜处表达[18],可介导胆固醇穿过细胞膜,促进细胞内游离胆固醇外流[19-22]。ABCA1广泛表达于多种不同组织中,尤其在肝、肠及巨噬细胞中表达较高[23-27]。肝脏ABCA1可以促进细胞内胆固醇流向载脂蛋白A-I (ApoA-I),并促进新生ApoA-I的酯化、形成HDL[28]。肝脏是HDL的主要合成场所,研究显示,肝脏ABCA1对调节血液中HDL-C水平具有重要作用,研究显示特异性敲除小鼠肝脏ABCA1的表达,可以显著降低约80%血浆HDL的水平,造成体内胆固醇逆向转运功能下降[29-30]。在本实验研究中发现,ApoE-/-小鼠肝脏ABCA1表达下降,提示肝细胞内存在胆固醇流出障碍,从而造成小鼠体内胆固醇蓄积和动脉粥样硬化病变。艾灸和艾烟干预可以显著提高小鼠肝脏ABCA1的表达,说明二者具有促进胆固醇逆向运转、减轻肝脏胆固醇蓄积的作用趋势。艾烟和艾灸两种干预方法在提高肝脏ABCA1表达的效果上没有体现明显差异。
本研究结果表明,早期艾灸关元穴在一定程度可以调整ApoE-/-小鼠血脂代谢紊乱的状态,减缓小鼠肝脏病变发生,并有抑制肝脏的CD36表达,促进ABCA1表达的作用趋势。减少肝脏内胆固醇的蓄积,可能是艾灸疗法预防动脉粥样硬化的作用机制之一。艾烟作为艾灸生成物,是艾灸发挥治疗作用的有效因素。
[1] 刘丽娟,任建素.半夏白术天麻汤治疗痰浊型高血压伴颈动脉粥样硬化患者的临床观察[J].光明中医,2013,(10):2075-2076.
[2] 齐锡友,董致郅,谢春荣.从病因病机谈颈动脉粥样硬化与痰浊的关系[J].北京中医药,2012,(6):480-481.
[3] 张红珍.浅谈动脉粥样硬化与虚瘀痰浊[J].新中医,2012, (8):173-175.
[4] 尹仁,吴焕淦,李璟,等.艾灸法治疗高脂血症并动脉粥样硬化研究进展[J].中国中医药信息杂志,2011,(11):104-107.
[5] 杨俊,岳增辉,谢涛,等.隔药饼灸与动脉粥样硬化易损斑块综述[J].中西医结合心脑血管病杂志,2014,(5):604-605.
[6] 嵇明月,王玲玲,姜劲峰.艾灸温通温补调节血管壁稳态失衡思路[J].上海针灸杂志,2013,32(4):235-237.
[7] 常小荣,严洁,岳增辉,等.隔药饼灸对高脂血症兔高低密度脂蛋白含量及比值的影响[J].中国中医药信息杂志,2004,11 (12):1054-1055.
[8] 冯起国,裴景春,马铁明,等.艾灸内关对家兔动脉粥样硬化作用的研究[J].辽宁中医杂志,2002,29(1):48-50.
[9] 岳增辉,严洁,常小荣,等.隔药饼灸对兔高脂血症合并动脉粥样硬化血管内皮细胞粘附因子E选择素mRNA表达的影响[J].中国中医药信息杂志,2006,13(7):37-39.
[10] 李虹.艾灸生成物干预高脂血症大鼠模型的实验研究[D].北京中医药大学,2009.
[11] 杨佳.不同浓度艾烟长期干预对大鼠心血管疾病易感因子影响的实验研究[D].北京中医药大学,2013.
[12] 黄玉海,李军,崔莹雪,等.艾烟对健康成年人血压、呼吸频率、心率、心电、血氧饱和度的影响[J].世界中医药,2014,9(6):784- 787.
[13] Xu H, Zhao B, Cui Y,. Effects of Moxa Smoke on Monoamine Neurotransmitters in SAMP8 Mice[J]., 2013:178067.
[14] 魏国华,刘兰,蔡晓波,等.高脂饮食所致动脉粥样硬化家兔肝组织学损伤评估[J].中国动脉硬化杂志,2008,16(5):373-375.
[15] Koonen DP, Jacobs RL, Febbraio M,. Increased hepatic CD36 expression contributes to dyslipidemia associated with diet-induced obesity[J]., 2007,56(12):2863-2871.
[16] Luiken JJ, Arumugam Y, Dyck DJ,. Increased rates of fatty acid uptake and plasmalemmal fatty acid transporters in obese Zucker rats[J]., 2001,276(44):40567-40573.
[17] Greco D, Kotronen A, Westerbacka J,. Gene expression in human NAFLD[J]., 2008,294(5): G1281-G1287.
[18] Wang N, Silver DL, Costet P,. Specific binding of ApoA-I, enhanced cholesterol efflux, and altered plasma membrane morpho- logy in cells expressing ABC1[J]., 2000,275 (42):33053-33058.
[19] Rosenson RS, Brewer HB Jr, Davidson WS,. Cholesterol efflux and atheroprotection: advancing the concept of reverse cholesterol transport[J]., 2012,125(15):1905-1919.
[20] McNeish J, Aiello RJ, Guyot D,. High density lipoprotein deficiency and foam cell accumulation in mice with targeted disruption of ATP-binding cassette transporter-1[J]., 2000,97(8):4245-4250.
[21] Kennedy MA, Barrera GC, Nakamura K,. ABCG1 has a critical role in mediating cholesterol efflux to HDL and preventing cellular lipid accumulation[J]., 2005,1(2):121-131.
[22] Wang N, Lan D, Chen W,. ATP-binding cassette transporters G1 and G4 mediate cellular cholesterol efflux to high-density lipopro- teins[J]., 2004,101(26):9774-9779.
[23] 甘淋,彭家和,鲁立,等.曲格列酮对THP-1巨噬细胞源性泡沫细胞ABCA1表达及胆固醇流出的影响[J].现代生物医学进展, 2007,(1):82-84.
[24] 马娜,孙振欧,申婷婷,等.黑米通过上调高脂高胆固醇膳食饲喂饲雌性小鼠小肠ABCG5/8和ABCA1表达降低胆固醇水平[J].中国食品添加剂,2015,(2):118-123.
[25] 杨莉军,常冠楠,徐新,等.氧化低密度脂蛋白、荷叶生物碱对THP-1巨噬细胞源性泡沫细胞ABCA1表达的影响[J].心血管康复医学杂志,2012,(1):21-25.
[26] 余其林,阳学风.姜黄素对脂变肝细胞胆固醇流出及ABCA1表达的影响[J].南华大学学报:医学版,2009,(6):693-695,752.
[27] 高丽君,齐晓勇,王秀萍,等.非诺贝特对高脂模型大鼠过氧化物酶增殖物活化受体γ、肝X受体α和ABCA1 mRNA及其蛋白表达的影响[J].中国老年学杂志,2012,(20):4421-4423.
[28] Singaraja RR, Van Eck M, Bissada N,. Both hepatic and extrahepatic ABCA1 have discrete and essential functions in the maintenance of plasma high-density lipoprotein cholesterol levels in vivo[J]., 2006,114(12):1301-1309.
[29] Timmins JM, Lee JY, Boudyguina E,. Targeted inactivation of hepatic Abca1 causes profound hypoalphalipoproteinemia and kidney hypercatabolism of apoA-I[J]., 2005,115 (5):1333-1342.
[30] Brunham LR, Singaraja RR, Duong M,. Tissue-specific roles of ABCA1 influence susceptibility to atherosclerosis[J]., 2009,29(4):548-554.
Effects of Moxibustion and Moxa Smoke on Blood Lipids, and Hepatic Pathologic Morphology and CD36 and ABCA1 Expressions in ApoE-/-mice
1,2,2,2.
1.100010,; 2.100029,
Objective To investigate the intervention effects of moxibustion and moxa smoke on blood lipids, hepatic pathological changes and intrahepatocytic molecules related to cholesterol metabolism and analyze the regulating effects of moxibustion and moxa smoke on cholesterol metabolism and explore the mechanisms of actions of moxibustion and moxa smoke. Method Fifty-one 8-week-old ApoE-/-mice were randomized into model, moxa smoke and moxibustion groups, 17 mice each. Twenty C57BL/6 mice comprised a blank control group. The normal and model groups of mice were routinely grabbed and fastened. The moxa smoke group of mice was exposed to 10-15 mg/m3moxa smoke circumstances. The moxibustion group of mice was given moxibustion on point Guanyuan(CV4). All interventions were made 20 min daily, 6 times a week, for 12 consecutive weeks. Total cholesterol (TC), triglyceride (TG), high density lipoprotein-cholesterol (HDL-C) and low density lipoprotein-cholesterol (LDL-C) were measured using an automatic biochemical analyzer. Hepatic pathologic morphology was observed by HE staining. Hepatic CD36 and ABCA1 expressions were determined by immunohistochemical method. Result In the model group of mice, serum TG and LDL-C contents were significantly higher than in the normal group (=0.003;=0.001); HDL-C content was significantly lower than in the normal group (=0.007); TC content had no significant difference compared with the normal group (>0.05). In the moxibustion group of mice, serum TG and LDL-C contents were significantly lower than in the model group (=0.03;=0.001) and HDL-C content had no significant difference compared with the model group (=0.11). In the moxa smoke group of mice, serum TG and LDL contents were significantly lower than in the model group (=0.01;=0.008) and HDL content had no significant difference compared with the model group (=0.11). There were no significant differences in various blood lipid indicators between the moxibustion and moxa smoke groups (>0.05). There were hepatic cell cord and sinusoid derangement and obvious hepatocytic swelling in the model group of mice. In the moxa smoke and moxibustion groups, hepatocytic swelling subsided significantly, and inflammatory cell infiltration reduced compared with the model group. In the model group,CD36 expression was significantly higher than in the normal group (=0.004) and ABCA1 expression was significantly lower than in the normal group (=0.001). In the moxibustion group, CD36 expression had no significant difference compared with the model group (=0.09) and ABCA1 expression was significantly higher than in the model group (=0.03). In the moxa smoke group, CD36 expression was significantly lower than in the normal group (=0.02) and ABCA1 expression was significantly higher than in the model group (=0.002). There were no significant differences in CD36 and ABCA1 expressions between the moxibustion and moxa smoke groups (>0.05). Conclusion Early moxibustion on point Guanyuan can regulate disorders of blood lipid metabolism, delay the occurrence of hepatic lesions and reduce intrahepatic accumulation of cholesterol to a certain extent in an ApoE-/-mouse model of atherosclerosis. That may be one of the mechanisms by which moxibustion therapy prevents atherosclerosis. Moxa smoke as the product of moxibustion is an effective factor in moxibustion producing a therapeutic effect.
Moxa stick moxibustion; Moxa smoke; ApoE-/-mice; Cholesterol
R2-03
A
10.13460/j.issn.1005-0957.2016.08.1008
2015-12-20
国家自然科学基金面上项目(81373730)
崔莹雪(1986 - ),女,住院医师,博士
赵百孝(1963 - ),男,教授,Email:baixiao100@vip.sina.com

