奶牛圆形、长形、成熟精子细胞微量RNA制备和含量分析
任小霞,陈晓丽,李秀岭,王 艳,秦 彤,王 栋*
(1.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;2.北京市大兴区动物疾病控制中心,北京 102600)
奶牛圆形、长形、成熟精子细胞微量RNA制备和含量分析
任小霞1,陈晓丽1,李秀岭2,王艳2,秦彤1,王栋1*
(1.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;2.北京市大兴区动物疾病控制中心,北京 102600)
本研究旨在探究奶牛变形精子细胞获取方法、建立稳定奶牛精子RNA提取体系及分析单个生精细胞RNA含量变化。采用激光显微捕获技术结合冰冻切片,采集奶牛圆形、长形精子细胞样品,利用附睾尾精子浮游法获得成熟精子,通过对已报道的小鼠、奶牛及人类精子RNA制备方法的尝试和比较,获得RNeasy Kit最佳奶牛精子RNA制备方法,并用PicoPure RNA Isolation Kit对圆形和长形精子细胞进行RNA制备,筛选去除白细胞、上皮细胞等体细胞污染及基因组DNA污染的反转录聚合酶链式反应(RT-PCR)检测方法,并对生精细胞RNA含量进行单因素方差分析。结果表明,激光显微切割技术可有效捕获圆形、长形精子细胞;通过RNeasy Kit获得的牛精子RNA纯度高、质量好,单个精子RNA含量为0.023~0.025 pg;同时,随精子细胞变形,其RNA含量显著降低,其中圆形精子到成熟精子RNA含量降低75倍。本研究从复杂样品取样、微量RNA细胞转录本制备与检测等方面,为精子发生与变形机理研究提供重要参考。
生精细胞;转录本;激光显微切割;附睾;表达
研究发现,精子中含有种类繁多的RNA[1-3],迄今只有少量研究对于这些RNA在受精[4-5]、获能[6]、胚胎发育[7]等过程中的重要作用进行探索,绝大部分RNA的作用尚不清晰。主要是因为精子为单倍体生殖细胞,且在发育成熟过程中伴随大量细胞质和细胞器的丢失,而细胞核的高度浓缩,使转录表达受到抑制,导致精子RNA含量更少[8]。研究表明,人单个体细胞约含RNA 1~3 pg,而单个精子的RNA含量却低至0.015 pg[9],而且,不同研究RNA检测结果差别很大,小鼠每个精子含RNA (0.16±0.13)pg,牛冷冻精子RNA含量则为0.000 18~0.14 pg[10-13]。RNA含量差异,一方面可能是物种本身或生理状况不同导致的,另一方面可能是精子RNA制备效率原因。精子细胞极难裂解,制备难度较大,不同实验室、不同制备方法RNA制备效率差异很大[10-11,14],由于精子不含有核糖体RNA[1,15],较难进行RNA制备效果检测。另外,精子样品采集时,精浆中白细胞与上皮细胞污染不可避免[1],高纯度精子的获取也是困扰精子RNA研究的重要因素。建立稳定高效的精子RNA制备方法,并进行精子RNA含量的精确分析至关重要。很多研究采用trizol法[16-17]、trizol和试剂盒结合法[18]及试剂盒法[19]分别对猪、奶牛和人类精子进行RNA制备分析。与体细胞比,精子RNA含量极低,且trizol法提取的RNA纯度低,影响后续的RNA测序分析;trizol和试剂盒结合法,操作复杂,步骤繁琐,增加试验操作时间,易导致RNA降解;而试剂盒法,操作简便,通过吸附柱富集得到的RNA纯度较高,同时吸附柱对RNA较敏感,通过吸附柱可实现少量RNA的富集。本研究前期经过对比多种试剂盒的RNA制备效果,发现RNeasy Kit (Qiagen,德国)效果最佳,且操作简便,耗时也短。利用该方法结合浮游法获取精子、蔗糖溶液洗涤及体细胞裂解等处理,有效富集高质量精子RNA,为后续试验提供基础。
关于精子RNA来源尚存争议。有研究认为,精子本身不发生转录,其含有的RNA是精子发生过程的遗留产物[20-21];而对人[22]、大鼠[23]、果蝇[24]研究发现,精子变形前后有转录差异,目前尚无关于精子变形期间转录本变化趋势的定量研究。本研究以奶牛作为试验动物,借助于在肿瘤研究领域广泛应用的单细胞激光显微切割(LCM)技术[25-26],突破精子变形期间细胞样品采集难题,针对各阶段生精细胞建立稳定的RNA制备方法,定量分析精子RNA含量,并对精子变形期间转录本的含量变化进行有意义的探索,为精子变形及受精机理研究奠定基础。
1 材料与方法
1.1试验动物及样品采集
以健康、有正常性行为的荷斯坦公牛为试验动物。采用散栏式饲养、全自动TMR日粮饲喂,每天上午06:00和下午15:00分两次投放饲料、保证自由采食和清洁饮水。睾丸及附睾采集后,立即用冰袋低温保存,3 h内运回实验室。冻精购于北京奶牛中心。
1.2试剂
HistoGene LCM Frozen Section Staining Kit,PicoPure RNA Isolation Kit,Reverse transcription Kit均购于life公司;蔗糖、无水乙醇、β-巯基乙醇、TritonX-100均购于鼎国生物公司。
1.3附睾尾精子和冷冻精子的获取及RNA制备
取附睾尾放到装有PBS的50 mL RNase-free离心管中,用剪刀剪碎,在4 ℃冰箱静置30 min,取上清于1.5 mL离心管中,然后从中取10 μL用PBS稀释100倍后,用显微镜检测精子形态、活力。正常形态精子数量大于75%,向前运动的精子达到50%则为达标样本,冷冻精子活力不低于30%即为达标[27]。将达标精子样本用25×16格的血球计数板进行细胞计数,17 800 g 4 ℃离心10 min,弃上清,得到附睾尾精子沉淀,用于制备精子RNA。将冻精37 ℃解冻,镜检合格后,同样进行细胞计数,在17 800 g 4 ℃离心10 min,获得冻精沉淀。将附睾尾精子及冻精沉淀用1 mL蔗糖溶液重悬,17 800 g 4 ℃离心10 min,弃上清,重复上述操作两遍后,向精子沉淀中加入1 mL体细胞裂解液,冰浴15 min后,17 800 g 4 ℃离心10 min,获得高纯度精子沉淀。
采用RNeasy Kit(Qiagen,德国)进行精子RNA制备。每5×107个精子加600 μL提取缓冲液RLT,用吸管反复吹打30 s。反复通过20 G 一次性注射器针头10次以剪切DNA;加入等体积70%乙醇,吹打混匀后加至吸附柱,8 000 g室温离心15 s,弃去收集到的液体,再向吸附柱加350 μL漂洗缓冲液RW1,重复漂洗1次后,再向吸附柱加80 μL DNaseI工作液,常温放置15 min,加350 μL漂洗缓冲液RW1至吸附柱,8 000 g室温离心15 s,加 500 μL漂洗液RPE至吸附柱,8 000 g室温离心15 s,加500 μL漂洗液RPE至吸附柱,12 000 g 室温离心2 min,加20 μL RNase-free水至吸附柱膜上,12 000 g室温离心1 min,收集管中液体即为细胞总RNA。用核酸测定仪(Biometra,德国)测定其RNA含量和纯度,并进行琼脂糖凝胶电泳检测。
1.4圆形、长形精子细胞的获取及RNA制备
用灭菌剪刀将睾丸剪成1.5 cm×1.5 cm×0.3 cm大小的组织块,放入1.5 mL的RNase-free离心管中,用包埋剂(OCT)包埋,液氮速冻,制作冰冻切片。将冰冻切片机机箱温度调至-20 ℃,样品温度调至-18 ℃,预冷15 min。将速冻好的组织块放到切片机机箱内平衡30 min,然后用OCT将其固定在样品托上至包埋剂完全凝固,将样品托固定到样品头上,将切片厚度调为20 μm左右开始修块,至组织块露出最大横截面积,将厚度调至5 μm开始正式切片,用RNase-free的激光显微切割仪专用膜玻片贴片,并用life染色试剂盒染色。首先,将膜玻片放入75%酒精中固定1 min,RNase-free H2O清洗30 s,洗去浮层酒精,用50 μL染色剂(HistoGene LCM Frozen Section Staining Kit)染色1 min,RNase-free H2O洗去浮层染色剂,再使用75%、95%、100%梯度酒精依次脱水30 s;然后,在激光显微切割仪下,根据细胞形态进行圆形、长形精子细胞确认。用鼠标选定所需切割线,沿细胞边缘画线,然后进行自动切割。切割细胞因自身重力落到含细胞裂解液的收集管盖子中,取下收集管,盖紧盖子,反复颠倒2 min。离心收集细胞消化液,并把圆形与长形精子样品分别标记为R1、R2、R3与L1、L2、L3,-80 ℃保存备用。取样时,每张切片更换一次收集管,每张切片切割时间40 min左右。
采用AB kit制备圆形和长形精子RNA。向切割获取的细胞样品中加Extration buffer至总体积100 μL,混匀后42 ℃孵育30 min,然后3 000 g离心2 min;吸取上清于另一离心管中,加入100 μL 70%的酒精,用移液枪混匀得到混合液体备用。
根据说明书要求,将吸附柱放入收集管,向吸附柱内加入250 μL condition buffer,16 000 g离心1 min;将上述混合液体加入吸附柱,100 g离心2 min,然后16 000 g离心30 s,去废液;加100 μL W1至吸附柱,8 000 g离心1 min;加40 μL DNaseI工作液,室温孵育15 min;加40 μL W1至吸附柱,8 000 g离心15 s;加100 μL W2至吸附柱,8 000 g离心1 min;加100 μL W2至吸附柱,16 000 g离心2 min;将吸附柱放入新的离心管,加入16 μL elution buffer,室温放置1 min,1 000 g 离心1 min,16 000 g离心1 min,得到RNA溶液。用核酸测定仪(Biometra,德国)测定其RNA含量和纯度,并进行琼脂糖凝胶电泳检测。
1.5反转录
取2 μL总RNA,加入Olig(dT) 1 μL,25 mmol·L-1MgCl24 μL,RNA酶抑制剂0.5 μL,10×反转录缓冲液2 μL,10 mmol·L-1dNTPs 2 μL,反转录酶0.6 μL,10× reverse buffer 2 μL用RNAse-free水补够20 μL体系,42 ℃ 1 h,95 ℃ 5 min,冰上急冷5 min。以所得cDNA 为模板进行后续聚合酶链反应(PCR)。
1.6RNA的完整性及基因组DNA和体细胞去除效果检测
针对白细胞特异表达基因CD45(NCBI登录号NM_001206523.1)的第4和第7外显子设计一对特异引物,扩增产物为320 bp;针对上皮细胞特异表达基因CDH1(CDH1,NCBI登录号NM_001002763.1)的第5、第6外显子设计上游引物,第8外显子设计下游引物,扩增产物为491 bp。针对GAPDH基因(NCBI登录号NM_001034034.2)的第4外显子和第6外显子设计一对特异性引物,其产物涵盖了第4、5内含子完整序列,当RNA不含有DNA污染时,其RT-PCR产物仅含249 bp条带,而含有基因组DNA污染时,则还显示470 bp条带。各引物信息见表1。
20 μL PCR 体系:TaqTMDNA 聚合酶mix 10 μL,引物1 μL,cDNA 3 μL,RNase-free H2O 6 μL。PCR 程序:94 ℃ 5 min预变性后,进入循环程序:94 ℃变性30 s;退火30 s(退火温度见表1),72 ℃延伸30 s,循环34次;最后72 ℃ 延伸10 min。RT-PCR产物经1.5%琼脂糖凝胶电泳鉴定。
表1PCR引物序列
Table 1RCR primer sequences

基因Gene表达细胞Expressioncells引物序列(5'-3')Primersequences退火温度/℃Annealingtemperature产物长度/bpProductsizeGAPDH广泛表达GCAAGTTCAACGGCACAGGGTTCACGCCCATCACAA53基因产物470转录产物249CD45白细胞AACCGCTCTCTCAACCATAGGCCAGTGTAAACAAAGGGAAG53转录产物320CDH1上皮细胞GGACCGTGAGAGTTTTCCCACGGGCACTTCCACTCTCTTT65转录产物491
1.7统计分析
使用SAS 9.2对附睾尾精子和冻精RNA量进行t检验分析,对圆形、长形精子细胞,附睾尾成熟精子细胞的RNA量进行单因子方差分析,P<0.05为差异显著。
2 结 果
2.1附睾尾精子与冷冻精子数量及活力
镜检结果(表2)显示,3个附睾尾样本的精子数量为2.750×107~5.275×107个,3个冷冻精子样本数量为1.500×107。采用目测评定法对精子活率进行测定(根据10级制精子活率评定法,新鲜精液活率不低于50%,冻精解冻不低于30%),附睾尾精子活率为0.72~0.85,冷冻精子样本活力为0.49~0.52,可以用于后续研究。
2.2切片染色及激光显微切割结果
奶牛睾丸组织冰冻切片染色后,显微镜下观察生精细胞在曲细精管上的位置及形状、大小,通过激光显微切割仪进行目标细胞切割、收集并统计。圆形、长形精子细胞切割前后及收集管收集的情况如图1(A~D)所示。A、B为63×物镜条件下激光显微切割仪切割前后圆形精子细胞;C、D为63×物镜条件下激光显微切割仪切割前后长形精子细胞;E为150×物镜条件下激光显微切割仪切割后收集管盖子里收集到的细胞。共收集到的圆形和长形精子细胞个数分别为30 254(Y1)、30 559(Y2)、29 763(Y3)、40 168(C1)、39 862(C2)、42 621(C3)。
表2样本精子数量及活力
Table 2The quantity and activity of sperm

精子类型Spermtypes样本Samples精子数量×107Spermquantity精子活率Spermactivity附睾尾精子Epididymalsperm1232.7505.2753.8500.72±0.020.85±0.040.83±0.04冷冻精子Frozensperm1231.5001.5001.5000.52±0.020.49±0.020.50±0.02
2.3RNA纯度检测及定量分析
表3显示,附睾尾精子(F1~ F3)和冷冻精子(D1~D3)RNA的OD260 nm/OD280 nm比值均为1.8~2.1,证明RNA纯度较高;但圆形精子细胞(Y1~Y3)和长形精子细胞(C1~C3)RNA的OD260 nm/OD280 nm比值均小于1.8,可能混有酚类等杂质,或由显微切割获取细胞样品较少导致RNA含量较低所致。3×104~4×104个圆形精子细胞总RNA量为516~524 ng,平均每个圆形精子细胞RNA含量约为17.06~21.73 pg;等量的长形精子细胞获得的RNA总量为401.4~446.0 ng,平均每个长形精子细胞RNA含量约为9.81~11.19 pg;2.750×107~5.275×107个附睾尾精子的RNA总提取量为734.4~950.4 ng,平均每个精子RNA约含0.014~0.035 pg;1.500×107个冷冻精子RNA总提取量为283.2~435.2 ng,平均每个精子RNA含量约为0.019~ 0.029 pg。表明单倍体精子细胞RNA含量极低,且随精子发育过程中细胞质和细胞器的丢失而逐渐减少。

A、B.激光显微切割仪切割前后圆形精子细胞(630×);C、D.激光显微切割仪切割前后长形精子细胞(630×);E.激光显微切割仪切割后收集到的细胞(1 500×)A,B.The round spermatids under the microscope of LCM(630×);C,D.The elongated spermatids under the microscope of LCM(630×);E.The collected spermatids under the microscope of LCM after dissecting(1 500×)图1 生精细胞的获取Fig.1 The capture of spermatogenic cells
表3总RNA浓度检测
Table 3The concentration of total RNA
Y1~Y3.圆形精子细胞;C1~C3.长形精子细胞;F1~F3.附睾尾精子;D1~D3.冷冻精子。下同
Y1-Y3.Round spermatids;C1-C3.Elongated spermatids;F1-F3.Epididymal sperm;D1-D3.Frozen sperm.The same as below
2.4RNA的完整性及基因组和体细胞的去除效果检测
2.4.1RNA的完整性检测对附睾尾精子和冷冻精子总RNA的琼脂糖凝胶电泳检测结果显示(图2),牛睾丸组织总RNA样品泳道出现了明亮的28S和18S rRNA条带,且宽度和亮度比接近2∶1,但精子RNA样品未检测到任何条带,其中圆形和长形精子细胞未出现条带,说明RNA含量极低,与检测结果一致;附睾尾精子和冷冻精液总RNA样品中未出现条带,与精子中不含有核糖体RNA或含量极低检测不到结果一致。
图2 RNA质量检测Fig.2 RNA quality test
2.4.2基因组DNA去除效果检测总RNA的RT-PCR检测结果见图3,各个RNA样品均在249 bp处出现明亮条带,与GAPDH基因的cDNA理论长度一致,没有出现470 bp基因组DNA条带,说明制备的精子总RNA完整性较好,且无基因组DNA污染。
M.Marker I。下同M.Marker I.The same as below图3 GAPDH基因RT-PCR检测Fig.3 RT-PCR test of GAPDH
2.4.3体细胞去除效果检测各RNA样品针对基因CD45和CDH1的RT-PCR检测结果(图4、图5)显示,只有睾丸组织样品检测到了320 bp的CD45基因产物和491 bp的CDH1基因产物,各种精子RNA样品均未检测到上述条带,表明精子RNA样品中无白细胞和上皮细胞污染。

图4 CD45基因RT-PCR检测Fig.4 RT-PCR test of CD45

图5 CDH1基因RT-PCR检测Fig.5 RT-PCR test of CDH1
2.5精子细胞中的RNA含量方差分析
根据各类精子细胞RNA制备结果,计算各阶段精子细胞中单个细胞的RNA含量,并进行单因素方差分析,结果显示(表4),圆形、长形和附睾尾精子RNA含量有显著差异,且随变形与成熟而逐渐减少,但附睾尾精子与冷冻精子RNA含量却差异不显著。
表4单个生精细胞RNA含量
Table 4RNA quantity of spermatogenic cell
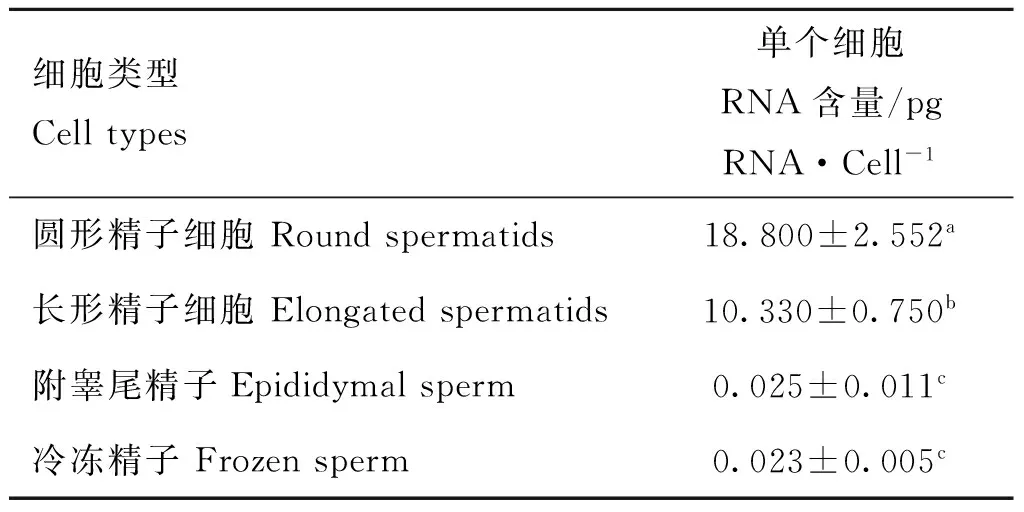
细胞类型Celltypes单个细胞RNA含量/pgRNA·Cell-1圆形精子细胞Roundspermatids18.800±2.552a长形精子细胞Elongatedspermatids10.330±0.750b附睾尾精子Epididymalsperm0.025±0.011c冷冻精子Frozensperm0.023±0.005c
结果用“平均值±标准差”表示(n=3);同行数据后所标字母相异表示差异显著(P<0.05),所标字母相同表示差异不显著(P>0.05)
The results are given as “means±SD”;Different letters in the same row means significant difference between the treatments(P<0.05),same letter in the same row means not significant difference between treatments(P>0.05)
3 讨 论
本研究前期通过对前人精子RNA制备方法[28-30]的重复和比较,发现trizol法获得的RNA样品纯度不高;而trizol和试剂盒结合的方法操作复杂,且时间过长,易导致样品降解;对Qiagen公司和Life公司的多种试剂盒进行比较分析发现,使用RNeasy Kit(Qiagen,德国)制备的RNA量最高,另外,对人类精子含量的研究发现,不同裂解液对精子细胞核裂解程度不同,核裂解程度影响RNA获得率[19],且发现该试剂盒对精子核裂解效果较好,试剂盒提取法获得的精子RNA纯度较高,质量较好,通过使用RNeasy Kit,并对精子样本进行蔗糖溶液洗涤及体细胞裂解液处理,筛选较为灵敏的体细胞及基因组去除效果检测方法,建立高效、高纯度奶牛精子RNA制备方法。本研究通过对大量样本的多次重复和冷冻精子对照分析,检测出奶牛单个精子的RNA含量为(0.023±0.005)pg,并且RNA提取量稳定。同时,附睾尾精子与冷冻精子RNA含量差异不显著,表明精子RNA在冻融前后[31]、获能前后[32]都存在差异,但是精子RNA含量还是相对稳定的,这为今后精子RNA制备及转录表达定量研究提供科学的指导。人类体细胞的RNA含量是成熟精子的600倍[9,33],本研究检测到奶牛每个精原干细胞约含25.133~30.696 pg RNA(未发表),与精子细胞存在显著差异,同时,变形期间精子细胞RNA含量也存在显著差异,其中,长形与圆形精子细胞的RNA含量分别是附睾尾精子的413倍和752倍,从圆形、长形到附睾精子的精子细胞变形成熟过程中,细胞RNA含量逐渐降低,从圆形到长形精子细胞RNA含量下降45.1%,从长形到附睾尾精子RNA含量下降99.8%,精子细胞RNA的这种变化趋势与精子变形过程中染色体逐渐致密紧凑的发展趋势相一致[34],说明染色体结构的改变导致了精子细胞中转录表达水平的逐渐降低,但是,究竟发育成熟的精子中是否继续进行基因的转录表达还需要进一步的证明。另外,本研究通过RNA凝胶电泳检测证明了前人的研究结论,即精子中可能不含有rRNA,或其含量极少以至于检测不到[1,15,35]。这将为精子RNA的提取提供一定的理论依据,更为大动物精子发生过程的转录组研究奠定基础。
本研究同时采集了牛的睾丸和附睾,其中睾丸用于采集圆形和长形精子细胞,用附睾精子浮游获得成熟精子样品,并且在检测分析时,力争使各级生精细胞及精子都来自同一个体,通过以个体为单位的系列研究,探索精子发育过程中真实的转录变化,保证了研究的延续性和可靠性。同时,圆形和长形精子细胞都与支持细胞相嵌合散在分布于曲细精管生精上皮上,难以进行细胞样品采集,本研究通过冷冻切片制作结合激光显微切割技术,突破了复杂细胞样品的取样技术瓶颈,解决了圆形、长形精子细胞取样难题。激光显微切割技术(Laser capture microdissection,LCM)是一项在显微镜下从组织切片中分离、纯化单一类型细胞群或单个细胞的技术,成功解决了组织中的细胞异质性问题[36]。精子细胞获取,使精子成熟过程中精子转录活性变化成为可能。激光显微切割技术为获取睾丸组织中圆形和长形精子细胞提供便利条件。但是激光对细胞的损伤仍不可忽略,因此设置合适的激光参数对于获取高质量细胞样品至关重要。本研究主要在63×物镜下进行激光切割获取细胞,经过多次试验摸索,最终确定的参数:Power设为10,Aperture设为1,Specimen Balance设为8,Head Current设为66%,Pulse Frequency设为 201时为最佳切割参数,可在最短时间内,顺利切下目的细胞,平均切割数量为长形精子细胞1 000个·片-1,圆形精子细胞700个·片-1,由于精原干细胞体积较大,数量较小,每张玻片只能收集500个左右。在选取目的细胞时尽量选取目的细胞群,这样可使所选区域的中间位置细胞免受激光损伤,保证细胞RNA完整性。另外,在收集细胞时,收集管的盖子里应放上细胞裂解液,裂解液里按100∶1加入RNase抑制剂。圆形、长形精子细胞的获取及RNA制备为后续高通量测序研究奠定技术基础,同时为深入进行精子发生与成熟机制研究提供重要参考。
[1]CARD C J,ANDERSON E J,ZAMBERLAN S,et al.Cryopreserved bovine spermatozoal transcript profile as revealed by high-throughput ribonucleic acid sequencing[J].BiolReprod,2013,88(2):49.
[2]HOSKEN D J,HODGSON D J.Why do sperm carry RNA? Relatedness,conflict,and control[J].TrendsEcolEvol,2014,29(8):451-455.
[3]MARTINS R P,KRAWETZ S A.RNA in human sperm[J].AsianJAndrol,2005,7 (2):115-120.
[4]FAGERLIND M,STÅLHAMMAR H,OLSSON B,et al.Expression of miRNAs in bull spermatozoa correlates with fertility rates[J].ReprodDomestAnim,2015,50(4):587-594.
[5]OSTERMEIER C G,GOODRICH R J,DIAMOND M P,et al.Toward using stable spermatozoal RNAs for prognostic assessment of male factor fertility[J].FertilSteril,2005,83(6):1687-1694.
[6]LAMBARD S,GALERAUD-DENIS I,MARTIN G,et al.Analysis and significance of mRNA in human ejaculated sperm from normozoospermic donors:relationship to sperm motility and capacitation[J].MolHumReprod,2004,10(7):535-541.
[7]FENG R Z,SANG Q,ZHU Y,et al.miRNA-320 in the human follicular fluid is associated with embryo qualityinvivoand affects mouse embryonic developmentinvitro[J].SciRep,2015,5:8689.
[8]STEGER K.Transcriptional and translational regulation of gene expression in haploid spermatids[J].AnatEmbryol(Berl),1999,199 (6):471-487.
[9]MILLER D,OSTERMEIER G C,KRAWETZ S A,et al.The controversy,potential and roles of spermatozoal RNA[J].TrendsMolMed,2005,11(4):156-163.
[10]GILBERT I,BISSONNETTE N,BOISSONNEAULT G,et al.A molecular analysis of the population of mRNA in bovine spermatozoa[J].Reproduction,2007,133(6):1073-1086.
[11]LALANCETTE C,MILLER D,LI Y,et al.Paternal contributions:new functional insights for spermatozoal RNA[J].JCellBiochem,2008,104(5):1570-1579.
[12]CONCHA I I,URZUA U,YAEZ A,et al.U1 and U2 snRNA are localized in the sperm nucleus[J].ExpCellRes,1993,204(2):378-381.
[13]PESSOT C A,BRITO M,FIGUEROA J,et al.Presence of RNA in the sperm nucleus[J].BiochemBiophysResCommun,1989,158 (1):272-278.
[14]OLIVA R,DIXON G H.Vertebrate protamine genes and the histone-to-protamine replacement reaction[J].ProgNucleicAcidResMolBiol,1991,40:25-94.
[15]YU Y,VANHORNE J,OKO R,et al.The origin and assembly of a zona pellucida binding protein,IAM38,during spermiogenesis[J].MicroscResTech,2009,72 (8):558-565.
[16]曾有权,仇恒滨,徐凯,等.猪精子RNA提取的初步研究[J].中国畜牧杂志,2008,44(17):18-22.
ZENG Y Q,QIU H B,XU K,et al.The preliminary study on extraction of RNA in swine spermatozoa[J].ChineseJournalofAnimalScience,2008,44(17):18-22.(in Chinese)
[17]GILBERT I,BISSONNETTE N,BOISSONNEAULT G,et al.A molecular analysis of the population of mRNA in bovine spermatozoa[J].Reproduction,2007,133(6):1073-1086.
[18]王惠娥,孙献莹,高庆华,等.奶牛精子RNA提取[J].中国畜牧兽医,2011,38(3):80-84.
WANG H E,SUN X Y,GAO Q H,et al.Sperm RNA extraction from dairy cattle[J].ChinaAnimalHusbandryandVeterinaryMedicine,2011,38(3):80-84.(in Chinese)
[19]李红钢,周慧,官黄涛,等.人精子RNA的提取及含量分析[J].生殖医学杂志2008,17(2):104-108.
LI H G,ZHOU H,GUAN H T,et al.The preparation and quantity of human sperm RNA[J].JournalofReproductiveMedicine,2008,17(2):104-108.(in Chinese)
[20]EDDY E M.Male germ cell gene expression[J].RecentProgHormRes,2002,57:103-128.
[21]GRUNEWALD S,PAASCH U,GLANDER H J,et al.Mature human spermatozoa do not transcribe novel RNA[J].Andrologia,2005,37(2-3):69-71.
[22]DADOUNE J P,PAWLAK A,ALFONSI M F,et al.Identification of transcripts by macroarrays,RT-PCR and in situ hybridization in human ejaculate spermatozoa[J].MolHumReprod,2005,11(2):133-140.
[23]WELCH J E,BARBEE R R,MAGYAR P L,et al.Expression of the spermatogenic cell-specific glyceraldehyde 3-phosphate dehydrogenase (GAPDS) in rat testis[J].MolReprodDev,2006,73(8):1052-1060.
[24]BARREAU C,BENSON E,GUDMANNSDOTTIR E,et al.Post-meiotic transcription in Drosophila testes[J].Development,2008,135(11):1897-1902.
[25]ANORUO B,VAN OORSCHOT R,MITCHELL J,et al.Isolating cells from non-sperm cellular mixtures using the PALM microlaser micro dissection system[J].ForensicSciInt,2007,173(2-3):93-96.
[26]VANDEWOESTYNE M,VAN HOOFSTAT D,VAN NIEUWERBURGH F,et al.Automatic detection of spermatozoa for laser capture microdissection[J].IntJLegalMed,2009,123(2):169-175.
[27]熊承良,吴明章,刘继红,等.人类精子学[M].武汉:湖北科技出版社,2002.
XIONG C L,WU M Z,LIU J H,et al.Human sperm[M].Wuhan:Hubei Science and Technology Press,2002.(in Chinese)
[28]OSTERMEIER G C,DIX D J,MILLER D,et al.Spermatozoal RNA profiles of normal fertile men[J].Lancet,2002,360(9335):772-777.
[29]LI H G,DING X F,LIAO A H,et al.Expression of CatSper family transcripts in the mouse testis during post-natal development and human ejaculated spermatozoa:relationship to sperm motility[J].MolHumReprod,2007,13(5):299-306.
[30]DAS P J,PARIA N,GUSTAFSON-SEABURY A,et al.Total RNA isolation from stallion sperm and testis biopsies[J].Theriogenology,2010,74(6):1099-1106.
[31]CHEN X,WANG Y,ZHU H,et al.Comparative transcript profiling of gene expression of fresh and frozen-thawed bull sperm[J].Theriogenology,2015,83(4):504-511.
[32]HWANG J Y,MULLIGAN B P,KIM H M,et al.Quantitative analysis of sperm mRNA in the pig:relationship with early embryo development and capacitation[J].ReprodFertilDev,2013,25(5):807-817.
[33]ZHAO Y,LI Q,YAO C,et al.Characterization and quantification of mRNA transcripts in ejaculated spermatozoa of fertile men by serial analysis of gene expression[J].HumReprod,2006,21(6):1583-1590.
[34]张俊芳,朱化彬,张留光,等.精子形成期基因转录表达的研究进展[J].遗传,2013,35(5):587-594.
ZHANG J F,ZHU H B,ZHANG L G,et al.Advance on research of gene expression during spermiogenesis at transcription level[J].Hereditas(Beijing),2013,35(5):587-594.(in Chinese)
[35]CAPPALLO-OBERMANN H,SCHULZE W,JASTROW H,et al.Highly purified spermatozoal RNA obtained by a novel method indicates an unusual 28S/18S rRNA ratio and suggests impaired ribosome assembly[J].MolHumReprod,2011,17(11):669-678.
[36]卫晋雄,赵怡芳.激光显微切割技术的发展和应用[J].国外医学口腔医学分册,2003,30(4):295-296,299.
WEI J X,ZHAO Y F.Development and application of laser microdissection[J].InternationalJournalofStomatology,2003,30(4):295-296,299.(in Chinese)
(编辑程金华)
The Preparation and Quantity Analysis of Trace RNA from Round Spermatids,Elongated Spermatids and Mature Sperm of Dairy Cattle
REN Xiao-xia1,CHEN Xiao-li1,LI Xiu-ling2,WANG Yan2,QIN Tong1,WANG Dong1*
(1.TheKeyLarboratoryforFarmAnimalGeneticandUtilizationofMinistryofAgricultureofChina,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China;2.AnimalDiseaseControlCenterofDaxingDestrictinBeijing,Beijing102600,China)
To explore the method to capture dairy cattles round and elongated spermatids and build the stable system extracting sperm RNA and analyzing the RNA quantity of spermatogenic cells,the round and elongated spermatids were captured by laser capture microdissection (LCM) combined with the technology of frozen section,and sperm samples were obtained using the method of sperm floating from epididymids.Compared the reported sperm RNA preparation methods,a better RNA preparation result was obtained from dairy cattle sperm using RNeasy Kit,and the better RNA preparation results were also obtained from round and elongated spermatids using PicoPure RNA Isolation Kit.Besides,the removal results of contaminated somatic cells and genomic DNA were tested by reverse transcription polymerase chain reaction(RT-PCR).The one-way analysis of variance showed that the round and elongated spermatids were successfully captured by LCM,the high quality RNA was extracted from sperm using RNeasy Kit,and the RNA quantity of each sperm was 0.023-0.025 pg.The RNA quantity decreased by 750-fold from round to elongated spermatids.The exploration that capture spermatogenic cells from complex tissues and extract RNA from less RNA containing cells will provide an important reference for the study on mechanism of spermatogenesis and spermiogenesis.
spermatogenic cells;transcripts;laser capture microdissection;epididymis;expression
10.11843/j.issn.0366-6964.2016.08.004
2016-02-02
国家自然科学基金(31372296)
任小霞(1988-),女,河南新乡人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:13552641190@163.com
王栋,博士,研究员,主要从事动物遗传育种与繁殖研究,E-mail:dwangcn2002@vip.sina.com
S814
A
0366-6964(2016)08-1546-09

