3,6'-二芥子酰基蔗糖联合tenuifoliside A协同抗抑郁作用及其机制的研究
赵润清,胡 园,李牧函,3,张 静,4,谭 潇,刘 屏(1.河北北方学院药学院,河北张家口 075000;.中国人民解放军总医院临床药理研究室,北京 100853;3.北京中医药大学中药学院,北京 100853;4.山西中医学院中药学院,山西太原 03004)
3,6'-二芥子酰基蔗糖联合tenuifoliside A协同抗抑郁作用及其机制的研究
赵润清1,2,胡园2,李牧函2,3,张静2,4,谭潇2,刘屏2
(1.河北北方学院药学院,河北张家口075000;2.中国人民解放军总医院临床药理研究室,北京100853;3.北京中医药大学中药学院,北京100853;4.山西中医学院中药学院,山西太原030024)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.048.html
目的研究远志中3,6'-二芥子酰基蔗糖(DISS)和tenuifoliside A(TFSA)协同抗抑郁作用及其初步作用机制。方法采用经典的行为绝望抑郁模型——小鼠悬尾实验,随机分为对照组、阳性药组、DISS 5、10 mg·kg-1、TFSA 5、10 mg·kg-1、DISS 5 mg·kg-1+TFSA 5 mg·kg-1、DISS 5 mg ·kg-1+TFSA 10 mg·kg-1、DISS 10 mg·kg-1+TFSA 5 mg ·kg-1和DISS 10 mg·kg-1+TFSA 10 mg·kg-1;灌胃给药7 d,观察DISS和TFSA单体及其合用对小鼠悬尾不动时间的影响;免疫组织化学方法检测小鼠海马及皮层内BDNF的表达;蛋白质印记法检测小鼠海马内CRTC1、CREB、p-CREB 及BDNF的表达。结果DISS和TFSA及其二者合用均可缩短悬尾小鼠的不动时间,其中DISS(10 mg·kg-1)和TFSA(10 mg·kg-1)组与单剂量药物组相比明显,并稳定缩短小鼠悬尾不动时间(P<0.05)。免疫组化实验中,DISS和TFSA及其合用组均可提高海马及皮层内BDNF的表达量(P<0.05),同时DISS和TFSA及其合用组可增加海马中CRTC1、CREB、p-CREB及BDNF蛋白的含量,其中合用组明显高于单药组(P<0.05)。结论DISS与TFSA双药合用启动CREB共转录因子CRTC1,激活海马内CREB的磷酸化,进而增加其下游BDNF表达,发挥协同抗抑郁作用。
DISS;TFSA;抑郁症;协同作用;CREB;BDNF
抑郁症是严重危害人类身心健康的一类情感性精神障碍疾病[1]。抑郁症的治疗并不乐观。抗抑郁的化学药物存在一系列问题,如起效慢、易复发及诸多不良反应[2]。目前,人们将抗抑郁药物的研发更多的转向了中医药领域。远志在中医临床上经常配伍应用于情志疾病,其代表方剂如开心散、定志小丸等,在动物实验及临床研究中均表现出良好的抗抑郁作用[3]。
3,6'-二芥子酰基蔗糖(DISS)和tenuifoliside A (TFSA)作为中药远志中的两个寡糖酯活性单体,表现出了良好的抗抑郁和神经保护作用。多项研究显示,DISS在多个经典的抗抑郁模型(小鼠强迫游泳、小鼠悬尾、大鼠强迫游泳、大鼠不可预知慢性应激结合孤养模型)中以及体外模拟的抑郁模型(皮质酮损伤SH-SY5Y和C6神经细胞)中,表现出了有明显的抗抑郁样作用[4-5]。其机制可能与增加新生细胞合成DNA,而减轻皮质酮对SH-SY5Y神经细胞的损伤,提高抑郁模型脑内5-HT含量、启动调控MAPK 和CaMK通路关键靶点的磷酸化,激活CRE的活化和转录,增加CREB的磷酸化,以及提高CREB下游靶基因BDNF的mRNA及蛋白的表达有关[6-7]。另一个寡糖酯TFSA对神经细胞也具有明显的保护作用,它可通过激活MAPK通路和PI3K通路后,同样促进下游CREB和GSK3β的磷酸化,从而增加其下游的关键蛋白而发挥作用[8]。本研究首次将DISS 和TFSA两种寡糖酯联合使用,从整体动物层次探讨其在治疗抑郁中存在的抗抑郁协同作用关系,并对其相关机制作以初步探讨。
1 材料与方法
1.1药品与试剂DISS和TFSA(由解放军总医院临床药理研究室制备,≥99%);氟西汀(FLU)标准品,购于美国Sigma公司;一抗:α-Tubulin、CRTC1、CREB、p-CREB、BDNF羊抗兔多克隆抗体,购于美国Abcam公司;二抗:羊抗兔、羊抗鼠,购于美国Bioworld公司。
1.2实验仪器动物行为学分析系统(上海移数有限公司);冷冻离心机,3K15型,购于美国Sigma公司;DDHZ-300多用途台式恒温振荡器,江苏太仓市实验设备厂;Western blot转印槽、电转槽,美国BIO-RAD公司;UVP凝胶成像系统,EC3 Imaging Systems,美国BIO-RAD公司。
1.3实验动物昆明小鼠,♀、♂各半,体质量18~22 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。置于室温下,12~12 h昼夜循环光照,自由进食、饮水。动物于实验前适应实验室环境5 d后,随机分为空白对照组、单药组(DISS 5 mg·kg-1、DISS 10 mg·kg-1、TFSA 5 mg·kg-1、TFSA 10 mg·kg-1)、联合给药组(DISS 5 mg·kg-1+TFSA 5 mg·kg-1、DISS 5 mg ·kg-1+TFSA 10 mg·kg-1、DISS 10 mg·kg-1+ TFSA 5 mg·kg-1、DISS 10 mg·kg-1+TFSA 10 mg ·kg-1)、阳性对照氟西汀组(20 mg·kg-1),每组12只,剂量选择参照文献[9]。
1.4小鼠悬尾实验[10]按照分组给药,连续灌胃7 d,于末次给药30 min后进行小鼠悬尾实验,将小鼠尾端2 cm处固定在悬尾仪吊环上,使动物呈倒挂状态,其头部对准仪器摄像头,采用小鼠悬尾仪器进行录像,小鼠悬挂2 min后,开始录像监测,持续4 min,记录4 min内小鼠的不动时间。实验结束后直接断头取脑,冰上快速取海马组织,存放于-80℃冰箱中备Western blot实验使用,每组剩余的小鼠灌注多聚甲醛做免疫组化。
1.5免疫组织化学方法测定海马、皮层内BDNF的表达常规石蜡切块,二甲苯脱蜡,乙醇梯度脱水,抗原热修复,加一抗(BDNF 1∶20),4℃过夜;加二抗,37℃恒温箱,20 min,PBS洗3次,5 min/次;加三抗(辣根酶),37℃恒温箱,20 min,PBS洗3次,5 min/次,DAB显色,镜下观察。20×物镜下取海马和皮层部位摄片,用Image pro软件检测其阳性细胞积分光密度值(integral optical density,IOD)。
1.6小鼠海马内CREB通路相关蛋白表达的测定将海马组织块置于1~2 mL匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎,加400 μL裂解液(含蛋白酶抑制剂及磷酸化蛋白酶抑制剂)于匀浆器中进行匀浆,然后置于冰上,几分钟后再碾一会儿再置于冰上,要重复碾几次,使组织尽量碾碎,裂解20 min后,用移液器将裂解液移至1.5 mL离心管中,在12 000×g 4℃离心20 min,取上清液于新的EP管中,用BCA蛋白定量法进行定量,每组取60 μg进行蛋白印记实验。
2 结果
2.1DISS联合TFSA对小鼠悬尾实验的影响如Fig 1所示,与空白对照组相比,DISS(10 mg· kg-1)及TFSA(10 mg·kg-1)组均能不同程度的缩短小鼠悬尾的不动时间,抑制率分别是26.11%和27.89%(P<0.05),而DISS(5 mg·kg-1)及TFSA (5 mg·kg-1)组则对小鼠悬尾不动时间没有明显的改善,但DISS与TFSA二者所有剂量合用组都能缩短小鼠悬尾的不动时间,表现出明显的协同抗抑郁作用(P<0.05),且效果与阳性抗抑郁药氟西汀(20 mg·kg-1)相当,其中DISS 10 mg·kg-1+TFSA 10 mg·kg-1大剂量合用组表现的作用最明显,抑制率为52.60%(P<0.05)。

Fig 1 Effects of the administration of DISS and TFSA on the immobility time of mice subjectedto tail suspension test(n=12)
2.2免疫组织化学法检测DISS和TFSA及二者合用对小鼠海马及皮层内BDNF蛋白含量变化的影响免疫组织化学结果如Fig 2所示,经Image pro分析结果如Fig 3可知,与对照组相比,氟西汀组及DISS(10 mg·kg-1)和TFSA(10 mg·kg-1)组可明显增加海马内BDNF的表达(P<0.05),双药合用所有剂量组与其单用相比明显增加BDNF的表达,表现出明显的协同加强效应;同时DISS、TFSA单药及双药合用均可提高皮层内BDNF的表达(Fig 4),其中高剂量(10 mg·kg-1)的双药合并组最大程度的增加了BDNF的表达水平(P<0.05)。

Fig 2 Effects of administration of DISS and TFSA on expressions of BDNF in mice hippocampus and cortex(20×)

Fig 3 Effects of administration of DISS and TFSA on expressions of BDNFin mice hippocampus

Fig 4 Effects of administration of DISS and TFSA onespressions of BDNF in mice cortex
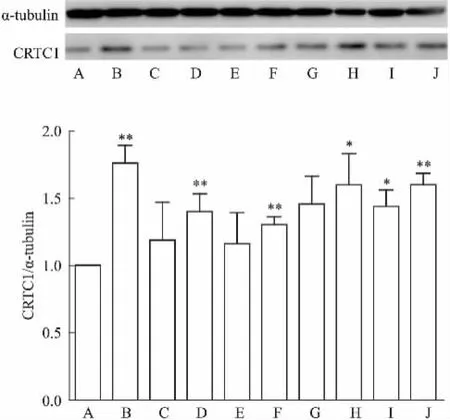
Fig 5 Effects of DISS and TFSA on CRTC1expression in mice hippocampus

Fig 6 Effects of DISS and TFSA on p-CREB/CREB expression in mice hippocampus
2.3DISS和 TFSA及二者合用对小鼠海马内CREB通路相关蛋白含量变化的影响如Fig 5所示,与空白对照组相比,DISS和TFSA单药组、合药组各组均可增加小鼠海马内CRTC1蛋白的表达,其中DISS 10 mg·kg-1和TFSA 10 mg·kg-1及其合用效果最明显(P<0.01)。由Fig 6可知,与对照组相比,氟西汀组及DISS和TFSA各组可明显增加海马内p-CREB/CREB的表达(P<0.05),表明DISS和TFSA均可增加小鼠海马内CREB的活化,诱导p-CREB表达增加,二者合用组效果与其单药组相比更加明显,表现出了明显的协同作用。如Fig 7所示,DISS、TFSA单药及双药合用均可提高海马内BDNF的表达(P<0.05),各合药组与其单药合用相比明显的增加BDNF的表达(P<0.05),其中高剂量(10 mg·kg-1)的双药合并组最大程度增加了BDNF的表达水平(P<0.05),这与免疫组化的结果相一致。
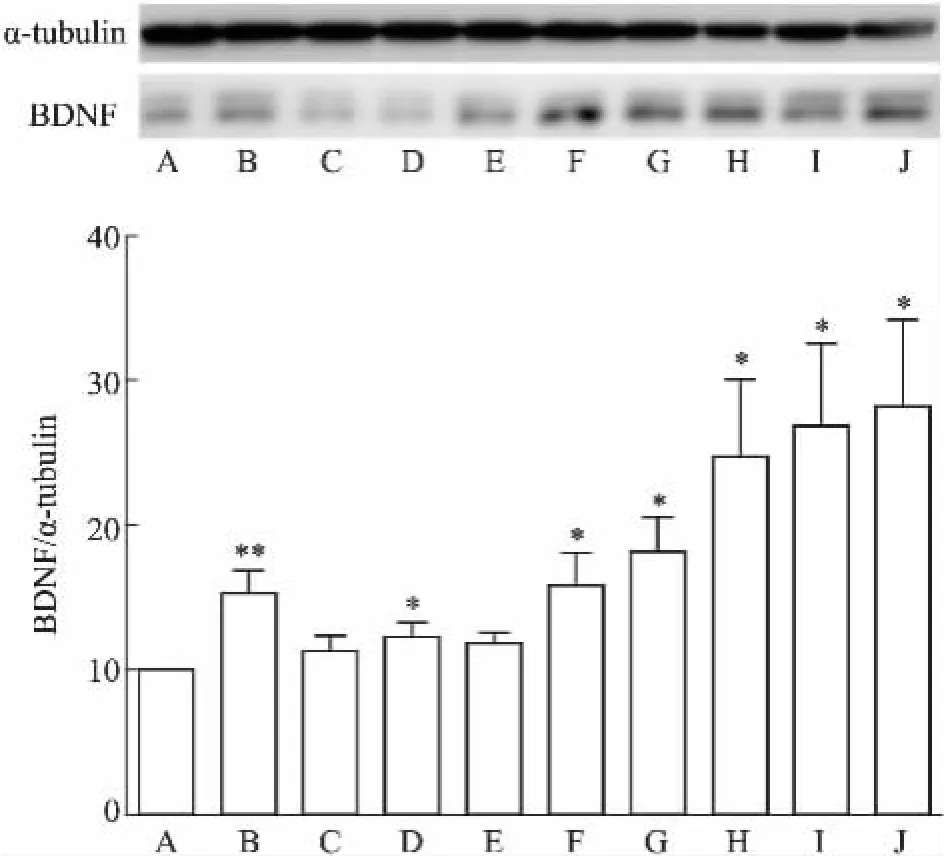
Fig 7 Effects of DISS and TFSA on BDNF expression in mice hippocampus
3 讨论
涂海华等[11]发现某些寡糖酯类化合物可能是远志中主要的生物活性物质,并可作为抗老化和脑保护新药开发的先导化合物。此次研究采用经典绝望模型(小鼠悬尾模型)评价了远志中两个寡糖酯TFSA和DISS合用抗抑郁的作用效果。首先在整体动物水平上证明了DISS和TFSA的协同抗抑郁效果。进一步的免疫组化研究发现,DISS与TFSA联用能够明显增加CREB相关通路蛋白的表达,增强神经保护作用。
早在1985年,Steru等提出的悬尾实验,广泛作为抗抑郁药物活性筛选的行为学检测方法,因其快速、方便、价廉、对多种抗抑郁药物有效,被广为接受和应用。实验的原理均为将动物置于不可逃脱的环境中,动物拼命挣扎,企图逃脱,在经过努力仍不能摆脱困境后,出现间断性不动,显示“行为绝望“状态。这种“行为绝望”状态与抑郁症类似[9,12]。记录实验动物产生行为绝望过程中的主要参数,如不动时间,可用于抗抑郁药物活性的筛选,绝大多数抗抑郁药物均可缩短实验动物不动时间。前期的预实验当中DISS(10 mg·kg-1、20 mg·kg-1)和TFSA (10、20 mg·kg-1)可呈现剂量依赖趋势改善悬尾小鼠的行为学指标,但双药大剂量(20 mg·kg-1)的合用并未表现出明显的抗抑郁协同作用。本研究小鼠悬尾试验中,DISS与TFSA的低剂量(5 mg· kg-1)对悬尾小鼠行为学没有明显的影响作用,但DISS(5、10 mg·kg-1)与TFSA(5、10 mg·kg-1)合用的抗抑郁作用明显超过了DISS和TFSA(5、10 mg ·kg-1)单独作用,提示DISS与TFSA在小、中剂量(5、10 mg·kg-1)合用时具有协同增强作用。同时DISS(10 mg·kg-1)单独作用时的抗抑郁活性,与课题组前期研究结果一致[13],本实验也发现TFSA在小鼠悬尾模型中表现出抗抑郁活性。
抑郁症患者的边缘系统部分脑区结构改变、功能受损、神经元再生出现障碍,大脑海马与情感体验和认知功能密切,因此由于海马神经元再生障碍导致的抑郁和情绪失控的研究备受关注。各种神经递质作用于大脑特异性脑区,由CREB等介导的基因表达,在相应脑区产生一些发挥保护性作用的物质,如BDNF[14-16]。因此,目前大量的研究聚焦于5-HT和神经营养通路中的关键组件转录因子环磷腺苷反应元件结合蛋白(CREB)和脑源性神经营养因子(BDNF),作为研究抑郁症的病因和抗抑郁药物作用的靶点[17-19],该通路由上游多条信号通路(主要是MAPK、CaMK和PI3K通路)调节,最终导致CREB磷酸化。同时 CREB的共转录因子之一(CRTC1)受胞质Ca2+和cAMP信号的传感器,以去磷酸化方式活化后,传递突触活动信号到细胞核介导CRE靶基因转录,促进CRE靶基因的表达,如BDNF、c-fos、nr4a2等[20],参与抑郁相关的神经保护作用。
前期研究发现DISS(5~20 mg·kg-1)对慢性应激大鼠下丘脑-垂体-肾上腺轴(hypothalamicpituitary-adrenal cortex axis,HPA)激素水平具有调节作用,但只有中、高剂量(10~20 mg·kg-1)DISS增加抑郁动物海马中磷酸化CREB表达,并能提高CREB下游靶基因 BDNF的 mRNA及蛋白的表达[21]。C6细胞株和原代培养神经细胞水平发现TFSA的神经保护机制与激活TrkB/BDNF,最终促进BDNF表达有关。本实验针对CREB通路的机制研究与动物行为学研究结果一致,5~10 mg·kg-1DISS与TFSA合用,可明显增加绝望模型中小鼠海马区CRTC1、p-CREB和BDNF的蛋白表达,比小剂量单药剂量组效果更好。中药制剂中不同有效成分,可能通过药动学和药效学两方面产生协同作用。可能机制包括:多靶向效应协同;改善溶解度、吸收速度及提高生物利用度;消除或中和不良效应[22]。推测DISS和TFSA在一定剂量和比例合用时,在中枢海马区CREB相关神经营养通路,产生多靶位协同增强作用,共同作用提高海马神经元再生和促进神经元保护,发挥抗抑郁作用。
DISS和 TFSA具有类似寡糖酯结构,针对CREB磷酸化通路相关的两药联合使用,可以同时启动MAPK、CaMK和PI3K通路参与CREB Ser133磷酸化依赖,同时参与 CTRC1调控的非CREBSer133磷酸化的下游基因转录,如BDNF,进而多靶位协同增强CREB-BDNF通路的活性,激活神经营养通路和提高海马的神经分化神经存活及保护有关的基因表达,比单独使用可能取得更明显的疗效。进而以达到降低用药剂量,提高药物疗效,为其开发新一代的高效低毒的抗抑郁药提供了思路,但具体的分子机制仍需要进一步的研究。
[1]刘佳莉,苑玉和,陈乃宏.抑郁症的治疗研究进展[J].中国药理学通报,2011,27(9):1193-6.
[1]Liu J L,Yuan Y H,Chen N H.Research progress in treatment of depression[J].Chin Pharmacol Bull,2011,27(9):1193-6.
[2]孙秀萍,李腾飞,石哲,等.人参总皂苷和远志总苷配伍对小鼠抗抑郁作用[J].中国比较医学杂志,2012,22(6):30-6.
[2]Sun X P,Li T F,Shi Z,et al.Study of antidepressant-like effects of combination of ginseng total saponins and polygala tenuifolia total glycosiders in mice[J].Chin J Comparat Med,2012,22(6):30 -6.
[3]Anderson H D,Pace W D,Libby A M,et al.Rates of 5 common antidepressant side effects among new adult and adolescent cases of depression:a retrospective US claims study[J].Clin Ther,2012,34(1):113-23.
[4]刘明月,胡园,穆丽华,等.基于CREB通路研究3,6'-二芥子酰基蔗糖的神经保护分子机制[J].中国药理学与毒理学杂志,2012,26(3):417.
[4]Liu M Y,Hu Y,Mu L H,et al.Study on the neural protective molecular mechanism of 3,6-disinapoyl sucrose based on the CREB pathway[J].Chin J Pharmacol Toxicol,2012,26(3):417.
[5]Hu Y,Li J,Liu P,et al.Protection of SH-SY5Y neuronal cells from glutamate-induced apoptosis by 3,6,-disinapoyl sucrose,a bioactive compound isolated from radix polygala[J].J Biomed Biotechnol,2012,2012:1-5.
[6]Hu Y,Liu M Y,Liu P,et al.Neuroprotective effects of 3,6'-disinapoyl sucrose through increased BDNF levels and CREB phosphorylation via the CaMKII and ERK1/2 pathway[J].J Mol Neurosci,2014,53(4):600-7.
[7]Hu Y,Liao H B,Liu P,et al.A bioactive compound from polygala tenuifolia regulates efficiency of chronic stress on hypothalamic-pituitary-adrenal axis[J].Neurochem Int,2010,56(3):461-5.
[8]余冰颖,董宪喆,刘明月,等.TenuifolisideA基于ERK通路保护皮质酮损伤C6细胞作用研究[J].中国药理学通报,2013,29 (4):506-11.
[8]Yu B Y,Dong X Z,Liu M Y,et al.TenuifolisideA inhibits corticosterone-induced neurotoxicity of rat glioma cells via ERK pathway[J].Chin Pharmacol Bull,2013,29(4):506-11.
[9]Steru L,Chermat R,Thierry B,et al.The tail suspension test:a new method for screening antidepressant in mice[J].Psychopharmacology(Beil),1985,85(3):367-70.
[10]夏宝妹,张海楼,薛文达,等.产后抑郁小鼠模型的构建及越鞠甘麦大枣汤对其抑郁样行为的影响[J].中国药理学通报,2015,31(9):1324-8.
[10]Xia B M,Zhang H L,Xue W D,et al.Postpartum depression animal model in mice and effect of yuejuganmaidazaotang on PPD model[J].Chin Pharmacol Bull,2015,31(9):1324-8.
[11]涂海华,刘屏,马亮,等.远志抗抑郁有效部位中寡糖酯单体的分离及活性研究[J].中国中药杂志,2008,33(11):1278 -80.
[11]Tu H H,Liu P,Ma L,et al.Study on antidepressant components of sucrose ester from polygala tenuifolia[J].China J Chin Mat Med,2008,33(11):1278-80.
[12]韦桂宁,楚世峰,苏华,等.拟黑多刺蚁醇提物抗抑郁作用研究[J].中国药理学通报,2015,31(9):1280-6.
[12]Wei G N,Chu S F,Su H,et al.Antidepressive-like effect of alcoholic extract of polyrhachis vicina Roger[J].Chin Pharmacol Bull,2015,31(9):1280-6.
[13]Sun X L,Ito H,Masuoka T,et al.Effect of polygala tenuifolia root extract on scopolamine-induced impairment of rat spatial cognition in an eight-arm radial maze task[J].Biol Pharm Bull,2007,30 (9):1727-31.
[14]刘迪,唐倩倩,曹君利.脑源性生长因子参与疼痛-抑郁共病的研究进展[J].中国药理学通报,2015,31(1):26-30.
[14]Liu D,Tang Q Q,Cao L J.Progress on brain-derived neurotrophic factor participating in pain-depression comorbidity[J].Chin Pharmacol Bull,2015,31(1):26-30.
[15]刘明月,董宪喆,张岗强,等.开心散对小鼠抑郁样行为及海马中脑源性神经营养因子的影响[J].第二军医大学学报,2012,33(12):1319-23.
[15]Liu M Y,Dong X Z,Zhang G Q,et al.Effect of Kaixin-San on depression behavior and hippocampal brain-derived neurotrophic factor in mice[J].Acad J Second Milit Med Univ,2012,33(12):1319-23.
[16]Taliaz D,Stall N,Dar D E,et al.Knock down of brain-derived neurotrophic factor inspecific brain sites precipitate behaviors associated with depression and reduces neurogenesis[J].Mol Psychiatry,2010,15(1):80-92.
[17]刘艳梅,祁红,陈红专.抗抑郁药的信号转导机制[J].中国临床药理学与治疗学,2004,9(12):1321-6.
[17]Liu Y M,Qi H,Chen H Z.Signal transduction mechanism of antidepressant action[J].Chin J Clin Pharmacol Ther,2004,9(12):1321-6.
[18]Croce N,Mathé A A,Gelfo F.Effects of lithium and valproic acid on BDNF protein and gene expression in an in vitro human neuronlike model of degeneration[J].J Psychopharmacol,2014,28(10):964-72.
[19]Réus G Z,Stringari R B,Ribeiro K F,et al.Ketamine plus imipramine treatment induces antidepressant-like behavior and increases CREB and BDNF protein levels and PKA and PKC phosphorylation in rat brain[J].Behav Brain Res,2011,221(1):166-71.
[20]Screaton R A,Conkright M D,Katoh Y,et al.The CREB coactivator TORC2 functions as a calcium-and cAMP-sensitive coincidence detector[J].Cell,2004,119(1):61-74.
[21]Liu P,Wang D X,Guo D H,et al.Antidepressant effect of 3,6-disinapoyl sucrose from polygala tenuifolia willd in pharmacological depression model[J].J Biomed Biotechnol,2011,43(18):1391 -4.
[22]王剑虹,吕金胜.中西药配伍的药动学及药效学相互作用[J].医学导报,2005,1(24):78-9.
[22]Wang J H,Lv J S.Pharmacokinetic and pharmacodynamic interaction of Chinese and Western medicine[J].Herald Med,2005,1 (24):78-9.
The administration of DISS and TFSA are used to activate CREB transcription factor CRTC1,and activate the phosphorylation of CREB in the hippocampus,and then increase the expression of BDNF in the hippocampus and plays a synergistic antidepressant effect.
Study on synergistic antidepressant effect of 3,6-disinapoyl
sucrose combined with tenuifoliside A and its possible mechanism
ZHAO Run-qing1,2,HU Yuan2,LI Mu-han2,3,ZHANG Jing2,4,TAN Xiao2,LIU Ping2
(1.Dept of Pharmacy,Hebei North University,Zhangjiakou,Hebei075000,China;2.Dept of Clinical Pharmacology,General Hospital of PLA,Beijing100853,China;3.Dept of Chinese Medicine,Beijing University of Chinese Medicine,Beijing100853,China;4.Dept of Chinese Medicine,Shanxi University of Traditional Chinese Medicine,Taiyuan030024,China)
AimTo study the synergistic anti-depression effect of 3,6-disinapoyl sucrose(DISS)and tenuifoliside A(TFSA)from Radix Polygalae and the preliminarymechanism.MethodsUsing the classicalbehavioral despair and depression model of mouse tail suspension test,120 mice were divided into control group,positive group,DISS 5 mg·kg-1group,DISS 10 mg·kg-1group,TFSA 5 mg·kg-1group,TFSA 10 mg·kg-1group,DISS 5 mg·kg-1+TFSA 5 mg· kg-1group,DISS 5 mg·kg-1+TFSA 10 mg·kg-1group,DISS 10 mg·kg-1+TFSA 5 mg·kg-1group and DISS 10 mg·kg-1+TFSA 10 mg·kg-1group randomly.They were given intragastric injection for 7 days continuously,to observe the effect of DISS and TFSA monomer and its combination on the time of mouse tail suspension.Expression of BDNF in the hippocampus of mice was detected by immunohistochemistry.The expressions of CREB,pCREB,CRTC1 and BDNF in the hippocampus of mice were detected by Western blot method.ResultsThe administration of DISS and TFSA could shorten the immobility time of mice subjected to the tail.DISS(10 mg·kg-1)and TFSA(10 mg·kg-1)group were significantly lower than single dose drug group(P<0.05).DISS and TFSA and the combination groups could increase the expression of BDNF in hippocampus and cortex by immunohistochemistry(P<0.05).At the same time,the contents of CREB,CRTC1,pCREB and BDNF protein in the hippocampus were increased by DISS and TFSA,and the combination group was significantly higher than the single drug group(P<0.05).Conclusion
3,6-disinapoyl sucrose;tenuifoliside A;depression;synergistic effect;CREB;BDNF
10.3969/j.issn.1001-1978.2016.05.024
A
1001-1978(2016)05-0716-07
R-332;R284.1;R322.81;R749.42;R971.43
2016-01-04,
2016-02-06
国家自然科学基金资助项目(No 81173579)
赵润清(1989-),女,硕士生,研究方向:中药神经药理学,E-mail:zrq19890316@163.com;胡园(1980-),女,博士,副研究员,研究方向:中药药理学,通讯作者,E-mail:huyuan1980619@126.com

