NT-3高表达促进神经干细胞向胆碱能神经元分化
闫宇辉,李少恒,孔 亮,姚璎珈,教亚男,陶震宇,宋 捷,杨静娴(辽宁中医药大学药学院药理学教研室,辽宁大连 116600)
NT-3高表达促进神经干细胞向胆碱能神经元分化
闫宇辉,李少恒,孔亮,姚璎珈,教亚男,陶震宇,宋捷,杨静娴
(辽宁中医药大学药学院药理学教研室,辽宁大连116600)
网络出版时间:2016-4-26 11:06网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160426.1106.018.html
目的体外研究神经营养因子3(neurotrophin-3,NT-3)基因转染神经干细胞(neural stem cells,NSCs)后对其向胆碱能神经元分化的影响,并探讨其机制。方法体外分离培养新生小鼠脑源NSCs,免疫荧光细胞化学法对其进行鉴定;将NSCs分为NSCs组(不作任何处理的NSCs)、GFP-NSCs组(转染GFP的NSCs)、NT-3-NSCs组(转染NT-3的NSCs),免疫荧光细胞化学法和ELISA法检测各组NSCs中NT-3的表达;免疫荧光细胞化学法和RT-PCR法检测各组NSCs向胆碱能神经元分化的能力;乙酰胆碱检测试剂盒检测乙酰胆碱分泌情况;RT-PCR法检测Notch信号通路相关靶基因Hes1、Mash 1和Neurogenin 1(Ngn1)表达情况。结果免疫荧光细胞化学法结果显示,NSCs表达其特异性标志蛋白
Nestin
神经干细胞;阿尔茨海默病;神经营养因子3;胆碱能神经元;分化;Notch信号通路
阿尔茨海默病(Alzheimer’s disease,AD)又称老年性痴呆,是中老年人常见的以进行性记忆力减退和认知功能障碍为主要表现的神经退行性疾病[1],典型的病理特征为大脑皮层和海马区出现老年斑与神经原纤维缠结,病灶周围持续存在的炎症反应和氧化应激损伤导致大量神经元溃变丢失、脑组织萎缩,其中以基底前脑胆碱能神经元丢失最为严重,引起学习与记忆障碍[2]。目前AD的治疗主要是应用胆碱酯酶(AChE)抑制剂,从而升高大脑中乙酰胆碱(ACh)的浓度。然而,该疗法虽能部分缓解症状,但无法补充大量丢失的神经细胞,且副作用严重[3-4],因此急需寻找并建立从根本上修复治疗AD的新方法。
近年来,神经干细胞(neural stem cells,NSCs)的发现及成功分离,为补充替代缺损神经元、有效修复治疗AD等神经退行性疾病带来了新的希望。NSCs是一类具有自我更新能力和多向分化潜能的细胞,可分化为神经元和神经胶质细胞[5-6]。如何诱导NSCs定向分化为目的神经元是有效修复损伤神经的关键,也是目前干细胞研究领域尚未解决的难点与研究热点。
神经营养因子-3(neurotrophin-3,NT-3)是NSCs的早期分化信号,体外研究表明,NT-3对交感神经元、感觉神经元、大脑皮层的上运动神经元、脊髓前角运动神经元以及大脑基底部的乙酰胆碱能神经元等均有维持存活的生物学作用[7-11]。本研究旨在探讨NSCs在NT-3诱导下体外是否能分化为胆碱能神经元,为AD进行细胞移植替代治疗提供实验基础和理论依据。
1 材料与方法
1.1动物C57BL/6小鼠购于大连医科大学实验动物中心,动物合格证号:SCXK(辽)2010-0001。
1.2试剂DMEM/F12培养基、B27、胎牛血清(fetal calf serum,FBS,Gibco);青-链霉素(penicillinstrepotomycin,P/S,Thermo);表皮生长因子(epidermal growth factor,EGF,Peptide);碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,Peptide);小鼠抗Nestin、NF-M、NG2、GFAP抗体(北京博奥森);兔抗Sox2抗体、Cy3标记种属特异性免疫荧光二抗(Jackson);TRIzol、LipofectamineTM2000、乙酰胆碱检测试剂盒(Invitrogen)。
1.3仪器Ti-S型荧光显微镜(日本尼康)、超低温冰箱(青岛海尔,DIV-86L386)、CO2培养箱(NUAIRE,BPN)、酶标仪(深圳迈瑞,MR-96A)、PCR仪(杭州朗基,MG96G)、凝胶成像系统(UVP,GeneGenius)、水平核酸电泳仪(Bio-Rad)。
1.4NSCs的培养与鉴定取新生(48 h内)小鼠大脑,分离其海马和侧脑室下区,剪碎后用0.05%胰蛋白酶于37℃消化15 min,终止消化后经筛网过滤得到细胞悬液。以1.0×108·L-1密度置于含有20 μg·L-1bFGF、20 μg·L-1EGF、2%B27和100 kU·L-1双抗的DMEM/F12中培养,每3 d换1次液。7 d后可诱导形成NSCs球,将NSCs球机械性分散为单个细胞后传代培养。取第5代NSCs球,以抗小鼠Nestin和Sox2抗体(未分化NSCs标志性蛋白)进行双标记免疫荧光细胞化学染色,共倒置荧光显微镜检测鉴定[12-13]。将NSCs单细胞以1.0 ×108·L-1的密度接种于含有10%FBS的DMEM/ F12中诱导分化。2周后,用免疫荧光细胞化学染色鉴定分化细胞中NF-M(神经元)、NG2(少突胶质细胞前体细胞)、GFAP(星形胶质细胞)等特异性蛋白的表达。
1.5NT-3基因转染NSCs及NT-3表达的检测[14]用Lipofectamine 2000介导构建的L.v.-NT-3-GFP 和L.v.-GFP分别转染293T包装细胞,培养24 h后荧光显微镜下观察两组细胞都呈现绿色荧光。分别收集72 h内上述293T细胞培养液上清(含病毒),离心、浓缩并检测病毒滴度;用浓缩的病毒上清转染第5代NSCs;分别作为NT-3-NSCs组和GFP-NSCs组,另取正常培养的第5代NSCs作为NSCs组,转染3 d后用免疫荧光细胞化学法和ELISA法检测NT-3在各组NSCs中的表达。
1.6NT-3高表达对NSCs向胆碱能神经元分化的影响取上述3组NSCs,轻柔吹打分散后,以5× 107·L-1的密度在培养箱中培养4h让细胞球贴壁,然后轻轻吸去培养基,加入含有 10%FBS的DMEM/F12培养基诱导分化。诱导分化2周后,小心弃去培养基,用4%多聚甲醛室温固定30 min,PBS漂洗3次,用0.03%Triton X-100透化30 min后,加入1∶100稀释的兔抗ChAT抗体,4℃孵育过夜,PBS漂洗3次后,再加入1∶150稀释的Cy3标记的驴抗兔二抗工作液,室温避光孵育1 h,PBS漂洗3次,再用DAPI染核15 min,PBS清洗后,吸净培养孔内的液体,滴加少量抗荧光淬灭封片液,盖上盖玻片。置于倒置荧光显微镜下观察各组细胞中胆碱能神经元标志物-胆碱乙酰转移酶(choline acetyltransferase,ChAT)的表达[15]。取各组细胞上清液,依据乙酰胆碱检测试剂盒说明书,测定各组细胞释放的乙酰胆碱浓度。
1.7RT-PCR实验分化条件下的各组单个NSCs培养于6孔板内,弃去培养液。按常规方法提取各组细胞总RNA[16],取稀释后的RNA按照说明书合成cDNA。引物序列见下表。反应体系50 μL:cDNA 2 μL,PCR Master Mix 25 μL,上、下游引物各2 μL,DEPC水19 μL,按以下条件进行:预变性95℃2 min,变性95℃ 30 s,退火54℃ 30 s,延伸72℃40 s,终延伸72℃ 10 min,35个循环,扩增ChAT、Hes 1、Mash1和Ngn1基因的mRNA,以β-actin为内参。取各组扩增产物5 μL,加1 μL Loading Buffer混匀,1.5% 琼脂糖凝胶电泳,用凝胶成像系统拍照,Image J图像分析软件对条带进行光密度扫描[17],结果用相对光密度表示,相对光密度=光密度目的基因/光密度β-actin。

Tab 1 Gene sequences
2 结果
2.1小鼠NSCs的培养与鉴定第5代NSCs半悬浮在增殖培养基中,形成多个大小不等的神经干细胞球,免疫细胞化学染色显示其表达高水平的神经干细胞特异性标志蛋白Nestin(绿色)和Sox2(红色),证明为未分化的NSCs(图1A)。将NSCs细胞球机械性吹打分散为单细胞,接种于分化培养基中诱导分化,2周后用免疫细胞化学法检测,结果显示,NSCs可分化为NF-M+神经元、NG2+少突胶质细胞前体细胞、GFAP+星形胶质细胞,说明其具有多向分化能力(Fig 1B)。
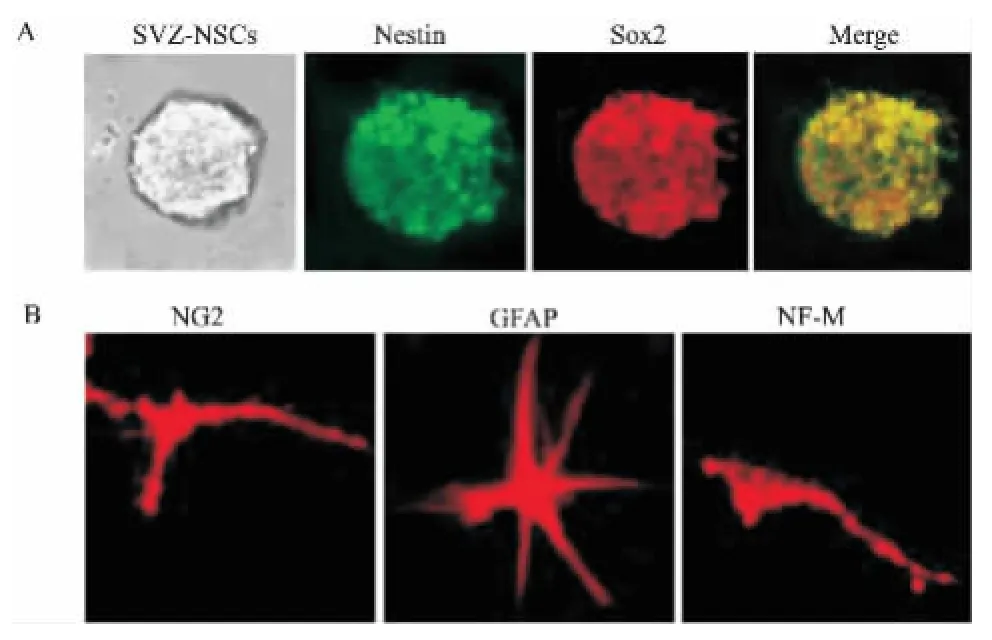
Fig 1 Generation and characterization of NSCs
2.2NT-3在NSCs中的表达检测免疫细胞化学法检测基因转染3 d后的NSCs,结果显示,NT-3-NSCs组和GFP-NSCs组均呈GFP+(绿色),而NSCs组无绿色荧光,说明除NSCs组外,其他2组细胞都被病毒质粒有效转染;NT-3(red)在NT-3-NSCs组中呈强阳性表达,而在GFP-NSCs和NSCs组中只微弱表达(Fig 2A);ELISA法检测各组细胞上清液中NT-3的浓度,结果显示,NT-3-NSCs组培养3d的上清液中NT-3的浓度明显升高,说明该组细胞能高表达NT-3(P<0.01,Fig 2B)。

Fig 2 Identification of NT-3 expression in NSCs
2.3NT-3高表达可促进NSCs向胆碱能神经元分化为了检测NT-3高表达对NSCs分化为胆碱能神经元能力的影响,我们将各组细胞接种于分化培养基中诱导分化。2周后用免疫细胞化学法和RTPCR法检测,结果显示,NT-3-NSCs组可更多地分化为ChAT+胆碱能神经元(22.86%±2.17%),而NSCs组(10.15% ±0.46%)和 GFP-NSCs组(10.25%±1.19%)向胆碱能神经元的分化率较低,组间比较差异具有显著性(P<0.01,Fig 3A-B),说明NT-3高表达能够促进NSCs向胆碱能神经元分化。RT-PCR法检测表明,NT-3-NSCs组细胞中ChAT mRNA的表达量与其他2组比较也明显增加(P<0.05,Fig 3C-D)。为进一步检测分化的胆碱能神经元是否能够分泌其特异性神经递质乙酰胆碱,我们采用乙酰胆碱检测试剂盒检测了各组细胞上清液中乙酰胆碱的含量。结果显示,NSCs组和GFPNSCs组上清液中乙酰胆碱的含量分别为(0.55± 0.12)μmol·L-1和(0.56±0.13)μmol·L-1,而NT-3-NSCs组可高达(2.92±0.24)μmol·L-1(P<0.01,Fig 3E)。
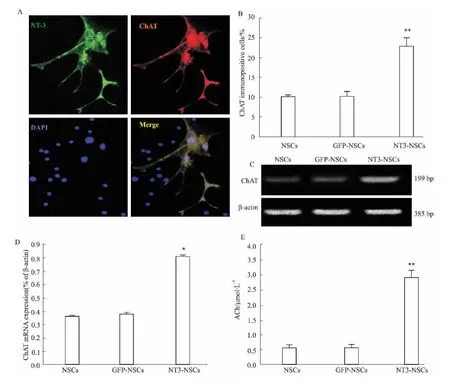
Fig 3 Expression of choline acetyltransferase(ChAT)in NT-3-transduced NSCs after 2 weeks’culturing in differentiation medium
2.4NT-3高表达调节NSCs内Notch通路相关基因的表达为了探讨NT-3促进NSCs向胆碱能神经元分化的机制,我们采用 Notch通路的抑制剂DAPT来阻断通路信号,应用 RT-PCR法检测了Hes1、Mash 1和Neurogenin 1(Ngn 1)mRNA的表达。Mash 1和Ngn 1是bHLH转录因子,激活bHLH转录因子能够激活神经元性分化。结果显示,NT-3-NSCs组 Hes 1 mRNA表达减少,而 Mash1、Ngn 1 mRNA的表达则增加,与GFP-NSCs和NSCs组比较差异具有显著性(P<0.05,Fig 4)。加入DAPT抑制剂后,Hes1 mRNA表达进一步减少,而Mash1、Ngn 1 mRNA的表达则进一步增加(P<0.01,Fig 4),说明NT-3高表达促进NSCs向胆碱能神经元分化可能是通过抑制Notch信号通路实现的。

Fig 4 Effect of NT-3 overexpression on Notch signaling pathway in NSCs
3 讨论
由于传统药物疗效有限,要想从根本上治疗AD等神经系统退行性疾病,修复和代替受损的脑组织,NSCs移植被认为是一种有效的治疗方法。NSCs替代治疗主要有两种途径:内源性途径,即诱导内源性NSCs的增殖和分化,受损的中枢神经系统可以自我修复;外源性途径,即直接更换有缺陷的组织或植入转基因细胞,这种细胞可以分泌生长因子,促进干细胞增殖。一些研究表明,NSCs在直接移植到受损区域时,它的分化会受限[18-19],且向神经元的分化率较低,对补充缺失的神经元是非常不利的。因此,如何诱导移植后的NSCs向神经元分化,尤其是定向分化为功能神经元是治疗AD等神经退行性疾病的关键[20]。
神经营养因子(neurotrophic factors,NTF)是一类对神经元的发育、存活和凋亡起重要作用的小分子蛋白质,与NSCs的增殖、分化密切相关,对NSCs分化到终末细胞的整个过程均有影响,其成员主要包括神经生长因子(NGF)、脑源性生长因子(BDNF)、神经营养因子3(NT-3)、神经营养因子4(NT-4)等。不同的NTF在NSCs的诱导分化中起重要作用,NT-3是其中重要的一员[21-22],有研究表明[23],将NT-3加入NSCs培养基中,18 d后NSCs可分化为更多的胆碱能神经元。NSCs自身表达的NT-3极少,难以达到有效修复神经损伤的目的,且NT-3在体内不稳定,极易被稀释或降解失活,吸收率不高[24],体外实验中,NT-3半衰期短,需要每天向培养基中加入才能发挥效用,给其临床应用带来了一定的局限性,基因转染技术为神经营养因子的临床应用提供了新的思路和途径。采用基因转染技术能使NSCs稳定高效表达NT-3,既能维持其有效作用浓度,达到促进神经再生的目的,又能避免NT-3给药途径上的不便[25]。在本实验中,我们构建了高表达NT-3的NSCs,观察其体外诱导NSCs向胆碱能神经元的分化,结果表明,NT-3高表达的NSCs可分化为更多的胆碱能神经元,且各组细胞上清液中释放的乙酰胆碱和ChAT mRNA的表达量也明显增加。
为了进一步探讨NT-3转基因促进NSCs向胆碱能神经元分化的分子机制,我们采用RT-PCR法检测了NSCs分化相关调控因子mRNA的表达,包括bHLH基因家族及Notch信号通路相关信号分子。NSCs的分化存在自身基因调控和外来信号调控两种机制。随着对中枢神经系统发育过程中控制神经细胞发生模式和特化的机制不断深入的研究,越来越多的研究揭示,bHLH(basic helix-loop-helix)基因家族在神经发生、神经发育和神经分化中发挥重要的调控作用[26-27]。bHLH基因家族是一类转录调节因子家族,分为正调控型(如Mash1、Ngn1)和负调控型(如Hes1)两类。Hes1(hairy and enhancer of split 1)在维持NSCs增殖、分化为适当数量的细胞及分化的多样性方面具有重要的作用。mash1 (mammalian achaete-scute homolog 1)则参与了神经前体细胞的产生以及促进这些多潜能前体细胞向不同类型的神经元分化[28-30]。γ-分泌酶是调节Notch信号通路的核心环节[31],它参与了Notch信号通路的酶解过程,DAPT是γ-分泌酶抑制剂,通过阻断γ-分泌酶,减少NICD(notch intracellular domain,Notch受体的活化形式)的产生,从而使下游信号分子处于静止状态,干细胞进入分化程序。本实验利用RT-PCR技术,检测了NSCs中的Hes1、Mash1和Ngn1 mRNA的表达。结果显示,与GFP-NSCs和NSCs组比较,NT-3-NSCs组Hes1 mRNA表达减少,而Mash1和Ngn1 mRNA的表达增加,DAPT抑制剂能够使Hes1 mRNA表达进一步减少,而Mash1、Ngn 1 mRNA的表达则进一步增加,说明NT-3可能是通过抑制Notch通路来促进NSCs向胆碱能神经元的分化,这为诱导NSCs定向分化为功能神经元提供了新的依据。
总之,本实验通过体外培养和鉴定NSCs,转染NT-3基因后,体外诱导分化并观察其向胆碱能神经元的分化情况,用RT-PCR技术检测出其定向分化机制可能与抑制Notch信号通路有关,为进一步研究细胞替代治疗AD等神经退行性疾病奠定了基础。
[1]李少恒,教亚男,姚璎珈,等.蛇床子素对感染APP基因的神经元突触的保护作用[J].中国药理学通报,2015,31(10):1383-8.
[1]Li S H,Jiao Y N,Yao Y J,et al.Neuroprotective effect of osthole on neuron synapses infected APP gene[J].Chin Pharmacol Bull,2015,31(10):1383-8.
[2]Moghadam F H,Alaie H,Karbalaie K,et al.Transplantation of primed or unprimed mouse embryonic stem cell-derived neural precursor cells improves cognitive function in Alzheimerian rats[J]. Differentiation,2009,78(2-3):59-68.
[3]Zhang Y,Kurup P,Xu J,et al.Genetic reduction of striatal-enriched tyrosine phosphatase(STEP)reverses cognitive and cellular deficits in an Alzheimer’s disease mouse model[J].Proc Natl Acad Sci USA,2010,107(44):19014-9.
[4]Iqbal K,Grundke-Iqbal I.Alzheimer’s disease,a multifactorial disorder seeking multitherapies[J].Alzheimers Demen,2010,6 (5):420-4.
[5]Magnus T,Rao M S.Neural stem cells in inflammatory CNS diseases:mechanisms and therapy[J].J Cell Mol Med,2005,9 (2):303-19.
[6]Yang J,Jiang Z,Fitzgerald D C,et al.Adult neural stem cells expressing IL-10 confer potent immunomodulation and remyelination in experimental autoimmune encephalitis[J].J Clin Invest,2009,119(12):3678-91.
[7]Li T,Jiang L,Zhang X,Chen H.In-vitro effects of brain-derived neurotrophic factor on neural progenitor/stem cells from rat hippocampus[J].Neuroreport,2009,20(3):295-300.
[8]Guo J,Zeng Y,Liang Y,et al.Cyclosporine affects the proliferation and differentiation of neural stem cells in culture[J].Neuroreport,2007,18(9):863-8.
[9]Kato M,Yoshimura S,Kokuzawa J,et al.Hepatocyte growth factor promotes neuronal differentiation of neural stem cells derived from embryonic stem cells[J].Neuroreport,2004,15(1):5-8.
[10] Kobayashi M,Matsuoka I.Enhancement of sympathetic neuron survival by synergistic action of NT3 and GDNF[J].Neuroreport,2000,11(11):2541-5.
[11]Lin S,Wang Y,Zhang C,et al.Modification of the neurotrophin-3 gene promotes cholinergic neuronal differentiation and survival of neural stem cells derived from rat embryonic spinal cord in vitro and in vivo[J].J Int Med Res,2012,40(4):1449-58.
[12]李少恒,胡昱,姚璎珈,等.蛇床子素对神经干细胞体外分化的影响[J].医药导报,2015,34(7):856-60.
[12]Li S H,Hu Y,Yao Y J,et al.Effects of osthole on differentiation of neural stem cells in vitro[J].Herald Med,2015,34(7):856 -60.
[13]姚璎珈,孔亮,教亚男,等.蛇床子素通过Wnt/β-catenin信号通路促进转染APP基因的神经干细胞分化为更多神经元且减少神经元凋亡[J].中国药理学通报,2015,31(11):1516 -23.
[13]Yao Y J,Kong L,Jiao Y N,et al.Osthole promotes differentiation into neurons and reduces neuronal apoptosis via Wnt/β-catenin signaling pathway in APP transduced neural stem cells[J]. Chin Pharmacol Bull,2015,31(11):1516-23
[14]Yang J,Yan Y,Xia Y,et al.Neurotrophin 3 transduction augments remyelinating and immunomodulatory capacity of neural stem cells[J].Mol Ther,2014,22(2):440-50.
[15]Gu G,Zhang W,Li M,et al.Transplantation of NSC-derived cholinergic neuron-like cells improves cognitive function in APP/ PS1 transgenic mice[J].Neuroscience,2015,16(291):81-92.
[16]Hu Y,Wen Q,Liang W,et al.Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation[J].Biol Pharm Bull,2013,36(12):1950-8.
[17]Xia Y,Kong L,Yao Y J,et al.Osthole confers neuroprotection against cortical stab wound injury and attenuates secondary brain injury[J].Neuroinflammation,2015,12(1):155-65.
[18]Cao Q L,Zhang Y P,Howard R M,et al.Pluripotent stem cells engrafted into the normal or lesioned adult rat spinal cord are restricted to a glial lineage[J].Exp Neurol,2001,167(1):48-58.
[19]Chow S Y,Moul J,Tobias C A,et al.Characterization and intraspinal grafting of EGF/b FGF-dependent neurospheres derived from embryonic rat spinal cord[J].Brain Res,2000,874(2):87 -106.
[20]Yang J,Rostami A,Zhang G X.Cellular remyelinating therapy in multiple sclerosis[J].J Neurol Sci,2009,276(1-2):1-5.
[21] Chao M V,Rajagopal R,Lee F S.Neurotrophin signaling in health and disease[J].Clin Sci(Lond),2006,110(2):167-73.
[22]Blesch A,Lu P,Tuszynski M H.Neurotrophic factors,gene therapy,and neural stem cells for spinal cord repair[J].Brain Res Bull,2002,57(6):833-8.
[23]Nilbratt M,Porras O,Marutle A,et al.Neurotrophic factors promote cholinergic differentiation in human embryonic stem cell-derived neurons[J].J Cell Mol Med,2010,14(6B):1476-84.
[24]Guo J S,Zeng Y S,Li H B,et al.Cotransplant of neural stem cells and NT-3 gene modified Schwann cells promote the recovery of transected spinal cord injury[J].Spinal Cord,2006,13(6):473-6.
[25]Zhang N,Kang T,Xia Y,et al.Effects of salvianolic acid B on survival,self-renewal and neuronal differentiation of bone marrow derived neural stem cells[J].Eur J Pharmacol,2012,697(1-3):32-9.
[26]Shi Y,Sun G,Zhao C,et al.Neural stem cell self-renewal[J]. Crit Rev Oncol Hematol,2008,65(1):43-53.
[27]Nyfeler Y,Kirch R D,Mantei N,et al.Jagged1 signals in the postnatal subventricular zone are required for neural stem cell selfrenewal[J].EMBO J,2005,24(19):3504-15.
[28]Kageyama R,Ohtsuka T,Hatakeyama J,et al.Roles of bHLH genes in neural stem cell differentiation[J].Exp Cell Res,2005,306(2):343.
[29]Nakazaki H,Reddy A C,Mania-Farnell B L,et al.Key basic helix-loop-helix transcription factor genes Hes1 and Ngn2 are regulated by Pax3 during mouse embryonic development[J].Dev Biol,2008,316(2):510-23.
[30]Goncalves M B,Agudo M,Connor S,et al.Sequential RARbeta and alpha signaling in vivo can induce adult forebrain neural progenitor cells to differentiate into neurons through Shh and FGF signaling pathways[J].Dev Biol,2009,326(2):305-13.
[31]Tagami S,Okochi M,Yanagida K,et al.Regulation of Notch signaling by dynamic changes in the precision of S3 cleavage of Notch-1[J].Mol Cell Biol,2008,28(1):165-76.
Neurotrophin 3 gene overexpression promotes cholinergic differentiation in neural stem cells
YAN Yu-hui,LI Shao-heng,KONG Liang,YAO Ying-jia,JIAO Ya-nan,
TAO Zhen-yu,SONG Jie,YANG Jing-xian
(Dept of Pharmacology,School of Pharmacy,Liaoning Unversity of Traditional Chinese Medicine,Dalian Liaoning116600,China)
AimTo investigate the effects of neurotrophin-3(NT-3)gene overexpression on the differentiation into cholinergic neuron of neural stem cells (NSCs)in vitro and its underlying mechanism.MethodsBrain-derived NSCs from newborn mice were isolated and cultured in vitro and determined by immunofluorescence.TheNSCsweredividedintothree groups:NSCs,GFP-NSCs and NT-3-NSCs groups. The expression of NT-3 was detected by immunofluorescence and ELISA.Then,the ability of NSCs on differentiation into cholinergic neuron was detected by immunofluorescence and RT-PCR,and the Acetylcholine Assay Kit was used for acetylcholine(ACh),and the expression of Hes1,Mash1 and Ngn1 mRNA was determined by RT-PCR.ResultsThe neurosphere displayed Nestin and Sox 2-postive by immunofluorescence,suggesting that the cultured cells were NSCs. The proportion of ChAT immunopositive cells was significantly higher in the NT-3-NSCs group than that in the other two groups(P<0.01).Ach secretion in NT-3-NSCs was significantly elevated compared with the other two groups(P<0.01).NSCs transfected with NT-3 increased the levels of Mash1 and Ngn1 mRNA,and decreased the level of Hes1 mRNA(P<0.05).ConclusionNT-3 can significantly promote the in vitro differentiation of NSCs into cholinergic neurons via probablly inhibiting Notch signaling pathway.
neural stem cells;Alzheimer’s disease;neurotrophin-3;cholinergic neuron;differentiation;Notch signaling pathway
10.3969/j.issn.1001-1978.2016.05.009
A
1001-1978(2016)05-0631-07
R-332;R322.8;R329.24;R394.2;R745.7;R977.6
2016-01-04,
2016-02-05
国家自然科学基金面上项目(No 81173580)
闫宇辉(1982-),女,博士生,讲师,研究方向:中药神经药理学,E-mail:ctyanyh@163.com;杨静娴(1963-),女,博士,教授,博士生导师,研究方向:神经药理学,通讯作者,Tel:0411-87586009,E-mail:jingxianyang@yahoo.com和Sox2,与NSCs组和GFP-NSCs组相比,NT-3-NSCs组能够分化为更多的胆碱能神经元(P<0.01),分化的胆碱能神经元可分泌乙酰胆碱(P<0.01),且能够减少Notch通路靶基因Hes 1 mRNA的表达,增加Mash1、Ngn 1 mRNA的表达(P <0.05)。结论NT-3高表达可促进NSCs分化为更多的胆碱能神经元,其机制可能与抑制Notch信号通路有关。

