从原位癌到微小浸润:乳腺肿瘤的临床病理分析及对外科治疗的影响
王一澎郭文青*张丽华※马沛卿张扬王仲照方仪宣立学高纪东王靖王翔陈国际#国家癌症中心/中国医学科学院北京协和医学院肿瘤医院乳腺外科,病理科,北京
从原位癌到微小浸润:乳腺肿瘤的临床病理分析及对外科治疗的影响
王一澎1郭文青1*张丽华1※马沛卿2张扬1王仲照1方仪1宣立学1高纪东1王靖1王翔1陈国际1#
国家癌症中心/中国医学科学院北京协和医学院肿瘤医院1乳腺外科,2病理科,北京1000210
背景对乳腺原位癌(CIS)是否应进行前哨淋巴结活检(SLNB)目前仍处于争议中。临床诊疗中常遇到:一些在术前穿刺或术中活检被诊断为原位癌且未进行SLNB的患者,术后却经病理确诊为乳腺微小浸润性癌(MIBC)。此时,是否二次手术进行腋窝淋巴结状态评估对外科医师来说是一个困难的选择。一方面,MIBC淋巴结转移风险尚不明确;另一方面,再次手术时SLNB的准确性及可操作性往往受到质疑,多数情况下腋窝淋巴结清扫成为唯一的选择。目的识别原位癌伴发微小浸润的危险因素;比较CIS和MIBC腋窝淋巴结的转移风险;探索选择合适的病例直接进行术中前哨淋巴结活检以避免二次手术的合理性。方法对接受手术且经病理确诊的乳腺原位癌(493例)及微小浸润癌(199例)患者的临床病历资料进行回顾性的统计分析;采用Pearson卡方检验和Fisher确切概率法进行组间比对;通过单因素分析和多因素Logistic回归识别原位癌伴发微小浸润的危险因素。结果原位癌组中出现4例小叶原位癌(LCIS),其余均为导管原位癌(DCIS),而MIBC所伴发的原位癌均以DCIS为主。单因素分析显示,X线片BI-RADS≥4级的钙化,肿瘤>2.5 cm,高级别DCIS,ER(-),PR(-),HER-2(+++)是原位癌伴微小浸润的危险因素(P均<0.05);Ki-67≥20%也可能与发生微小浸润有关(P= 0.057)。使用Logistic回归将重要协变量(年龄)与上述危险因素一起进行多因素分析显示,年龄>50岁(P= 0.034),肿瘤>2.5 cm(P=0.033),高级别DCIS(P=0.011)等是原位癌伴微小浸润的独立危险因素。此外,相对于2.0%的原位癌淋巴结转移概率,MIBC的淋巴结转移概率为5.5%,二者比较差异具有统计学意义(P=0.029)。结论MIBC淋巴结转移风险为5.5%,多伴发于患者年龄超过50岁的较大范围的高级别DCIS中。目前来说,对合并这些高风险因素的原位癌患者直接进行SLNB是一种合理和稳妥的诊治手段,可以有效避免二次手术的发生并为下一步治疗提供依据。
乳腺癌;原位癌;导管原位癌;乳腺微小浸润癌;导管原位癌伴微小浸润;前哨淋巴结活检
Oncol Prog,2016,14(5)
正常乳腺上皮的“增生—不典型增生—原位癌—浸润癌”直线性进展模式于40多年前被Wellings 和Jensen提出[1-2],尽管目前认为该模式过于简单并受到质疑,但乳腺原位癌(carcinoma in situ,CIS)作为重要的癌前病变的地位已成为不争的事实。由原位癌进展到浸润性癌是乳腺癌发展最重要的一步,其意味着由一种低危的病变进展为一种潜在的致死性的疾病。浸润癌的发生涉及多个复杂机制以及一系列的细胞学和分子学的改变,包括肿瘤细胞及其所介导的周围间质细胞反应,这个过程通常需要很长时间,甚至数十年。近来的一些研究者推测乳腺微小浸润癌(microinvasive breast cancer,MIBC)可能是原位癌和浸润性癌的中间过渡阶段[3-4]。
MIBC的定义为:“癌细胞范围超过基底膜浸润临近组织,但无病灶最大范围超过0.1 cm。当存在多个微小浸润病灶时,只有最大的病灶可以用于对微小浸润的分类,并且单独病灶的大小不应累加在一起”。符合这个定义的病变被视作T1期乳腺癌的一个亚型,归为T1mic期[5]。根据这个定义,一般认为其发病率低于1%[6-7]。尽管有文献报道小叶原位癌(lobular carcinoma in situ,LCIS)伴微小浸润的病例[8],但MIBC更常伴发于较大区域的高级别导管原位癌(ductal carcinoma in situ,DCIS),并表现为所伴发的原位癌的特点,如钙化、肿块或者乳头溢液等。
事实上,随着钼靶的普及,越来越多的原位癌被诊断出来。但临床医师经常遇到的一个问题:术前核芯针穿刺或术中活检诊断为原位癌的病例,术后病理却为浸润性癌,文献报道这类情况的比例可高达39%[9]。此时,再一次的腋窝手术进行淋巴结状态评估多不可避免。除了造成可能的医疗资源浪费以及患者额外的身体和精神痛苦外,往往还存在以下几个问题:第一,再次手术时前哨淋巴结活检(sentinel lymph node biopsy,SLNB)的准确性及可操作性往往受到质疑;第二,即使发生浸润,这类患者的浸润灶较小,甚至是MIBC,淋巴结转移概率很低,多数患者其实并不需要再次手术;第三,对于那些已接受乳腺全部切除的患者,再次手术往往意味着清扫淋巴结,这无疑大大增加了术后并发症,如上肢水肿等的发生风险。为避免这种状况的出现,对所有这类患者进行术中SLNB似乎是一种较为理想的方案,但它同样面临着腋窝手术之后的并发症,尽管其较腋窝清扫术已经有所减少。另外,对于活检后淋巴结检测阴性的病例,尤其是术后病理证实为原位癌的患者,已然进行了过度治疗。因此,识别原位癌伴发微小浸润的危险因素,选择合适的病例进行术中SLNB成为亟待解决的一个问题。
本研究回顾性分析493例和199例经术后病理证实的CIS和MIBC患者的临床资料,总结两组患者的临床病理特点和腋窝淋巴结转移状况,探寻原位癌伴发微小浸润的危险因素,以期为此类患者的临床治疗提供思路及参考。
1 对象与方法
1.1研究对象
选取中国医学科学院肿瘤医院2010年7月至2015年6月5年间接受手术且经病理确诊的所有CIS及MIBC病例,其中排除双侧乳腺癌患者,乳腺癌新辅助化疗后或既往曾接受其他恶性肿瘤放化疗者,肿物外院已切除活检或既往曾接受乳腺恶性肿瘤切除术的患者。共收集CIS病例493例,MIBC病例199例。对患者的年龄、性别、临床及影像学诊断,是否伴佩吉特(Paget)病,肿瘤大小,病理组织学分类和分级,免疫组化(ER/PR/HER-2/Ki-67等)以及腋窝淋巴结状态等临床特征进行统计总结。
1.2诊断标准
1.2.1临床及影像学表现重点关注了两类患者是否伴有Paget病,以及其X线片中的钙化表现。本研究的病例中多数的X线片仅表现为成簇或泥沙样的微小钙化,因此乳腺影像报告和数据系统(breast imaging reporting and data system,BIRADS)分类主要依据钙化情况进行分级。为更好地说明该类患者的临床特点,伴微小簇状钙化且BI-RADS≥4级单独归为一组;未伴钙化者,即使BI-RADS≥4级,亦归为“其他”组。
1.2.2病理诊断依据WHO及美国癌症联合委员会(AJCC)的诊断标准[10],乳腺CIS和MIBC的主要区分在于肿瘤细胞是否突破基底膜进入临近组织。因此,所有患者均对肌上皮细胞及基底膜进行免疫组化评估以确定诊断。相关的免疫组化抗体包括SMA、Calponin、P63、Actin、CK5/6、S-100等,必要时可对标本进行连续切片以确诊。如仍不能明确有无浸润,则归类为原位癌。
1.2.3肿瘤大小以术后大体标本中的病变范围计算,部分患者由于病变累及范围广或伴Paget病,或信息不全,则不进行大小评估。病理组织学分类及分级以原位癌或MIBC所伴发的原位癌成分进行评估,分类包括DCIS和LCIS,分级分高、中、低三个级别。
1.2.4免疫组化对激素受体,如ER、PR状态的评估以及对HER-2、Ki-67的检测均选择原位癌或MIBC中所伴发的原位癌成分;部分MIBC患者仅对浸润灶进行了检测,视作未知病例。需要注意的是,ER、PR均以1%作为临界值;Ki-67指数以20%作为临界值;HER-2的评估以IHC检测结果为准:0或+视为阴性,+++为阳性,因浸润灶小,几乎所有的++患者均未行荧光原位杂交(fluorescence in situ hybridization,FISH)检测,因此++被视作待定而单独列出。
1.2.5腋窝淋巴结状态以SLNB或腋窝清扫作为标准,按照常规HE染色结果证实的淋巴结受累数目确定淋巴结分级。转移灶>2 mm被认为是宏转移,转移灶≤2 mm且>0.2 mm为微转移。由于对常规HE结果证实阴性的患者,均未进行IHC或分子生物学方法(如反转录聚合酶链反应)来做进一步的检测,因此本组中最大径不超过0.2 mm的孤立肿瘤细胞并未被发现。
1.3统计学方法
应用SAS9.2统计软件分析原位癌伴发微小浸润的危险因素。Pearson卡方检验和Fisher确切概率法进行单因素分析,单因素分析有统计学意义的因素及P值<0.1者,使用Logistic回归将重要协变量(年龄)一起进行多因素分析。以P<0.05为差异有统计学意义。
2 结果
2010年7月至2015年6月,共11 398例乳腺癌患者在本院接受手术,确诊乳腺CIS患者493例,MIBC患者199例,分别占同期手术患者比例的4.3%和1.7%,其中位年龄分别为49岁(25~80岁)和51岁(30~81岁)。两类患者中仅有4例为男性,均为原位癌病例。除去未知病例,CIS组中53.9% (223/414)伴有BI-RADS≥4级的钙化,而在MIBC组中这一比例为70.3%(116/165)。分别有34例(6.9%)原位癌和18例(9.0%)MIBC患者伴有乳头Paget病。CIS和MIBC组中位肿瘤最大径分别为2.0 cm(0.4~13.0 cm)和2.5 cm(0.4~14.0 cm)。CIS组中出现4例LCIS,而在MIBC组中所有病例均以DCIS为主(部分病例伴少量小叶癌化),未出现LCIS病例。进一步的组织学分级显示高级别病变在两组中分别占63.5%(254/400)和85.0%(147/ 173)。而激素受体检测结果显示:除去未知病例外,ER、PR、HER-2、Ki-67在原位癌组中的阳性表达比例分别为74.7%(357/478)、77.2%(369/478)、43.1% (193/448)和51.3%(163/318);而对MIBC所伴发的DCIS中,其对应的比例分别为56.3%(54/96)、57.3% (55/96)、69.8%(67/96)和63.5%(47/74)。(表1)
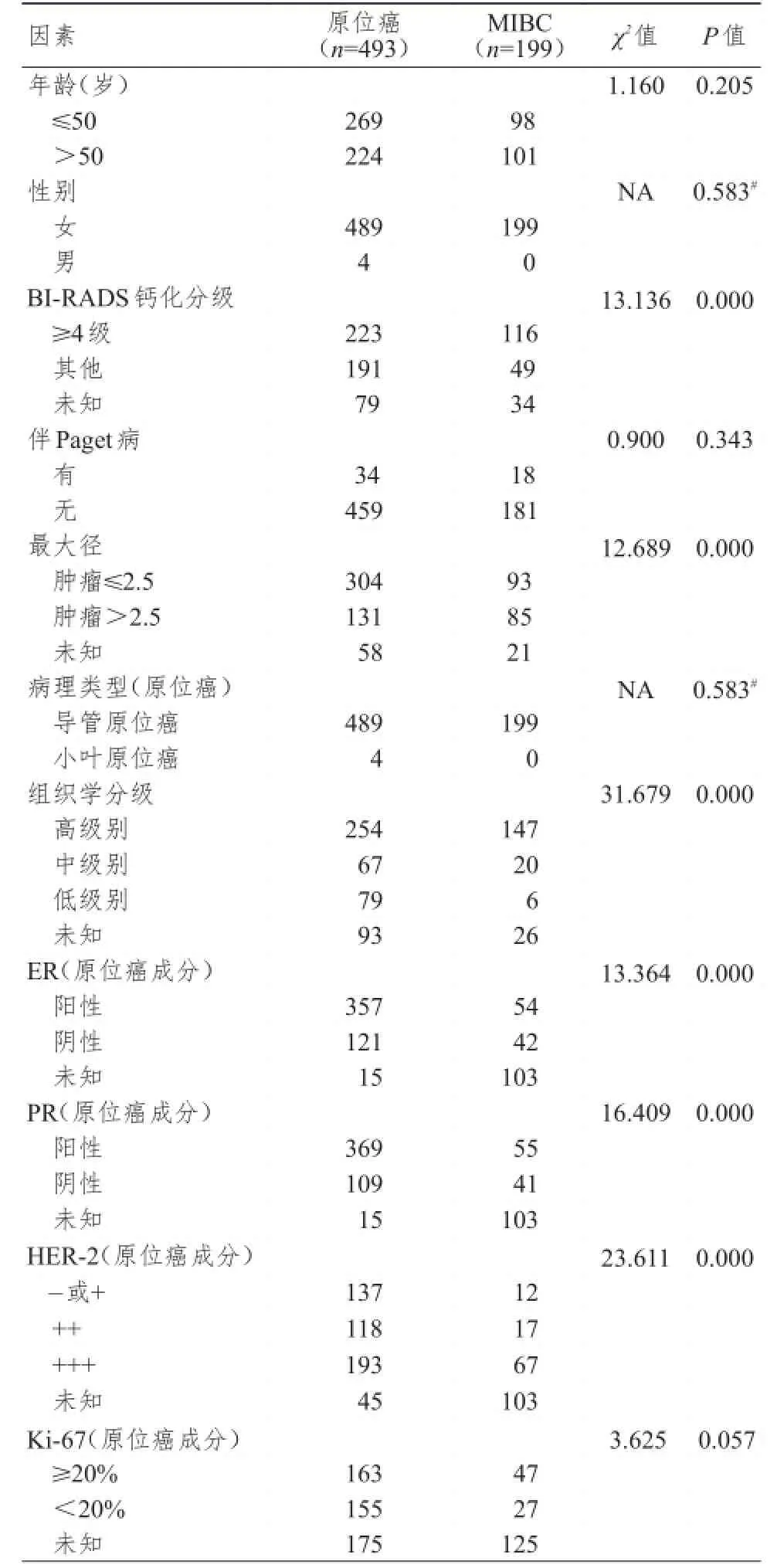
表 1 原位癌及微小浸润癌的单因素分析
2.1原位癌伴发微小浸润的单因素及多因素分析
原位癌伴发微小浸润的可能相关因素见表1。单因素分析显示BI-RADS钙化分级≥4级,肿瘤>2.5 cm,高级别DCIS,ER(-),PR(-),HER-2 (+++)是原位癌伴微小浸润的危险因素(P均<0.05);Ki-67≥20%也可能与发生微小浸润有关(P= 0.057)。采用Logistic回归分析将重要协变量(年龄)与上述危险因素一起进行多因素分析显示(表2):年龄>50岁(P=0.034),肿瘤>2.5 cm(P= 0.033),高级别DCIS(P=0.011)等是原位癌伴微小浸润的独立危险因素,经Firth回归校正后依然有统计学意义。
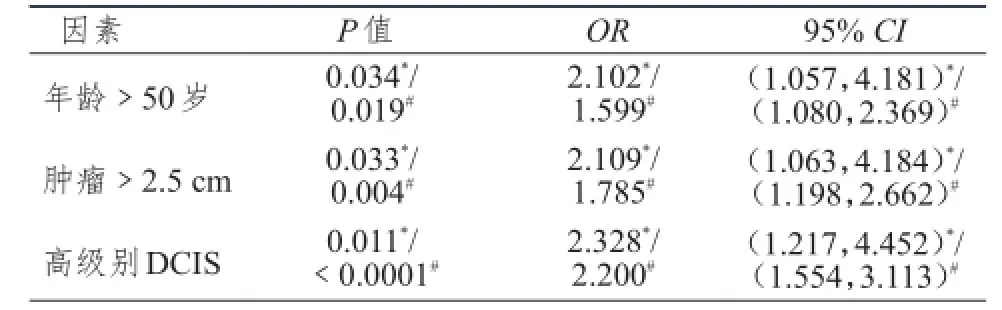
表2 原位癌伴发微小浸润的多因素分析
2.2手术方式及淋巴结转移情况分析
手术方式上,共有155例(31.4%)CIS和22例MIBC(11.1%)患者接受保乳手术,其余均为乳腺全部切除术。351例CIS患者接受腋窝淋巴结状态评估,其中SLNB者248例,腋窝清扫103例;其中7例(2.0%)患者发现淋巴结转移,平均转移个数15.7个(1~38个),且均为宏转移。同样,有182例MIBC患者接受腋窝淋巴结状态评估,包括SLNB93例和腋窝淋巴结清扫89例;其中10例(5.5%)患者出现淋巴结转移,8例为宏转移,2例为微转移;平均转移个数1.2个(1~2个)。相对于2.0%的原位癌淋巴结转移概率,MIBC的淋巴结转移概率为5.5%,二者比较差异具有统计学意义(P= 0.029)。(表3)

表3 原位癌及MIBCMIBC的手术方式及淋巴结转移情况分析
3 讨论
随着诊疗技术的进展,越来越多的原位癌被诊断出来。如国外文献报道[11],DCIS已占新诊断乳腺癌的20%~25%。大部分DCIS在钼靶普查中被发现,而在这之前,DCIS较为罕见(<5%)。LCIS更为罕见,真实发病率难以统计,其通常在由于其他原因而进行的活检或切除中被发现。需要对原位癌进行处理的主要原因是其存在进展为浸润性癌的风险,这已被流行病学、表观遗传学、基因学等多个方面予以证实。然而,并非所有的原位癌均进展为浸润性癌,其本身存在的组织学和生物学上的多样性,如起源、演化、分级等的不同,可能会影响到其发生浸润性乳腺癌的概率,浸润性癌的类型及各种治疗方法的敏感性;此外,浸润性癌的发展应当也是一个循序渐进、由小增大的过程,因此,有理由推测MIBC应当是肿瘤发展的早期阶段;最后,由原位癌进展至浸润性癌应当有其阶段特异性表现,不管从基因表达还是临床表观上,但就目前而言,预测DCIS进展为浸润性癌的分子学标志物尚未明确。因此,研究者倾向于选择分析临床病理特点变化这种简单易行的方法来分析其每个阶段的生物学特征,一方面可以为基础研究提供思路及参考,另一方面能解决临床诊疗过程中的实际问题,如本文涉及的识别有可能发生浸润的高危原位癌患者,其宜直接进行术中腋窝前哨淋巴结活检。
事实上,几乎所有的MIBC均与DCIS伴发,提示DCIS是MIBC发生的重要基础,本研究进一步支持了这个观点,尽管LCIS伴微小浸润及不超过1 mm的原发浸润癌都符合MIBC的定义,但均十分罕见[6,8]。因此,MIBC多显现伴发DCIS的临床表现,如钙化、累及乳头的Paget病等。然而,潜在的转移可能性使MIBC与DCIS又有着明显的不同[7,12]:首先,MIBC的病变一般较单纯DCIS大,如在Wang等[4]的研究中,63.4%的MIBC患者肿块直径超过2 cm;Mori等[3]的研究中其肿瘤中位直径为3.5 cm。本研究中其中位直径为2.5 cm,而本组中DCIS中位直径为2.0 cm,且无论单因素还是多因素分析中,肿瘤>2.5 cm都是发生微小浸润的重要危险因素;其次为年龄,多因素分析显示MIBC较DCIS患者年龄更大,这同样得到另外几个研究的证实[3,13],超过50岁也成为发生微小浸润的独立危险因素。由此我们推测,随时间推移的克隆演化可能是DCIS发生微小浸润的推动力。因此,时间越长,肿瘤越大,随机基因异常导致更具进攻性的肿瘤出现并占据优势,发生浸润的可能性更高。
其次,相对于DCIS来说,文献报道MIBC伴发的原位癌往往有着更高的核分级或组织学分级[3,7,14-16]。这同样在本文中得以体现,85.0%的MIBC所伴发的DCIS为高级别病变,而原位癌组该比例仅为63.5%。这似乎可以解释为高级别DCIS是多数浸润性癌发展的必经阶段,低级别可能先进展为高级别,之后才导致浸润性癌的出现。然而,事实可能并非如此。首先,基因阵列技术已证明大部分分子改变在原位癌和浸润性癌中是一致的,二者有着共同的基因表达异常,显示出高度的全基因一致性,均包括所谓的luminal、basel和HER-2扩增型,提示这些分子改变可能最先出现在DCIS中,然后扩展到浸润性癌,与浸润性癌的发生和进展有关[17-23]。另外,进一步的分析发现[17,24-27],根据肿瘤形态、激素受体类型和调控基因的不同,将乳腺癌分为两类:一组为低级别组,基因表达谱表现为存在ER/PR及相关调控基因的表达,缺乏HER-2和basel相关基因的表达,免疫和分子表型类似于luminal A型,主要与扁平上皮不典型增生(FEA)、不典型增生(ADH)、低级别DCIS、小叶瘤变以及相关的浸润性癌相关。其共同的基因改变为超过80%的病例与染色体16q缺失有关,提示低级别导管内癌和分化好的浸润癌相关;另一组为高级别组,其基因表达谱更加复杂多变,涉及到十余种对染色体的多个基因缺陷,主要与高级别DCIS、除luminal A型以外的其他癌以及内分泌型乳腺癌相关,并发现仅仅不到30%的高级别组存在染色体16q缺失,提示仅仅一小部分高级别DCIS是由低级别DCIS发展而来的。因此我们推测低级别DCIS和高级别DCIS是本质上不同的病变,与不同类型的浸润性癌的发生有关[28]。而高级别病变可能从一开始就更具有进攻性,进展为浸润癌速率更快,因此在MIBC病例中表现中明显的比例升高。
此外,从生物学分子标志物表达来看,不同分级的DCIS之间也存在明显的不同[24,29-31]:几乎所有分化良好或低级别的DCIS在所有细胞中ER与PR均高表达(90%~100%),HER-2扩增很罕见(约10%),细胞增殖指数(Ki-67)在5%~6%,细胞凋亡率一般不到1%;相反,高级别DCIS中ER阳性表达比例在30%~90%,PR比例也相应降低,HER-2扩增比例可高至70%,细胞增殖指数(Ki-67)升高到30%~40%,细胞凋亡则从不到1%增加到5%,并以钙化的方式表现出来。本研究中,由于MIBC所伴发的DCIS多为高级别,因此表现出来ER/PR降低、HER-2扩增、Ki-67指数增加、钙化比例升高的趋势,说明肿瘤的侵袭性及恶性度更高,尽管多因素分析中差异并不具有统计学意义。
最后,本研究对CIS及MIBC的淋巴结转移情况也进行了分析。据文献报道二者的大多数转移灶为微转移或孤立肿瘤细胞,DCIS的淋巴结转移风险为0~10%[32-33],而MIBC的风险在0~25%[34]。本组病例中,相对于2.0%的原位癌淋巴结转移概率,MIBC的淋巴结转移概率为5.5%,二者差异显著(P=0.029)。进一步研究发现了一个奇怪的现象:与MIBC平均1~2个淋巴结转移不同,原位癌中的7例患者平均转移个数15.7个(1~38个),且均为宏转移。经复查及复阅切片后认为取材充分,未存在误诊。这种现象曾出现于隐匿性乳腺癌,有研究者推测这可能由于宿主对原发瘤和转移灶不同免疫反应引起,但具体原因仍有待于进一步探索。值得注意的是:所有7例患者均在术前检查中诊断腋窝淋巴结转移,因此不存在术中额外的淋巴结活检问题;而如果仅考虑对临床腋窝淋巴结阴性的患者才进行SLNB的话(去除这7例患者),原位癌组则完全没有必要进行SLNB,而只需要对MIBC患者进行活检,更加凸显了找到原位癌发生微小浸润的危险因素的重要性。此外,一些研究者认为MIBC患者淋巴结转移概率仍然很低,SLNB应当仅针对一些有着很高淋巴结转移风险的MIBC患者进行而非所有的MIBC患者,然而找到这些高风险的患者依然很困难。
综上,MIBC具有比CIS更高的淋巴结转移风险,且多伴发于患者年龄超过50岁的较大范围的高级别DCIS中。就目前来说,对合并这些高风险因素的原位癌患者直接进行SLNB是一种合理和稳妥的诊治手段,可以有效避免二次手术的发生,并为下一步治疗提供依据。
本研究是一项回顾性研究,主要针对一些在术前穿刺或术中活检诊断为原位癌的病例是否应当进行SLNB而进行深入的分析和探讨,由于保乳病例数少以及随访时间短等因素,因此并没有对其复发及预后进行分析。即便如此,它仍然是目前已知的关于此类疾病的最大样本量的研究之一,希望能对该类疾病的临床诊治提供一定的思路和参考。笔者相信未来大样本量的前瞻性的研究以及分子生物学上的进展能完整地揭示原位癌及MIBC的本质,以便为个体化诊治指引方向。
[1]Wellings SR,Jensen HM.On the origin and progression of ductal carcinoma in the human breast[J].J Natl Cancer Inst,1973,50(5):1111-1118.
[2]Wellings SR,Jensen HM,Marcum RG.An atlas of subgross pathology of the human breast with special reference to possible precancerous lesions[J].J Natl Cancer Inst,1975,55(2):231-273.
[3]Mori M,Tsugawa K,Yamauchi H,et al.Pathological as-sessment of microinvasive carcinoma of the breast[J]. Breast Cancer,2013,20(4):331-335.
[4]Wang L,Zhang W,Lyu S,et al.Clinicopathologic characteristics and molecular subtypes of microinvasive carcinoma of the breast[J].Tumour Biol,2015,36(4):2241-2248.
[5]Edge SB,Compton CC.The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471-1474.
[6]Bianchi S,Vezzosi V.Microinvasive carcinoma of the breast [J].Pathol Oncol Res,2008,14(2):105-111.
[7]Vieira CC,Mercado CL,Cangiarella JF,et al.Microinvasive ductal carcinoma in situ:clinical presentation,imaging features,pathologic findings,and outcome[J].Eur J Radiol,2010,73(1):102-107.
[8]Ross DS,Hoda SA.Microinvasive(T1mic)lobular carcinoma of the breast:clinicopathologic profile of 16 cases[J]. Am J Surg Pathol,2011,35(5):750-756.
[9]Tunon-de-Lara C,Chauvet MP,Baranzelli MC,et al.The role of sentinel lymph node biopsy and factors associated with invasion in extensive DCIS of the breast treated by mastectomy:the cinnamome prospective multicenter study [J].Ann Surg Oncol,2015,22(12):3853-3860.
[10]Pinder SE EI,Schnitt SJ,Tan PH,et al.Microinvasive carcinoma[M]//Lakhani SR,Ellis IO,Schnitt SJ,et al.WHO classification of tumors of the breast.Lyon:IARC Press,2012:96-97.
[11]Weir HK,Thun MJ,Hankey BF,et al.Annual report to the nation on the status of cancer,1975-2000,featuring the uses of surveillance data for cancer prevention and control [J].J Natl Cancer Inst,2003,95(17):1276-1299.
[12]Parikh RR,Haffty BG,Lannin D,et al.Ductal carcinoma in situ with microinvasion:prognostic implications,longterm outcomes,and role of axillary evaluation[J].Int J Radiat Oncol Biol Phys,2012,82(1):7-13.
[13]Orzalesi L,Casella D,Criscenti V,et al.Microinvasive breast cancer:pathological parameters,cancer subtypes distribution,and correlation with axillary lymph nodes invasion.Results of a large single-institution series[J].Breast Cancer,2016,23(4):640-648.
[14]de Mascarel I,Mac Grogan G,Mathoulin-Pelissier S,et al. Breast ductal carcinoma in situ with microinvasion:a definition supported by a long-term study of 1248 serially sectioned ductal carcinomas[J].Cancer,2002,94(8):2134-2142.
[15]Colleoni M,Rotmensz N,Peruzzotti G,et al.Minimal and small size invasive breast cancer with no axillary lymph node involvement:the need for tailored adjuvant therapies [J].Ann Oncol,2004,15(11):1633-1639.
[16]Margalit DN,Sreedhara M,Chen YH,et al.Microinvasive breast cancer:ER,PR,and HER-2/neu status and clinical outcomes after breast-conserving therapy or mastectomy [J].Ann Surg Oncol,2013,20(3):811-818.
[17]Ma XJ,Salunga R,Tuggle JT,et al.Gene expression profiles of human breast cancer progression[J].Proc Natl Acad Sci U S A,2003,100(10):5974-5979.
[18]Perou CM,Sorlie T,Eisen MB,et al.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[19]Livasy CA,Perou CM,Karaca G,et al.Identification of a basal-like subtype of breast ductal carcinoma in situ[J]. Hum Pathol,2007,38(2):197-204.
[20]Zhou W,Jirstrom K,Johansson C,et al.Long-term survival of women with basal-like ductal carcinoma in situ of the breast:a population-based cohort study[J].BMC Cancer,2010,10:653.
[21]Allred DC,Wu Y,Mao S,et al.Ductal carcinoma in situ and the emergence of diversity during breast cancer evolution[J].Clin Cancer Res,2008,14(2):370-378.
[22]Hannemann J,Velds A,Halfwerk JB,et al.Classification of ductal carcinoma in situ by gene expression profiling [J].Breast Cancer Res,2006,8(5):R61.
[23]Porter D,Lahti-Domenici J,Keshaviah A,et al.Molecular markers in ductal carcinoma in situ of the breast[J].Mol Cancer Res,2003,1(5):362-375.
[24]Lopez-Garcia MA,Geyer FC,Lacroix-Triki M,et al. Breast cancer precursors revisited:molecular features and progression pathways[J].Histopathology,2010,57(2):171-192.
[25]Natrajan R,Lambros MB,Rodriguez-Pinilla SM,et al.Tiling path genomic profiling of grade 3 invasive ductal breast cancers[J].Clin Cancer Res,2009,15(8):2711-2722.
[26]Weigelt B,Reis-Filho JS.Histological and molecular types of breast cancer:is there a unifying taxonomy?[J]. Nat Rev Clin Oncol,2009,6(12):718-730.
[27]Sgroi DC.Preinvasive breast cancer[J].Annu Rev Pathol,2010,5:193-221.
[28]Balleine RL,Webster LR,Davis S,et al.Molecular grading of ductal carcinoma in situ of the breast[J].Clin Cancer Res,2008,14(24):8244-8252.
[29]Bai M,Agnantis NJ,Kamina S,et al.In vivo cell kinetics in breast carcinogenesis[J].Breast Cancer Res,2001,3(4):276-283.
[30]Harn HJ,Shen KL,Yueh KC,et al.Apoptosis occurs more frequently in intraductal carcinoma than in infiltrating duct carcinoma of human breast cancer and correlates with altered p53 expression:detected by terminal-deoxynucleotidyl-transferase-mediated dUTP-FITC nick end labelling(TUNEL)[J].Histopathology,1997,31(6):534-539.
[31]Bodis S,Siziopikou KP,Schnitt SJ,et al.Extensive apoptosis in ductal carcinoma in situ of the breast[J].Cancer,1996,77(9):1831-1835.
[32]Francis AM,Haugen CE,Grimes LM,et al.Is sentinel lymph node dissection warranted for patients with a diagnosis of ductal carcinoma In situ?[J].Ann Surg Oncol,2015,22(13):4270-4279.
[33]Meretoja TJ,Heikkila PS,Salmenkivi K,et al.Outcome of patients with ductal carcinoma in situ and sentinel node biopsy[J].Ann Surg Oncol,2012,19(7):2345-2351.
[34]Hanna MG,Jaffer S,Bleiweiss IJ,et al.Re-evaluating the role of sentinel lymph node biopsy in microinvasive breast carcinoma[J].Mod Pathol,2014,27(11):1489-1498.
Clinicopathologic characteristics of the breast carcinoma in situ and their correlations with microinvasion
WANG Yi-peng1GUO Wen-qing1*ZHANG Li-hua1※MAPei-qing2ZHANG Yang1WANG Zhong-zhao1FANG Yi1XUAN Li-xue1GAO Ji-dong1WANG Jing1WANG Xiang1CHEN Guo-ji1#1
Department of Breast Surgery,2Department of Pathology,National Cancer Center/Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing Cancer Hospital,Beijing 100021,China
BackgroundroundPerforming sentinel lymph node biopsy(SLNB)for preoperative diagnosis of carcinoma in situ(CIS)remains controversial.A common scenario:some patients are diagnosed as CIS by preoperative core needle biopsy(CNB)or intraoperative frozen section,yet without SLNB,whereas microinvasive breast cancer(MIBC)is the final pathologic finding after surgery,making it a difficult choice to perform reoperation for evaluating the status of axillary lymph nodes.On one hand,the risk of lymph node metastasis is unclear for MIBC;on the other hand,the sensitivity and feasibility of SLNB as reoperation is often questionable,while axillary lymph node dissection(ALND)is left to be the only option generally.ObjectivectiveTo determine the risk factors associated with CIS and microinvasion;compare the risk of auxiliary metastasis of CIS and MIBC;determine the criteria of enrolling patients to take upfront intra and pre-operative SLNB and avoid reoperation.MethodethodAll cases with pathologically confirmed CIS(n=493)and MIBC(n=199)were included and retrospectively analyzed for clinicopathologic parameters;.comparison between the two groups were carried out with Pearson chi-square test and Fisher exact test;univariate and multivariate analysis were used to identify factors predictive of microinvasion from CIS.ResultesultThere were 4 cases of lobular carcinoma in situ(LCIS)in the CIS group,and all the others were ductal carcinoma in situ(DCIS),whereas MIBC was almost always accompanied with DCIS.Univariate analysis revealed that patients with MIBC had a higher frequency of tumors with microcalcification of BI-RADS≥4,tumor size>2.5 cm,high-grade DCIS,ER(-),PR(-)and HER-2(+++)overexpression(all P<0.05);perhaps including the ki-67≥20%(P=0.057).All these factors(including age)were further analyzed by Logistic regression analysis,and it was found that age>50(P=0.034),tumor size>2.5 cm(P=0.033)and high-grade DCIS(P=0.011)were independent predictors of microinvasion.Comparing to the lymph node positivity rate of 2.0%for CIS cases,the rate rose up to 5.5%for MIBC(P=0.029).ConclusionusionThe rate of lymph node involvement was as high as 5.5%for MIBC cases.Microinvasion was associated with more extensive DCIS,higher grade and older patients(age≥50).Therefore,upfront SLNB for patients with these characteristics is a reasonable and safe choice,by which can avoid the unnecessary reoperations and pave the way for further therapy.
rdsbreast cancer;carcinoma in situ;ductal carcinoma in situ;microinvasive breast cancer;ductal carcinoma in situ with microinvasion;sentinel lymph node biopsy
R737. 9
A
10.11877/j.issn.1672-1535.2016.14.05.07
(corresponding author),邮箱:yidoctor99@126.com
*进修医师,原工作单位为山西煤炭中心医院普外科
※进修医师,原工作单位为华北石油管理局总医院普外科
2015-04-07)

