新型卵母细胞载体降温速率的实验研究
李维杰 王利红 刘宝林 周新丽 楼 伟 吴国荣
(1 上海理工大学生物热科学研究所 上海 200093;2 上海交通大学附属第六人民医院 上海 200233;3上海安久生物科技有限公司 上海 201108)
新型卵母细胞载体降温速率的实验研究
李维杰1王利红2刘宝林1周新丽1楼 伟3吴国荣1
(1 上海理工大学生物热科学研究所上海200093;2 上海交通大学附属第六人民医院上海200233;3上海安久生物科技有限公司上海201108)
降温速率是决定细胞低温保存效果的关键,而冷冻载体的形式和使用方式对细胞的降温速率有重要影响。本文采用数字示波器、线径80 μm的T型热电偶建立高速测温系统,研究了一种新型封闭式卵母细胞冷冻载体以不同的方式从空气插入液氮的降温速率,结果发现载体的降温主要通过对流换热实现;载体横卧时,载体的气孔方向与液氮垂直时降温速率高于气孔与液氮相切时的降温速率;将载体直接插入液氮时的降温速度大于插入后左右摆动的操作方法的降温速率;当采用载体倒置插入时,降温速度高于采用载体正置和横卧的降温速率。当采用载体倒置直接插入时,降温速率最高,可以达到54572 ± 1338 K/min,有利于卵母细胞的玻璃化保存。
冷冻载体;降温速率;液氮;莱顿弗罗斯特效应
卵母细胞是哺乳动物的重要生殖细胞,对其低温保存一直以来都是医学研究的重要内容[1-3],早在1984年Jondet M等[4]报道了使用慢速冷冻的方法冷冻卵母细胞,但没有对细胞的存活率等结果进行统计。之后的研究者逐渐意识到高速降温实现玻璃化才能有效提高卵母细胞存活率,各种低温保存载体被用于低温保存。微滴法(Micro-Droplet)是早期的一种玻璃化冷冻方法,由Landa V等[5]较早用于胚胎保存,它是将卵母细胞悬浮溶液以液滴的形式弹射进入液氮进行冷冻,但是细胞的冷冻速率不高,对卵细胞的保存效果较差[6]。开放式拉伸麦管法(Open Pulled Straws,OPS)是一种使用较多的卵母细胞玻璃化冷冻方法,从1998年一直使用至今[7,8]。之后又发展出显微镜铜网格法(Electron Microscope Copper Grids,EMCG)[9],由于冷冻保护液较多且细胞被完全包裹,阻碍了细胞与冷源间的传热。尼龙网法(Nylon Mesh)由Matsumoto H等[10]首先使用,该方法先将尼龙线圈浸入冷冻液中,借助溶液的表面张力作用,在线圈上形成一层薄膜,然后将预处理的卵母细胞加载到薄膜上,投入液氮中直接冷冻,该方法处理速度快。冷冻环法(Cryoloop)由Lane M等[11]首先提出,由于构成Cryoloop的尼龙丝十分细软,难以支撑冷冻保护剂液膜,操作十分困难,和尼龙网法一样,都具有易受污染、不便保存和易破裂等缺点。石英毛细管法[12](Quartz Micro-Capillary,QMC)是在开放式拉伸麦管法基础上发展而来的,所采用的材料为导热性比塑料好的石英。与开放式拉伸麦管法相比,石英毛细管的管直径更小,管壁更薄,所用的溶液体积比较小。Cryotop法是Kuwayama M等[13]于2005年根据最小化溶液体积原理提出的高速冷冻方法,此法用于卵母细胞的玻璃化保存后取得了较高的存活率和发育率,但是该方法依然是开放法,无法避免细胞污染。
上海安久生物科技有限公司提出了一种封闭式高速降温的冷冻装置,该装置由两部分构成,包括一个底座,底座中心由薄膜构成的厚度可以达到2 μm,底座上有螺纹可以和上盖闭合,闭合后薄膜和上盖构成封闭腔体,上盖和下盖由贯穿孔从两侧穿过,冷冻时液氮从薄膜旁边穿过。由于该方法保持样品与液氮分离,安全性较高,同时由于接触膜较薄,热阻小,降温效果较好。降温速率是细胞冷冻成败的决定因素[14],由于涉及到对流等因素的影响,不同的操作方式造成降温速率差别较大,有必要研究不同插入方式对该载体降温速率的影响。
1 材料与方法
1.1 仪器和设备
DS1062CD示波器(RIGOL®,中国);直径80 μm T型热电偶(Omega,美国);液氮(复旦大学,中国);卵母细胞载体(上海安久生物科技有限公司,中国)见图1,其中上沿可以用手术钳等器具夹取,载物膜与底座相连,为几微米的薄膜,底座和上盖采用螺纹连接,底座和上盖有一个贯穿的孔,底座中空,方便冷源与薄膜接触。
1.2 实验方法
用针状物在细胞载体底部扎孔,孔径约500 μm,该孔与细胞保存腔体连通,将热电偶测温端从小孔插入,其头部保持在载体腔内,且不与腔体壁接触,热电偶参比端接示波器且暴露在空气中,远离冷源液氮,保证参比端的温度不被冷源温度干扰。使用手术钳夹紧载体,做适当固定,将载体按一定的方式插入液氮,使用示波器记录细胞载体降温过程中电势差-时间的散点图。
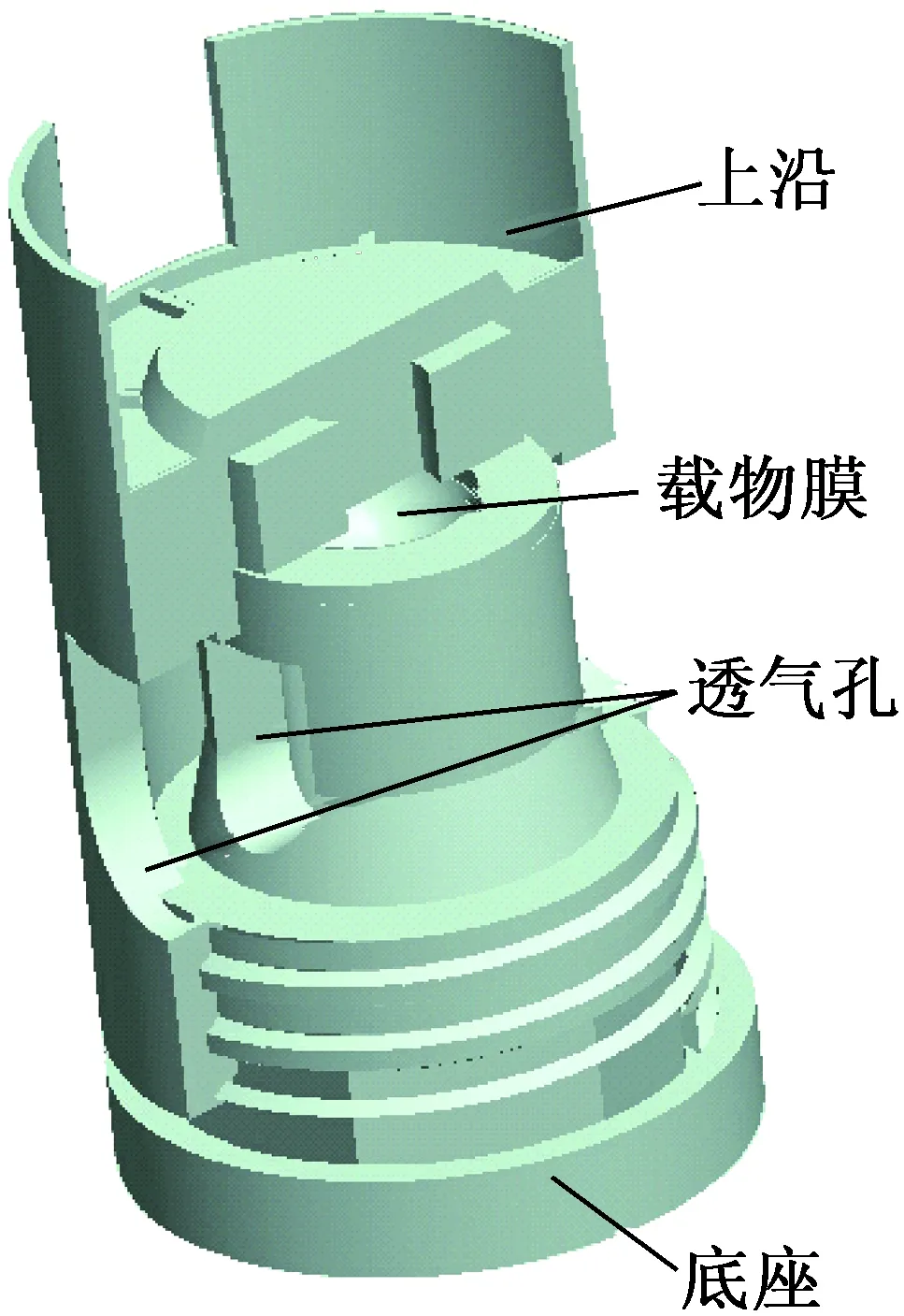
图1 冷冻载体的半剖组装图Fig.1 Assembly drawing of the freezing carrier(for details, half of the shell is removed)
1.3 插入方式
载体插入液氮的方式分为表1的6种方式,插入液氮的速度保持一致。
表1冷冻载体插入液氮的方式和气孔与液氮的相对位置
Tab.1Ways of freezing carrier inserted into liquid nitrogen and relative positions of liquid nitrogen and air hole
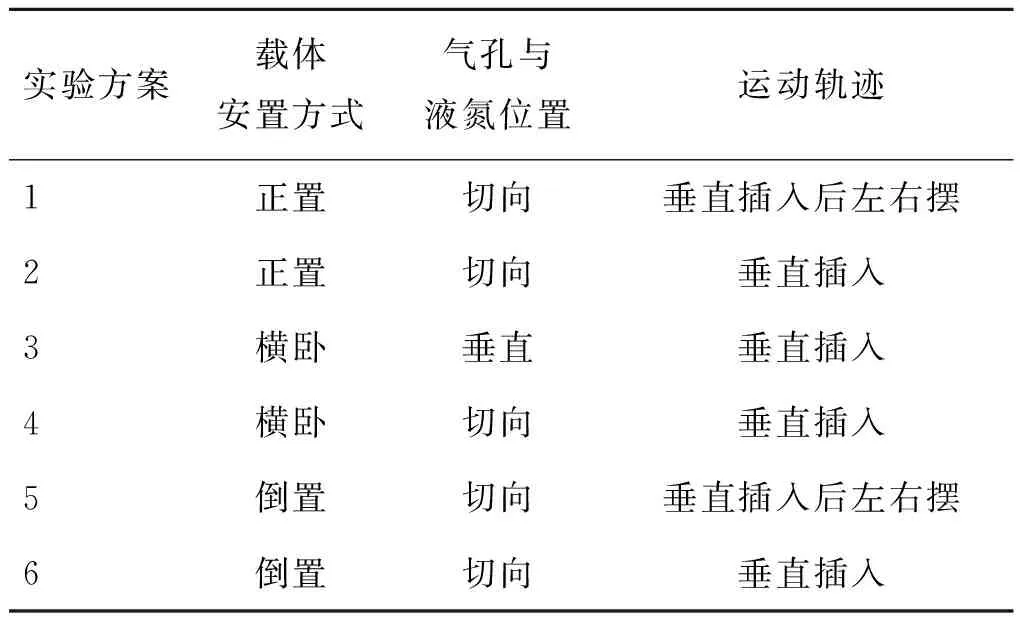
实验方案载体安置方式气孔与液氮位置运动轨迹1正置切向垂直插入后左右摆2正置切向垂直插入3横卧垂直垂直插入4横卧切向垂直插入5倒置切向垂直插入后左右摆6倒置切向垂直插入
图2具体展示了插入的方式和运动轨迹,箭头代表运动轨迹。
1.4 数据处理[15-16]
对Omega公司提供的T型热电偶的分度表拟合成函数为:
t=-0.046[E(t, 0)]4-0.109[E(t, 0)]3-0.829[E(t, 0)]2+26.22E(t, 0)+0.120
(1)
室温为26 ℃,根据中间温度定理,需要对电势差修正:
E(t, 0)=E(t, 26)+E(26, 0)=E(t, 26) +1.033
(2)
将式(2)代入式(1)可得温度与电势差的关系为:
t=-0.046[E(t, 26)+1.033]4-0.109[E(t, 26)+1.033]3-0.829[E(t, 26)+1.033]2+26.22[E(t, 26)+1.033]+0.120
(3)

图2 冷冻载体使用方式和轨迹Fig.2 Usages and movements of the freezing carrier
将电势差-时间散点图转化为温度-时间散点图,对该图分段拟合曲线求斜率,其值即为降温速率,求取斜率最大部分的值作为最大降温速率。温度-时间散点图示例见图3。

图3 温度时间曲线图Fig.3 Temperature vs time curve
2 结果与讨论
2.1 实验结果概述
当采用常规的使用方式,即载物台正置插入后左右晃动的方式进入液氮时,腔体内平均最快降温速率为31276±6858 K/min,此速度只有常见的Cryotop[17]降温速率的一半,因此可能难以实现玻璃化保存。当采用载体正置,直接插入的方式进入液氮时,降温速率可以达到50476±13073 K/min,比直接插入后晃动的方式有所提高,但范围波动较大,可能受插入速度影响较大。当采用载体横卧、气窗正对液面插入时,降温速率显著提高,可以达到49057±14106 K/min;当采用载体横卧、气窗与液氮相切进入液氮时,降温速率与标准插入方式相近,只有31451±7605 K/min。载物台倒置插入,左右晃动平均最快降温速率为46299±11387 K/min。载物台倒置插入,平均最快降温速率为54572±1338 K/min。标准插入方式效果不佳,主要由于底座中空,插入过程会裹挟大量气体进入腔体内,根据莱顿弗罗斯特效应[18],液氮并不能浸润表面,从而延缓了降温。尽管底座旁边开有贯穿孔,由于气体流出的速度远小于降温速率,阻力较大,液氮由于加热气化会源源不断产生气体并形成气团,气团一直集中载物膜上,影响了传热,实验结果见表2。
表2不同插入方式的降温速率
Tab.2The cooling rates of different inserting ways

测量次序最快段降温速率/(K/s)最快段降温速率/(K/min)1521±11431276±68582841±21750476±13073*3817±23549057±14106*4524±12631451±76055771±18946299±11387*6909±22354572±1338*
注:*表示p<0.01,差异极显著。
2.2 运动方式对降温速率的影响
结果发现,当载体的摆放方式一致时,插入方式对降温速率的影响较显著。当采用载体正置和倒置的方式插入液氮时,直接插入的降温速率比插入后摆动的降温速率显著提高。这是由于当采用一个简单的插入动作时,插入速度可以很高;当采用复杂动作时,插入过程中由于要减速后改变运动方向,液氮流体在腔体内经历了方向转化,抑制了液体的流出速度,对流换热速度较低,同时插入后再左右摆动容易造成初始插入速度不足,导致空腔内部液氮和载体之间的对流不充分,极大影响了降温速率。此外,载体在液氮内滑动过程中会产生大量氮气,气体会在载体表面形成一层气膜阻碍液氮和载物膜接触,减缓了降温速率。
2.3 气孔与液氮相对位置对降温速率的影响
方案(c)和方案(d)均采用了横卧式插入液氮,不同点在于气孔开口是否与液氮相切。当开口方向与液氮相切时,其降温速率明显低于开口与液氮垂直时的降温速率,这是由于相切时液氮从开口表面划过,不能直接从开口进入到空腔内,热量主要从载体的外壁传导到载体外,外壁较厚,热阻较大。当采用垂直插入时,液氮流体直接进入小孔,与内部薄膜接触,薄膜非常薄,热阻小,液氮和冷冻样品换热好。
2.4 载体放置方式对实验结果的影响
对于插入后左右摆动的运动方式来说,载体是否倒置对实验结果影响不显著(p=0.61),可能摆动是造成降温速率降低的重要原因,插入后再左右晃动容易造成初始插入速度不足,液氮和载体之间的强制对流不充分,极大影响了降温速率。对于简单的直插运动来说,载体的竖立显著高于横卧的降温速率,其中倒置的降温速率最高,达到54572±1338 K/min,可以实现细胞的玻璃化保存[19]。这可能由于倒置时载体的凹槽朝上,不易发生氮气的裹挟,产生的气体可以方便的与载体脱离,增加了紊流效果,提高了对流换热系数,降温速率较快。
3 结论
细胞低温载体的传热方式主要以对流换热为主,因此强制对流的优劣决定了降温速率的快慢,实验是对降温速率的筛选,实际是比较不同操作方法的对流换热效果。实验采用数字示波器、线径80 μm的T型热电偶建立高速测温系统,测量低温载体从空气中插入液氮的瞬时降温速度可知:载体横卧时,气孔与液氮相切时的降温速率低于与液氮垂直时的降温速率;直接插入时的速度大于插入后左右摆动时的速度;载体倒置时降温速率高于载体正置和横卧时降温速率。当采用载体倒置直接插入时,降温速率最高,最快降温速率可以达到54572±1338 K/min,而常规的使用方式即载体正置,插入后摆动的降温速率仅有31276±6858 K/min,但载体对细胞的保存效果还有待于进一步研究。
[1]Franks F. Biophysics and biochemistry at low temperatures[M]. Cambridge Press, 1985.
[2]Shaw J M, Oranratnachai A, Trounson A O. Fundamental cryobiology of mammalian oocytes and ovarian tissue [J]. Theriogenology, 2000, 53(1): 59-72.
[3]Cobo A, Meseguer M, Remohi J, et al. Use of cryobanked oocytes in an ovum donation program: a prospective, randomized, controlled clinical trial editorial comment[J]. Obstetrical & Gynecological Survey, 2010, 65(12): 775-777.
[4]Jondet M, Dominique S, Scholler R. Effects of freezing and thawing on mammalian oocyte[J]. Cryobiology, 1984, 21(2): 192-199.
[5]Landa V, Tepla O. Cryopreservation of mouse 8-cell embryos in microdrops[J]. Folia Biologica, 1990, 36(3/4): 153-158.
[6]Riesco M F, Martinez-Pastor F, Chereguini O, et al. Evaluation of zebrafish (danio rerio) pgcs viability and DNA damage using different cryopreservation protocols[J]. Theriogenology, 2012, 77(1): 122-130.
[7]Vajta G, Kuwayama M, Booth P J, et al. Open pulled straw (ops) vitrification of cattle oocytes[J]. Theriogenology, 1998, 49(1): 176.
[8]Liang Y Y, Srirattana K, Phermthai T, et al. Effects of vitrification cryoprotectant treatment and cooling method on the viability and development of buffalo oocytes after intracytoplasmic sperm injection[J]. Cryobiology, 2012, 65(2): 151-156.
[9]Martino A, Songsasen N, Leibo S P. Development into blastocysts of bovine oocytes cryopreserved by ultra-rapid cooling[J]. Biology of Reproduction, 1996, 54(5): 1059-1069.
[10] Matsumoto H, Jiang J Y, Tanaka T, et al. Vitrification of large quantities of immature bovine oocytes using nylon mesh[J]. Cryobiology, 2001, 42(2): 139-144.
[11] Lane M, Schoolcraft W B, Gardner D K. Vitrification of mouse and human blastocysts using a novel cryoloop container-less technique[J]. Fertility & Sterility, 1999, 72(6): 1073-1078.
[12] He X M, Park E Y H, Fowler A, et al. Vitrification by ultra-fast cooling at a low concentration of cryoprotectants in a quartz micro-capillary: a study using murine embryonic stem cells[J]. Cryobiology, 2008, 56(3): 223-232.
[13] Kuwayama M, Vajta G, Kato O, et al. Highly efficient vitrification method for cryopreservation of human oocytes[J]. Reproductive Biomedicine Online, 2005, 11(3): 300-308.
[14] 华泽钊, 任禾盛. 低温生物医学技术[M]. 北京: 科学出版社, 1994.
[15] Li W, Zhou X, Wang H, et al. Numerical analysis to determine the performance of different oocyte vitrification devices for cryopreservation[J]. Cryoletters, 2012, 33(2): 143-149.
[16] 李维杰, 周新丽, 戴建军, 等. 冷冻载体Cryotop降温速率的测量及系统优化[J]. 制冷学报, 2013, 34(5): 95-98.(LI Weijie, ZHOU Xinli, DAI Jianjun, et al. Cooling rate measurement and system optimization for cryotop device[J]. Journal of Refrigeration, 2013, 34(5): 95-98.)
[17] Sansinena M, Santos M V, Zaritzky N, et al. Numerical simulation of cooling rates in vitrification systems used for oocyte cryopreservation[J]. Cryobiology, 2011, 63(1): 32-37.
[18] Lee C H, Kim D Y, Kim H D, et al. Dynamic behavior and micro-explosion characteristics of impinging droplets on a high-temperature surface[J]. Journal of Visualization, 2015, 18(1): 59-70.
[19] Lee H J, Elmoazzen H, Wright D, et al. Ultra-rapid vitrification of mouse oocytes in low cryoprotectant concentrations[J]. Reproductive Biomedicine Online, 2010, 20(2): 201-208.
About the corresponding author
Wang Lihong, female, Ph. D., associate chief physician, Shanghai Jiao Tong University Affiliated Sixth People′s Hospital, +86 21-63468920, E-mail:lihongwang1976@126.com. Research fields: cryopreservation of oocytes.
Experimental Study on the Cooling Rate of a New Type of Oocyte Carriers
Li Weijie1Wang Lihong2Liu Baolin1Zhou Xinli1Lou Wei3Wu Guorong1
(1. Institue of Biothermal Science and Technology, University of Shanghai for Science and Technology, Shanghai, 200093, China; 2. Shanghai Jiao Tong University Affiliated Sixth People′s Hospital, Shanghai, 200233, China; 3. Shanghai Anjiu Biotechnology Co., Ltd., Shanghai, 201108, China)
Cooling rate is the key factor that determines the cryopreserving effect of cells, which has much to do with the forms and the usages of freezing carrier. In this study, digital oscilloscopes and type T thermocouple of 80 μm diameter were employed to establish a high speed temperature measurement system. The cooling rates of cells were measured by using a new type of enclosed oocyte freezing carrier in different ways of being inserted from air to liquid nitrogen. The results showed that the cooling of freezing carrier is mainly fulfilled via heat convection; when the carriers were horizontally placed, the cooling rate of carrier when the air hole was perpendicular to liquid nitrogen is higher than that when the air hole was tangent to liquid nitrogen; when the freezing carrier was directly inserted into liquid nitrogen, the cooling rate of carrier was higher than that when the freezing carrier was inserted into liquid nitrogen and then swayed; when the freezing carrier was placed downwards, the cooling rate of carrier was higher than that vertically or horizontally placed. Based on the results mentioned above, when the carrier was directly inserted into liquid nitrogen downwards, the cooling rate could reach as high as 54572 ± 1338 K/min, which is the highest and favorable to verification of oocytes.
freezing carrier; cooling rate; liquid nitrogen; Leidenfrost effect
0253-4339(2016) 01-0114-05
10.3969/j.issn.0253-4339.2016.01.114
国家自然科学基金(81300554)资助项目。(The project was supported by the National Natural Science Foundation of China (No. 81300554).)
2015年4月18日
TB61+1;R318.52
A
简介
王利红,女,博士,副主任医师,上海交通大学附属第六人民医院,(021)63468920,E-mail: lihongwang1976@126.com。研究方向:卵母细胞低温保存。

