头穴丛刺结合跑台训练对坐骨神经损伤大鼠轴突再生及S-100蛋白表达影响①
王艳,赵玖玫,朱路文
·基础研究·
头穴丛刺结合跑台训练对坐骨神经损伤大鼠轴突再生及S-100蛋白表达影响①
王艳1,赵玖玫2,朱路文1
目的探讨头穴丛刺结合跑台训练对坐骨神经损伤大鼠轴突再生及S-100蛋白表达的影响。方法清洁级健康雄性Sprague-Dawley大鼠90只,随机分为空白组、假手术组、模型组、跑台组和头穴丛刺结合跑台组,每组18只,每组分为7 d、14 d、21 d三个亚组。钳夹法造模,假手术组暴露坐骨神经但不钳夹。造模3 d后进行干预,跑台组进行跑台训练,头穴丛刺结合跑台组行头穴丛刺治疗结合跑台训练,空白组、假手术组及模型组除定时抓取外不做任何干预。各组相应时间点测定坐骨神经功能指数(SFI);取材后坐骨神经HE染色观察轴突生长情况,免疫组化染色检测S-100蛋白表达情况。结果各时间点跑台组及头穴丛刺结合跑台组SFI高于模型组(P<0.05),但低于假手术组和空白组;头穴丛刺结合跑台组SFI高于跑台组(P<0.05)。各时间点跑台组和头穴丛刺结合跑台组轴突生长情况均优于模型组,头穴丛刺结合跑台组优于跑台组。各时间点空白组和假手术组S-100蛋白均呈少量表达,跑台组、头穴丛刺结合跑台组S-100蛋白表达均高于模型组(P<0.05),头穴丛刺结合跑台组S-100蛋白表达高于跑台组(P<0.05)。结论头穴丛刺结合跑台训练能够促进S-100蛋白的表达,促进损伤神经轴突再生,提高坐骨神经功能。
坐骨神经损伤;头穴丛刺;跑台训练;S-100蛋白;坐骨神经功能指数
[本文著录格式]王艳,赵玖玫,朱路文.头穴丛刺结合跑台训练对坐骨神经损伤大鼠轴突再生及S-100蛋白表达影响[J].中国康复理论与实践,2016,22(8):904-910.
CITED AS:Wang Y,Zhao JM,Zhu LW.Effect of cluster needling of scalp acupuncture combined with treadmill training on axonal re-generation and expression of S-100 protein in rats with sciatic nerve injury[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(8):904-910.
神经几乎存在于人体所有的组织器官中。与中枢神经系统不同,大多数周围神经更加表浅并缺乏骨性结构的保护,因此周围神经损伤是临床常见问题,非战争时期约占全部创伤的1.5%~4%,35%的血管损伤并发周围神经损伤,7%~9%的骨折、脱位并发周围神经损伤,而且修复缓慢[1-2]。
周围神经损伤主要表现为神经支配区的疼痛,运动和/或感觉功能障碍等。周围神经损伤的修复是一个复杂的过程。虽然显微手术可以精细修复神经的连续性,但其功能的恢复不尽人意,据统计仅有50%可能会完全恢复[3]。周围神经损伤后,中枢神经、损伤部位和远端肌肉及末梢效应器均会发生改变。中枢神经系统结构和功能的完整性是靠外周信号的输入和效应器官的正常功能活动来维持的,周围神经损伤和中枢神经系统损伤一样也会引起脑功能的重塑。皮层代表区的持续竞争使那些接受重要信息的皮层区域增大,并导致其他区域减小。神经信号输入不足或完全丧失可导致邻近皮层代表区侵入去神经输入的皮层代表区,使其功能进一步丧失[4]。周围神经损伤后脑功能重塑的程度是影响神经功能恢复的重要因素之一[5]。因而康复治疗应从周围神经系统和中枢神经系统综合考虑。
针灸在周围神经损伤后的治疗作用早有研究证实,但多数是在受损部位局部取穴[6]。头部针刺对周围神经损伤治疗作用及机制尚有待研究。跑台训练作为运动训练的一种方式,由于其精确、可控等优点,现已在实验中广泛应用。崔松彪等对坐骨神经卡压的大鼠进行跑台训练,证明运动训练能够促进神经运动功能的恢复[7]。坐骨神经横断后即刻进行适度的跑台运动,可促进轴突再生,恢复肌肉反射能力,提高大鼠适应不同生物力学要求的步行能力[8]。
神经损伤修复的微环境中,功能最显著、最被人熟知的周围神经胶质细胞就是施万细胞,它包绕周围神经轴突[9],功能活跃。研究周围神经损伤后施万细胞增殖已成为促进神经损伤修复的热点[10]。在周围神经系统中,S-100蛋白只分布于施万细胞内。在周围神经系统中检查到S-100蛋白时,则表明该处施万细胞增殖活跃[11-12]。
本研究观察头穴丛刺结合跑台训练对坐骨神经损伤大鼠S-100蛋白表达及轴突再生[13]的影响,为周围神经损伤的治疗提供理论依据。
1 材料与方法
1.1实验设备
组织包埋机:德国THERMO HISTOSTAR。HM 340E石蜡切片机:德国THERMO。BX60研究型显微镜、DP72显微摄像系统:日本OLYMPUS。数码医学图像分析系统Med 6.0:中国MOTIC。
1.2实验动物与分组
清洁级健康雄性Sprague-Dawley大鼠90只,体质量(200±20)g,由黑龙江中医药大学实验动物中心提供。采用随机数字表法随机分为空白组、假手术组、模型组、跑台组、头穴丛刺结合跑台组,每组18只。每组按时间点分为3个亚组,每个时间点6只。三个时间点分别是造模后7 d、14 d、21 d。
1.3模型制备
用10%水合氯醛3.5 ml/kg腹腔注射麻醉,以角膜反射消失为标准。于大鼠右侧股后正中行长1 cm纵形切口,逐层分离深筋膜及肌肉,游离出坐骨神经,在距坐骨结节6 mm处,用长约12 cm止血钳,前端套无菌滴管进行钳夹,钳夹处神经长约3 mm,扣满3扣,钳夹10 s,放松10 s,连续3次,然后逐层缝合。假手术组游离神经后不钳夹神经。空白组不手术。
1.4造模成功判定标准
经行为学观察,造模后大鼠行走时身体向健侧倾斜,患侧腿部肌肉收缩无力,前行时靠患侧臀部肌肉的收缩代偿,足拖地且足背下垂,患侧足趾并拢,伸趾不能,整体行走时呈现出扭臀且跳跃步态,镜下可见轴突、髓鞘、内膜管及内在纤维断裂,但束膜尚完整,符合SunderlandⅢ度损伤,即为造模成功。
1.5干预方法
空白组、假手术组、模型组均正常饲养,除每天定时抓取外不做其他任何干预。跑台组于造模后3 d行跑台训练,头穴丛刺结合跑台组于造模后3 d行头部针刺治疗的同时进行跑台训练。
1.5.1跑台训练
造模前,跑台组和头穴丛刺结合跑台组大鼠均进行适应性跑台训练3 d。将大鼠放置于跑台上,启动跑台,缓慢调节至大鼠所能适应的速度,保证大鼠运动速度与跑台速度一致。造模成功3 d后,开始正式训练,坡度为0°。速度:训练第1~3天8 m/min,第4~7天12 m/min,7 d后15 m/min。每次30 min,每天1次。
1.5.2头穴丛刺
采用直径0.25 mm,长25 mm针灸针(安迪),经碘伏消毒后,取百会及其两侧旁开2 mm处平刺,深15 mm。快速捻转l min后留针2 h,每天1次。
1.6坐骨神经功能指数(sciatic functional index,SFI)[14]
自制大鼠足印行走箱,内径8.5 cm,长50 cm,一侧开门,将等宽、等长70 g白纸放在箱底。大鼠双足蘸碳素墨水后由一端放入箱内,走向箱的另一端,并从侧门走出。每侧足留下3或4个足印,选实验侧足(E)、正常侧足(N)足印测量3个变量。
①足印长度(podogram length,PL):足印的最长距离,即从足跟到足尖。②足趾宽度(toe spread,TS):第1趾到第5趾连线长。③中间足趾距离(inter-toes distance,IT):第2趾到第4趾连线长。将上述3个变量代入Bain公式计算出SFI。

SFI以0为正常值,-100为神经完全断离。
1.7标本采集
各时间点,用10%水合氯醛0.35 ml/100g腹腔注射麻醉大鼠后,经由造模时切口,逐层分离,暴露神经,手术线标记受损神经远端,剪取钳夹处的神经组织约1 cm,即刻固定于10%甲醛溶液中。
1.8标本制备
将组织切成厚0.3 mm的组织块,放入包埋盒内再固定。梯度酒精脱水,二甲苯透明,石蜡包埋。石蜡切片,厚4 μm,60℃烤片机内烤片12 h,4℃冰箱备用。
1.9HE染色
切片脱蜡至水,入苏木素染液5 min,70%盐酸酒精分化10 s,自来水充分冲洗,使细胞核蓝化,蒸馏水洗,入伊红染液1 min,梯度酒精脱水,二甲苯透明,树脂封片。每组取6张切片,每张切片随机取5个视野。采用BX60多功能显微镜进行观察。
1.10免疫组化染色
切片脱蜡、水化。采用抗原修复液(pH 6.0)对组织切片进行预处置。3%H2O2去离子水孵育15 min,以阻断内源性过氧化物酶,PBS冲洗。滴加一抗(S-100蛋白,1∶200,北京中杉金桥生物制剂有限公司),4℃孵育过夜。PBS浸洗,滴加IgG抗体-Fab 段-HRP多聚体,室温37℃孵育30 min,PBS洗3 min×5次。DAB显色,蒸馏水冲洗,苏木素复染,梯度酒精脱水,二甲苯透明、树脂封片。每组观察6张切片,每张切片随机取5个视野。采用BX60多功能显微镜进行观察。采用Mad 6.0数字病理图像分析系统(麦克奥迪公司)对图像进行分析,得出IOD值。
1.11统计学分析
2 结果
2.1一般情况
造模大鼠均于造模结束1.5 h后苏醒,其中模型组、跑台组和头穴丛刺结合跑台组大鼠造模后较空白组和假手术组大鼠活动减少,患侧后肢拖行,患侧足背伸无力,足下垂现象明显。治疗后,随着治疗时间延长,跑台组和头穴丛刺结合跑台组活动量逐渐增大,拖行、足背伸无力、足下垂现象均改善,模型组自然恢复也略有改善,但改善程度远不及另两组。
假手术组大鼠未出现自噬现象,模型组自噬现象最重,可见趾骨暴露,患侧足部肿大、溃烂,跑台组、头穴丛刺结合跑台组偶有自噬且程度均较轻,偶见患足略红肿,未出现溃烂现象。与其他组比较,模型组大鼠毛发光滑度差且精神萎靡。跑台组、头穴丛刺结合跑台组大鼠较模型组大鼠精神活跃,毛发光泽。
2.2SFI
空白组和假手术组各时间点大鼠SFI为0。随着时间推移,各组造模大鼠SFI增加。造模后各时间点,头穴丛刺结合跑台组和跑台组SFI均高于模型组(P<0.05),头穴丛刺结合跑台组SFI均高于跑台组(P<0.05)。见表1。
2.3HE染色
各时间点空白组和假手术组呈现出正常神经的解剖结构,即坐骨神经由大小不等的神经束组成,外面由外膜、束膜两层包绕,神经组织结构完整,轴突直径一致,均匀分布,紧密有序、排列规则。
各时间点模型组神经组织排列松散,纤维杂乱无序、纤维发生溃变,细胞肿胀,间质水肿,呈现明显空泡样改变,胞核皱缩或溶解碎裂明显。可见炎性细胞小灶性浸润。再生髓鞘少且薄,再生神经纤维稀少、分散。
各时间点跑台组和头穴丛刺结合跑台组与模型组比较,细胞肿胀较轻,空泡和核的改变较少,散在炎性细胞浸润,髓鞘较完整、规则,出现的新生纤维较多,神经干和外膜也有新生血管,束间结缔组织较少。且头穴丛刺结合跑台组轴突生长情况优于跑台组。见图1。
其中7 d时即损伤初期,模型组、跑台组、头穴丛刺结合跑台组组间差异最小,各组损伤最重,治疗后,各组开始恢复,随着治疗时间延长,三组间差异逐渐变大,21 d时组间差异最大。
2.4免疫组织化学染色
各时间点空白组和假手术组S-100蛋白均少量表达。术后7 d可见模型组、跑台组、头穴丛刺结合跑台组S-100蛋白表达升高(P<0.05),且7 d时各组S-100蛋白表达最高,出现峰值,术后14 d、21 d呈下降趋势。与模型组比较,7 d、14 d、21 d各干预组S-100蛋白均有不同程度升高(P<0.05),且头穴丛刺结合跑台组表达高于跑台组(P<0.05)。见图2、表2。

表1 各组大鼠各时间点SFI
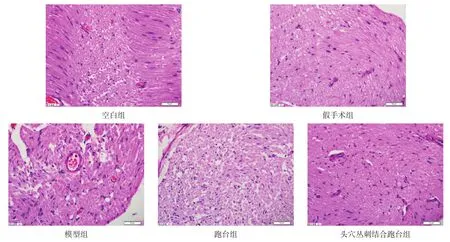
图1 各组坐骨神经21 d形态(HE染色,bar=50 μm)
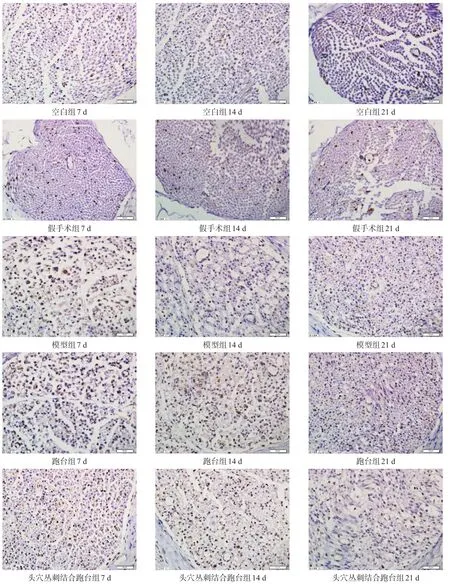
图2 各时间点各组坐骨神经S-100蛋白表达(免疫组化染色,bar=50 μm)

表2 各组大鼠各时间点坐骨神经S-100蛋白表达(IOD)
3 讨论
以往研究发现中枢神经具有可塑性[15]。有学者指出周围神经也具有可塑性,人体和动物研究,已发现在周围神经系统损伤后大脑皮质代表区可以很快出现重构的现象,周围神经损伤后几秒的时间里,就可观察到相应的大脑皮质代表区发生了变化[16]。
周围神经损伤后,治疗也应从中枢和周围两方面入手。我们一方面针刺头部运动代表区加强对中枢的刺激,一方面进行跑台训练,对坐骨神经损伤大鼠进行双向干预。结果显示头穴丛刺结合跑台训练效果优于单纯跑台训练,也就是中枢、外周双向干预效果优于单纯的外周干预。
施万细胞是周围神经系统特有的胶质细胞,不但在周围神经的发生、发育、形态和功能维持方面起重要作用,也在周围神经损伤后轴突再生与髓鞘形成过程中起着重要作用[17]。一方面吞噬轴突和髓鞘溃变而形成的髓球和脂滴,另一方面增殖的施万细胞沿着基膜管整齐排列形成细胞索带,对再生轴突起引导作用,诱导轴突生长锥沿一定方向生长直至终末器官。而且施万细胞能分泌多种活性物质,从而诱导、刺激和调控轴突的再生和髓鞘的形成;还能产生细胞外基质和细胞黏附分子,与相邻轴突形成缝隙连接和紧密连接,这些功能都与神经再生密切相关[18]。促进施万细胞增殖,可能促进周围神经修复与再生[19]。
S-100蛋白是一种分子量为21~24 kDa的高溶解性酶。免疫组化和免疫细胞化学的研究发现,在周围神经系统中,S-100蛋白只存在于施万细胞中,当施万细胞增殖活跃时,S-100蛋白的表达水平随之升高。检测S-100蛋白的含量,可间接反映神经损伤后施万细胞的增殖情况,是一种较好的反映周围神经修复与再生的形态学指标[20]。本实验结果显示,头穴丛刺结合跑台训练可以提高S-100蛋白的表达水平并促进轴突再生,说明头穴丛刺结合跑台训练可能通过促进施万细胞的增殖来进一步诱导轴突再生,从而促进了神经损伤的修复。
头穴丛刺针法是由于致顺教授首先提出。多年研究证明,对头部穴位针刺可产生针场,将生物电传到大脑皮层以改变大脑皮层神经细胞的兴奋性[21-22]。根据周围神经损伤后引起皮质代表区改变的特点,本实验针刺区域覆盖与大鼠运动功能最密切的顶区、顶前区[23],并在针刺同时进行跑台训练,结果显示,通过干预,头穴丛刺结合跑台组大鼠轴突生长情况较模型组和跑台组改善,S-100蛋白的表达高于模型组和跑台组,SFI也高于模型组和跑台组。说明头穴丛刺结合跑台训练可以促进轴突再生和S-100蛋白高表达,从而促进大鼠坐骨神经损伤的修复。本课题组前期的研究中也证实头穴丛刺、神经松动术以及头穴丛刺结合神经松动术均能改善周围神经损伤术后患者的运动和感觉功能,并且头穴丛刺结合神经松动术优于单纯的头穴丛刺与神经松动术[24]。
跑台训练对周围神经的作用早有证实。朱齐宁等制备坐骨神经切断模型,每天进行零坡度跑台运动训练,每周递增速度,结果表明跑台训练组可促进神经轴突再生,提高运动神经元存活率[25]。本实验用跑台训练治疗坐骨神经损伤的大鼠,HE染色结果显示各时间点跑台训练可减轻损伤神经的炎性反应,有效促进神经轴突的再生;跑台组SFI高于模型组,跑台组S-100蛋白的表达均高于模型组,可见跑台训练可促进坐骨神经功能的恢复、轴突再生及S-100蛋白的表达。池松鹤对神经损伤大鼠进行不同负荷的跑台训练,研究发现其可增加大鼠在倾斜台上维持姿势的最大角度,提高SFI,缩短潜伏期,增大波幅,也证实对坐骨神经受损伤大白鼠进行运动训练时能促进其运动功能的恢复[26]。
在本研究中,模型组、跑台组、头穴丛刺结合跑台组S-100蛋白表达均呈先升高后降低的趋势。7 d、14 d头穴丛刺结合跑台组表达高于跑台组,跑台组高于模型组。表明两种干预方法都可以促进施万细胞增殖,但头穴丛刺结合跑台组的效果更好。损伤后21 d,各组S-100蛋白表达水平下降,逐渐趋于正常水平,HE染色结果也显示神经纤维有序排列,这时头穴丛刺结合跑台组及跑台组S-100蛋白表达高于模型组,而头穴丛刺结合跑台组又优于跑台组。各时间点头穴丛刺结合跑台组及跑台组SFI值高于模型组,而头穴丛刺结合跑台组又高于跑台组。这些总体说明两个处理组延缓了S-100蛋白的下降,但头穴丛刺结合跑台组的作用更明显。有研究显示,损伤后神经组织内S-100合成增加、积聚明显,至损伤后5、7 d达高峰,之后S-100轴浆转运加速,积聚的S-100开始减少,至21 d趋正常[27],与本实验的研究一致。
综上所述,头穴丛刺结合跑台训练可以上调S-100蛋白表达水平并促进轴突再生,对促进大鼠坐骨神经损伤修复有重要意义。
[1]Geuna S,Raimondo S,Ronchi G,et al.Chapter 3 Histology of the peripheral nerve and changes occurring during nerve regeneration[J].Int Rev Neurobiol,2009,87:27-46.
[2]Yookyung J,Ng JH,Keating CP,et al.Comprehensive evaluation of peripheral nerve regeneration in the acute healing phase using tissue clearing and optical microscopy in a rodent model[J].PLoS One,2014,9(4):e94054.
[3]Lee SK,Wolfe SW.Peripheral nerve injury and repair[J].J Am Acad Orthop Surg,2000,8(4):243-252.
[4]王艳,唐强,陈国平.神经松动术结合头穴丛刺与康复训练对臂丛神经损伤后上肢功能的影响[J].中国康复医学杂志,2011,26(6):575-576.
[5]Bialosky JE,Bishop MD,Price DD,et al.A randomized sham-controlled trial of a neurodynamic technique in the treatment of carpal tunnel syndrome[J].J Orthop Sports Phys Ther,2009,39(10):710-720.
[6]薛映城,吴剑涛.针刺治疗小儿臂丛神经损伤20例临床观察[J].实用中医内科杂志,2016,30(4):108-109.
[7]崔松彪,赵和荣,朴虎男,等.运动训练对周围神经损伤大白鼠神经功能恢复的影响[J].中国临床康复,2004,8(34):7705-7707.
[8]Boeltz T,Ireland M,Mathis K,et al.Effects of treadmill training on functional recovery following peripheral nerve injury in rats[J].J Neurophysiol,2013,109(11):2645-2657.
[9]Jessen KR,Mirsky R.Embryonic Schwann cell development:the biology of Schwann cell precursors and early Schwann cells[J].JAnat,1997,191(Pt 4):501-505.
[10]Shi H,Gong Y,Qiang L,et al.Derivation of Schwann cell pre
cursors from neural crest cells resident in bone marrow for cell therapy to improve peripheral nerve regeneration[J].Biomaterials,2016,89:25-37.
[11]田德虎,张英泽,米立新,等.分米波在周围神经损伤后S-100蛋白表达变化中作用的实验研究[J].中国康复医学杂志,2004,19(4):269-271.
[12]Villarreal A,Reyes RXA,Angelo MF,et al.S100B alters neuronal survival and dendrite extension via RAGE-mediated NF-κB signaling[J].J Neurochem,2011,117(2):321-332.
[13]Gaudet AD,Popovich PG,Ramer MS.Wallerian degeneration:gaining perspective on inflammatory events after peripheral nerve injury[J].J Neuroinflammation,2011,8:110.
[14]沈宁将,朱家恺.评价坐骨神经功能的实验研究[J].中国矫形外科杂志,1995,2(7):191-193.
[15]Hirotoshi A,Fumiyo S,Ayako S,et al.Downregulation of immediate-early genes linking to suppression of neuronal plasticity in rats after 28-day exposure to glycidol[J].Toxicol Appl Pharmacol,2014,279(2):150-162.
[16]Mogilner A,Grossman JA,Ribrary U,et al.Somatosensory cortical plasticity in adult humans revealed by magnetoencephalograph[J].Proc NatlAcad Sci USA,1993,90(8):3593-3597.
[17]Kumar R,Sinha S,Hagner A,et al.Adult skin-derived precursor Schwann cells exhibit Superior myelination and regeneration supportive properties compared to chronically denervated nerve-derived Schwann cells[J].Exp Neurol,2016,278:127-142.
[18]Stratton JA,Shah P.Macrophage polarization in nerve injury:do Schwann cells play a role?[J].Neural Regen Res,2016,11 (1):53-57.
[19]李军,刘浩宇,刘飙,等.周围神经损伤后Schwann细胞与轴突再生关系的超微形态学研究[J].中国实验诊断学,2008,12 (1):35-37.
[20]Popović M,Bresjanac M,Sketelj J.Role of axon-deprived Schwann cells in perineurial regeneration in the rat sciatic nerve[J].NeuropatholAppl Neurobiol,2000,26(3):221-231.
[21]姚舜,姚凤祯.电针额区腧穴治疗中风后焦虑的临床观察[J].针灸临床杂志,2010,26(4):35-37.
[22]孙远征,武文鹏.头穴丛刺治疗缺血性脑卒中后认知功能障碍36例[J].针灸临床杂志,2011,27(9):11-13.
[23]孙忠人,朱路文,于致顺.于氏头穴丛刺针法特色介绍及临床疗效分析[C].北京:中国针灸学会年会,2011:567-570.
[24]裴飞.头穴丛刺结合神经松动术治疗下肢周围神经损伤术后的临床观察[D].哈尔滨:黑龙江中医药大学,2013.
[25]朱齐宁,崔静.鼠肢芽提取液及运动对坐骨神经损伤修复的比较[J].中国组织工程研究与临床康复,2007,11(32):6436-6439.
[26]池松鹤.运动训练对坐骨神经损伤大白鼠神经功能恢复的影响[D].延边:延边大学,2002.
[27]李勇,黄瀛,范明,等.大鼠坐骨神经钳伤后变性和再生过程中S-100蛋白的变化[J].解剖学杂志,1996,19(4):304.
Effect of Cluster Needling of Scalp Acupuncture Combined with Treadmill Training on Axonal Regeneration and Expression of S-100 Protein in Rats with Sciatic Nerve Injury
WANG Yan1,ZHAO Jiu-mei2,ZHU Lu-wen1
1.The Second Affiliated Hospital of Heilongjiang University of Chinese Medicine,Harbin,Heilongjiang 150001,China;2.Heilongjiang University of Chinese Medicine,Harbin,Heilongjiang 150040,China
Correspondence to WANG Yan.E-mail:swallow-1113@163.com
Objective To explore the effect of cluster needling of scalp acupuncture combined with treadmill training on axonal regeneration and expression of S-100 protein in rats with sciatic nerve injury.Methods Ninety male Sprague-Dawley rats were randomly divided into blank group,sham group,model group,treadmill group and cluster needling of scalp point combined with treadmill group(combination group),each group was further divided into 7,14 and 21 days subgroups,with 6 rats in each subgroup.The sciatic nerve of rats was clamped in the model group,the treadmill group and the combination group.The sham group was subjected to the same surgical procedure with sciatic nerve exposure but without crush injury.Three days after modeling,the treadmill group was treated with treadmill training,and the combination group was treated with cluster needling of scalp acupuncture and treadmill training,while the other groups were grabbed regularly,with no other intervention.The sciatic functional index(SFI)was tested,the condition of axon growth was observed with HE staining,and the expression of S-100 protein was examined with immunohistochemistry at each time point.Results At each time point,SFI was higher,the axon grew better,and the S-100 protein was higher expressed in the treadmill group and the combination group than in the model group (P<0.05),especially in the combination group(P<0.05).Conclusion Cluster needling of scalp acupuncture combined with treadmill training can accelerate the regeneration of axons and increase the expression of S-100 protein and improve sciatic function after sciatic nerve injury.
sciatic nerve injury;cluster needling of scalp acupuncture;treadmill training;S-100 protein;sciatic functional index
10.3969/j.issn.1006-9771.2016.08.006
R745.4
A
1006-9771(2016)08-0904-07
1.黑龙江中医药大学创新人才基金项目(No.051290);2.黑龙江省博士后基金项目(No.LBH-Z13202)。
1.黑龙江中医药大学附属第二医院,黑龙江哈尔滨市150001;2.黑龙江中医药大学,黑龙江哈尔滨市150040。作者简介:王艳(1967-),女,辽宁庄河县人,博士,博士后,主任医师,教授,主要研究方向:周围神经损伤康复。E-mail:swallow-1113@163.com
(2016-02-02
2016-03-28)

