完全性骶上脊髓损伤后神经源性膀胱大鼠模型的建立及尿流动力学分析①
许明,张泓,刘继生,张健,尹秀婷,张雨辰
专题脊髓损伤康复
完全性骶上脊髓损伤后神经源性膀胱大鼠模型的建立及尿流动力学分析①
许明1a,1b,张泓1a,刘继生1a,张健1a,尹秀婷1a,张雨辰2
目的建立完全性骶上脊髓损伤后神经源性膀胱大鼠模型的制作方法,并进行尿流动力学分析和评价。方法40只成年Sprague-Dawley大鼠随机分为对照组(n=10)和实验组(n=30)。实验组采用改良的脊髓横断法制作T10脊髓损伤模型,术后采用Crede手法辅助排尿并记录尿量,记录单天成模大鼠只数。模型稳定后对所有大鼠进行尿流动力学检测,HE染色观察膀胱的组织形态学差异。结果实验组大鼠死亡4只。模型大鼠尿量在术后第18天减少至相对稳定水平,术后21 d模型成功24只。实验组膀胱最大容量小于对照组(t=3.150,P=0.021),膀胱基础压力、膀胱最大压力、漏尿点压力明显大于对照组(t>3.125,P<0.01),膀胱顺应性明显小于对照组(t=5.330,P=0.002)。结论脊髓横断法完全性骶上脊髓损伤可复制痉挛性神经源性膀胱大鼠模型。
骶上脊髓损伤;神经源性膀胱;动物模型;尿流动力学;大鼠
[本文著录格式]许明,张泓,刘继生,等.完全性骶上脊髓损伤后神经源性膀胱大鼠模型的建立及尿流动力学分析[J].中国康复理论与实践,2016,22(8):869-875.
CITED AS:Xu M,Zhang H,Liu JS,et al.Establishment of rat model for neurogenic bladder after complete suprasacral spinal cord injury and urodynamic analysis[J].Zhongguo Kangfu Lilun Yu Shijian,2016,22(8):869-875.
神经源性膀胱(neurogenic bladder)是一类由于神经系统病变导致膀胱和尿道功能障碍,进而产生一系列下尿路症状的疾病总称,是脊髓损伤(spinal cord injury)后严重的并发症[1]。脊髓损伤根据损伤水平可分为骶髓上损伤和骶髓损伤,其中骶髓上损伤的脊髓损伤患者占80%以上[2]。脊髓损伤伴发的神经源性膀胱最大危害在于因下尿路排尿障碍而引发上尿路功能受损,甚至导致肾衰竭,这常常是截瘫患者晚期的主要死因[3]。因此,如何有效治疗脊髓损伤后神经源性膀胱,提高患者的生活质量,是目前医学研究亟待解决的热点与重点[4-5]。由于无法依靠临床开展系统的病理学研究,通过建立动物模型进行实验研究则显得尤为重要。
本实验在总结目前国内外大鼠脊髓损伤后神经源性膀胱模型制备以及术后护理方案文献的基础上[6-8],加以改进并探索建立一个可供比较、重复性好、可变系数低的动物模型。
1 材料与方法
1.1实验材料
1.1.1实验动物及分组
健康雌性Sprague-Dawley大鼠40只,体质量(220±20)g,合格证编号43004700019739,由湖南中医药大学动物实验中心提供。大鼠尾部编号为1~40,按照随机数字表分成对照组(n=10)和实验组(n=30)。所有动物均在通风良好的条件下分笼饲养,昼夜节律为12/12 h、室温为24~26℃、湿度为50%~70%,自由饮水与摄食。适应性饲喂至体质量(250±20)g后进行实验研究。实验过程中对动物处置符合2006年科学技术部发布的《关于善待实验动物的指导性意见》[9]。
1.1.2主要实验试剂及仪器
水合氯醛,分析纯,批号20131031:国药集团化学试剂有限公司。青霉素钠,批号15050401-2:哈药集团制药总厂。橡皮生肌膏,批号20150413:湖南中医药大学第一附属医院。5#牙探针,编码1306:上海玉荣医疗有限公司。眼用手术剪,10 cm直圆头:上海医疗器械有限公司手术器械厂。WZ-50C6微量注射泵,出厂编号150202698:浙江史密斯医学仪器有限公司。F3导尿管,批号150301J:上海上医康鸽医用器材有限责任公司。MP150-WSW型16通道生理记录仪:美国BIOPAC公司。
1.2动物麻醉
实验组大鼠禁食24 h后,10%水合氯醛350 mg/kg腹腔注射麻醉。麻醉成功标准:大鼠肌肉松弛,角膜反射、夹尾反射均消失。将麻醉成功的大鼠俯卧于自制鼠板上,固定四肢。
1.3造模
实验组大鼠采用Hassan Shaker脊髓横断法[10]并加以改良,制作大鼠脊髓横断模型。本次实验模型大鼠的损伤节段统一定在T10/11[11-13]。方法如下。造模手术前2 h腹腔注射青霉素钠2×105U以抗炎。以其最下一组浮肋连接第13胸椎作为骨性标志来定位,确定损伤部位后,备皮、消毒,沿脊柱长轴以椎体为中心做长约2~3 cm的纵向切口。依次切开皮肤、皮下筋膜,钝性分离两侧竖脊肌,使棘突和棘突旁肌肉暴露,用弯镊将肌肉与它们附着的棘突钝性分离,暴露T10、T11棘突以及与之相邻的椎弓。用显微咬骨器从尾侧向头侧咬除T10椎板直至两侧椎弓根,同时用医用纱布压迫止血,直至脊髓暴露。用5#牙探针弯钩从椎间隙中将脊髓轻轻勾出,手术刀尖沿牙科钩快速切断。为确保脊髓完全切断,可反复勾几次并用刀片尖端切断,最后用弯镊轻抬起脊椎两断端以确保脊髓完全横断,注意尽可能小地损伤脊髓被膜。观察大鼠的心跳和呼吸无异常后,依次缝合肌肉、筋膜和皮肤,并用5%络合碘消毒切口及周围。在伤口周边撒上青霉素粉剂以抗感染。
对照组大鼠常规饲养直至尿流动力学检测,不做其他处理。
1.4术后护理
术后用电热毯和电暖灯保温直到大鼠完全苏醒,用体温计监测体温。采用大笼单笼饲养,每天更换清洁、干燥的垫料,始终保持笼内干燥,适当调低饲料及水的高度,确保大鼠能自主饮食。术后1~3 d,模型大鼠每12小时(早、晚)采用Crede手法在大鼠清醒状态下进行人工辅助排尿,用注射器测量尿量;排尿后腹部轻揉推摩辅助排便。手法应缓慢、轻柔,若大鼠紧张躁动时停止,待其平静后再行排尿,切记勿用暴力,以防止膀胱因不能自行排尿而胀破。皮下注射乳酸盐林格溶液20 ml/kg以防酸碱失衡和电解质紊乱,每天2次;腹腔注射青霉素钠2×105U,每天2次。术后4~7 d,模型大鼠每6小时(1:00、7:00、13:00、19:00)采用Crede手法辅助排尿并记录尿量,腹部轻揉推摩辅助排便;腹腔注射青霉素钠2×105U,每天1次。每次排尿后用5%络合碘擦拭大鼠双下肢、下腹部、腹股沟及会阴区域,以防止二便交叉感染和压疮,有压疮形成的用橡皮生肌膏涂抹以促进伤口愈合。因手术后大鼠的下肢感觉缺失,部分大鼠会出现自噬现象,对于自噬大鼠应防治感染,保持伤口洁净干燥,涂抹橡皮生肌膏后用纱布包扎,每24小时换药1次并腹腔注射青霉素钠2×105U以抗炎,直至伤口结痂。待脊髓休克期后,大鼠生命体征稳定,结束体温控制,在室温24~26℃、相对湿度50%~70%环境下单笼饲养,自由进食饮水。
1.5成模标准及剔除标准
1.5.1成模标准
①后肢运动功能:观察实验组大鼠后肢是否参与行走,如果后肢只有在前肢行走时处于拖动状态,不能参与行走,BBB评分为0分,则认为是成功的骶上脊髓损伤大鼠模型。②膀胱排尿功能:在手术麻醉及脊髓休克期,膀胱处于潴留状态,膀胱胀大明显,不能自行排尿;而脊髓休克期过后表现为膀胱容量下降,膀胱胀大不明显,无需手法辅助排尿,且大鼠下腹部及笼内垫料潮湿,再结合尿流动力学检测证实模型大鼠膀胱逼尿肌已经产生了无抑制性收缩。
1.5.2剔除标准
模型大鼠中如出现双后肢自主运动或自主排尿、自噬或死亡的情况,则不纳入实验。
1.6评价指标
1.6.1术后并发症
记录实验组术后并发症情况及相应处理方法。
1.6.2排尿量
记录实验组大鼠造模后21 d内排尿情况。
1.6.3成模情况
记录21 d内每天大鼠模型成功只数。
1.6.4尿动力检测
手术造模后第21天对实验组和对照组行尿流动力学检测。实验组与对照组大鼠平行交替进行膀胱灌注实验,记录膀胱压力曲线图,比较膀胱压力反射活动状况。10%水合氯醛350 mg/kg腹腔注射麻醉。成功后取仰卧位,经三通管将F3导尿管与微量灌注泵及MP150-WSW型16通道生理记录仪连接。排出仪器和管内空气,借助润滑剂将F3导管经尿道轻导入大鼠膀胱,以0.1 ml/min速率灌注温度为25~35℃的生理盐水,同步记录随容积增加膀胱压力波形、大小及变化规律。灌注液首次自尿道口流出时记录灌注时间,记为膀胱最大容积,继续灌注至出现稳定波形。
1.6.5HE染色
10%水合氯醛350 mg/kg腹腔注射麻醉,用0.01 mol/L PBS从左心室快速灌注,至右心耳流出液体变清亮后,改用4%多聚甲醛灌注固定,剖取膀胱,在冰上截取膀胱逼尿肌平滑肌1×1×1 mm,冰生理盐水冲洗,置于4%多聚甲醛中固定48 h后,冲洗,脱水,透明,浸腊,石蜡包埋,冷却固定后,进行连续切片,厚度为4 μm。行HE染色,常规梯度脱水、透明,中性树胶封片。光学显微镜下观察。
1.7统计学分析
2 结果
2.1一般情况
实验组术后并发症情况见表1。大部分并发症在表中列举的对应方法处理后得到改善,症状减轻。模型大鼠的存活率为86.67%,死亡4只,主要发生在术后1~3 d,包括感染死亡2只,血块堵塞尿道致膀胱破裂1只,腹水死亡1只。自噬大鼠1只,予剔除。血尿主要出现在术后1~3 d。造模1周后,模型大鼠各项体征逐步稳定,手法排尿和腹部按摩感觉到大鼠腹部有长条状质地较硬的肌肉条索。因脊髓损伤后大鼠饮食减少,体质量普遍降低。

表1 实验组术后并发症及处理情况
2.2排尿情况
实验组尿量在第5天达到高峰,前10 d尿量较多且标准差波动较大,之后下降且标准差波动较小,逐渐趋于稳定,第18天尿量较少且整体稳定。见图1。
2.3成模情况
成模时间基本集中在造模后第16~18天,其中以第18天最多。1只大鼠直至第21天仍未达模型标准,为持续尿潴留状态,予以剔除。见图2。
2.4尿流动力学检测
手术造模后第21天,实验组24只成功模型大鼠和对照组10只大鼠进行尿流动力学检测。实验组膀胱最大容量小于对照组(P<0.05),膀胱基础压力、膀胱最大压力、漏尿点压力明显大于对照组(P<0.01),膀胱顺应性明显小于对照组(P<0.01)。见表2。
对照组大鼠的膀胱呈现稳定的周期性排尿收缩活动。实验组大鼠的膀胱先产生无效性收缩,待膀胱内压持续缓慢上升达到一定程度时膀胱相应产生重复的不完全排尿收缩。见图3、图4。
2.5HE染色
对照组移行上皮细胞整齐排列,固有膜完整,无炎性及水肿改变。逼尿肌细胞形态大小均一,肌纤维有序排列,肌束之间结构紧密,结缔组织充满间隙。模型组中逼尿肌纤维的数量和层次显著高于对照组,同时肌纤维肥大上皮的层次和数量也增多,固有层及黏膜层附近有出血,部分细胞结构被破坏,部分肌层及浆膜下层可见散在的表面颗粒状的肥大细胞。见图5。
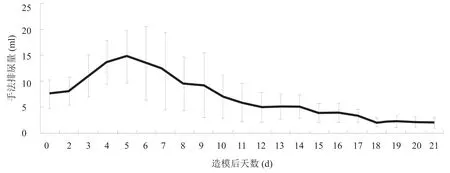
图1 实验组大鼠每天手法排尿量

图2 实验组大鼠成模情况
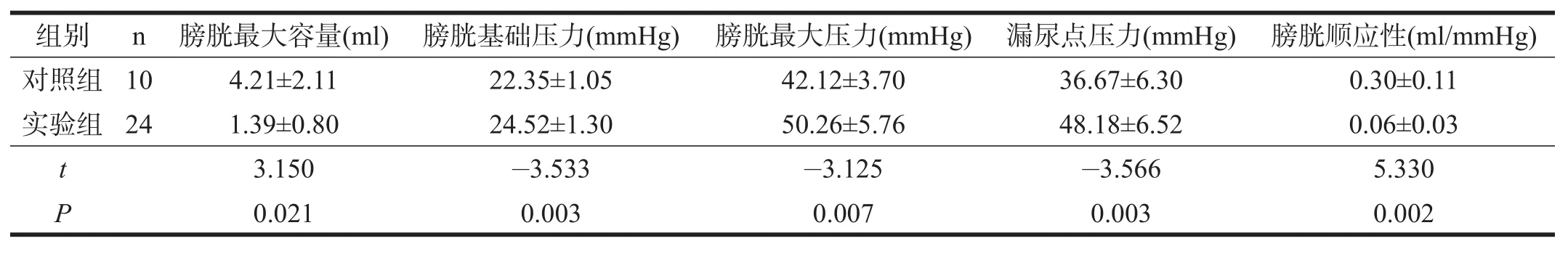
表2 两组大鼠尿流动力学指标比较

图3 对照组大鼠90 min内膀胱内压
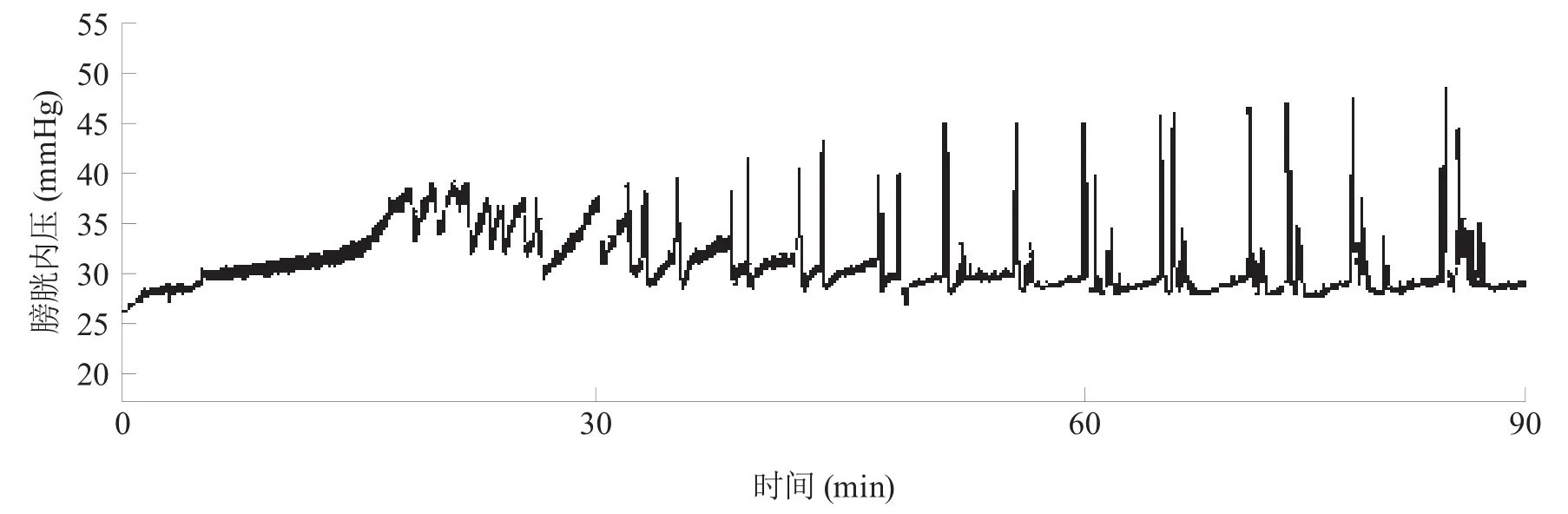
图4 实验组大鼠90 min内膀胱内压
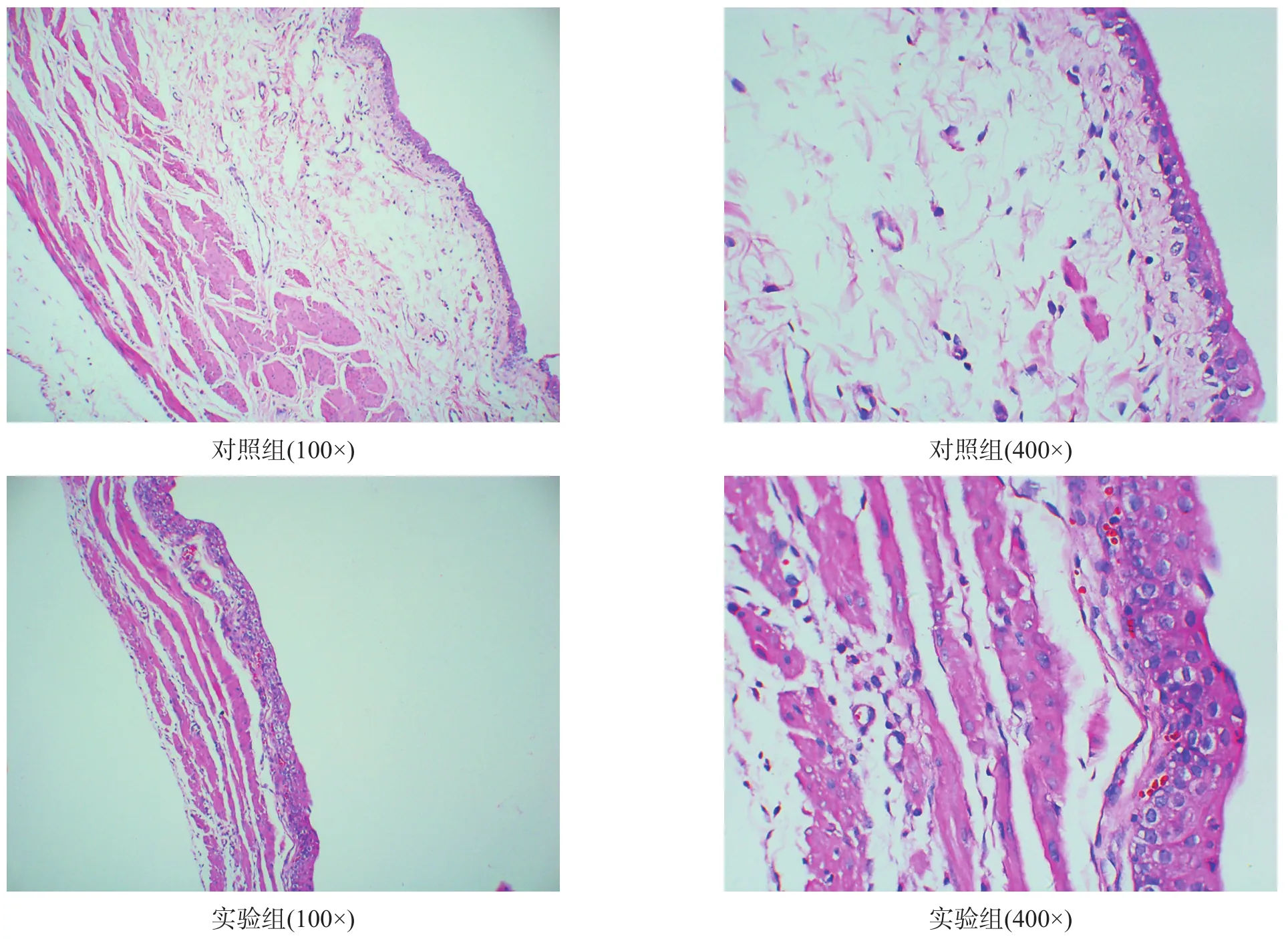
图5 各组膀胱组织形态学(HE染色)
3 讨论
近年来,关于神经源性膀胱的制备方法,文献报道有多种,包括脊髓横断法[9,14]、重物坠落法[15]、动脉夹压力法[16]、挫伤模型[17]、静脉压迫法[18]、化学药物介导[19-20]等,其对应的处理和护理方案也不相同。
本研究采用脊髓横断法,虽然与人类脊髓损伤后神经源性膀胱的形成还存在差距,但很大程度上保证了模型的一致性,利于开展治疗方法和疗效相关机制的实验研究。手术过程中,我们未填充异物阻断脊髓是考虑到与临床及大鼠生理特点相符;术后并发症的护理过程中,除保证脊髓损伤的常规护理措施外,较为关键的一点就是单笼饲养,能用大笼具单笼饲养效果最佳,适当降低食物和水的高度。
根据我们的经验,大笼单笼饲养可以大大降低模型大鼠的自噬率以及尿路感染、血尿以及腹胀/肠梗阻和后肢畸形的发生率,从而可以保证较高的成活率和成模率。考虑大笼比小笼更好的原因为以下两点。①大笼内模型大鼠活动范围广,运动增多,腹胀和后肢畸形自然减少;②模型大鼠自噬的一个可能原因是脊髓损伤后双后肢感觉功能缺失,如果笼内空间狭小造成的束缚感会引起大鼠不适,大鼠通过自噬双下肢以挣脱束缚。
模型大鼠术后1~3 d出现的血尿可能是由膀胱壁膨胀致毛细血管破裂而产生[11],之后会消失。造模1周后,腹部出现肌肉条索,考虑为腹部相关肌肉的张力增高,而后逐步出现瘫痪的双后肢肌张力增高;如不处理则双后肢挛缩、僵硬,甚至扭曲变形而影响实验研究。因此,我们认为每天适当对模型大鼠双后肢进行被动运动是必要的。对成模时间的观察中,前18 d的总体成模率为73.33%,前19 d总体成模率为76.67%;再结合图1术后尿量情况中,第18天尿量达到最小值且标准差最小,故我们认为骶上脊髓损伤后神经源性膀胱大鼠手术后的成模时间约为18 d。
人和大鼠膀胱的神经控制系统类似,但在椎管中的位置不完全相同。人交感神经位于T10~L2,副交感神经和躯体神经均位于S2~S4;而大鼠,交感神经位于L1~L2,副交感神经和躯体神经均位于L6~S1[12]。T10完全横断大鼠模型保留膀胱功能的低级神经控制,提高了大鼠存活率,且大量文献[12-13]均选此节段造模。膀胱由复杂且分布广泛的神经支配。交感神经和副交感神经传出纤维分别通过下腹神经和盆腔内脏神经传至膀胱和尿道,膀胱的机械敏感性所表现出的静态和动态的变化,以及在绝对水平上对刺激和尿液形成的反应,依赖于逼尿肌在低速膨胀过程中的适应性变化。膀胱膨胀(充盈)速度可以严重影响膀胱测压的测定结果[21]。国际尿控协会规定,人体采用慢速充盈即速度低于10 ml/min作为生理性充盈。Shea等的研究曾采用生理盐水以100 μl/min的速度模拟生理性充盈进行大鼠膀胱灌注[22],故本研究中尿流动力学的检测采用此速度进行持续灌注。
本研究中采用的是经尿道插管法进行尿流动力学检测,因导尿管部分堵塞正常尿道,导致排尿较膀胱造瘘法稍困难,其膀胱最大压力、膀胱逼尿肌漏尿点压力值稍偏大,但由于实验组和对照组均采用同样的测量方法,故对实验结果的分析无影响。
目前国内外尚缺乏统一的模型判定标准来确定大鼠脊髓损伤后痉挛性膀胱。Madersbacher通过对尿道外括约肌和膀胱逼尿肌的动力学和肌电图检查,来对动物模型进行评定,认为脊髓损伤休克期过后的高张力、高反射的功能障碍为痉挛性膀胱[23];Karoutas通过膀胱透视,测定膀胱内压和膀胱容量,认为膀胱内压增高,容量减少标志痉挛性膀胱的形成[24]。而痉挛性膀胱形成时间的确定对于介入治疗有指导意义。结合国内外研究和我们的经验[6-8,23-26],认为骶上脊髓损伤后神经源性膀胱模型大鼠成功的尿动力学指标为:膀胱先产生无效性收缩,待膀胱内压持续缓慢上升达到一定程度时膀胱相应产生重复的不完全排尿收缩;膀胱最大容量较对照组明显减少,顺应性明显降低,膀胱基础压力、膀胱最大压力、漏尿点压力较对照组明显增高。
综上所述,本研究采用改良的脊髓横断法建立完全性骶上脊髓损伤后神经源性膀胱模型,并完善相应的术前术后护理方案,提高了动物模型存活率、成模率,降低了术后并发症发生率,提供了一套可靠性高、简单经济、重复性好、可变系数低的脊髓损伤后神经源性膀胱模型。
[1]廖利民.神经源性膀胱的治疗现状[J].中国康复医学杂志,2011,26(3):201-205.
[2]胡力丰.大鼠脊髓完全性损伤后神经源性膀胱的研究[D].重庆:第三军医大学,2012.
[3]Silva AI,Sousa P,Miranda MJ,et al.Bladder stones in acute spinal cord injury[J].Acta Med Port,2010,23(1):119-124.
[4]匡静之,张泓,李景兴,等.脊髓损伤后神经源性膀胱临床治疗与机制的研究探讨[J].湖南中医药大学学报,2014,22(2):267-269.
[5]中国残疾人康复协会脊髓损伤康复专业委员会,国际脊髓学会中国脊髓损伤学会,中华医学会泌尿外科学分会尿控学组.脊髓损伤患者泌尿系管理与临床康复指南[J].中国康复理论与实践,2013,19(4):301-317.
[6]曾凡硕,周谋望,刘楠,等.犬脊髓损伤痉挛性膀胱动物模型的建立及尿动力学分析[J].中国康复医学杂志,2011,26(11):1000-1003.
[7]张雨辰,张泓,艾坤,等.大鼠脊髓损伤后神经源性膀胱模型的制备[J].中国康复医学杂志,2014,29(6):542-546.
[8]章慧平,陈忠,叶章群,等.多节段脊髓平面损伤后大鼠神经源性膀胱模型的制备[J].临床外科杂志,2007,15(3):196-197.
[9]中华人民共和国科学技术部.关于善待实验动物的指导性意见[Z].国科发财字〔2006〕398号,2006-09-30.
[10]Shaker H,Mourad MS,Elbialy MH,et al.Urinary bladder hyperreflexia:a rat animal model[J].Neurourol Urodyn,2003,22 (7):693-698.
[11]Santos-Benito FF,Muñoz-Quiles C,Ramón-Cueto A. Long-term care of paraplegic laboratory mammals[J].J Neurotrauma,2006,23(3-4):521-536.
[12]Inskip JA,Ramer LM,Ramer MS,et al.Autonomic assessment of animals with spinal cord injury:tools,techniques and translation[J].Spinal Cord,2009,47(1):2-35.
[13]Li RZ,Zhou MW,Zeng FS.Observation of neuropeptides in bladder after spinal cord injury in rats[J].Zhonghua Yi Xue Za Zhi,2012,92(15):1058-1061.
[14]Hill RL,Zhang YP,Burke DA,et al.Anatomical and functional outcomes following a precise,graded,dorsal laceration spinal cord injury in C57BL/6 mice[J].Neurotrauma,2009,26 (1):1-15.
[15]Allen A.Surgery of experimental lesion of spinal cord equivalent to crush injury of fracture dislocation of spinal column:A preliminary report[J].JAMA,1911,37(11):878-880.
[16]Joshi M,Fehlings MG.Development and characterization of a novel,graded model of clip compressive spinal cord injury in the mouse:part 2.Quantitative neuroanatomical assessment and analysis of the relationships between axonal tracts,residual tissue,and locomotor recovery[J].Neurotrauma,2002,19(2):191-203.
[17]Scheff SW,Rabchevsky AG,FAugaccia I,et al.Experimental modeling of spinal cord injury:characterization of a force-defined injury device[J].Neurotrauma,2003,20(2):179-193.
[18]Sufianova GZ,Usov LA,Sufianov AA,et al.New minimally invasive model of spinal cord ischemia in rats[J].Bull Exp BiolMed,2002,133(1):98-101.
[19]Garcia-Alias G,Verdu E,Fores J,et al.Functional and electrophysiological characterization of photochemical graded spinal cord injury in the rat[J].Neurotrauma,2003,20(5):501-510.
[20]Benton RL,Woock JP,Gozal E,et al.Intraspinal application of endothelin results in focal ischemic injury of spinal gray matter and restricts the differentiation of engrafted neural stem cells[J].Neurochem Res,2005,30(6-7):809-823.
[21]赖焕玲,梁志健,吴清和,等.不同灌注速度及方法对大鼠膀胱容量、压力及神经传入电活动测定的影响[J].中国病理生理杂志,2015,31(2):379-384.
[22]Shea VK,Cai R,Crepps B,et al.Sensory fibers of the pelvic nerve innervating the rat's urinary bladder[J].J Neurophysiol,2000,84(4):1924-1933.
[23]Madersbacher H.Intravesical electrical stimulation for the rehabilitation of the neuropathic bladder[J].Paraplegia,1990,28 (6):349-352.
[24]Karoutas G,Karacostas D,Artemis N,et al.Restoration of micturition using microelectric current in experimentally induced spastic urinary bladder in rabbits[J].Exp Neurol,1988,102(3):333-339.
[25]艾坤,张泓,张雨辰,等.电针对骶髓损伤后神经源性膀胱大鼠尿流动力学及膀胱组织中Caspase-3表达的影响[J].中国康复理论与实践,2013,19(12):1104-1107.
[26]Shi Q,Gao W,Han X,et al.Collagen scaffolds modified with collagen-binding bFGF promotes the neural regeneration in a rat hemisected spinal cord injury model[J].Sci China Life Sci,2014,57(2):232-240.
Establishment of Rat Model for Neurogenic Bladder after Complete Suprasacral Spinal Cord Injury and UrodynamicAnalysis
XU Ming1a,1b,ZHANG Hong1a,LIU Ji-sheng1a,ZHANG Jian1a,YIN Xiu-ting1a,ZHANG Yu-chen2
1.a.Department of Acupuncture,Moxibustion and Tuina;b.Hunan Provincial Key Laboratory of Diagnostics in Chinese Medicine,Hunan University of Traditional Chinese Medicine,Changsha,Hunan 410208,China;2.The Second Affiliated Hospital of Hunan University of Traditional Chinese Medicine,Changsha,Hunan 410208,China
Correspondence to ZHANG Hong.E-mail:zh5381271@sina.com
Objective To establish the rat model for neurogenic bladder after complete suprasacral spinal cord injury,and analyze the urodynamics.Methods Forty adult Sprague-Dawley rats were randomly divided into control group(n=10)and experimental group(n=30). The spinal cord injury model on T10was made with modified spinal cord transaction.The Crede's method was used to urinate assistantly after modeling.The amounts of urine and successful rat model everyday were recorded.The urodynamics was measured in both groups,and the morphology was observed with HE staining.Results Four rats died in the experimental group.The amount of urine was the least and stable on the 18th day,and 24 rats were successfully modeled on the 21st day.Compared with the control group,maximum bladder capacity decreased(t=3.150,P=0.021),bladder base pressure,maximum bladder pressure and leak point pressure increased(t>3.125,P<0.01),and bladder compliancy decreased(t=5.330,P=0.002)in the experimental group.Conclusion The complete suprasacral after spinal cord injury of neurogenic bladder in a rat model of manufacturing method is of high reliability,good repeatability,and low coefficient of variable characteristics for spastistic neurogenic bladder basic experimental studies.
suprasacral spinal cord injury;neurogenic bladder;animal model;urodynamics;rats
10.3969/j.issn.1006-9771.2016.08.001
R651.2
A
1006-9771(2016)08-0869-07
国家自然科学基金面上项目(No.81473753)。
1.湖南中医药大学,a.针灸推拿学院,b.中医诊断学湖南省重点实验室,湖南长沙市410208;2.湖南中医药大学第二附属医院,湖南长沙市410208。作者简介:许明(1990-),男,汉族,湖南益阳市人,硕士研究生,主要研究方向:常见病的中医康复机理与临床研究。通讯作者:张泓(1963-),男,教授,博士研究生导师,主要研究方向:针灸治病机理的研究。E-mail:zh5381271@sina.com。
(2016-05-03
2016-06-20)

