清肺口服液对RSV感染小鼠Treg/Th17及IL-2和IL-17水平的影响*
胡婵婵 袁 斌△ 周立华 徐建亚 李江全 王明明 孔 飞(.南京中医药大学附属医院,江苏 南京 009;.南京中医药大学,江苏 南京 009)
·研究报告·
清肺口服液对RSV感染小鼠Treg/Th17及IL-2和IL-17水平的影响*
胡婵婵1袁斌1△周立华2徐建亚2李江全2王明明2孔飞1
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学,江苏 南京 210029)
目的 观察清肺口服液对呼吸道合胞病毒(RSV)感染小鼠Treg/Th17细胞平衡的影响及对白介素-2 (IL-2)和白介素-17(IL-17)表达的影响。方法 将50只BABL/c小鼠按随机数字法分为空白组、模型组、清肺低剂量组(1.33 g/mL)、清肺高剂量组(4 g/mL)、利巴韦林组,每组10只。用RSV(Long株)滴鼻48 h后,经口灌胃分别给予相应药物及等量0.9%氯化钠注射液刺激,24 h后处死小鼠,立即取小鼠肺组织行病理分析,ELISA方法检测肺泡灌洗液(BALF)中IL-2、IL-17的含量,流式细胞术方法检测小鼠脾脏细胞中Treg、Th17细胞的表达含量。结果 与空白组相比,模型组的Treg/Th17及IL-2的水平下降(P<0.01),IL-17的水平升高(P<0.01);与模型组相比,各给药组的Treg/Th17升高(P<0.05),IL-2水平升高(P<0.01),IL-17的水平下降(P<0.01);与利巴韦林组相比,清肺组IL-2水平升高(P<0.01),清肺高剂量组Treg/Th17升高(P<0.05),IL-17的水平下降(P<0.01),清肺低剂量组Treg/Th17下降(P<0.01),IL-17的水平升高(P<0.01)。结论 清肺口服液可以调节Treg/TH17细胞的平衡,并上调RSV感染小鼠IL-2的表达水平及下调IL-17的水平,从而发挥其抗RSV的作用。
清肺口服液RSVTreg/Th17IL-2IL-17
【Abstract】Objective:To investigate the effects of Qingfei oral liquid on the expression of Interleukin(IL)-2,Interleukin(IL)-17 and the balance of Treg/Th17 in mice's lung tissue infected with respiratory syncytial virus (RSV).Methods:Fifty BABL/c mice were classified into five groups randomly:the control group,the model group,Qingfei oral liquid low dose group(1.33 g/mL)and high dose group(4 g/mL),Ribavirin group,ten mice in each group.Mice were molded with RSV(long strain)virus and given 48-hours'cultivation.24hours later,they were killed and the lung tissue was taken for pathological analysis immediately.ELISA was used to test the expression levels of IL-2 and IL-17 in BALF and flow cytometry test to the level of Treg and Th17 in the spleen. Results:Compared with the control group,the level of IL-2 and Treg/Th17 decreased and the level of IL-17 increased in the model group(P<0.01);compared with the model group,both Qingfei oral liquid groups and Ribavirin group showed a significant increase in the expression of Treg/Th17(P<0.05)and IL-2(P<0.01),a decrease in expression of IL-17(P<0.01);compared with Ribavirin group,Qingfei oral liquid groups showed a significant increase in expressions of IL-2(P<0.01).Qingfei Oral Liquid high dose group showed an increase in expression of Treg/Th17(P<0.05)and a decrease in expressions of IL-17(P<0.01).Qingfei oral liquid low dose group showed a decrease in expression of Treg/Th17(P<0.05)and an increase in the expressions of IL-17(P< 0.01).Conclusion:Qingfei oral liquid can regulate the balance of Treg/Th17,increase the expressions of IL-2 and decrease the expressions of IL-17 in the lung tissue of RSV infected mice,through which it can play a role of anti-RSV.
【Key words】Qingfei oral liquid;RSV;Treg/Th17;IL-2;IL-17
呼吸道合胞病毒(RSV)是肺炎患儿中检出率最高的病毒[1],也是引起婴幼儿患病和死亡的重要原因[2],大约有90%的儿童在2岁之内感染过RSV[3]。目前西医治疗尚缺乏特异性方案,中医药在提高免疫力、抗病毒、改善呼吸道症状等方面有独特优势。中药制剂清肺口服液是在经方麻杏甘石汤的基础上加减而成,具有开肺化痰、解毒活血之功效,临床已证实其对RSV肺炎具有良好的效果[4-5]。本实验通过建立RSV感染的小鼠模型,观察清肺口服液对RSV感染的小鼠白介素-17(IL-17)、白介素-2(IL-2)及Treg/Th17表达的影响,探讨清肺口服液治疗RSV感染的作用机制,以期为RSV感染的临床治疗提供理论依据。
1 材料与方法
1.1动物及分组取6~8周龄雌性BALB/c小鼠50只,体质量(20±2)g,购于北京维通利华实验动物技术中心,合格证:SCXK(京)2012-0001。将50只小鼠按照随机数字表法分为空白组、模型组、清肺低剂量组、清肺高剂量组、利巴韦林组,每组各10只。
1.2病毒株呼吸道合胞病毒A亚型 (Long株),由武汉国家典型培养物保藏中心提供,保存于南京中医药大学第一临床医学院实验研究中心。
1.3药物与试剂清肺口服液:炙麻黄4 g,杏仁10 g,生石膏24 g,葶苈子6 g,桑白皮10 g,紫花前胡10 g,拳参12 g,制僵蚕6 g,丹参6 g,虎杖12 g。按照2010年版的《中华人民共和国药典》中方法,制成质量浓度相当于生药1.33 g/mL和4 g/mL两种剂量的水煎剂(根据人与动物等效剂量折算公式得出)。新博林颗粒(利巴韦林颗粒),由四川百利药业有限责任公司生产,规格:50 mg/袋。国药准字:H51023508。批号:090532。配成质量浓度相当于生药0.0025/mL。胎牛血清及培养基(维森特生物技术有限公司),ELISA试剂盒(上海联硕生物科技有限公司),流式细胞术试剂盒:Mouse Treg/TH 17 Phenotyping Kit(出品:BD Pharmingen),Leukocyte Activation Cocktail,with BD Golgiplug(出品:BD Pharmingen),Stain Buffer(FBS)(出品:BD Pharmingen)。
1.4仪器低温高速离心机Centrifuge 5810R;酶标仪EXL800型 (BioTek,USA);流式细胞仪 (贝克曼CytomicsTMFC 500);CO2培养箱(MCO-20,日本SANYO公司);倒置显微镜(DMIL,德国Leica公司)等。
1.5模型制备在清洁级实验动物房适应性饲养小鼠5 d后,分别将各组小鼠置于密封透明容器内以乙醚吸入性麻醉,空白组每只小鼠给予50 μL 0.9%氯化钠注射液滴鼻刺激,其余各组给予RSV病毒按50 μL/只滴鼻。造模48 h后,分别予利巴韦林0.0025 g/mL(相当于小儿临床等效量),清肺口服液1.33 g/mL(相当于小儿临床等效量)和4 g/mL(相当于小儿临床3倍等效量)灌胃给药,空白组和模型组给予等剂量0.9%氯化钠注射液刺激。
1.6标本采集与检测给药24 h后处死小鼠。1)肺病理组织评分。剖取肺小叶,经4%多聚甲醛溶液固定,常规取材,脱水,石蜡包理,制片,HE染色,由病理专业人员在光学显微镜下200倍阅片,评分标准[6]:肺泡壁充血、水肿、炎细胞浸润各1分;肺气肿1分;肺泡腔渗出1分;肺内支气管上皮变性、腔内渗出各1分,累加所有分数,即为病理得分。2)酶联免疫吸附法(ELISA)检测小鼠肺泡灌洗液(BALF)中IL-2和IL-17的表达。摘眼球取血后处死小鼠,剥离出气管,在环状软骨处剪一小口,插入8号灌胃器针头并固定,连接1 mL注射器,先后用预冷的PBS 0.8 mL、0.6 mL、0.5 mL冲洗小鼠肺脏,灌洗液移至5 mL离心管中,整个过程于冰上进行,将离心管置于2500 r/min离心5 min,取上清液。根据ELISA试剂盒说明书,制作标准曲线,加样,温育,洗涤后用底物显色,用酶标仪在450 nm波长下测定吸光度(OD)值,计算样品浓度。3)流式细胞术检测小鼠脾脏细胞中Treg/Th17的水平。将刚摘取的小鼠脾脏加人冷的PBS研磨成为单细胞悬液,每管抽取200 μL左右;根据流式试剂盒操作流程进行染色、破膜及固定,最后上流式细胞仪检测。
1.7统计学处理应用SPSS17.0统计软件处理。正态分布数据用(±s)表示,偏态分布用中位数(四分位间距)表示。资料正态分布且方差齐时,采用单因素方差分析,组间两两比较采用最小显著差异法;资料偏态分布时,采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
表1 各组小鼠肺组织病理改变评分比较(分,±s)

表1 各组小鼠肺组织病理改变评分比较(分,±s)
与模型组比较,*P<0.05。
组别 n空白组 5模型组 5清肺高剂量组 5评分0.80±0.35*5.60±0.65 4.00±0.71*清肺低剂量组 5 4.80±0.57利巴韦林组 5 3.30±0.76*
2.1各组小鼠肺组织病理改变见表1。空白组小鼠肺组织未见异常变化;模型组小鼠肺组织出现肺泡壁中度充血、水肿,致肺泡壁增厚,肺内支气管上皮变性;利巴韦林组小鼠肺内支气管上皮细胞排列较整齐,腔内无明显炎性渗出物;清肺低剂量组小鼠肺组织出现少量中性粒细胞和单核巨噬细胞浸润;清肺高剂量小鼠肺组织未见明显细胞坏死,管腔内未见渗出物,支气管周围无明显水肿或炎细胞浸润(见图1)。与空白组比较,模型组肺组织病理评分增高 (P<0.01);与模型组比较,利巴韦林组、清肺高剂量组肺组织病理评分降低(P<0.05)。

图1 各组小鼠组织病理改图片结果(HE染色,×200)
2.2各组小鼠BALF中IL-2、IL-17表达水平的比较如表2。空白组与模型组相比,两者之间IL-2和IL-17的差异具有统计学意义(P<0.01),各给药组与模型组相比,清肺高、低剂量组,利巴韦林组作用于小鼠RSV肺炎可升高IL-2的水平(P<0.01),并降低IL-17的表达水平(P<0.01)。
表2 各组小鼠BALF中IL-2、IL-17表达水平比较(±s)
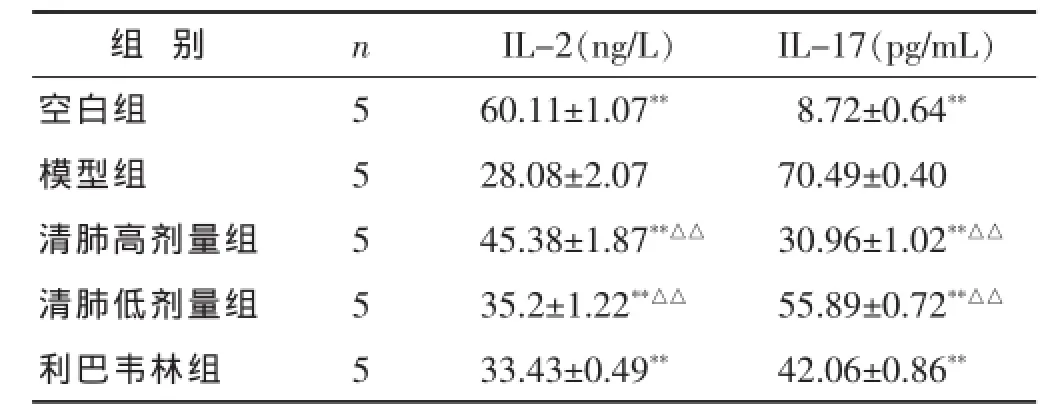
表2 各组小鼠BALF中IL-2、IL-17表达水平比较(±s)
与模型组比较,*P<0.05,**P<0.01;与利巴韦林组比较,△P<0.05,△△P<0.01。下同。
组 别 n IL-2(ng/L) IL-17(pg/mL)空白组 5 60.11±1.07** 8.72±0.64**模型组 5 28.08±2.07 70.49±0.40清肺高剂量组 5 45.38±1.87**△△ 30.96±1.02**△△清肺低剂量组 5 35.2±1.22**△△ 55.89±0.72**△△利巴韦林组 5 33.43±0.49** 42.06±0.86**
2.3各组小鼠脾脏细胞中Treg/Th17水平的比较见表3。空白组与模型组相比,Treg/Th17的差异具有统计学意义(P<0.01),各给药组与模型组相比,清肺口服液高、低剂量组作用于RSV肺炎小鼠后可上调Treg 及Treg/Th17的水平,下调Th17。
表3 各组小鼠脾脏细胞中Treg、Th17表达水平及Treg/Th17比值比较(±s)

表3 各组小鼠脾脏细胞中Treg、Th17表达水平及Treg/Th17比值比较(±s)
组 别 n Treg空白组 4 4.70±0.39**模型组 4 2.41±0.49清肺高剂量组 4 4.70±0.84**△△清肺低剂量组 4 3.43±0.30*利巴韦林组 4 4.86±0.80**Th17 Treg/Th17 1.37±0.29** 3.52(1.61)**5.26±1.15 0.42(0.20)0.87±0.05**△△5.09(2.36)**△1.76±0.18*△△1.98(0.25)*△△1.23±0.07** 4.03(1.42)**
3 讨 论
RSV感染引起的RSV肺炎是引起婴幼儿下呼吸道感染最常见的原因[7]。患病时年龄越小,RSV病毒载量越高,其病情越重,住院时间及临床症状持续的时间越长[8-9]。婴儿时期有严重RSV肺炎病史的儿童,以后发展成为哮喘等过敏性疾病的几率增加[10],并可能影响其免疫系统的发育[11]。西医尚无有效的防治方法,中医药清热解毒、活血化瘀、化痰止咳等方法,在抗病毒、缩短病程、改善症状等方面具有一定的优势[12-13]。清肺口服液具有开肺化痰,解毒活血之功效,在治疗RSV肺炎痰热闭肺证中取得了良好的效果[5],但中药复方抗RSV的机理尚未完全揭示,其与免疫学、分子细胞生物学方面的结合有待进一步研究。
RSV感染可以上调Th17细胞,下调Treg细胞[14]。Th17在炎症反应中发挥着重要的作用,其分泌的IL-17具有促炎作用[15]。而Treg在防止RSV病毒引起的免疫损伤方面具有重要的作用,其可以抑制炎症反应[16]。研究表明,Treg细胞可以通过下调抗病毒的T细胞的反应性来减轻由于病毒高复制引起的免疫损伤[17]。IL-2是调控免疫应答的重要因子,可以抑制CD4+T淋巴细胞向Th17细胞的分化,促进Treg细胞的增加[18],并与某些自身免疫疾病的产生有关[19]。IL-2连续10 d用于正常的小鼠,可以使血中的Treg增加至2倍[20],结核杆菌感染的早期应用IL-2治疗,可以同时使血液和肺间隔的Treg细胞增多,减轻肺结核患者肺部的炎症和损伤[21]。IL-2具有抑制Th17细胞和IL-17产生的作用,研究显示,敲除IL-2基因可使小鼠血清中IL-17及Th17细胞的水平升高[22]。IL-17可通过直接抑制T-bet、IFN-γ等的活性发挥促炎作用,严重的RSV感染的婴幼儿其呼吸道分泌物中IL-17的水平升高,敲除IL-17基因或给予抗IL-17治疗可使RSV感染小鼠的呼吸道黏液分泌明显减少,炎症减轻,病毒载量下降,同时IL-17还参与了RSV相关的过敏性的呼吸道疾病[23]。转化生长因子-β(TGF-β)由Treg细胞分泌,是调节组织炎症和修复的重要细胞因子,其与促炎因子结合可以影响Th17和Treg的水平。TGF-β在低浓度时与IL-6和IL-21协同促进IL-23R的表达,从而上调Th17,高浓度时则抑制IL-23R的表达,从而上调Treg。Foxp3和RORγt分别为Treg和Th17的转录因子,在体内TGF-β可以促使Foxp3抑制RORγt的功能从而下调 Th17;IL-6,IL-21和 IL-23可以降低Foxp3对RORγt的抑制,上调Th17细胞,因此,Th17 和Treg细胞的平衡依赖于多种细胞因子的调节,失去Treg的作用,Th17细胞会失去抑制而异常升高[24],从而发生严重的炎症反应。
本次实验研究结果显示,模型组小鼠肺泡壁明显增厚,中度充血及肺间质炎症细胞浸润,给药组小鼠肺组织病变程度较模型组减轻,肺部无明显充血及炎性渗出物。与模型组相比,清肺口服液及利巴韦林颗粒作用于RSV肺炎小鼠后可使BALF中IL-2的水平升高,IL-17的水平降低,同时可以上调Treg,下调Th17,使Treg/Th17的水平升高,表明清肺口服液可以通过上调Treg/Th17及IL-2的水平,降低IL-17的水平而发挥抗病毒、开肺化痰、解毒活血之功效。与利巴韦林组相比,清肺高剂量组的Treg/Th17及IL-2的水平升高,IL-17的水平降低,清肺低剂量组的Treg/Th17的水平下降,IL-2及IL-17的水平升高,表明清肺口服液高剂量组的作用优于利巴韦林组,但清肺口服液低剂量组在升高Treg/Th17及降低IL-17水平方面劣于利巴韦林组,由此可知清肺口服液治疗RSV肺炎具有剂量依赖性,剂量越高,效果越好,适当增加剂量,其治疗RSV肺炎的作用可优于利巴韦林。中医中药在治疗RSV肺炎中具有较好的应用前景,本实验不仅证实了清肺口服液治疗RSV肺炎的有效性,也为探讨其发病机制提供了思路。
[1]Everard ML.The role of the respiratory syncytial virus in airway syndromes in childhood[J].Current Allergy and Asthma Reports,2006,6(2):97-102.
[2]Lozano R,Naghavi M,Foremanet K,et al.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the global burden of sisease atudy 2010[J].The Lancet,2012,380(9859):2095-2128.
[3]K Thorburn,S Kerr,N Taylor,et al.RSV outbreak in a paediatric intensive care unit[J].Journal of Hospital Infection,2004,57(3):194-201.
[4]张程,袁斌,徐建亚,等.清肺口服液对RSV肺炎患儿血清中IL-6及TNF-α表达水平的影响[J].中国中医急症,2012,21(8):1216-1217.
[5]袁斌,任现志,孙轶秋,等.清肺口服液治疗小儿呼吸道合胞病毒肺炎166例多中心单盲对照临床观察[J].中医杂志,2009,50(3):221-223.
[6]Martin RJ,Chu HW,honour JM,et al.Airway inflammation and bronchial hyperresponsiveness after Mycoplasma pneumoniae infection in a murine model[J].J Am J Reapir Cell Mol Biol,2001,24(5):577-582.
[7] Drago L,Nicola L,Ossola F,et al.In vitro antiviral activity of resveratrol against respiratory viruses[J].Journal of Chemotherapy,2008,20(3):393-394.
[8] Lili Zhou,Qiuyan Xiao.The impact of viral dynamics on the clinical severity of infants with respiratory syncytial virus bronchiolitis[J].J Med Virol,2015,87(8):1276-1284.
[9]Shaw KN,Bell LM,Sherman NH,et al.Outpatient assessment of infants with bronchiolitis[J].American journal of diseases of children,1991,145(2):151-155.
[10]Sigurs N,Aljassim F,Kjellman B,et al.Asthma and allergy patterns over 18 years after severe RSV bronchiolitis in the first year of life[J].Thorax,2011,65(12):1045-1052.
[11]Tregoning JS,Schwarze J.Respiratory viral infections in infants:causes,clinicalsymptoms,virology,andimmunology[J]. Clinical Microbiology Reviews,2010,23(1):74-98.
[12]徐玲,李志山,桂玉平,等.清肺口服液治疗小儿呼吸道合胞病毒肺炎痰热闭肺证临床研究[J].山东中医杂志,2008,27(10):660-662.
[13]吕旭潇,崔清华,何军,等.小儿双金清热口服液对RSV病毒感染小鼠血清炎症因子的影响[J].山东中医药大学学报,2015,39(5):456-457.
[14]Qin L,Hu CP,Feng JT,et al.Activation of lymphocytes induced by bronchial epithelial cells with prolonged RSV infection[J].PLoS ONE,2011,6(12):e27113.
[15]Yu Raymond Y,Gallagher Grantl.A naturally occurring,soluble antagonist of human IL-23 inhibits the development and in vitro function of human Th17 cells[J].Journal of Immunology,2010,185(12):7302-7308.
[16]Fulton RB,Meyerholz DK,Varga SM.Foxp3+CD4 regulatory T cells limit pulmonary immunopathology by modulating the CD8 T cell response during respiratory syncytial virus infection[J].J Immunol,2010,185(4):2382-2392.
[17]Schmitz I,Schneider C,Frihlich A,et al.IL-21 restricts virus-driven Treg Cell expansion in chronic LCMV infection[J].PLoS Pathog,2013,9(5):e1003362.
[18]Laurence Arian,Tato Cristina M,Davidson Todd S,et al.Interleukin-2 signaling via STAT5 constrains T helper 17 cell generation[J].Immunity,2007,26(3):371-381.
[19]Sakaguchi S,Ono M,Setoguchi R,et al.Foxp3+CD25+CD4+natural regulatory T cells in dominant self-tolerance and autoimmune disease[J].Immunol Rev,2006,212(1):8-27.
[20]González FB,Villar SR,Bussy RF,et al.Immunoendocrine dysbalance during uncontrolled T.cruzi infection is associated with the acquisition of a Th-1-like phenotype by Foxp3+T cells[J].BrainBehaviorandImmunity,2015,45(3):219-232.
[21]Chen CY,Huang D,Yao SY,et al.IL-2 simultaneously expands Foxp3+T regulatory and T effector cells and confers resistance to Severe Tuberculosis(TB):implicative Treg-T effector cooperation in immunity to TB[J].Journal of Immunology,2012,188(9):4278-4288.
[22]JS Stumhofer,J Silver,CA Hunter,et al.Negative regulation of Th17 responses[J].Seminars in Immunology,2007,19(6):394-399.
[23]Mukherjee S,Lindell DM.IL-17-induced pulmonary pathogenesis during respiratory viral infection and exacerbation of allergic disease[J].Am J Pathol,2011,179(1):248-258.
[24]Chaudhry A,Rudra D,Treuting P,et al.CD4+regulatory T cells control TH17 responses in a Stat3-dependent manner[J]. Science,2009,326(5955):986-991.
(收入日期2016-02-25)
The Effects of Qingfei Oral Liquid on Expression of Treg/Th17,IL-2 and IL-17 in RSV Infected Mice
HU Chanchan,YUAN Bin,ZHOU Lihua,et al.The Affiliated Hospital of Nanjing University of Chinese Medicine,Jiangsu,Nanjing 210029,China.
R285.5文献标志码:A
1004-745X(2016)06-0941-04
10.3969/j.issn.1004-745X.2016.06.001
国家自然科学基金资助项目(81574025);江苏省儿童呼吸疾病(中医药)重点实验室开放课题(JKLPRD201410)
△(电子邮箱:yuanbin68358@163.com)

