施肥和苜蓿接种根瘤菌对苜蓿生长及铁尾矿砂基质理化性质的影响
杨何宝,李继泉,2*,王俊娟,李玉灵,2(.河北农业大学林学院,河北保定07000;2.河北省林木种质资源和森林保护重点实验室,河北保定07000)
施肥和苜蓿接种根瘤菌对苜蓿生长及铁尾矿砂基质理化性质的影响
杨何宝1,李继泉1,2*,王俊娟1,李玉灵1,2
(1.河北农业大学林学院,河北保定071000;2.河北省林木种质资源和森林保护重点实验室,河北保定071000)
本研究采用室外盆栽的方式,探讨了施肥水平和苜蓿接种不同根瘤菌菌株对紫花苜蓿生长及铁尾矿砂基质理化性质的影响。结果表明,接种根瘤菌可显著促进紫花苜蓿株高、根长、地上鲜重、根鲜重、总生物量和瘤鲜重的增加,其中以接种菌株17676的效果最佳。而接种根瘤菌的苜蓿在种植当年对铁尾矿砂基质理化性质的改善有一定的促进作用,但效果不显著。施肥明显促进了苜蓿生长,随着施肥水平的提高,苜蓿株高、根长、地上鲜重、根鲜重和总生物量逐渐增大,在N3施肥水平时最高,并且N3施肥水平条件下的株高、地上部鲜重和总生物量与N2和N1两个施肥水平间差异显著。在促进根瘤重的增加方面,N2施肥水平效果最好,但与N3水平间差异不显著。在改良铁尾矿砂理化性质方面,施肥不仅能明显促进铁尾矿砂容重和p H值的降低,还能显著促进其田间持水量、总孔隙度以及有机质、碱解氮、速效磷和速效钾含量的增加。在降低容重、酸碱度以及提高有机质、速效磷和速效钾含量方面,N3施肥水平的效果均明显优于N1和N2水平。
铁尾矿;紫花苜蓿;根瘤菌;施肥;理化性质
http://cyxb.lzu.edu.cn
杨何宝,李继泉,王俊娟,李玉灵.施肥和苜蓿接种根瘤菌对苜蓿生长及铁尾矿砂基质理化性质的影响.草业学报,2016,25(2):68-76.
YANG He-Bao,LIJi-Quan,WANG Jun-Juan,LI Yu-Ling.Effects of fertilizer and Rhizobium inoculation on alfalfa growth on mine tailings and the physicochemical properties of iron tailings.Acta Prataculturae Sinica,2016,25(2):68-76.
随着我国铁矿资源的开发和利用,产出大量的铁尾矿,不仅占用大量土地,而且破坏植被、严重污染环境[1]。研究表明,植被恢复与重建是治理矿山废弃地的有效途径[2-3]。紫花苜蓿(Medicago sativa)因其根系可与根瘤菌形成固氮体系,具有适应性强、产草量高、富含蛋白质等特点被称作“牧草之王”,同时还具改良土壤理化性质、改善生态环境的作用,是牧草生产和沙化、退化土壤及金属尾矿植被恢复的首选牧草[2,4-5]。因此,利用铁尾矿种植紫花苜蓿不仅能增加苜蓿种植面积,利于发展畜牧生产,而且对于治理因铁尾矿大量堆积造成的环境污染,改善生态环境具有重要意义。
然而,铁尾矿砂营养成分极度匮乏、结构松散、持水力差,这些恶劣的理化性质严重制约着苜蓿及其他植物的正常生长[3,5-6]。因此,改善铁尾矿砂理化性质、提高苜蓿抗逆性是促进苜蓿正常生长的重要方面。研究表明,接种根瘤菌可以促进苜蓿早结瘤、多结瘤、增加固氮量,提高苜蓿的品质及抗逆性[7-8],并且种植接种根瘤菌的苜蓿还能促进土壤养分含量的增加[9]。施用有机肥能改善土壤结构,提高养分含量,增强土壤保水保肥能力,进而提高苜蓿产量[10-12]。可见,施用有机肥和苜蓿接种根瘤菌处理不仅能明显促进苜蓿生长,还能显著改善土壤的理化性质。但施用有机肥和苜蓿接种根瘤菌能否促进铁尾矿砂上种植的苜蓿结瘤和生长,以及对铁尾矿基质的改良效果如何未见报道。
因此,本试验采用裂区试验方法,通过室外盆栽的方式,研究施用有机肥和苜蓿接种根瘤菌处理对铁尾矿砂上种植的紫花苜蓿生长状况及其生长基质理化性质的影响,以期为紫花苜蓿在铁尾矿废弃地上快速定植与生长提供技术参考。
1 材料与方法
1.1试验材料
供试植物:阿尔冈金紫花苜蓿(Medicago sativa cv.Algonquin),购自北京正道生态科技有限公司。
供试根瘤菌菌株:菌株ACCC17512、17513和17676,由中国农业微生物菌株保藏中心提供。
供试铁尾矿砂:取自迁安马兰庄铁矿尾矿库,其p H为7.67,养分含量为有机质1.15 g/kg、碱解氮1.41 mg/kg、速效磷0.24 g/kg、速效钾15.50 mg/kg。
根瘤菌培养基:蔗糖,10 g;K2HPO4,0.5 g;NaCl,0.1 g;酵母膏,1 g;柠檬酸铁(1%),1 m L;CaSO4,0.2 g;MgSO4·7H2O,0.2 g;MnSO4(1%),1 m L;Na Mo O4(1%),1 m L;硼酸(1%),1 m L;琼脂,20 g;1000 m L水;p H 6.8~7.0。该配方由中国农业微生物菌株保藏中心提供。
根瘤菌营养液:1000 m L水中加硼酸(H3BO3)2.86 g,钼酸钠(Na2MoO4·7H2O)2.03 g。
供试有机肥:经发酵处理的鸡粪有机肥(p H 5.90,有机质285.47 g/kg,全氮14.0 g/kg,碱解氮0.46 g/kg,全磷1.3 g/kg,速效磷0.88 g/kg,全钾14.3 g/kg,速效钾7.46 g/kg),购于藁城市发达生物发酵肥有限公司。
1.2试验方法
1.2.1试验设计采用裂区试验设计方法进行盆栽试验,每盆(φ=15 cm,H=18 cm)装基质5 kg。设4个主处理和4个副处理。主处理为苜蓿不接种根瘤菌(A0)、接种根瘤菌17512(A1)、根瘤菌17513(A2)和根瘤菌17676(A3);副处理为4个有机肥水平,包括N0(5 kg铁尾矿砂+0 kg有机肥)、N1(4.95 kg铁尾矿砂+0.05 kg有机肥)、N2(4.875 kg铁尾矿砂+0.125 kg有机肥)和N3(4.75 kg铁尾矿砂+0.25 kg有机肥),每个主处理分别与4个副处理进行组合,共16个处理,以不种苜蓿的铁尾矿砂为空白对照(CK),每个处理3次重复,共48盆。
1.2.2根瘤菌培养与制备吸取0.3~0.4 m L的根瘤菌营养液,滴入装有冻干菌株的安瓿管内轻轻振荡,使菌体溶解成悬浮液,采用平板画线法接种于根瘤菌固体培养基上,于28℃培养3~4 d,然后转接到液体培养基中,在28℃下恒温振荡培养1 d,经4000 r/min离心10 min后,收集菌体,用平板计数法测定含菌量为5×109个/g,保证在接种过程中每粒种子表面含有不少于103个有效的根瘤菌[13]。
1.2.3接种将苜蓿种子于50~60℃水中浸泡0.5 h后,捞出。白天放在阳光下暴晒,夜间转至阴凉处,并加水保持种子湿润,当大部分种子略有膨胀时,按根瘤菌与干种子重量比为1∶10的比例进行拌种。在拌种前,根瘤菌中加入1%羧甲基纤维素钠溶液作为黏着剂[14]。
1.2.4播种及后期管理铁尾矿砂过筛去除杂质,并加入硼砂(1.7 mg/kg)和钼酸钠(0.007 mg/kg),与添加不同比例的有机肥混合均匀后装盆。于2013年5月初播种,采用穴播的方式,穴深1~2 cm,在盆中4角和中心播种,每穴播种3粒种子,出苗一周后,盆中5个点各留一株长势最好的植株。为保证根瘤菌更好地发挥固氮能力,间苗在每盆中各加入含硼砂(2.86 mg/m L)和钼酸钠(2.03 mg/m L)的混合溶液20 m L。在苜蓿的生长过程中,及时浇水,除虫和除草。
1.3测定指标与方法
1.3.1苜蓿生长性状的测定于2013年10月中旬收获,分别测定植株株高、根长、地上部分和根鲜重、总生物量、根瘤鲜重[4]。
1.3.2铁尾矿砂理化性质的测定苜蓿收获后,将盆中的尾矿砂混匀并去除杂物,用于测定其理化性质。容重、总孔隙度和田间持水量采用环刀法测定[15]。土壤p H用p H计测定;土壤碱解N采用碱解扩散法;土壤速效P采用碳酸氢钠浸提钼蓝比色法;土壤速效K采用NH4OAc浸提—火焰光度法;土壤有机质含量采用重铬酸钾容量法-外稀释法[16]。
1.4统计分析
不同处理对铁尾矿砂理化性质的影响均以各指标的测定值与空白对照比较所得的差值即增减量来表示。利用Excel、SPSS统计工具对试验数据进行统计分析,不同水平间的多重比较采用LSD法,相关性分析采用Pearson法。
2 结果与分析
2.1接种根瘤菌和施肥对紫花苜蓿生长状况的影响
通过F值检验(表1),结果表明,接种根瘤菌对紫花苜蓿株高、根长、地上鲜重、根鲜重、总生物量和根瘤重提高的影响达到了显著水平(P<0.05)。施肥处理对苜蓿各项生长指标提高的影响均达到了极显著水平(P<0.01)。此外,接种根瘤菌和施肥处理对苜蓿株高、根长、根鲜重和根瘤重提高的影响存在交互作用,且达到了显著水平(P<0.05)。
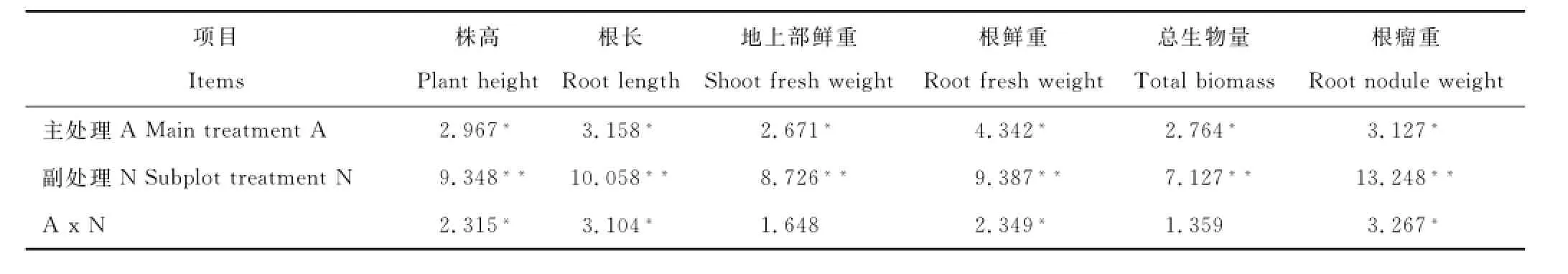
表1 紫花苜蓿各生长指标F值Table1 F value of alfalfa growth indexes
接种根瘤菌后,苜蓿的株高、根长、根鲜重、总生物量和根瘤重等生长指标均明显高于不接种处理,特别是根瘤重的提高幅度最大,为不接种处理的2.4~3.4倍。接种菌株17676(A3)后,除根瘤重的提高程度不显著外,其余各生长指标均明显高于接种其他两个菌株。与菌株17513(A2)相比,接种菌株17512(A1)苜蓿的根鲜重明显增大,其他各生长指标虽然也都有一定程度的提高,但差异不显著(表2)。

表2 接种根瘤菌对紫花苜蓿生长的影响Table2 Effects of Rhizobium inoculation on alfalfa growth
由表3可知,施肥对苜蓿生长的促进作用显著优于不施肥处理(P<0.05)。随着施肥水平的提高,除根瘤重外其他各生长指标均逐渐增大。N3水平的苜蓿株高、地上部鲜重和总生物量明显高于N2和N1水平,说明N3施肥水平对苜蓿地上部分的生长和总生物量的提高显著高于其他较低的施肥水平。在促进根瘤重的增加方面,N2施肥水平效果最好,但与N3水平间差异不显著。
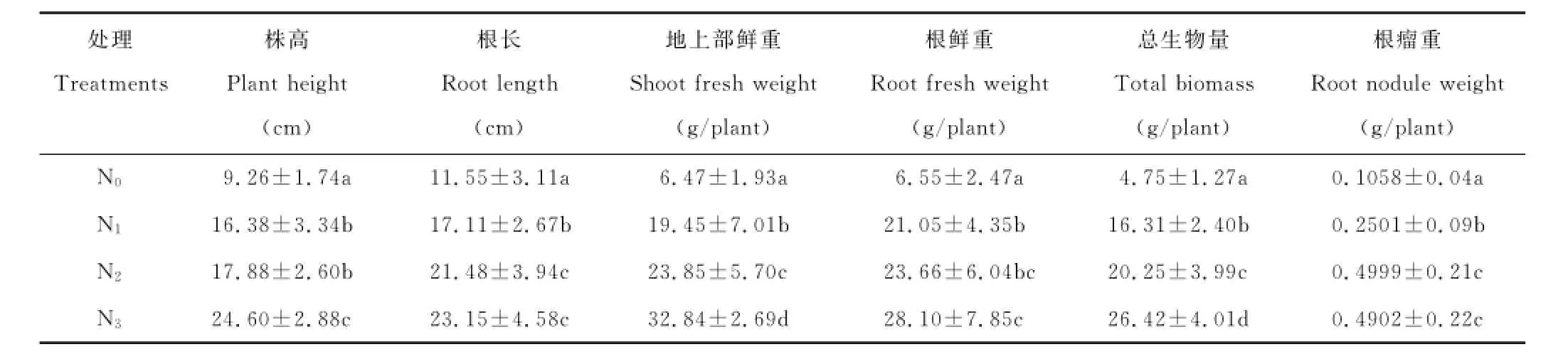
表3 施肥对紫花苜蓿生长的影响Table3 Effects of fertilization on alfalfa growth
相关性分析表明,根瘤重与株高、根长、地上部鲜重、根鲜重和总生物量间均呈极显著地正相关(株高,r= 0.803;根长,r=0.888;地上部鲜重,r=0.814;根鲜重,r=0.863;总生物量,r=0.867),这表明良好的结瘤性对苜蓿生长有显著的促进作用。
2.2苜蓿接种根瘤菌和施肥对铁尾矿砂理化性质的影响
2.2.1对铁尾矿砂物理性质的影响经F检验发现,种植接种根瘤菌的苜蓿对尾矿砂容重的降低以及田间持水量和总孔隙度的提高均无显著影响,而施肥对以上指标的影响达到了极显著的水平(P<0.01)(表4)。
由表5可知,种植接种根瘤菌的苜蓿对铁尾矿砂容重的降低以及田间持水量和总孔隙度的提高均无显著影响,但种植接种根瘤菌苜蓿的铁尾矿砂容重的减少量以及田间持水量和总孔隙度的增加量均大于种植不接种苜蓿,这表明接种根瘤菌的苜蓿在种植当年对铁尾矿砂物理性质的改善有一定的促进作用,但效果不明显。种植接种不同菌株的苜蓿对以上指标增减量的影响也存在一定的差异,以接种菌株17676(A3)的效果最好。
随着施肥水平的提高,容重的降低幅度以及田间持水量和总孔隙度的增加量逐渐增大。在降低铁尾矿砂容重方面,N3施肥水平的效果明显好于其他处理(P<0.05)。在提高田间持水量和总孔隙度方面,N2和N3施肥水平的作用均明显大于其他处理,而两者间的差异不明显,但对以上指标提高的数量方面仍有区别,以N3水平的效果最佳,说明施有机肥可明显改善铁尾矿砂的物理性质(表6)。
2.2.2对铁尾矿砂化学性质的影响经F检验可知,种植接种根瘤菌的苜蓿对铁尾矿砂p H的减少量及其他营养物质的增加量的影响不显著,而施肥处理对以上指标变化的影响达到了极显著的水平(P<0.01)。在提高碱解氮和速效钾含量方面,苜蓿接种根瘤菌和施肥处理间存在交互作用(P<0.05)(表7)。
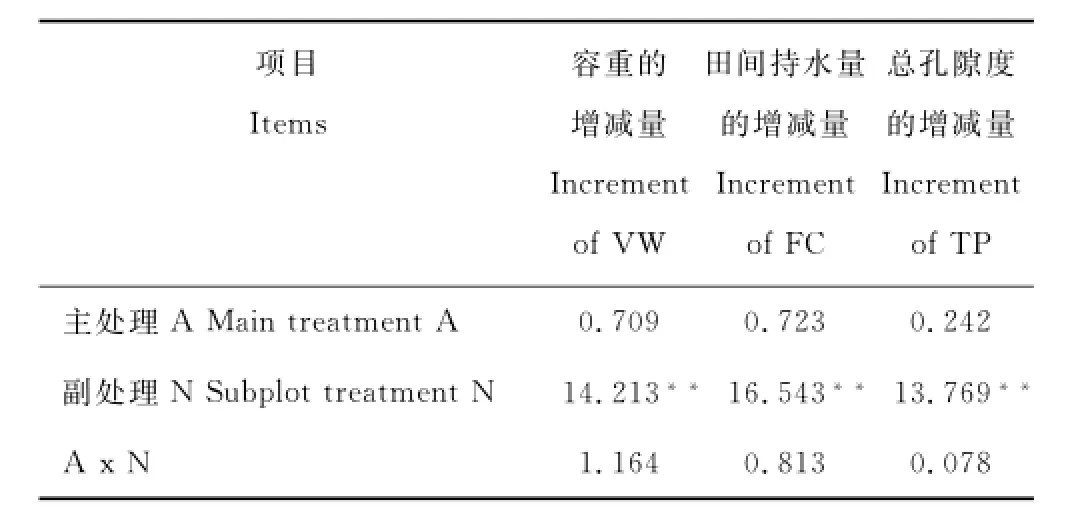
表4 铁尾矿砂物理性质F值Table4 F value of the physical properties of iron-mine tailings
表5 苜蓿接种根瘤菌对铁尾矿砂物理性质的影响Table5 Effects of Rhizobium inoculation on the physical properties of iron-mine tailings
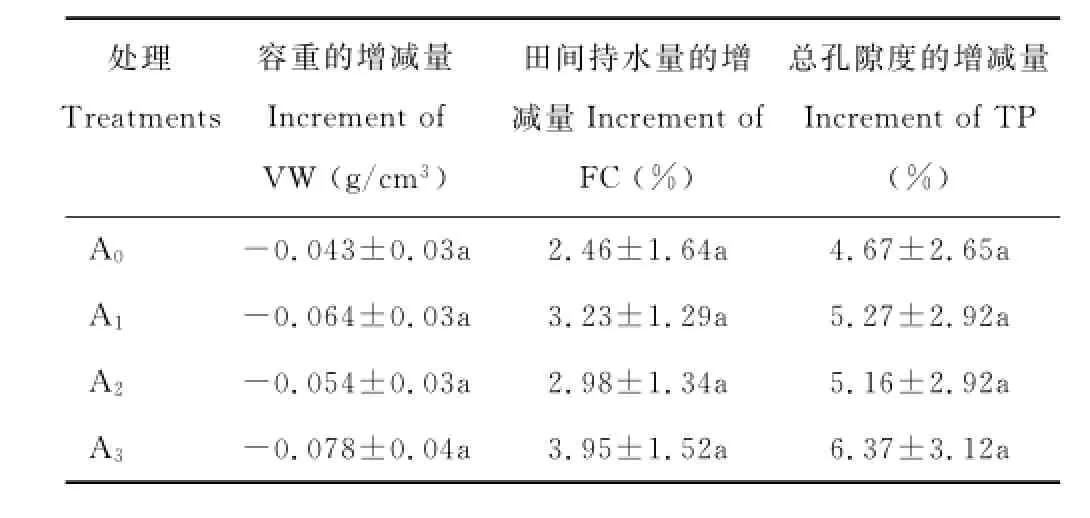
表5 苜蓿接种根瘤菌对铁尾矿砂物理性质的影响Table5 Effects of Rhizobium inoculation on the physical properties of iron-mine tailings
处理Treatments容重的增减量Increment of VW(g/cm3)田间持水量的增减量Increment of FC(%)总孔隙度的增减量Increment of TP (%)A0-0.043±0.03a 2.46±1.64a 4.67±2.65a A1-0.064±0.03a 3.23±1.29a 5.27±2.92a A2-0.054±0.03a 2.98±1.34a 5.16±2.92a A3-0.078±0.04a 3.95±1.52a 6.37±3.12a
表6 施肥对铁尾矿砂物理性质的影响Table6 Effects of fertilization on the physical properties of iron-mine tailings

表6 施肥对铁尾矿砂物理性质的影响Table6 Effects of fertilization on the physical properties of iron-mine tailings
处理Treatments容重的增减量Increment of VW(g/cm3)田间持水量的增减量Increment of FC(%)总孔隙度的增减量Increment of TP (%)N0-0.027±0.01a 1.53±0.55a 1.40±0.48a N1-0.040±0.01ab 2.55±0.84a 5.04±0.74b N2-0.072±0.01b 3.73±0.89b 7.20±0.79c N3-0.100±0.03c 4.79±0.40b 7.83±0.90c
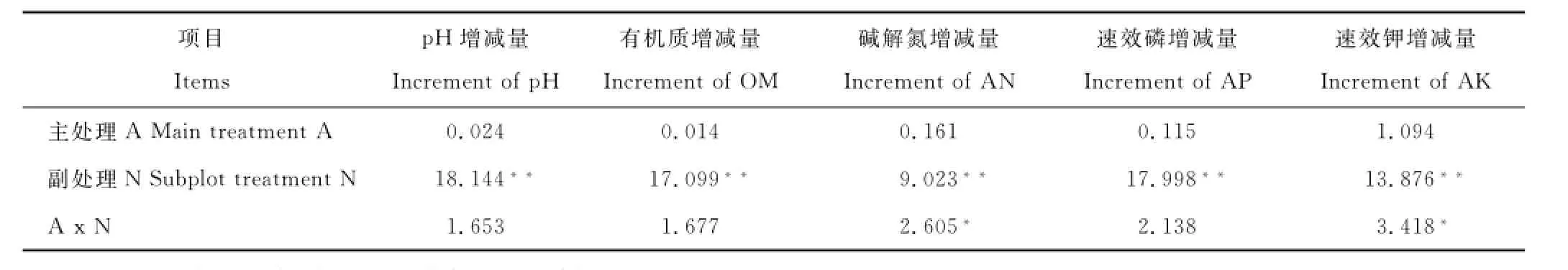
表7 铁尾矿砂化学性质F值Table7 F value of the chemical properties of iron-mine tailings
由表8可知,种植接种根瘤菌的苜蓿对铁尾矿砂p H值的降低量及其他营养物质的增加量的影响并不显著,但种植接种根瘤菌的苜蓿后铁尾矿砂p H值的减少量及其他营养物质的增加量均在一定程度上大于种植不接种苜蓿,并且这些指标的增减量在不同菌株间也有差异,接种根瘤菌菌株17676的效果最佳。表明接种根瘤菌的苜蓿在种植当年对铁尾矿砂肥力的提高及酸碱度的改良有一定的积极作用,但效果不显著。
经分析发现,与不施肥处理相比,施肥对铁尾矿砂p H值的降低幅度及有机质、速效磷增加量的影响达到了显著程度。随着施肥水平的提高,p H值的降低幅度及营养物质的增加量逐渐增大。并且N3水平对降低p H以及提高有机质、速效磷和速效钾含量的效果明显优于N1和N2水平,使铁尾矿砂的p H值降低了0.54,由原来的7.67降至7.13;有机质、速效磷和速效钾含量分别增加了17.1 g/kg、0.6 g/kg和7.49 mg/kg。在提高碱解氮含量方面,虽然N3与N2水平间无显著差异,但在增加量上前者高于后者。因此,N3施肥水平在改良铁尾矿酸碱度及提高养分含量方面效果最佳,其次为N2和N1水平(表9)。
表8 苜蓿接种根瘤菌对铁尾矿砂化学性质的影响Table8 Effects of Rhizobium inoculation on the chemical properties of iron-mine tailings
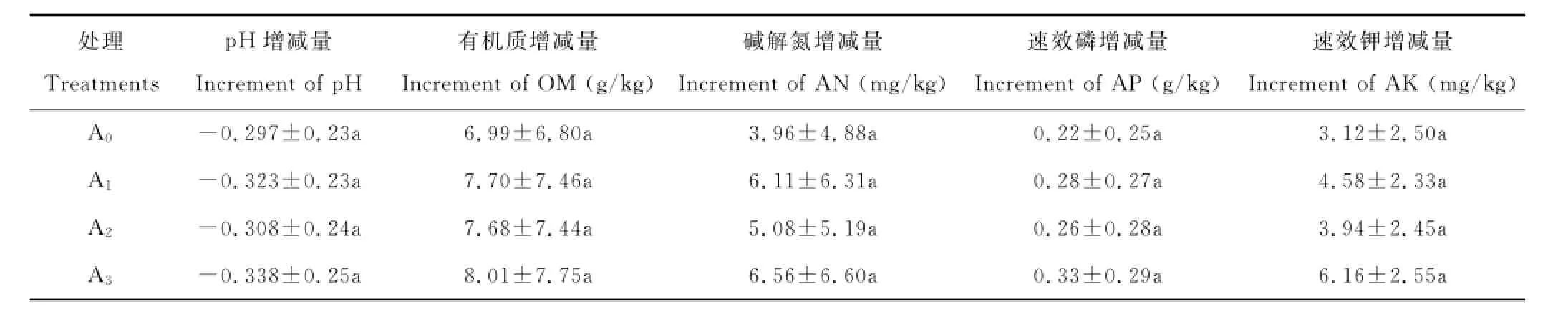
表8 苜蓿接种根瘤菌对铁尾矿砂化学性质的影响Table8 Effects of Rhizobium inoculation on the chemical properties of iron-mine tailings
处理Treatments p H增减量Increment of p H有机质增减量Increment of OM(g/kg)碱解氮增减量Increment of AN(mg/kg)速效磷增减量Increment of AP(g/kg)速效钾增减量Increment of AK(mg/kg)A0-0.297±0.23a 6.99±6.80a 3.96±4.88a 0.22±0.25a 3.12±2.50a A1-0.323±0.23a 7.70±7.46a 6.11±6.31a 0.28±0.27a 4.58±2.33a A2-0.308±0.24a 7.68±7.44a 5.08±5.19a 0.26±0.28a 3.94±2.45a A3-0.338±0.25a 8.01±7.75a 6.56±6.60a 0.33±0.29a 6.16±2.55a
表9 施肥对铁尾矿砂化学性质的影响Table9 Effects of fertilization on the chemical properties of iron-mine tailings
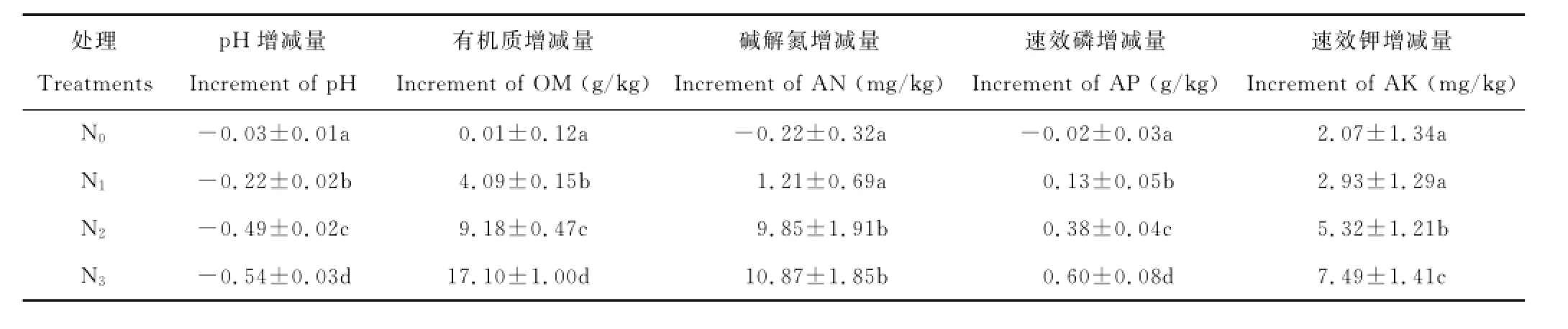
表9 施肥对铁尾矿砂化学性质的影响Table9 Effects of fertilization on the chemical properties of iron-mine tailings
处理Treatments p H增减量Increment of p H有机质增减量Increment of OM(g/kg)碱解氮增减量Increment of AN(mg/kg)速效磷增减量Increment of AP(g/kg)速效钾增减量Increment of AK(mg/kg)N0-0.03±0.01a 0.01±0.12a-0.22±0.32a-0.02±0.03a 2.07±1.34a N1-0.22±0.02b 4.09±0.15b 1.21±0.69a 0.13±0.05b 2.93±1.29a N2-0.49±0.02c 9.18±0.47c 9.85±1.91b 0.38±0.04c 5.32±1.21b N3-0.54±0.03d 17.10±1.00d 10.87±1.85b 0.60±0.08d 7.49±1.41c
3 讨论
本研究中,接种根瘤菌显著提高了紫花苜蓿的根瘤重,促进了其地上和地下部的生长(表2),并且根瘤重与株高、根长、地上部鲜重、根鲜重和总生物量间呈极显著正相关关系,这表明良好的结瘤性能够提高铁尾矿砂中紫花苜蓿的产量。其主要原因是根瘤菌通过促进苜蓿早结瘤、提高结瘤率和单株结瘤量,增强植株对空气中氮素的固定与利用[14,17]。然而,本研究中的3株根瘤菌对阿尔冈金紫花苜蓿生长的促进作用存在差异,其中17676菌株的作用最为显著(表2)。与之类似,Zeng等[17]将17株根瘤菌与苜蓿品种Vector进行田间接种实验的结果表明,接种CCBAU30138菌株的苜蓿结瘤率及干草产量最高。这是由于苜蓿根瘤菌对寄主的选择有很强的专一性,苜蓿品种与菌种间的不同共生组合,其固氮效果差异较大。这种差异由根瘤菌菌种和苜蓿品种双方基因的相容性所决定,并涉及宿主植物、根瘤菌和环境间复杂的互作[18-20]。
同样,施肥也能促进苜蓿生长[21]。李凤霞等[12]比较了不同改良剂对宁夏盐碱地中苜蓿生物量的影响,结果显示,在各种改良剂中,有机肥对苜蓿株高和生物量提高的促进作用最为显著。本研究结果也表明,施用有机肥后苜蓿的各项生长指标均明显提高,并随着施肥量的增加,苜蓿各生长指标(根瘤重除外)均有不同程度的提高,特别是地上部鲜重及总生物量达到了显著的程度(表3),表明铁尾矿砂基质中施用有机肥能明显促进苜蓿生长。然而,过量施肥导致土壤中的化合态氮浓度过高,会影响根瘤菌对根毛的侵染,降低结瘤数量,抑制固氮酶活性,降低固氮效率,并随着菌株和宿主植物不同而异[19]。马霞等[4]研究发现,当施氮量超过50 kg/hm2时,则抑制根瘤菌结瘤,引起苜蓿固氮量和生物量下降。蒯佳林等[22]的研究结果显示,当氮素浓度超过105 mg/L时,苜蓿的株高随着浓度的提高虽然仍有少量增加,但受浓度的影响已不显著,而根长随氮素水平的增加而降低。本研究也发现,当施肥水平由2.5%升高到5%时,苜蓿根长和根鲜重虽然仍有一定程度的提高,但差异不显著,而根瘤重却表现出下降的趋势(表3)。表明5%水平为施肥量的上限,此施肥水平对地下部分生长的促进效应已明显减弱,特别是对苜蓿结瘤产生了轻度抑制,这可能是由于铁尾矿基质中的氮素浓度较高所致。
在促进紫花苜蓿生长的同时,施肥也促进了铁尾矿砂理化性质的改善。在物理性质方面,施肥使铁尾矿砂基质容重的降幅以及田间持水量和总孔隙度的增幅明显增大,并随着施肥量的增加表现出不同程度的提高(表8)。这可能有2个方面的原因:一是有机肥有利于有机质含量的增加和土壤团粒结构的聚集,从而使容重下降以及田间持水量和总孔隙度提高[23-24]。本研究结果表明,随着有机肥施用量的提高,有机质含量的增幅明显增大(表8),并且有机质的增加量与铁尾矿砂基质的容重、田间持水量和总孔隙度的变化幅度呈极显著相关(容重,r= -0.862,P<0.01;田间持水量,r=0.866,P<0.01;总孔隙度,r=0.817,P<0.01),这与聂军等[23]的研究结果一致;二是有机肥通过促进苜蓿根系的快速生长使铁尾矿砂基质的物理性质得到明显改善。本研究中,施肥明显促进了根鲜重的提高(表3)。相关性分析表明,根鲜重与容重、田间持水量和总孔隙度的增减量呈极显著相关(容重,r=-0.903,P<0.01;田间持水量,r=0.908,P<0.01;总孔隙度,r=0.949,P<0.01)。李勇等[25]也发现,随着根量的增加,土壤容重的降幅和非毛管孔隙度的增幅明显增大。
在改善铁尾矿砂的化学性质方面,施用有机肥使有机质及速效养分的增加量显著提高,并随着施肥水平的提高其增加量均表现出不同程度的增大(表9),说明有机肥本身对基质养分有添加作用。此外,有机肥的施入会促进根系生长及微生物活动加强,根系分泌物和微生物的共同作用加快了铁尾矿砂中无机养分的溶解和有机物的分解转化[26]。施有机肥还降低了铁尾矿砂基质的p H,由偏碱性逐渐接近中性(表9)。这可能有3个方面的原因:一是有机肥含有的大量腐殖酸等酸性物质导致了p H值的降低[27];二是苜蓿根系在生长过程中不断向环境中分泌有机酸,有机肥促进了根系生长及有机酸向环境中的分泌[28];三是有机肥通过提高微生物的数量和活性,促进其在有机物分解及自身代谢过程中所产生的酸性物质向基质中的释放[29-30]。
相关研究表明,苜蓿接种根瘤菌后,不仅能通过促进苜蓿生长来增加有机质和速效氮含量[31],还会降低土壤容重、增加田间持水量[32],并且随着苜蓿种植年限的延长对土壤理化性质的改良效果逐渐增大[33-34]。本研究中,接种根瘤菌的苜蓿在种植的当年对铁尾矿砂基质理化性质的改善有一定的促进作用,但效果不显著(表5,表8),这说明有机质及速效养分在铁尾矿砂中的积累速度较为缓慢,在苜蓿种植当年不足以引起铁尾矿砂理化性质的明显改善。在今后的研究中,应延长苜蓿的种植年限。
References:
[1]Wei R L,Zhang J.Research progress of utilization of ore tailings as resources.Mineral Engineering,2014,12(1):56-59.
[2]Mendez M O,Maier R M.Phytostabilization of mine tailings in arid and semiarid environments—an emerging remediation technology.Environmental Health Perspectives,2008,116(3):278-283.
[3]Borgegard S,Rybin H.Utilization of waste products and inorganic fertilizer in the restoration of iron-mine tailings.Journal of Applied Ecology,1989,26:1083-1088.
[4]Ma X,Wang L L,Li W J,et al.Effects of different nitrogen levels on nitrogen fixation and seed production of alfalfa inoculated with rhizobia.Acta Prataculturae Sinica,2013,22(1):95-102.
[5]Gu J F,Cai T J,Yang Y.Research on vegetation restoration of abandoned mine land in alpine areas.Journal of Soil and Water Conservation,2014,28(3):29-36.
[6]Johnson M S,Bradshaw A D.Ecological principles for the restoration of disturbed and degraded land.Applied Biology,1979,4:141-200.
[7]Chen L Y,Zhang L J,Zhou Z Y.Research of salt tolerable rhizobia inoculation effects on Medicago sativa.Acta Prataculturae Sinica,2008,17(5):43-47.
[8]Zhang P,Yang P Z,Wang W D,et al.Study on physiological change of alfalfa with symbiotic Rhizobium under drought stress.Acta Agrestia Sinica,2013,21(5):938-944.
[9]Yao X C,Shi S L.Effect of intermittent drought on soil nutrients of alfalfa grassland inoculated with Rhizobium in a cold and drought Region.Chinese Journal of Soil Science,2007,38(3):457-462.
[10]Han B J,Chen Y,Qiao Y F,et al.Effect of long-term application organic fertilizer on soil physiochemical properties.System Sciences and Comprehensive Studies in Agriculture,2004,20(4):294-296.
[11]Mader P,Fliessbach A,Dubois D,et al.Soil fertility and biodiversity in organic farming.Science,2002,296(5573):1694-1697.
[12]Li F X,Guo Y Z,Wang X Q,et al.Effect of different soil improvement measures on microbial diversity and alfalfa biomass in saline-alkali soil in Ningxia.Chinese Agricultural Science Bulletin,2012,28(30):49-55.
[13]Ma X T.The Study of Screening High Symbiotic Matching Combinations of Rhizobia and Alfalfa Varieties[D].Beijing:Graduate School Academy of Agricultural Sciences,2009.
[14]Shi J,Zhang L,Zhang Q,et al.The effects of calcium and acid-tolerant Rhizobium on the growth of alfalfa planted in acid soil.Plant Nutrition and Fertilizer Science,2008,14(3):602-607.
[15]Institute of Soil Science,Chinese Academy of Sciences.Soil Physical Chemistry Analysis[M].Shanghai:Shanghai Science and Technology Press,1978.
[16]Bao S D.Soil Agricultural Chemistry Analysis[M].Beijing:China Agriculture Press,2000:34-35,56-58.
[17]Zeng Z H,Chen W X,Hu Y G,et al.Screening of highly effective Sinorhizobium meliloti strains for“Vector”alfalfa and testing its competitive nodulation ability in the field.Pedosphere,2007,17(2):219-228.
[18]Tan G Y,Tan W K.Interaction between alfalfa cultivars and Rhizobium strains for nitronen fixation.Theoretical and Applied Genetics,1986,71:724-729.
[19]Li Y G,Zhou J C.The main factors of influencing the efficiency of rhizobia symbiotic nitrogen fixation and genetic modification.Microbiology China,2002,29(6):86-89.
[20]Liu X Y,Guo Z G,Li Q X,et al.Screening of highly-effective rhizobial strains on Alfalfa(Medicago polymorpha)in soil. Acta Ecologica Sinica,2011,31(14):4034-4041.
[21]Li F K,Zhai G Y,Shen Y X,et al.Effect of superphosphate application and rhizobia inoculation on growth and forage quality of Medicago sativa in the Yellow River Delta.Acta Prataculturae Sinica,2005,14(3):87-93.
[22]Kuai J L,Liu X J,Li W Q.Effects of different nitrogen levels on the growth characteristics of alfalfa inoculated with Rhizobium.Grassland and Turf,2011,31(3):56-60.
[23]Nie J,Zheng S X,Yang Z P,et al.Effects of long-term application of chemical fertilizer,pig manure and rice straw on physical properties of a reddish paddy soil.Scientia Agricultura Sinica,2010,43(7):1404-1413.
[24]Zanuzzi A,Arocena J M,van Mourik J M,et al.Amendments with organic and industrial wastes stimulate soil formation in mine tailings as revealed by micromorphology.Geoderma,2009,154:69-75.
[25]Li Y,Xu X Q,Zhu X M.Effective model of improving soil physical property by roots of Chinese pine plantation on the Loess Plateau.Scientia Silvae Sinicae,1993,29(3):193-198.
[26]Jiao X G,Gao C S,Sui Y Y,et al.Research on soil microbial ecology under different soil organic matter levels in farmland. Scientia Agricultura Sinica,2011,44(18):3759-3767.
[27]Shi J P,Zhang F D,Lin B.Effects of long-term located fertilization on the physicochemical property of soil humus.Scientia Agricultura Sinica,2002,35(2):174-180.
[28]Lipton D S,Blanchar R W,Blevins D G.Citrate,malate,and succinate concentration in exudates from P-sufficient and P-stressed Medicago sativa L.seedlings.Plant Physiology,1987,85:315-317.
[29]Tian X M,Li J H,Wang C,et al.Effects of continuous application of bio-organic fertilizer for three years on soil nutrients,microbial biomass and enzyme activity.Soils,2014,46(3):481-488.
[30]Zhao X R,Lin Q M,Li B G.The relationship between the ability of dissolving ground phosphate rock of microbe and p H and the secretion of organic acids.Journal of Microbiology,2003,23(3):5-7.
[31]Lu H P.The experimental study on the influence of rhizobia on yield of alfalfa.Grassland and Turf,2007,2:56-59.
[32]Liu X G,Zheng D W,Pan Z H,et al.Effects of inoculated rhizobia and humic-acid fertilizer in soil on wind erosion.Journal of Soil and Water Conservation,2006,20(1):61-68.
[33]Tai J C,Yang H S,Zhang Q G,et al.Influence of planting years on nitrogen-fixing capacity of rhizosphere and contents of carbon and nitrogen in artificial pastures of alfalfa.Chinese Journal of Soil Science,2010,41(3):603-607.
[34]Guo Z B,Wang D Z,Li F M.Effects of converting degraded cropland to alfalfa(Medicago sativa)grassland on soil physicochemical properties.Acta Agrestia Sinica,2013,21(5):888-894.
[1]魏瑞丽,张婕.铁尾矿资源化利用研究进展.矿业工程,2014,12(1):56-59.
[4]马霞,王丽丽,李卫军,等.不同施氮水平下接种根瘤菌对苜蓿固氮效能及种子生产的影响.草业学报,2013,22(1):95-102.
[5]谷金锋,蔡体久,杨业.高寒山区采矿迹地植被恢复研究.水土保持学报,2014,28(3):29-36.
[7]陈利云,张丽静,周志宇.耐盐根瘤菌对紫花苜蓿接种效果的研究.草业学报,2008,17(5):43-47.
[8]张攀,杨培志,王卫栋,等.干旱胁迫下根瘤菌共生紫花苜蓿抗旱生理变化研究.草地学报,2013,21(5):938-944.
[9]姚新春,师尚礼.寒区旱区间歇性干旱对接种根瘤菌苜蓿草地土壤养分动态的影响.土壤通报,2007,38(3):457-462.
[10]韩秉进,陈渊,乔云发,等.连年施用有机肥对土壤理化性状的影响.农业系统科学与综合研究,2004,20(4):294-296.
[12]李凤霞,郭永忠,王学琴,等.不同改良措施对宁夏盐碱地土壤微生物及苜蓿生物量的影响.中国农学通报,2012,28(30):49-55.
[13]马晓彤.苜蓿根瘤菌与苜蓿品种共生匹配优良组合筛选的研究[D].北京:中国农业科学院,2009.
[14]石杰,张磊,张琴,等.接种耐酸根瘤菌和施钙对酸性土上紫花苜蓿生长的影响.植物营养与肥料学报,2008,14(3):602-607.
[15]中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1978.
[16]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2002:34-35,56-58.
[19]李友国,周俊初.影响根瘤菌共生固氮效率的主要因素及遗传改造.微生物学通报,2002,29(6):86-89.
[20]刘晓云,郭振国,李乔仙,等.南苜蓿高效共生根瘤菌土壤的筛选.生态学报,2011,31(14):4034-4041.
[21]李富宽,翟桂玉,沈益新,等.施磷和接种根瘤菌对黄河三角洲紫花苜蓿生长及品质的影响.草业学报,2005,14(3):87-93.
[22]蒯佳林,刘晓静,李文卿.不同氮素水平对接种根瘤菌紫花苜蓿生长特性的影响.草原与草坪,2011,31(3):56-60.
[23]聂军,郑圣先,杨曾平,等.长期施用化肥、猪粪和稻草对红壤性水稻土物理性质的影响.中国农业科学,2010,43(7):1404-1413.
[25]李勇,徐晓琴,朱显谟.黄土高原油松人工林根系改善土壤物理性质的有效性模式.林业科学,1993,29(3):193-198.
[26]焦晓光,高崇升,隋跃宇,等.不同有机质含量农田土壤微生物生态特征.中国农业科学,2011,44(18):3759-3767.
[27]史吉平,张夫道,林葆.长期定位施肥对土壤腐殖质理化性质的影响.中国农业科学,2002,35(2):174-180.
[29]田小明,李俊华,王成,等.连续3年施用生物有机肥对土壤养分、微生物生物量及酶活性的影响.土壤,2014,46(3):481-488.
[30]赵小蓉,林启美,李保国.微生物溶解磷矿粉能力与p H及分泌有机酸的关系.微生物杂志,2003,23(3):5-7.
[31]鲁鸿佩.根瘤菌对紫花苜蓿产草量的影响试验研究.草原与草坪,2007,2:56-59.
[32]刘晓光,郑大玮,潘志华,等.接种根瘤菌和腐殖酸肥处理下的土壤风蚀效应分析.水土保持学报,2006,20(1):61-68.
[33]邰继承,杨恒山,张庆国,等.种植年限对紫花苜蓿人工草地土壤碳、氮含量及根际土壤固氮力的影响.土壤通报,2010,41(3):603-607.
[34]郭志彬,王道中,李风民.退化耕地转化为紫花苜蓿草地对土壤理化性质的影响.草地学报,2013,21(5):888-894.
Effects of fertilizer and Rhizobium inoculation on alfalfa growth on mine tailings and the physicochemical properties of iron tailings
YANG He-Bao1,LI Ji-Quan1,2*,WANG Jun-Juan1,LI Yu-Ling1,2
1.College of Forestry,Agricultural University of Hebei,Baoding 071000,China;2.Hebei Province Key Laboratory of Genetic Resources of Forest and Forest Protection,Baoding 071000,China
This study was undertaken to determine the effects of fertilizer application(iron tailings and organic fertilizer)and Rhizobium inoculation with different strains on the growth of alfalfa planted in iron mine tailings and the physicochemical properties of the soil-plant system in outdoor pots.Rhizobium inoculation significantly increased height growth,root growth,above ground fresh weight,root fresh weight,total biomass and fresh nodule weight.The most effective Rhizobium was strain No.17676.Inoculated alfalfa also influenced the physicochemical properties of iron mine tailings,but the effect was not significant in the first year of the study.Fertilizer application markedly promoted alfalfa growth.Increasing fertilizer rates increased plant height,above ground fresh weight and total biomass.The N2fertilizer treatment produced the greatest increase in root nodule weight.Fertilizer application significantly reduced soil bulk density and p H but increased organic matter,available nitrogen,available phosphorus,and available potassium in the mine tailings soil.These effects were significantly higher for the N3treatment compared to lower fertilizer rates.
iron tailings;alfalfa(Medicago sativa);Rhizobium;fertilization;physicochemical properties
10.11686/cyxb2015121
2015-03-09;改回日期:2015-04-20
“十二五”环境领域国家科技计划课题(2012BAC09B03)和“十二五”农村领域国家科技计划课题(2011BAD38B0103)资助。
杨何宝(1987-),男,河北唐山人,在读硕士。E-mail:327735736@qq.com
Corresponding author.E-mail:lijqbd@163.com

